允许免疫细胞浸润到肿瘤中的方法与流程
本公开总体上涉及用于允许瘤内免疫浸润和/或用于治疗患有癌症的受试者的方法。本公开的方法基于作为单一剂或在与多西他赛的联合疗法中的抗簇集蛋白抗体或其抗原结合片段的施用。还提供了用于这种用途的联合疗法、药物和试剂盒。
背景技术:
0、背景
1、随着关键调节因子的鉴定,负责转移癌发生的分子机制开始得到阐明。越来越多的证据表明,肿瘤细胞向上皮间质转化(emt)是转移演变的一个重要贡献过程。在肿瘤进展过程中emt的出现使得非侵袭性和非转移性的上皮肿瘤细胞从原发性肿瘤转移,侵入周围组织,进入血流,最终扩散到继发性部位并在那里增殖。另外,经历emt的上皮癌细胞采取与癌症干细胞(csc)非常相似的行为,包括对化学疗法和免疫逃避的固有抗性(shibue等人,2017;terry等人2017)。
2、尽管一线和二线疗法诸如化学治疗剂和免疫检查点抑制剂在癌症疗法中短期有效,但由于肿瘤细胞对抗肿瘤剂的抗性和肿瘤起始细胞的存活(两个最终导致转移增加和受试者存活差的事件),高比例的受试者对这些疗法变得难治。
3、对免疫检查点抑制剂产生抗性的机制可以各不相同。然而,普遍认为检查点抑制剂对所谓的免疫上热性肿瘤最有效,所述免疫上热性肿瘤是指被t细胞侵袭而产生发炎肿瘤的肿瘤。相比之下,免疫冷性肿瘤对免疫疗法的反应很差,因为出于未知的原因这些肿瘤尚未被识别或尚未引发强烈的免疫反应,因此t细胞尚未渗透到肿瘤或其微环境中。
4、在二线中向已接受作为单一剂的先前一线免疫检查点抑制剂的患者提供基于铂的化学疗法。在同时或连续施用的免疫检查点抑制和铂双重化学疗法失败后,可将单剂多西他赛作为二线或三线疗法施用。由于大多数患者在免疫化学疗法后最终进展,并且由于多西他赛在这种情况下的疗效非常有限,因此迫切需要新型疗法。
技术实现思路
0、概述
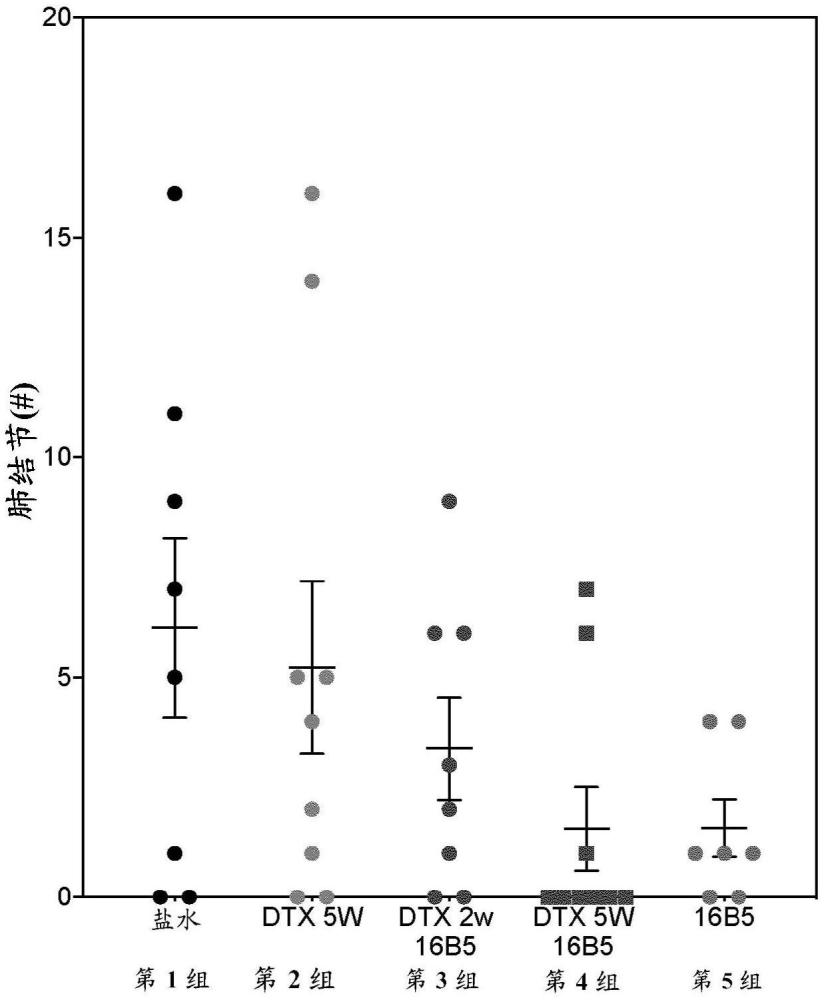
1、本技术人意外地发现,用抗簇集蛋白抗体或其抗原结合片段诸如ab-16b5治疗导致肿瘤内免疫浸润增加。
2、本技术人已开发了基于作为单一剂或在与多西他赛的联合疗法中的抗簇集蛋白或其抗原结合片段的施用的治疗。
3、本公开提供了允许免疫细胞浸润到肿瘤(例如,实体瘤)微环境中的方法,该方法包括向有需要的受试者施用抗簇集蛋白抗体或其抗原结合片段的步骤。
4、根据本公开,抗簇集蛋白抗体或其抗原结合片段可用于有需要的受试者,以允许免疫细胞浸润到肿瘤(例如,实体瘤)微环境中,或用于制造允许免疫细胞浸润到肿瘤(例如,实体瘤)微环境中的药物。
5、本公开还提供了用于治疗患有癌症(例如,实体瘤)的受试者的方法,该方法包括向有需要的受试者施用抗簇集蛋白抗体或其抗原结合片段的步骤。
6、根据本公开,抗簇集蛋白抗体或其抗原结合片段可用于治疗患有癌症的受试者,或者用于制造用于治疗患有癌症的受试者的药物。
7、在示例性实施方案中,以足以导致免疫细胞浸润到肿瘤(例如,实体瘤)微环境中的剂量和/或施用间隔和/或治疗期施用抗簇集蛋白抗体或其抗原结合片段。
8、本公开的方法还可包括向有需要的受试者施用多西他赛的步骤。
9、在示例性实施方案中,以足以允许化学疗法诱导的肿瘤免疫原性调节的剂量和/或施用间隔和/或治疗期施用多西他赛。
10、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛均各自以足以允许免疫细胞浸润到肿瘤微环境中和/或化学疗法诱导的肿瘤免疫原性调节的剂量和/或施用间隔和/或治疗期施用。
11、根据本公开,有需要的受试者是患有肿瘤或癌症且具有功能性免疫系统的受试者。
12、根据本公开,有需要的受试者是患有肿瘤或癌症且具有足够的器官和免疫功能的受试者。
13、因此,本公开提供了治疗患有癌症的受试者的方法,该方法包括施用包含抗簇集蛋白抗体或其抗原结合片段和多西他赛的联合疗法的步骤,其中受试者具有功能性免疫系统或足够的器官和免疫功能。
14、根据本公开,抗簇集蛋白抗体或其抗原结合片段和多西他赛的联合疗法可用于治疗患有癌症的受试者或用于制备治疗患有癌症的受试者的药物,其中受试者具有功能性免疫系统或足够的器官和免疫功能。
15、根据本公开,该方法可导致肿瘤微环境中免疫细胞的增加(在存在或数量方面)。
16、根据本公开,该方法可导致肿瘤微环境中免疫细胞活性的增强。
17、根据本公开,该方法可导致针对肿瘤细胞的免疫反应的调节。
18、根据本公开,抗簇集蛋白抗体或其抗原结合片段或联合疗法可导致免疫难治性较低的肿瘤微环境。
19、根据本公开,抗簇集蛋白抗体或其抗原结合片段和多西他赛的联合疗法可有助于创造具有增强的抗肿瘤细胞毒性t细胞活性的更有利的免疫环境。
20、根据本公开,在用联合疗法治疗后,特异性cd8+细胞毒性t细胞的细胞杀伤活性可得以增强。
21、根据本公开,该方法可导致肿瘤对免疫疗法治疗更敏感。
22、根据本公开,抗簇集蛋白抗体或其抗原结合片段包含轻链可变区和重链可变区,所述轻链可变区包含seq id no:9中所示的轻链可变区的互补决定区(cdr),所述重链可变区包含seq id no:10中所示的重链可变区的cdr。
23、根据本公开,抗簇集蛋白抗体或其抗原结合片段包含轻链可变区和重链可变区,所述轻链可变区具有与seq id no:9中所示的氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少99%同一性、或与seq id no:9中所示的氨基酸序列相同或包含seqidno:9中所示的氨基酸序列的氨基酸序列,所述重链可变区具有与seq id no:10中所示的氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少99%同一性、或与seq idno:10中所示的氨基酸序列相同或包含seq id no:10中所示的氨基酸序列的氨基酸序列。
24、根据本公开,抗簇集蛋白抗体或其抗原结合片段包含轻链和重链,所述轻链具有与seq id no:11中所示的氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少99%同一性、或与seq id no:11中所示的氨基酸序列相同或包含seq id no:11中所示的氨基酸序列的氨基酸序列,所述重链具有与seq id no:12中所示的氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少99%同一性、或与seq id no:12中所示的氨基酸序列相同或包含seq id no:12中所示的氨基酸序列的氨基酸序列。
25、根据本公开,抗体或其抗原结合片段能够与抗体竞争结合簇集蛋白(例如,分泌型簇集蛋白(sclu)或肿瘤相关sclu(ta-sclu))或竞争结合包含seq id no:35中所示的氨基酸序列的多肽,所述抗体包含具有seq id no:9中所示的氨基酸序列的轻链可变区和具有seq id no:10中所示的氨基酸序列的重链可变区。
26、根据本公开,抗簇集蛋白抗体或其抗原结合片段包含表9中所示的cdr、轻链和重链可变区或轻链和重链的氨基酸序列。
27、根据本公开,该方法可导致免疫细胞浸润到原发性肿瘤微环境中。
28、根据本公开,该方法可导致浆细胞浸润到肿瘤微环境中。
29、根据本公开,该方法可导致t细胞浸润到肿瘤微环境中。在一些实施方案中,t细胞包括cd4+t细胞。在一些实施方案中,t细胞包括cd8+t细胞。在其它实施方案中,t细胞包括cd4+t细胞和cd8+t细胞。
30、根据本公开,该方法可导致b细胞浸润到肿瘤微环境中。
31、根据本公开,该方法可导致t细胞和b细胞浸润到肿瘤微环境中。
32、根据本公开,该方法可导致肿瘤坏死。
33、在一些实施方案中,每周一次施用抗簇集蛋白抗体或其抗原结合片段。
34、在一些实施方案中,每周施用两次抗簇集蛋白抗体或其抗原结合片段。
35、在一些实施方案中,每两周一次施用抗簇集蛋白抗体或其抗原结合片段。
36、在一些实施方案中,每三周一次施用抗簇集蛋白抗体或其抗原结合片段。
37、在一些实施方案中,每四周一次施用抗簇集蛋白抗体或其抗原结合片段。
38、在一些实施方案中,每周一次施用多西他赛。
39、在一些实施方案中,每两周一次施用多西他赛。
40、在一些实施方案中,每三周一次施用多西他赛。
41、在一些实施方案中,每四周一次施用多西他赛。
42、根据本公开,可以以介于约3mg/kg与约20mg/kg之间,例如,介于约4mg/kg与约20mg/kg之间、介于约5mg/kg与约20mg/kg之间、介于约6mg/kg与约20mg/kg之间、介于约6mg/kg与约18mg/kg之间、介于约6mg/kg与约17mg/kg之间、介于约6mg/kg与约16mg/kg之间、介于约6mg/kg与约15mg/kg之间、介于约6mg/kg与约14mg/kg之间、介于约6mg/kg与约13mg/kg之间、介于约6mg/kg与约12mg/kg之间、介于约7mg/kg与约18mg/kg之间、介于约7mg/kg与约17mg/kg之间、介于约7mg/kg与约16mg/kg之间、介于约7mg/kg与约15mg/kg之间、介于约7mg/kg与约14mg/kg之间、介于约7mg/kg与约13mg/kg之间、介于约7mg/kg与约12mg/kg之间、介于约8mg/kg与约18mg/kg之间、介于约8mg/kg与约17mg/kg之间、介于约8mg/kg与约16mg/kg之间、介于约8mg/kg与约15mg/kg之间、介于约8mg/kg与约14mg/kg之间、介于约8mg/kg与约13mg/kg之间、介于约8mg/kg与约12mg/kg之间、介于约9mg/kg与约18mg/kg之间、介于约9mg/kg与约17mg/kg之间、介于约9mg/kg与约16mg/kg之间、介于约9mg/kg与约15mg/kg之间、介于约9mg/kg与约14mg/kg之间、介于约9mg/kg与约13mg/kg之间、介于约9mg/kg与约12mg/kg之间、介于约10mg/kg与约18mg/kg之间、介于约10mg/kg与约17mg/kg之间、介于约10mg/kg与约16mg/kg之间、介于约10mg/kg与约15mg/kg之间、介于约10mg/kg与约14mg/kg之间、介于约10mg/kg与约13mg/kg之间或介于约10mg/kg与约12mg/kg之间的剂量施用抗簇集蛋白抗体或其抗原结合片段。在一些实施方案中,以约6mg/kg的剂量施用抗簇集蛋白抗体或其抗原结合片段。
43、在一些实施方案中,以约9mg/kg的剂量施用抗簇集蛋白抗体或其抗原结合片段。
44、在一些实施方案中,以约12mg/kg的剂量施用抗簇集蛋白抗体或其抗原结合片段。
45、根据本公开,以约约60mg/m2至约100mg/m2,例如,约60mg/m2至约95mg/m2、约60mg/m2至约90mg/m2、约60mg/m2至约85mg/m2、约60mg/m2至约80mg/m2、约60mg/m2至约75mg/m2、约75mg/m2至约95mg/m2、约75mg/m2至约90mg/m2、约75mg/m2至约85mg/m2、约75mg/m2至约80mg/m2、约70mg/m2至约95mg/m2、约70mg/m2至约90mg/m2、约70mg/m2至约85mg/m2、约70mg/m2至约80mg/m2或约70mg/m2至约75mg/m2的剂量施用多西他赛。
46、在一些实施方案中,以约60mg/m2的剂量施用多西他赛。
47、在一些实施方案中,以约75mg/m2的剂量施用多西他赛。
48、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约12mg/kg的剂量每周一次治疗,并用多西他赛以约75mg/m2的剂量每三周一次治疗。
49、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约12mg/kg的剂量每周一次治疗,并用多西他赛以约60mg/m2的剂量每三周一次治疗。
50、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约9mg/kg的剂量每周一次治疗,并用多西他赛以约75mg/m2的剂量每三周一次治疗。
51、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约9mg/kg的剂量每周一次治疗,并用多西他赛以约60mg/m2的剂量每三周一次治疗。
52、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约6mg/kg的剂量每周一次治疗,并用多西他赛以约75mg/m2的剂量每三周一次治疗。
53、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约6mg/kg的剂量每周一次治疗,并用多西他赛以约60mg/m2的剂量每三周一次治疗。
54、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约3mg/kg的剂量每周一次治疗,并用多西他赛以约75mg/m2的剂量每三周一次治疗。
55、在一些实施方案中,受试者用抗簇集蛋白抗体或其抗原结合片段以约3mg/kg的剂量每周一次治疗,并用多西他赛以约60mg/m2的剂量每三周一次治疗。
56、在一些实施方案中,可在同一天施用抗簇集蛋白抗体或其抗原结合片段和多西他赛。
57、在一些实施方案中,可在同一天分别施用抗簇集蛋白抗体或其抗原结合片段和多西他赛。
58、在一些实施方案中,可在大约1小时的时间范围内通过输注施用抗簇集蛋白抗体或其抗原结合片段和/或多西他赛。
59、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛均在整个治疗期过程中施用。
60、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛基本上均在整个治疗期过程中施用。
61、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛均在治疗期的第一周期中施用,然后均基本上在治疗期的剩余周期中施用。
62、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛均在治疗期的第一个、前两个、前三个、前四个或前五个周期中施用,然后基本上均在治疗期的剩余周期中施用。
63、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段和多西他赛均在每个治疗周期施用。
64、在一些实施方案中,除抗簇集蛋白抗体或其抗原结合片段和/或多西他赛,有需要的受试者不接受同时治疗。
65、在一些实施方案中,除抗簇集蛋白抗体或其抗原结合片段和/或多西他赛外,有需要的受试者不需要同时治疗。
66、根据本公开,有需要的受试者是有需要的人。
67、根据本公开,有需要的受试者是患有表征为转移性的肿瘤的受试者。
68、根据本公开,有需要的受试者是患有癌症的受试者。
69、根据本公开,有需要的受试者是患有转移性癌的受试者。
70、根据本公开,有需要的受试者是患有或被选择为患有表征为免疫上冷性(immunologically cold)的肿瘤的受试者。
71、在一些实施方案中,有需要的受试者是患有或被选择为患有对免疫疗法无反应的表征为免疫上温性(immunologically warm)或热性(immunologically hot)的肿瘤的受试者。
72、在其它实施方案中,有需要的受试者是患有或被选择为患有在一线免疫检查点疗法治疗后进展的癌症的受试者。
73、在其它实施方案中,有需要的受试者是患有在利用含铂双重治疗和免疫检查点疗法(同时或依次地)的先前治疗中失败的癌症的受试者。
74、在其它实施方案中,受试者患有或被选择为患有在利用抗pd-1或抗pd-l1免疫检查点抗体和含铂双重治疗的先前治疗中失败的癌症。
75、在另外的实施方案中,有需要的受试者是患有或被选择为患有在利用含铂双重治疗和抗pd1或pd-l1免疫检查点抗体(例如,同时或依次地)的先前治疗中失败的癌症的受试者。
76、根据本公开,有需要的受试者患有表达或分泌簇集蛋白的肿瘤。
77、在示例性实施方案中,有需要的受试者可能患有例如子宫内膜癌、乳腺癌、肝癌、前列腺癌、肾癌、膀胱癌、宫颈癌、卵巢癌、结直肠癌、胰腺癌、肺癌、胃癌、头颈癌、甲状腺癌、胆管癌、间皮瘤、黑色素瘤。
78、根据本公开,有需要的受试者是患有非小细胞肺癌(nsclc)的受试者。
79、在一些实施方案中,有需要的受试者是患有转移性nsclc的受试者。
80、在一些实施方案中,有需要的受试者是患有iii至iv期nsclc的受试者。
81、根据本公开,有需要的受试者是患有乳腺癌的受试者。
82、在一些实施方案中,有需要的受试者是患有转移性乳腺癌的受试者。
83、根据本公开,有需要的受试者是患有前列腺癌的受试者。
84、在一些实施方案中,有需要的受试者是患有转移性前列腺癌的受试者。
85、根据本公开,有需要的受试者是患有胃癌的受试者。
86、在一些实施方案中,有需要的受试者是患有转移性胃癌的受试者。
87、根据本公开,有需要的受试者是患有头颈癌的受试者。
88、在一些实施方案中,有需要的受试者是患有转移性头颈癌的受试者。
89、根据本公开,有需要的受试者是患有甲状腺癌的受试者。
90、在一些实施方案中,有需要的受试者是患有转移性甲状腺癌的受试者。
91、根据本公开,有需要的受试者是患有卵巢癌的受试者。
92、在一些实施方案中,有需要的受试者是患有转移性卵巢癌的受试者。
93、根据本公开,有需要的受试者是患有子宫内膜癌的受试者。
94、在一些实施方案中,有需要的受试者是患有转移性子宫内膜癌的受试者。
95、根据本公开,有需要的受试者是患有肝癌的受试者。
96、在一些实施方案中,有需要的受试者是患有转移性肝癌的受试者。
97、根据本公开,有需要的受试者是患有结直肠癌的受试者。
98、在一些实施方案中,有需要的受试者是患有转移性结直肠癌的受试者。
99、根据本公开,有需要的受试者是患有胰腺癌的受试者。
100、在一些实施方案中,有需要的受试者是患有转移性胰腺癌的受试者。
101、根据本公开,有需要的受试者是患有胆管癌的受试者。
102、在一些实施方案中,有需要的受试者是患有转移性胆管癌的受试者。
103、根据本公开,有需要的受试者是患有间皮瘤的受试者。
104、在一些实施方案中,有需要的受试者是患有转移性间皮瘤的受试者。
105、根据本公开,有需要的受试者是患有黑色素瘤的受试者。
106、在一些实施方案中,有需要的受试者是患有转移性黑色素瘤的受试者。
107、根据本公开,有需要的受试者是在治疗前14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天、2天或1天内未受到免疫抑制或未接受免疫抑制药物治疗的受试者。
108、根据本公开,有需要的受试者是之前没有接受过多西他赛治疗的受试者。
109、根据本公开,对受试者进行一个或多个治疗周期的治疗。在一些实施方案中,一个治疗周期约为21天。
110、在示例性实施方案中,受试者接受至少一个治疗周期的治疗。
111、在另一个示例性实施方案中,受试者接受至少两个治疗周期的治疗。
112、在另外的示例性实施方案中,受试者接受至少三个治疗周期的治疗。
113、在又一另外的示例性实施方案中,受试者接受至少四个治疗周期的治疗。
114、在其它示例性实施方案中,受试者接受治疗或接受四个或更多、五个或更多、六个或更多、七个或更多、八个或更多、九个或更多、十个或更多、十一个或更多、十二个或更多、十三个或更多、十四个或更多、十五个或更多、十六个或更多、十七个或更多、十八个或更多、十九个或更多、二十个或更多治疗周期。
115、在一些实施方案中,治疗周期是连续的。
116、在一些实施方案中,治疗周期被中断一段时间(从一天至数周或数月)。在一些实施方案中,至少一个治疗周期被中断。在其它实施方案中,不止一个治疗周期被中断。在其它实施方案中,在由医师或临床医师确定的特定一段时间之后,中断治疗。
117、根据本公开,通过活组织检查证实了免疫细胞浸润到肿瘤微环境中。
118、根据本公开,通过成像(例如,磁共振成像)来确认免疫细胞浸润到肿瘤微环境中。
119、根据本公开,该方法包括在一个或多个周期的作为单一剂或与多西他的赛联合疗法中的抗簇集蛋白抗体或其抗原结合片段后,施用免疫疗法(免疫检查点抑制剂、细胞免疫疗法等)的步骤。
120、在一些实施方案中,免疫疗法包括细胞免疫疗法(car-t、til等)。
121、在一些实施方案中,免疫疗法包括免疫检查点抑制剂。
122、在一些实施方案中,该方法包括在一个或多个周期的作为单一剂的或与多西他赛的联合疗法中的抗簇集蛋白抗体或其抗原结合片段后,施用伊匹木单抗、纳武单抗、帕博利珠单抗、西米普利单抗、阿替利珠单抗、阿维单抗或德瓦鲁单抗的步骤。在一些实施方案中,用一个或多个周期的作为单一剂或与多西他赛的联合疗法中的抗簇集蛋白抗体或其抗原结合片段来治疗受试者,随后用他以前没有接受过的免疫检查点抑制剂治疗。
123、本公开还提供了包含抗簇集蛋白抗体或其抗原结合片段的药物,用于允许患有癌症的受试者中免疫细胞浸润到肿瘤(例如,实体瘤)微环境中。
124、在一些实施方案中,所述药物用于与多西他赛联合使用。
125、本公开还提供了用于治疗患有癌症的受试者的包含用于与多西他赛联合使用的抗簇集蛋白抗体或其抗原结合片段的药物,其中受试者具有功能性免疫系统或足够的器官和免疫功能。
126、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段被配制成浓度约为10mg/ml的注射液。
127、在一些实施方案中,抗簇集蛋白抗体或其抗原结合片段被配制成用于递送约3mg/kg至约20mg/kg的剂量的静脉输液。
128、在一些实施方案中,多西他赛被配制成浓度为约10mg/ml至约40mg/ml的注射液。
129、在一些实施方案中,多西他赛被配制成用于递送约60mg/m2至约100mg/m2的剂量的静脉输液。
130、本发明还提供了联合疗法,其包含含有被配制用于以约3mg/kg至约20mg/kg的剂量施用的抗簇集蛋白抗体或其抗原结合片段的药物组合物和含有被配制用于以约60mg/m2至100mg/m2的剂量施用的多西他赛的药物组合物。
131、根据本公开,抗簇集蛋白抗体或其抗原结合片段包含本文所述的cdr、可变区或轻链和重链。
132、根据本公开,联合疗法或药物用于治疗有需要的受试者或供治疗所述受试者使用。
133、根据本公开,联合疗法或药物用于治疗患有本文所述的癌症的受试者或供治疗所述受试者使用。
134、在一些示例性实施方案中,联合疗法或药物用于治疗患有癌症的受试者或供治疗所述受试者使用。
135、在一些示例性实施方案中,联合疗法或药物用于治疗患有转移性癌的受试者或供治疗所述受试者使用。
136、根据本公开,联合疗法或药物用于治疗患有或被选择为患有在一线免疫检查点疗法后进展的癌症的受试者或供治疗所述受试者使用。
137、根据本公开,联合疗法或药物用于治疗患有或被选择为患有在利用含铂双重治疗和免疫检查点疗法(例如,同时或依次地)的先前治疗中失败的癌症的受试者,或供治疗所述受试者使用。
138、根据本公开,联合疗法或药物用于治疗患有或被选择为患有在利用含铂双重治疗和抗pd或抗pd-l1免疫检查点抗体(例如,同时或依次地)的先前治疗中失败的癌症的受试者,或供治疗所述受试者使用。
139、在一些示例性实施方案中,联合疗法或药物用于治疗患有非小细胞肺癌的受试者或供治疗所述受试者使用。在一些实施方案中,受试者患有转移性nsclc或iii至iv期nsclc。
140、在一些示例性实施方案中,联合疗法或药物用于治疗患有乳腺癌、前列腺癌、胃癌、头颈癌、甲状腺癌或卵巢癌的受试者或供治疗所述受试者使用。
141、在其它示例性实施方案中,联合疗法或药物用于治疗患有转移性乳腺癌、转移性前列腺癌、转移性胃癌、转移性头颈癌、转移性甲状腺癌或转移性卵巢癌的受试者,或供治疗所述受试者使用。
142、在一些示例性实施方案中,联合疗法或药物用于未受免疫抑制或在治疗前7天内未接受免疫抑制药物治疗的受试者,或供所述受试者使用。
143、在一些示例性实施方案中,联合疗法或药物用于先前未接受多西他赛治疗的受试者或供所述受试者使用。
144、在一些实施方案中,包含抗簇集蛋白抗体或其抗原结合片段的药物组合物和包含多西他赛的药物组合物均在整个治疗期过程中施用。
145、根据本公开,抗簇集蛋白抗体或其抗原结合片段以本文公开的剂量使用或供使用。
146、根据本公开,多西他赛以本文公开的剂量使用或供使用。
147、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以12mg/kg的剂量每周使用或供使用一次,并且多西他赛以75mg/m2的剂量每三周使用一次。
148、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以12mg/kg的剂量每周使用或供使用一次,并且多西他赛以60mg/m2的剂量每三周使用一次。
149、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以9mg/kg的剂量每周使用或供使用一次,并且多西他赛以75mg/m2的剂量每三周使用一次。
150、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以9mg/kg的剂量每周使用或供使用一次,并且多西他赛以60mg/m2的剂量每三周使用一次。
151、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以6mg/kg的剂量每周使用或供使用一次,并且多西他赛以75mg/m2的剂量每三周使用一次。
152、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以6mg/kg的剂量每周使用或供使用一次,并且多西他赛以60mg/m2的剂量每三周使用一次。
153、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以3mg/kg的剂量每周使用或供使用一次,并且多西他赛以75mg/m2的剂量每三周使用一次。
154、在示例性实施方案中,抗簇集蛋白抗体或其抗原结合片段以3mg/kg的剂量每周使用或供使用一次,并且多西他赛以60mg/m2的剂量每三周使用一次。
155、本公开还提供了试剂盒,其包含一个或多个包含至少一个剂量的抗簇集蛋白抗体或其抗原结合片段的容器、一个或多个包含至少一个剂量的用于联合疗法的多西他赛的容器,以及包含用于治疗有需要的受试者的说明书的包装插页。
156、本公开的试剂盒包含本文公开的抗簇集蛋白抗体或其抗原结合片段。
157、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有癌症的受试者。
158、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性癌症的受试者。
159、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗如本文所公开的有需要的受试者。
160、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有在一线免疫检查点疗法后进展的癌症的受试者。
161、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有在利用含铂双重治疗和免疫检查点疗法(例如,同时或依次地)的先前治疗中失败的癌症的患者。
162、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有在利用含铂双重治疗和抗pd1或抗pd-l1免疫检查点抗体(例如,同时或依次地)的先前治疗中失败的癌症的受试者。
163、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有非小细胞肺癌(nsclc)诸如晚期nsclc、iii期nsclc和/或iv期nsclc的受试者。
164、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有乳腺癌的受试者。
165、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性乳腺癌的受试者。
166、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有前列腺癌的受试者。
167、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性前列腺癌的受试者。
168、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有胃癌的受试者。
169、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性胃癌的受试者。
170、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有头颈癌的受试者。
171、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性头颈癌的受试者。
172、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有甲状腺癌的受试者。
173、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性甲状腺癌的受试者。
174、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有卵巢癌的受试者。
175、在一些实施方案中,包装说明陈述了明联合疗法旨在用于治疗患有转移性卵巢癌的受试者。
176、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有子宫内膜癌的受试者。
177、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性子宫内膜癌的受试者。
178、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有肝癌的受试者。
179、在一些实施方案中,包装说明书声明联合疗法旨在用于治疗患有转移性肝癌的受试者。
180、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有结直肠癌的受试者。
181、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性结直肠癌的受试者。
182、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有胰腺癌的受试者。
183、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性胰腺癌的受试者。
184、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有胆管癌的受试者。
185、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性胆管癌的受试者。
186、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有间皮瘤的受试者。
187、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性间皮瘤的受试者。
188、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有黑色素瘤的受试者。
189、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗患有转移性黑色素瘤的受试者。
190、在一些实施方案中,包装说明陈述了明联合疗法旨在用于治疗患有未受免疫抑制或在治疗前7天内未接受免疫抑制药物的受试者。
191、在一些实施方案中,包装插页陈述了联合疗法旨在用于治疗之前未接受多西他赛治疗的受试者。
192、在一些实施方案中,包装插页陈述了基本上在整个治疗期过程中(例如,在整个治疗期中)施用联合疗法。
193、本发明还涉及试剂盒,其包含一个或多个含有至少一个剂量的本文所公开的药物的容器和含有用于治疗有需要的受试者的说明书的本文公开的包装插页,其中所述抗簇集蛋白抗体或其抗原结合片段和多西他赛在单独的容器中提供。
- 还没有人留言评论。精彩留言会获得点赞!