一种脑脱细胞基质的制备方法
1.本发明属于生物材料技术领域,具体涉及一种脑脱细胞基质的制备方法。
背景技术:
2.创伤性脑损伤(traumatic brain injury,tbi)是一种常见的中枢神经系统疾病,在临床上难以治愈。因为脑属于中枢神经系统,而中枢神经系统的神经元,由于其再生潜能较弱以及损伤环境对神经元再生的抑制作用,几乎不能再生。创伤性脑损伤可能会严重影响神经系统,导致患者的功能障碍,甚至威胁到他们的生命。对于此类疾病,干细胞治疗方案已被广泛应用,但传统的输注神经干细胞的治疗方法效果并不理想。于是,近年来研究者将目光转向了组织工程疗法,即在体外培养从体内分离的细胞并将其与生物支架复合,使细胞黏附或封装在生物支架中,然后植入损伤部位,最终实现组织再生。已有相关报道说明干细胞移植、生物支架、外源体是治疗此类疾病的理想方法。
3.细胞外基质(ecm)是分布在细胞外部空间的一种三维网架结构,主要由组织细胞分泌的蛋白、多糖等生物大分子构成。ecm对细胞生存和生长具有重要意义,它为细胞提供了必要的生存微环境,赋予了组织和器官一定的机械性能,对细胞具有连接、支持、保水、保护等作用。更重要的是,它可调控细胞的增殖、迁移、分化等生命活动。利用特定方法去除组织或器官内的细胞和可溶性蛋白可以得到无免疫原性或免疫原性极低的脱细胞基质,这种脱细胞后的ecm支架保留了组织的微环境,维持了天然的生物学结构,表现出优异的仿生性、生物相容性和细胞黏附性,作为组织工程学的构建基础,它比合成材料具有更大的优势,已被广泛用作再生医学的支架材料。研究表明,脱细胞基质支架联合间充质干细胞、神经干细胞等种子细胞的治疗方法对中枢神经系统的神经元修复与再生具有良好效果。
4.制备脱细胞基质既要最大程度地去除组织中的细胞成分、减小抗原性,又要尽可能地保留其三维超微结构、组织完整性和生物活性。目前,常用的脱细胞方法有物理法(冻融、加压、机械搅拌等)、化学法(酸碱、非离子型除垢剂、离子型除垢剂等)和生物法(核酸酶、脂肪酶、胰蛋白酶、螯合剂、毒素等)。然而,在脱细胞基质的构建过程中往往难以达到去细胞率和组织完整性之间的平衡。为了解决这一问题,一般联合多种方法制备脱细胞生物支架。脱细胞方法的选择需要综合考虑多种因素,比如组织来源和细胞数量。现有的脱细胞方法都会对组织造成一定破坏,需要尽可能减少这种破坏。由于脑组织的脆弱性,其脱细胞基质的制备具有一定难度,目前还没有公认的方法。因此,设计一种恰当的脑脱细胞方法来制备脑脱细胞基质对外伤性脑损伤的治疗具有深远意义。
技术实现要素:
5.本发明的目的在于提供一种脑脱细胞的方法,有效去除脑组织的细胞成分,保留了多种关键蛋白、细胞生长因子等成分。
6.本发明的第一方面,提供一种脑脱细胞基质的制备方法,所述制备方法包括以下步骤:
7.i)提取小鼠的脑作为脱细胞基质的原材料;
8.ii)采用物理法、化学法和生物法对小鼠的脑进行脱细胞处理得到脑脱细胞基质。
9.在另一优选例中,所述物理法为对材料进行冻融、加压和/或机械搅拌;
10.所述化学法为采用酸碱、非离子型除垢剂和/或离子型除垢剂处理材料;
11.所述生物法为使用核酸酶、脂肪酶、螯合剂-和/或毒素处理材料。
12.在另一优选例中,所述制备方法还包括对步骤ii)所得的脑脱细胞基质进行冷冻干燥。
13.在另一优选例中,冷冻干燥的脑脱细胞基质能够用于神经修复。
14.在另一优选例中,所述的冷冻干燥的温度为-80℃,冷冻干燥的时间为2~3d。
15.在另一优选例中,步骤i)包括以下步骤:提取小鼠的脑后去除小脑并延冠状面切成两半,用pbs溶液清洗后作为原材料。
16.在另一优选例中,所述pbs溶液中包含0.5-2.5v/v%,较佳为1-2v/v%青霉素-链霉素溶液(双抗)。
17.本发明中,每毫升青霉素-链霉素溶液包含10000单位青霉素和10000μg链霉素。在另一优选例中,步骤ii)中脱细胞处理包括以下步骤:
18.a)用液氮反复冻融原材料2-5次;
19.b)在20-30℃下(较佳25℃)用dh2o清洗5-15h(较佳6-12或8-10小时);
20.c)用2-6w/v%(较佳3-5w/v%或4w/v%)的脱氧胆酸钠(sdc)溶液处理10-20h(较佳12-18或14-16小时),用pbs溶液清洗20-60min(较佳30-40min);
21.d)在35-38℃(较佳37℃)下用30-50ku/ml(较佳34-45ku/ml或40ku/ml)的dna酶ⅰ溶液处理0.5-2.5h(较佳1-2小时),在20-30℃(较佳25℃)下用pbs溶液清洗20-60min(较佳30-40min),再用dh2o清洗3-5h(较佳3.5-4.5或4小时);
22.e)在20-30℃下用2-5v/v%(较佳2.5-4.5v/v%或3-4v/v%)的triton-x100溶液处理1-5h(较佳2-4小时),再用pbs溶液清洗20-60min(较佳30-40min);
23.f)在35-38℃(较佳37℃)下用30-50ku/ml(较佳34-45ku/ml或40ku/ml)的dna酶ⅰ溶液处理0.5-2.5h(较佳1-2小时),在20-30℃(较佳25℃)下用pbs溶液清洗20-60min(较佳30-40min)。
24.脱氧胆酸钠是一种离子型除垢剂,可以裂解细胞,溶解膜蛋白;triton-x100是一种非离子型除垢剂,其作用是增加膜的通透性、去除质膜内膜系统。
25.在另一优选例中,步骤a)中冻融是指在液氮中冷冻5-15min,融化升温至室温,用pbs溶液清洗5-30min。
26.在另一优选例中,步骤b)-f)进行两到四次。
27.在另一优选例中,步骤b)-f)中,在50-100rpm(较佳60-90rpm)的震荡条件下用dh2o、sdc溶液、dna酶ⅰ溶液、triton-x100溶液处理。
28.在另一优选例中,所述dh2o、sdc溶液、pbs、dna酶ⅰ溶液、triton-x100溶液中包含0.5-2.5v/v%、较佳为1-2v/v%的青霉素-链霉素溶液(双抗)。
29.本发明中,脱氧胆酸钠和triton-x100是以蒸馏水稀释的,然后加入了0.5-2.5v/v%,较佳为1-2v/v%的青霉素-链霉素溶液(双抗)。
30.本发明中,dna酶ⅰ所用溶剂是1m nacl溶液,配制为30-50ku/ml优选40ku/ml的dna
酶ⅰ溶液,再加入了0.5-2.5v/v%、较佳为1-2v/v%的青霉素-链霉素溶液(双抗)。
31.本发明的制备方法,包括:(1)提取小鼠的脑作为脱细胞基质的原材料;(2)对步骤(1)所提取的脑进行脱细胞处理得到脱细胞基质,整个脱细胞流程融合了物理法、化学法和生物法三种方法,脱细胞方法包含了冻融循环。制备方法还包括步骤(3):对步骤(2)所得脱细胞脑组织进行冷冻干燥,用于后续脱细胞基质基材料的制备。本发明中,冻融循环使脑组织形成细胞内冰晶破坏细胞膜、释放细胞内容物,多次反复冻融可使细胞结构破碎;离子型除垢剂脱氧胆酸钠(sdc)和非离子型除垢剂triton-x100的使用可以使细胞裂解、膜蛋白溶解、膜系统去除;dnaseⅰ使细胞内的dna水解;用蒸馏水和pbs溶液清洗的目的是冲出细胞破碎的成分。物理法、化学法和酶解法三种脱细胞方法的配合使用可以高效脱除脑组织的细胞。
32.本发明的第二方面,提供一种脑脱细胞基质,采用第一方面所述的制备方法获得。
33.本发明的第三方面,提供第二方面所述的脑脱细胞基质的用途,用于制备治疗创伤性脑损伤的基质材料或用于制备组织工程支架。
34.在另一优选例中,所述组织工程支架用作神经修复生物支架。
35.在另一优选例中,所述组织工程支架用于培养干细胞。
36.在另一优选例中,脑脱细胞基质用于创伤性脑损伤后中枢神经系统的损伤修复。
37.与现有技术相比,本发明的有益效果主要体现在:
38.(1)本发明的脑脱细胞基质制备方法通过物理法(冻融、振荡)、化学法(非离子型除垢剂、离子型除垢剂)和生物法(核酸酶)三种去细胞方法的配合使用,有效去除了脑组织的细胞成分,去细胞率高达95%以上。
39.(2)本发明的脱细胞方法基本保留了脑组织细胞外基质的显微结构,保留了所需的关键蛋白和生长因子,如胶原蛋白、层粘连蛋白(laminin)、糖胺聚糖(gag)、脑源性神经营养因子(bdnf)、神经生长因子(ngf)等。
40.(3)本发明的脱细胞方法为脑组织脱细胞提供了一种新的选择,本发明的脑脱细胞基质可以联合其它生物材料搭载种子细胞应用在创伤性脑损伤后中枢神经系统的损伤修复上面。
41.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。说明书中所揭示的各个特征,可以被任何提供相同、均等或相似目的的替代性特征取代。限于篇幅,在此不再一一累述。
附图说明
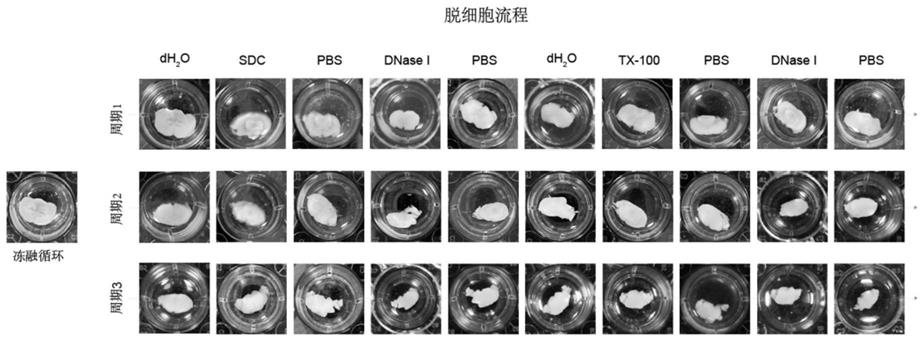
42.图1为本发明的脑组织脱细胞处理的过程图。
43.图2为本发明的脑组织脱细胞前后的dapi染色图,其中(a)和(b)分别为放大20倍观察到的未脱细胞和脱细胞的脑组织dapi染色图,(c)和(d)分别为放大60倍观察到的未脱细胞和脱细胞的脑组织he染色图。
44.图3为本发明的脑组织脱细胞前后的he染色图,其中(a)和(b)分别为放大5倍观察到的未脱细胞和脱细胞的脑组织he染色图,(c)和(d)分别为放大30倍观察到的未脱细胞和脱细胞的脑组织he染色图。
45.图4为本发明的脱细胞方法与只使用周期循环而未使用冻融循环的脱细胞方法的dna定量对比图,其中**是指在只使用周期循环脱细胞方法的实验组与使用本发明脱细胞方法的实验组之间进行t检验,p值小于0.01,表示两组之间有显著统计学差异。
46.图5为本发明的脑脱细胞基质中残留物质含量的检测结果图,其中(a)示出糖胺聚糖gag含量,(b)示出层粘连蛋白ln含量,(c)示出脑源性神经营养因子bdnf含量,(d)示出神经生长因子ngf含量。
具体实施方式
47.本技术的发明人经过广泛而深入地研究,研发出一种脑脱细胞基质的制备方法,脱细胞过程采用了冻融循环加周期循环的方法。此方法有效脱除了脑组织中具有免疫原性的细胞成分,由he染色和dapi染色可知,细胞基本去除;根据dna定量测定结果,脱细胞率高达95.0%~99.4%;酶联免疫吸附试验证实了脑脱细胞基质中保留了多种关键蛋白和因子。所得脑脱细胞基质可用于神经修复生物支架的制备。在此基础上,完成了本发明。
48.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件(如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件)或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
49.除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
50.实施例1
51.c57小鼠脑脱细胞基质的制备
52.利用颈脱位法对6-8周的c57bl/6小鼠进行处死,浸泡在75v/v%乙醇溶液中消毒2min,开颅取脑。将所提取的脑去除小脑并延冠状面切成质量相当的两半,浸泡在加了1%(v/v)双抗的pbs溶液中清洗。
53.对脑组织进行脱细胞,第一步是冻融循环处理。将脑组织置于1.5ml的ep管中,用液氮反复冻融3次:每次冷冻10min,约20min的时间融化升温至室温。然后用pbs溶液冲洗5~10min。
54.第二步是将脑组织转移至24孔板,在摇床上80rpm的振荡条件下进行周期循环脱细胞,所用试剂均加入了1%(v/v)双抗(gibco,15140-122)。如图1所示,首先在25℃下用dh2o清洗7h,用4w/v%(如4g sdc粉末溶于100ml dh2o)的脱氧胆酸钠(sdc,sigma,30970)处理14h,再用pbs溶液清洗30min;然后在37℃下用40ku/ml的dna酶ⅰ(sigma,d4263)处理1h,在25℃下用pbs溶液清洗30min,再用dh2o清洗4h;进一步地,在25℃的条件下用3v/v%(如3ml triton-x100溶于97ml dh2o)的triton-x100(sigma,x100)处理2h,继续用pbs溶液清洗30min;最后,再一次于37℃下用40ku/ml的dna酶ⅰ处理1h,在25℃下用pbs溶液清洗30min。
55.上述第二步的周期循环脱细胞再进行两个周期,得到小鼠的脑脱细胞基质,储存于-20℃,再经-80℃冷冻干燥后可用于生物支架的构建。
56.实施例2
57.c57小鼠脑脱细胞基质的评价
58.1.组织学评价
59.对实施例1获得的脱细胞的脑(即脑脱细胞基质)进行细胞核去除效果的评估。为此,用4%多聚甲醛在室温下固定脱细胞脑切片和未脱细胞脑切片,用4’,6-二脒基-2-苯基吲哚(dapi)染色,用共聚焦显微镜观察。dapi染色图如图2所示,结果表明:脱细胞后的脑组织中未见细胞核残留。
60.另外,用he染色验证脱细胞的效果,如图3所示,表明本发明的脱细胞方法脱细胞效果好,细胞核残留少。
61.对脑脱细胞基质中dna含量进行定量检测。利用dneasy blood&tissue kit(qiagen,hilden,germany)提纯dna,然后用荧光定量仪(thermo fisher scientific,waltham,usa)定量检测dsdna含量。检测结果如图4所示,该脱细胞方法脱除了脑组织98.2%(脱细胞过程中脱除的dsdna含量与未脱细胞脑组织中dsdna含量的比值)的dsdna,进一步说明了该脱细胞方法的有效性。
62.2.分子生物学评价
63.用小鼠糖胺聚糖(gag)酶联免疫吸附测定试剂盒(购买自上海酶联生物科技有限公司)定量表征脱细胞后脱细胞基质内gag的含量。
64.用小鼠层粘连蛋白(ln)酶联免疫吸附测定试剂盒(购买自上海酶联生物科技有限公司)定量表征脱细胞后脱细胞基质内ln的含量。
65.用上述试剂盒分别测定脑组织中gag和ln的含量,测试步骤一致,如下所述:
66.(1)将脑组织剪碎,以1∶10的重量体积比加入pbs溶液,用玻璃匀浆器充分匀浆。之后4℃,3000rpm离心15min,取上清液作为待测样本。
67.(2)从试剂盒中拿出所需板条,平衡至室温。设置标准品孔和样本孔,标准品孔各加不同浓度的标准液50μl,样本孔中加待测样本50μl,空白孔不加。
68.(3)样本孔加入生物素标记抗体50μl,标准品孔和空白孔不加,用封板膜封住反应孔,37℃恒温箱温育30min。
69.(4)弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。
70.(5)除空白孔外,标准品孔和样本孔每孔加入辣根过氧化物酶(hrp)标记的检测抗体100μl,用封板膜封住反应孔,37℃恒温箱温育30min。
71.(6)弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。
72.(7)每孔加入底物a、b各50μl,37℃避光孵育15min。
73.(8)每孔加入终止液50μl,15min内在450nm波长处测定各孔的od值。
74.(9)根据标准品孔的od值和相对应的标准品浓度绘制标准曲线,根据标准曲线方程计算出各样本浓度值,再推算出脑组织中的gag或ln含量。
75.测定结果如图5所示,以未脱细胞脑组织为依照,脑脱细胞基质中gag保留了70.0%(脱细胞脑组织中gag的含量与未脱细胞脑组织中gag含量的比值),ln保留了79.4%(脱细胞脑组织中ln的含量与未脱细胞脑组织中ln含量的比值)。同样,脱细胞基质中bdnf
和ngf含量的测定结果显示这两种因子在脱细胞过程中基本没有损失。这些结果证明了本发明的脱细胞方法可以保留脑组织中的一些关键蛋白和因子。
76.实施例3
77.利用颈脱位法对6-8周的c57bl/6小鼠进行处死,浸泡在75%乙醇溶液中消毒2min,开颅取脑。将所提取的脑去除小脑并延冠状面切成质量相当的两半,浸泡在加了2%(v/v)双抗的pbs溶液中清洗。
78.对脑组织进行脱细胞,第一步是冻融循环处理,同实施例1,进行3次冻融循环。
79.第二步是在摇床上60rpm的振荡条件下进行周期循环脱细胞,所用试剂均加入了2%(v/v)双抗。首先在25℃下用dh2o清洗7h,用4w/v%的脱氧胆酸钠(sdc)处理12h,再用pbs溶液清洗30min;然后在37℃下用40ku/ml的dna酶ⅰ处理1h,在25℃下用pbs溶液清洗30min,再用dh2o清洗3h;进一步地,在25℃的条件下用1v/v%的triton-x100处理2h,继续用pbs溶液清洗30min;最后,再一次于37℃下用40ku/ml的dna酶ⅰ处理1h,在25℃下用pbs溶液清洗30min;上述第二步的周期循环脱细胞再进行两个周期,得到小鼠的脑脱细胞基质。
80.采用实施例2的方法对脱细胞的脑进行细胞核去除效果的评估。进行dapi染色和he染色验证脱细胞的效果,再对脑脱细胞基质中dna含量进行定量检测。检测结果表明该脱细胞方法去细胞率达到95.0%。
81.酶联免疫吸附试验结果显示,脱细胞基质中保留了74%的gag和85%ln以及90%以上的bdnf和ngf(分别为gag、ln、bdnf和ngf在脱细胞脑组织中的含量与未脱细胞脑组织中的含量的比值)。
82.实施例4
83.利用颈脱位法对6-8周的c57bl/6小鼠进行处死,浸泡在75%乙醇溶液中消毒2min,开颅取脑。将所提取的脑去除小脑并延冠状面切成质量相当的两半,浸泡在加了2%(v/v)双抗的pbs溶液中清洗。之后,对脑组织进行脱细胞,用液氮反复冻融5次:每次冷冻10min,融化升温至室温。然后用pbs冲洗5~15min。第二步是在摇床上80rpm的振荡条件下进行周期循环脱细胞,所用试剂均加入了2%(v/v)双抗。首先在25℃下用dh2o清洗10h,用4w/v%的脱氧胆酸钠(sdc)处理14h,再用pbs溶液清洗60min;然后在37℃下用40ku/ml的dna酶ⅰ处理2h,在25℃下用pbs溶液清洗60min,再用dh2o清洗5h;进一步地,在25℃的条件下用3v/v%的triton-x100处理4h,继续用pbs溶液清洗60min;最后,再一次于37℃下用40ku/ml的dna酶ⅰ处理2h,在25℃下用pbs溶液清洗60min;上述第二步的周期循环脱细胞再进行两个周期,得到小鼠的脑脱细胞基质。
84.采用实施例2的方法对脱细胞的脑进行细胞核去除效果的评估。进行dapi染色和he染色定性表征以及dna含量定量检测。检测结果表明该脱细胞方法去细胞率达到99.4%。
85.酶联免疫吸附试验结果显示,脱细胞基质中保留了50%的gag和70%ln以及80%的bdnf和ngf。
86.对比例1
87.参照实施例1,脑组织不经冻融循环处理,只进行周期循环处理。所用试剂、处理时间、处理条件均一致。
88.采用实施例2的方法对脱细胞的脑进行细胞核去除效果的评估。进行dapi染色和he染色定性表征以及dna含量定量检测。如图4所示,检测结果表明该脱细胞方法去细胞率
仅能达到83.7%。
89.对比例2
90.参照实施例4,脑组织不经冻融循环处理,只进行周期循环处理。所用试剂、处理时间、处理条件均一致。
91.采用实施例2的方法对脱细胞的脑进行细胞核去除效果的评估。dna含量定量检测结果表明该脱细胞流程去细胞率仅为86.2%。
92.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1