骨髓间充质干细胞外泌体的应用
1.本发明涉及生物及医学领域,尤其涉及骨髓间充质干细胞外泌体的应用。
背景技术:
2.肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,hiri)是指肝外科手术过程中阻断肝脏血流供应一段时间后恢复血流供应,肝脏功能障碍和结构损伤不仅没有减轻,反而加重的病理现象。hiri是肝外伤处理、肝叶切除、肝移植等常见的临床问题,可导致器官功能衰竭、增加排斥反应的发生率,对患者的预后及生存具有很大的影响。截至目前,临床上仍缺乏行之有效的干预措施。在缺血再灌注过程中,细胞处于氧化应激状态,出现内质网应激和钙超载、线粒体肿胀和外膜断裂、细胞色素c释放,从而促发凋亡信号通路,导致细胞凋亡的发生。
3.间充质干细胞(mesenchymal stem cells,mscs)是临床实践中用于免疫调节、器官重建和组织修复的最广泛使用的干细胞类型之一,可在静息或缺氧、应激、辐射和氧化损伤等刺激下分泌外泌体(exosome,exo)。外泌体被认为是一种新的治疗工具,用于递送功能性蛋白质、mrna、mirna和lncrna,将生物活性分子运送到受体细胞以调节细胞功能,其与干细胞相比具有更高的生物安全性和更稳定的信号转导效率,可以作为无细胞治疗的强有力的候选物。研究表明间充质干细胞外泌体能调控细胞凋亡,减轻肝缺血再灌注损伤,但是,干细胞外泌体中含有多种生物活性物质,对于干细胞外泌体减轻肝缺血再灌注损伤的作用机制需要进行深入研究。
技术实现要素:
4.为了克服现有技术的不足,本发明的目的之一在于提供一种骨髓间充质干细胞外泌体的应用。
5.本发明的目的之一采用如下技术方案实现:一种骨髓间充质干细胞外泌体在制备用于治疗肝脏缺血再灌注损伤的药物中的应用,所述药物用于抑制mapk/erk信号通路和pi3k/akt信号通路。
6.作为一种实施方式,所述骨髓间充质干细胞外泌体包含mir-25-3p。
7.本发明的目的之二在于提供一种骨髓间充质干细胞外泌体来源的mirna在制备用于治疗肝脏缺血再灌注损伤的药物中的应用。
8.本发明的目的之二采用如下技术方案实现:一种骨髓间充质干细胞外泌体来源的mirna在制备用于治疗肝脏缺血再灌注损伤的药物中的应用,所述药物用于抑制mapk/erk信号通路和pi3k/akt信号通路。
9.作为一种实施方式,所述mirna为mir-25-3p。
10.本发明的目的之三在于提供一种用于治疗肝脏缺血再灌注损伤的药物。
11.本发明的目的之三采用如下技术方案实现:一种用于治疗肝脏缺血再灌注损伤的药物,所述药物含有抑制mapk/erk信号通路和pi3k/akt信号通路的组分。
12.作为一种实施方式,所述药物含有mir-25-3p。
13.相比现有技术,本发明的有益效果在于:本发明发现人骨髓间充质干细胞外泌体来源的mirnamir-25-3p通过抑制mapk/erk和pi3k/akt信号通路抑制hiri损伤诱导的肝细胞凋亡,进而能够减轻肝缺血再灌注损伤。因此,本发明为hiri的治疗提供了新的思路。
附图说明
14.图1a为本发明实施例提供的zetaview检测外泌体的直径大小结果图;
15.图1b为本发明实施例提供的采用透射电镜显示外泌体的形态特征图;
16.图1c为本发明实施例提供的蛋白质印迹检测外泌体标志蛋白的结果图;
17.图2为本发明实施例提供的bmscs外泌体注入hiri小鼠体内,分别再灌注3h、6h、9h后血清中的alt和ast的含量结果图;
18.图3为本发明实施例提供的qrt-pcr检测mir-25-3p在hiri小鼠肝脏及其对照ck、bmscs、bmscs-exo、bmscs-exo处理hiri小鼠组及其对照pbs处理hiri小鼠组中的含量结果图;
19.图4a和图4b为本发明实施例提供的tunel检测肝组织细胞凋亡情况的结果图;其中,图4a中的白色的细胞表示凋亡细胞,灰色的细胞表示正常细胞;
20.图4c为本发明实施例提供的qrt-pcr检测肝组织中gsdmd和nlrp3mrna的含量的结果图;
21.图4d和图4e为本发明实施例提供的western blot检测肝组织中caspase1的含量的结果图;其中,图4d的1和2道为生理盐水ns,3和4道为mir-25-3p agomir;
22.图4f为本发明实施例提供的qrt-pcr检测aml12细胞炎症相关基因含量的结果图;
23.图5a为本发明实施例提供的mir-25-3p模拟物处理缺血再灌注损伤小鼠后,血清中alt和ast的含量的结果图;
24.图5b为本发明实施例提供的mir-25-3p模拟物处理肝缺血再灌注小鼠后,肝组织he染色结果图;
25.图6a和图6b为本发明实施例提供的western blot检测肝组织中p-akt和p-erk的表达的结果图;其中,图6a中的1和2道表示ns,3和4道表示agomir;
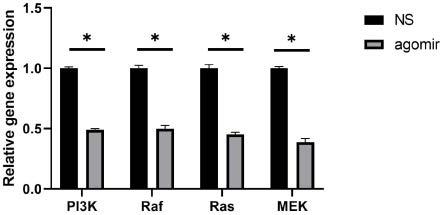
26.图6c为本发明实施例提供的qrt-pcr检测肝组织中pi3k、raf、ras、mek基因mrna的含量的结果图;
27.图6d为本发明实施例提供的qrt-pcr检测aml12缺氧复氧肝细胞中pi3k和mek基因mrna的含量的结果图。
具体实施方式
28.下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。文中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年出版的《分子克隆实验指南》一书中所述的条件,或按照制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,
任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。
29.一、实验方法
30.1、bmscs外泌体的收集、纯化和鉴定
31.人骨髓间充质干细胞(bmscs)购买于武汉普诺赛生命科技有限公司(cp-h166),培养于含10%胎牛血清的dmem培养基中,在细胞达到70%-80%融合时,用pbs冲洗,1:3接种到无血清培养基中培养48h后,在4℃下收集上清液,300g离心10min,保留上清;2000g再次离心10min,保留上清;10000g离心30min,保留上清;使用0.22μm滤膜过滤后,在100000g下离心2h,保留沉淀。加入pbs混匀,在100000g下再次离心2h,保留沉淀,沉淀即为较纯外泌体。在外泌体中加入100μl pbs,冻存于-80℃冰箱。颗粒分析仪检测外泌体直径。透射电子显微镜观察外泌体形态。western blot鉴定外泌体表面标志物。
32.2、实验动物
33.spf级雄性昆明小鼠,体重20-25g,购买于湖南斯莱克景达实验动物有限公司(生产许可证:scxk(湘)2021-0002)。喂食普通小鼠饲料,自由引用过滤自来水。室温22℃
±
1℃,湿度65%
±
5%,12h光照/黑暗交替。动物实验方案得到了桂林医学院动物伦理委员会的审核和批准。实验过程严格按照实验动物福利伦理审查指南中华人民共和国国家标准(gb/t 35892-2018)实施。
34.3、mir-25-3p模拟物的来源
35.从广州锐博生物科技有限公司购买用于细胞的mir-25-3p的模拟物mir-25-3p mimic及其对照mir-25-3p mimic nc,以及用于动物的mir-25-3p的模拟物mir-25-3p agomir。用生理盐水(ns)作为mir-25-3p agomir的对照。。
36.4、小鼠肝脏缺血再灌注损伤模型制备
37.小鼠分为实验组(agomir)和对照组(ns),每组3只。术前24h每只小鼠通过尾静脉注射100μl生理盐水稀释的13nmol agomir或100μl生理盐水。术前12h禁食,自由饮水。4%水合氯醛以0.1ml/10g腹腔注射麻醉,用胶带固定四肢。70%酒精消毒,从腹部正中纵行开口,分别剪开皮肤层和肌肉层,上至剑突。暴露肝左叶和中叶,用无创血管夹夹闭中叶和左叶的肝动脉和门静脉。夹闭过程中切口覆盖湿纱布,将小鼠放在37℃恒温加热垫上保温。完成持续缺血60min后,迅速取出血管夹,恢复缺血肝血流,逐层缝合腹腔肌肉和皮肤,消毒切口。小鼠于再灌注6h取材。
38.5、细胞缺氧复氧模型
39.小鼠肝细胞(aml12)购买自中国科学院典型培养物保藏委员会细胞库(scsp-550)。用含有10%胎牛血清的dmem培养基培养细胞。细胞提前24h按照1.5
×
105~2.5
×
105个/孔的密度铺在24孔板中。待细胞覆盖率达到60%~70%左右时,转染mir-25-3p mimic及其对照mir-25-3p mimic nc 100nm。24h后细胞在缺氧条件下(5%co2、1%o2和94%n2,37℃)用pbs培养6h,然后在正常条件下培养12h。
40.6、血清学指标检测
41.小鼠于再灌注6h小鼠眼球采血,室温静置30min,然后1800g 15min 4℃离心,取上层血清,利用南京建成生物工程研究所的试剂盒测定血清中的天冬氨酸氨基转移酶(ast)和丙氨酸氨基转移酶(alt)的水平,波长510mm的酶标仪测定各孔od值。
42.7、tunel实验
43.肝组织用4%多聚甲醛固定48h,梯度酒精脱水,石蜡包埋,石蜡切片机切片,厚度4μm。60℃烤箱中烘烤4.5h,脱蜡,梯度酒精水化。proteinase k 37℃处理组织20min,每个组织上加50μl tunel反应混合液,在37℃湿盒避光反应1h;滴加dapi染色液100ul,恒温孵育盒避光室温孵育20min;水溶性封片剂封片。用荧光显微镜,绿色波长488nm、红色波长596nm观察并拍照,计算tunel阳性率。
44.8、苏木精-伊红(he)染色实验
45.肝组织用4%多聚甲醛固定48h,梯度酒精脱水,石蜡包埋,石蜡切片机切片,厚度4μm。60℃烤箱中烘烤4.5h,脱蜡,梯度酒精水化。苏木精染色5min,盐酸乙醇分化30sec,伊红染色5min。梯度酒精脱水,中性树胶封固。光学显微镜观察。
46.9、实时定量pcr(qrt-pcr)实验
47.使用生工生物工程(上海)股份有限公司的uniq-10柱式trizol总rna抽提试剂盒提取aml12细胞或肝组织中mrna和mirna。采用分光光度计测定od260值以及od260/280比值,根据od260计算rna浓度,1%琼脂糖凝胶电泳鉴定总rna完整性。使用maxima reverse transcriptase(thermo scientific)将mirna和mrna反转录为cdna。采用2x sg fast qpcr master mix(high rox,b639273,bbi,abi)对mrna进行qrt-pcr,根据使用说明书对mirna进行ribobio mirna检测。采用2-ddct法测定基因的相对表达量。mrna和mirna表达的内源性对照分别为gapdh和u6。各引物序列如下:
[0048][0049][0050]
10、western blot实验
[0051]
将肝组织或细胞加入蛋白酶抑制剂、ripa裂解液提取总蛋白。使用bca蛋白定量试剂盒(solarbio)测定蛋白浓度。根据蛋白分子量选取不同浓度(10%-15%)分离胶进行电泳分离,用甲醇活化pvdf膜,安装“三明治”结构,将蛋白通过电泳转移到pvdf膜上,5%脱脂牛奶室温封闭1h。pbst洗膜三次,一抗4℃孵育过夜,二抗37℃孵育1h。pbst洗膜三次,用ecl试剂盒(millipore)检测蛋白条带。凝胶成像系统扫描并定量分析条带的光密度值。
[0052]
11、透射电镜
[0053]
2%多聚甲醛-2.5%戊二醛预固定的肝细胞,冷缓冲液漂洗15min
×
3次,1%锇酸常温固定2h,梯度乙醇脱水,环氧丙烷置换两次,环氧丙烷与epon 812树脂混合物浸透过夜,epon 812树脂包埋,35℃聚合24h,45℃12h,55℃12h和60℃24h,半薄切片定位后,玻璃刀50nm超薄切片,醋酸双氧铀和枸橼酸铅双重电子染色,jem-1230型透射电镜观察。细胞消化后把细胞制成悬液才能进行包埋和切片,外泌体电镜外泌体滴于孔径2nm的载体铜网上,静置2min,3%磷钨酸负染5min,jem-1230型透射电镜观察。
[0054]
12、统计学分析
[0055]
采用spss 25.0统计软件进行分析,p《0.05为差异具有统计学意义。
[0056]
二、实验结果
[0057]
1、bmscs外泌体的分离与鉴定
[0058]
收集p3代bmscs细胞培养上清,进行差速离心,获得的外泌体用颗粒分析仪检测外泌体的颗粒大小。图1a为zetaview检测外泌体的直径大小结果图;图1b为采用透射电镜显示外泌体的形态特征图;图1c为蛋白质印迹(western blot)检测标志蛋白的结果图。具体结果如下:zetaview检测所提纯外泌体中颗粒直径约为60-200nm。透射电镜显示外泌体直径约为60-200nm,胞内可见低电子密度成分,呈圆形或椭圆形,细胞膜结构完整。western blot显示在外泌体中cd9和cd63是阳性,calnexin是阴性。
[0059]
2、bmscs外泌体能改善hiri造成的肝损伤
[0060]
为检测bmscs外泌体对hiri小鼠的影响,把100μg bmscs外泌体溶解于100μl pbs,通过尾静脉注射入hiri小鼠中,分别再灌注3h、6h、9h通过眼球采血检测血清中的alt、ast含量。请参阅图2,结果显示在再灌注3h、6h、9h三个时间点,bmscs外泌体注射组的alt和ast均低于pbs注射组。
[0061]
3、mir-25-3p参与bmscs外泌体减轻hiri损伤
[0062]
为明确mir-25-3p与bmscs外泌体减轻hiri损伤的相关性,通过qrt-pcr检测了mir-25-3p在hiri小鼠肝脏及其对照ck、bmscs、bmscs-exo、bmscs-exo处理hiri小鼠组及其对照pbs处理hiri小鼠组中的含量。请参阅图3,可以看出mir-25-3p在hiri肝脏中表达低于ck组;bmscs和bmscs-exo均含有mir-25-3p;当通过尾静脉把bmscs-exo转入hiri小鼠后,肝组织内mir-25-3p含量提高。因此,mir-25-3p存在于bmscs及其外泌体中,并参与bmscs外泌体减轻hiri损伤。
[0063]
4、mir-25-3p抑制细胞凋亡
[0064]
mir-25-3p模拟物agomir可使动物体内mir-25-3p过表达,通过尾静脉注射入hiri小鼠体内,于再灌注6h取肝脏制作石蜡切片,tunel实验检测细胞凋亡情况,用dapi标记细胞核。请参阅图4a和图4b,结果显示,实验组(agomir组)小鼠tunel阳性细胞率低于注射生理盐水组(ns组)。请参阅图4c,qrt-pcr检测显示实验组肝组织中gsdmd和nlrp3 mrna的含量也低于生理盐水组。请参阅图4d和图4e,实验组肝组织中caspase1蛋白的含量低于ns组。mir-25-3p模拟物mimic可使细胞内mir-25-3p过表达,将mir-25-3p mimic及对照nc转入至aml12缺氧复氧肝细胞中,qrt-pcr检测炎症相关基因含量,请参阅图4f,发现tnf-α、il-6、il-1b和il-18含量低于对照组,并且tnf-α和il-1b达到显著性差异。
[0065]
5、mir-25-3p减轻肝损伤
[0066]
血清alt和ast水平一般可反映肝细胞损伤程度。用mir-25-3p agomir转入hiri小
鼠后,眼球采血,检测血清中alt和ast的含量。请参阅5a,结果表明,mir-25-3p组的alt和ast含量低于对照ns组,alt含量显著下降。请参阅5b,观察肝组织结构发现实验组肝小叶结构完整,肝细胞索排列较整齐,细胞质均匀,而对照ns组肝小叶结构不清晰,肝细胞排列紊乱,有不同程度增大,出现空泡样变性、炎性浸润。
[0067]
6、mir-25-3p调控mapk/erk和pi3k/akt信号通路
[0068]
为阐明mir-25-3p调控细胞凋亡的信号通路,取实验组和对照组小鼠肝组织进行检测。请参阅图6a和图6b,western blot结果显示mir-25-3p的过表达明显抑制p-akt和p-erk的表达。请参阅图6c,qrt-pcr结果显示pi3k、raf、ras和mek含量也低于对照组。当aml12细胞转入mir-25-3p mimic以后,请参阅图6d,qrt-pcr也显示pi3k和mek mrna含量降低。其中,raf、ras、mek和erk为mapk/erk信号通路的相关因子,pi3k和akt是pi3k/akt信号通路的相关因子。由此可以说明,mir-25-3p抑制mapk/erk信号通路和pi3k/akt信号通路。
[0069]
7、小结
[0070]
本发明实施例中,通过上述的实验及分析,可以看出,mir-25-3p在hiri小鼠肝脏中表达下调,当把bmscs外泌体注射入hiri小鼠后可以减轻hiri,并且实验验证mir-25-3p存在于bmscs及其外泌体中,并参与bmscs外泌体减轻hiri损伤。
[0071]
通过将mir-25-3p转染到小鼠肝细胞aml12缺氧复氧模型后,qrt-pcr显示炎性因子tnf-α、il-6、il-1β、il-18表达量下降。mir-25-3p还会引起hiri小鼠肝组织中细胞凋亡相关因子caspase-1、nlrp3、gsdmd表达量下降。由此说明,mir-25-3p在hiri中起着抑制炎症和细胞凋亡的作用,并通过检测血清中alt、ast含量,以及肝组织结构观察可以得出mir-25-3p能够减缓肝损伤。
[0072]
一些研究发现细胞通讯网络因子1(cellular communication network factor 1,ccn1)下调可降低c57bl/6hiri小鼠alt、ast水平、mpo活性、il-6和tnf-α水平,抑制mek/erk信号通路,减轻炎症反应和肝损伤。并有研究也发现脑蛋白酶i(cerebroprotein hydrolysate-i,ch-i)通过抑制脑缺血/再灌注损伤后mek-erk-creb的表达,提高bdnf的表达,从而起到神经保护作用,改善大脑中动脉栓塞大鼠的神经行为功能。从而,说明抑制mek/erk信号通路可以减轻炎症反应,对缺血/再灌注的器官起保护作用。另有研究发现奥曲肽(octreotide,oct)可通过抑制pi3k/akt/mtor/s757-ulk1信号通路抑制p62表达,并提高beclin-1、atg7和lc3的表达,导致肝脏自噬,维持一系列抗氧化和抗炎级联反应,对缺血再灌注损伤的肝脏起保护作用。同时,pi3k/akt通路参与对细胞凋亡的调控。并有研究发现脊髓损伤后tlr4被激活,促进了lncrna-f630028o10rik的表达。该lncrna作为mir-1231-5p/col1a1轴的cerna,通过激活pi3k/akt通路增强脊髓损伤后小胶质细胞的凋亡。从而,说明抑制pi3k/akt信号通路可以减轻炎症反应,对缺血/再灌注的器官起保护作用。因此,抑制mek/erk信号通路和pi3k/akt信号通路可以减轻炎症反应,对缺血/再灌注的器官起保护作用。
[0073]
本技术通过实验发现,mir-25-3p降低mapk/erk信号通路raf、ras、mek和erk的含量,也降低pi3k/akt信号通路pi3k和akt的含量。因此,mir-25-3p抑制mapk/erk信号通路和pi3k/akt信号通路。
[0074]
综上所述,mir-25-3p通过抑制mapk/erk和pi3k/akt信号通路抑制hiri损伤诱导的肝细胞凋亡,从而改善hiri,为hiri的治疗提供了新的思路。
[0075]
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1