一种用于皮肤组织损伤的细胞因子冻干粉的制备方法与流程
1.本发明属于细胞因子冻干粉领域,尤其是涉及一种用于皮肤组织损伤的细胞因子冻干粉的制备方法。
背景技术:
2.皮肤组织的损伤常由机械性、物理性、化学性和生物性等因素引起,机体对形成的损伤进行修补的过程称为组织修复。传统意义的美容行业针对肌肤损伤主要是通过植皮术、激光、冷冻、手术切除、磨削术、注射地塞米松等方式。植皮术就是在自身健康皮肤处取下一部分皮肤,用来覆盖切除了瘢痕的区域。供区的皮肤需要在受区得到新的血管供血才能够成活。一般情况下,自体皮肤移植成功的几率较大;激光这个被现代人所熟知光学武器,它对脱毛有一定的功效,但它对疤痕却是无能为力,许多疤痕增生或疤痕疙瘩的患者为了急于求成,他们采用激光,其结果是疤痕处当时平整了,但伴随着红肿,出血,需要吃消炎药,不小心容易感染,且极大可能出现二次剧烈增生,疤痕长的又快又高。冷冻由于冷冻操作难控制强度及深度,同时组织对低温的抵抗力不同,出现治疗不彻底,复发率高,容易造成组织缺损,色素脱失。磨削术一般用于青春痘留下的凹坑和炎性增生疤痕采用此法,这种办法可谓是磨轻了,不明显,磨重了,皮肤组织缺损,极易留下色素沉淀。注射地塞米松极易反弹,长期使用者免疫力下降,容易不孕不育,疤痕疙瘩采用此法。
3.随着分子生物学的发展,对组织损伤修复的认识逐步深入,有关组织修复过程又被看做是各种修复细胞的增值、分化、迁移、调往和消失的过程。同时组织修复还是一系列不同类型的修复细胞、结构蛋白和生长因子等形成网络式交互作用的结果。由损伤周围的同种细胞进行结构和功能修复称为再生,若完全恢复伤前组织的机构和功能,称为完全再生,由县委结缔组织来修复,称为县委修复或瘢痕修复。
4.诸多证据表明,细胞因子对创口愈合有重要的作用,这些细胞通过不同的机制对创口炎症反应、上皮再生、肉芽组织形成、血管形成和细胞外基质的产生有重要作用。细胞因子包含多种生长因子,有表皮细胞生长因子(egf)、成纤维细胞生长因子(fgf)、角化细胞生长因子(kgf)、转化生长因子(tgf-β)、血管内皮生长因子等(vegf)。现有的细胞因子用于制备皮肤组织损伤,提取方法复杂,活性低。
技术实现要素:
5.针对现阶段用于治疗皮肤组织损伤的细胞因子,提取方法复杂,活性低问题,本发明提供了一种用于皮肤组织损伤的细胞因子冻干粉的制备方法,通过单核-巨噬细胞的培养,诱导得到间充质干细胞,加入辅料冻干即得。采用上述方法获得细胞因子活性好。
6.本发明的技术方案如下:一种用于皮肤组织损伤的细胞因子冻干粉的制备方法,包括以下步骤:(1) 单核-巨噬细胞的培养:取新鲜脐带血,密度梯度离心法获得thp-1单核细胞,培养thp-1单核细胞,用于建立巨噬细胞系,在培养基中加入佛波酯,培养后thp-1单核细胞
分化为巨噬细胞;(2) 间充质干细胞的诱导培养:向步骤(1)巨噬细胞培养的细胞培养基,加入vb12和vc,继续培养,培养结束后收集细胞上清;(3) 细胞因子冻干粉的制备:将步骤(2)的上清液,加入甘露醇、海藻糖、聚山梨醇80、烟酰胺,冻干后即得。
7.优选地,步骤(1)所述培养基为:含有10%胎牛血清的rpmi-1640培养基;佛波酯加入的浓度10 ng/ml。
8.优选地,步骤(1)巨噬细胞为m0型巨噬细胞,在m0型巨噬细胞培养体系中加入脂多糖和干扰素-γ,孵育,使其极化为m1型巨噬细胞,即促炎型巨噬细胞;加入il-4,孵育,使其极化为 m2 型巨噬细胞,即抑炎型巨噬细胞。
9.优选地,vb12的加入浓度为1.0 μg/ml-2.0 μg/ml;vc的加入浓度为1 μg/ml-10 μg/ml。
10.优选地,步骤(3)中,甘露醇浓度质量分数为2 %-15 %,海藻糖浓度质量分数为0.1 %-5 %,聚山梨醇80浓度质量分数为0.1 %-5 %,烟酰胺浓度质量分数为0.1 %-1 %。
11.本发明的有益效果通过单核-巨噬细胞的培养得到巨噬细胞,经过vb12和vc诱导得到间充质干细胞,加入辅料冻干即得。采用上述方法获得高egf含量冻干粉可以有效促进表皮细胞增殖,增强皮肤的修复能力。
12.具体实施方式:下面将结合具体实施例来详细说明本发明,在此本发明的示意性实施例以及说明用来解释本发明,但并不作为对本发明的限定。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
13.实施例1:一种用于皮肤组织损伤的细胞因子冻干粉的制备方法,具体步骤如下:(1)单核-巨噬细胞的培养:取新鲜脐带血,按照1:1的浓度加入密度梯度分离液,密度梯度离心法获得thp-1单核细胞,用含有10%胎牛血清的rpmi-1640培养基培养thp-1单核细胞,接种于6孔板,用于建立巨噬细胞系;在培养基中按照10 ng/ml的浓度加入佛波酯,培养48 h后thp-1单核细胞分化为m0期巨噬细胞。在m0期巨噬细胞培养体系中加入0.5 ng/ml的脂多糖和10 ng/ml的干扰素-γ ,孵育24 h,使其极化为m1型巨噬细胞(促炎型巨噬细胞);加入2μl il-4(10 ng/ml),孵育24 h,使其极化为 m2 型巨噬细胞(抑炎型巨噬细胞 )。
14.2、间充质干细胞的诱导培养:取上述步骤巨噬细胞培养的细胞培养基,加入1.5 μg/ml的vb12和5 μg/mlvc,继续培养24 h,培养结束后收集细胞上清。
15.3、新型的细胞因子冻干粉的制备:将上述步骤所得到的细胞培养上清液,加入8 %的甘露醇、1 %的海藻糖、1 %的聚山梨醇80、1 %的烟酰胺,分装于7 ml的西林瓶,每瓶2 ml,冻干后即得。
16.实施例2
一种用于皮肤组织损伤的细胞因子冻干粉的制备方法,具体步骤如下:1.单核-巨噬细胞的培养:取新鲜脐带血,按照1:1的浓度加入密度梯度分离液,密度梯度离心法获得thp-1单核细胞,用含有10%胎牛血清的rpmi-1640培养基培养thp-1单核细胞,接种于6孔板,用于建立巨噬细胞系;在培养基中按照10ng/ml的浓度加入佛波酯,培养48h后thp-1单核细胞分化为m0期巨噬细胞;加入0.5ng/ml的脂多糖和10ng/ml的干扰素-γ,孵育24h,使其极化为m1型巨噬细胞(促炎型巨噬细胞);加入2μlil-4(10ng/ml),孵育24h,使其极化为m2型巨噬细胞(抑炎型巨噬细胞)。
17.2、间充质干细胞的诱导培养:取上述步骤巨噬细胞培养的细胞培养基,加入1.0μg/ml的vb12和10μg/mlvc,继续培养24h,培养结束后收集细胞上清。
18.3、新型的细胞因子冻干粉的制备:将上述步骤所得到的细胞培养上清液,加入2%的甘露醇、5%的海藻糖、0.1%的聚山梨醇80、1%的烟酰胺,分装于7ml的西林瓶,每瓶2ml,冻干后即得。
19.实施例3一种用于皮肤组织损伤的细胞因子冻干粉的制备方法,具体步骤如下:单核-巨噬细胞的培养:取新鲜脐带血,按照1:1的浓度加入密度梯度分离液,密度梯度离心法获得thp-1单核细胞,用含有10%胎牛血清的rpmi-1640培养基培养thp-1单核细胞,接种于6孔板,用于建立巨噬细胞系;在培养基中按照10ng/ml的浓度加入佛波酯,培养48h后thp-1单核细胞分化为m0期巨噬细胞;加入0.5ng/ml的脂多糖和10ng/ml的干扰素-γ,孵育24h,使其极化为m1型巨噬细胞(促炎型巨噬细胞);加入2μlil-4(10ng/ml),孵育24h,使其极化为m2型巨噬细胞(抑炎型巨噬细胞)。
20.2、间充质干细胞的诱导培养:取上述步骤巨噬细胞培养的细胞培养基,加入2μg/ml的vb12和1μg/mlvc,继续培养24h,培养结束后收集细胞上清。
21.3、新型的细胞因子冻干粉的制备:将上述步骤所得到的细胞培养上清液,加入15%的甘露醇、0.1%的海藻糖、5%的聚山梨醇80、0.11%的烟酰胺,分装于7ml的西林瓶,每瓶2ml,冻干后即得。
22.对比例1:按照常规培养方式培养间充质干细胞,去对数生长期的细胞接种于新的细胞培养瓶,培养24h后,取上清,加入8%的甘露醇、1%的海藻糖、1%的聚山梨醇80、1%的烟酰胺,分装于7ml的西林瓶,每瓶2ml,冻干后即得。
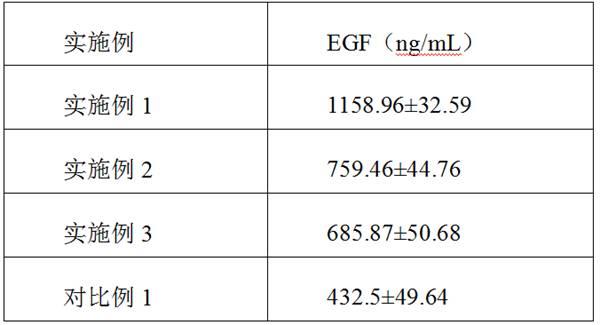
23.实施效果例分别检测实施例1-3与对比例1中的egf因子的含量:细胞因子溶媒液的制备:高分子量透明质酸钠0.1%
中分子量透明质酸钠0.1%低分子量透明质酸钠0.1%丁二醇5%丙二醇1%甘油3%抗菌剂0.2%其余成分为超纯水,将上述组分别充分溶解于超纯水,分装于7ml的西林瓶,每瓶5ml,即得。
24.1、将实施例1与对比例1中所获得的冻干粉与溶媒液,充分混合溶解,用elisa-egf试剂盒分别检测两组冻干粉的egf含量,结果如下:。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1