一种诺氟沙星滴眼液及其制备方法与流程
1.本发明属于医药技术领域,具体涉及一种不含抑菌剂的诺氟沙星滴眼液及其制备方法。
背景技术:
2.诺氟沙星,化学名为1-乙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸,为第三代喹诺酮类抗菌药,会阻碍消化道内致病细菌的dna旋转酶的作用,阻碍细菌dna复制,对细菌有抑制作用,是治疗肠炎痢疾的常用药。但此药对未成年人骨骼形成有延缓作用,会影响到发育,故禁止未成年人服用。
3.诺氟沙星滴眼液,适应症为用于敏感菌所致的外眼感染,如结膜炎、角膜炎、角膜溃疡等。眼用制剂直接用于眼部发挥治疗作用的无菌制剂,微生物污染是滴眼液在生产、储存,尤其是使用过程中存在的重要问题,抑菌剂的合理使用是解决此问题的一项主要措施。目前几乎所有的滴眼液的处方都使用了抑菌剂,其他眼科外用药药品几乎都添加抑菌剂。市场上的滴眼液为了达到无菌状态应加入适量的抑菌剂,但长期治疗中抑菌成分也会给患者带来不良毒副作用,如:角结膜上皮细胞损伤甚至发生干眼症,还包括刺激性,变态反应,角膜变形等。对于滴眼液的抑菌成分的安全性和有效性,探究抑菌剂的浓度在使用过程中逐渐完善。
技术实现要素:
4.鉴于此,本发明的目的在于,提供一种不含抑菌剂的诺氟沙星滴眼液及其制备方法,能避免因使用含抑菌剂的眼用制剂对眼睛引起的不良反应,避免了由于抑菌剂引起的潜在危险和对眼睛的毒副作用。
5.为了达到上述发明目的,进而采取的技术方案如下:
6.诺氟沙星滴眼液,每1000ml滴眼液由下述原料制备而成:诺氟沙星3.0
‑ꢀ
3.1g,氯化钠0-2.0g,磷酸二氢钾6.6-6.7g,磷酸氢二钠1.8-1.85g,玻璃酸钠1.0-1.1g,余量为注射用水。
7.作为本发明的进一步改进,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.0g,氯化钠2.0g,磷酸二氢钾6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,余量为注射用水。
8.作为本发明的进一步改进,所述磷酸二氢钾可以用磷酸二氢钠或硼酸替代。
9.作为本发明的进一步改进,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.03g、磷酸二氢钠6.62g、磷酸氢二钠1.81g、玻璃酸钠1.02g,余量为注射用水。
10.作为本发明的进一步改进,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.06g、磷酸二氢钠6.67g、磷酸氢二钠1.80g、玻璃酸钠1.06g,余量为注射用水。
11.作为本发明的进一步改进,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.0g,氯化钠2.0g,硼酸6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,余量为注射用水。
12.一种制备诺氟沙星滴眼液的方法,包括以下步骤:
13.a.精密称取诺氟沙星3.0-3.1g,氯化钠0-2.0g,磷酸二氢钾6.6-6.7g,磷酸氢二钠1.8-1.85g,玻璃酸钠1.0-1.1g,其中,磷酸二氢钾可以用磷酸二氢钠或硼酸替代,加入溶解当量的注射用水溶解,搅拌均匀后,再加入注射用水定容至1000ml,得药液;
14.b.将上述药液用0.45μm微孔滤膜过滤1次,在百级环境下,再用0.22μm 微孔滤膜过滤2次;
15.c.将步骤b所得药液进行热压灭菌;
16.d.灭菌后的药液检验合格后,在百级环境下,灌装0.1-0.5ml此药液至1ml 单剂量包装塑料容器中,封口,即得成品诺氟沙星滴眼液。
17.本发明与现有技术相比,存在以下优点:
18.1.本发明的滴眼液不含抑菌剂,避免了由于抑菌剂引起的潜在危险和对眼睛的毒副作用,使用本发明产品更加安全、可靠;
19.2.本发明采用无菌操作灌装工艺生产或灭菌工艺生产,保证了产品的无菌要求;
20.3.本发明采用单剂量独立包装,一次性使用后弃去,药液不可能被二次污染,其它单剂量独立包装的完整性不受影响;
21.4.本发明产品不含抑菌剂,节省了多剂量包装必须添加抑菌剂等辅料的成本费用。
具体实施方式
22.下面给出的实施例拟对本发明作进一步说明,但不能理解为是对本发明保护范围的限制,本领域技术人员根据本发明内容对本发明的一些非本质的改进和调整,仍属于本发明的保护范围。
23.实施例1
24.诺氟沙星滴眼液,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.0g,氯化钠2.0g,磷酸二氢钾6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,余量为注射用水。
25.一种制备诺氟沙星滴眼液的方法,包括以下步骤:
26.a.精密称取诺氟沙星滴眼液,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.0g,氯化钠2.0g,磷酸二氢钾6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,加入溶解当量的注射用水溶解,搅拌均匀后,再加入注射用水定容至1000ml,得药液;
27.b.将上述药液用0.45μm微孔滤膜过滤1次,在百级环境下,再用0.22μm 微孔滤膜过滤2次;
28.c.将步骤b所得药液进行热压灭菌;
29.d.灭菌后的药液检验合格后,在百级环境下,灌装0.5ml此药液至1ml单剂量包装塑料容器中,封口,即得成品诺氟沙星滴眼液。
30.实施例2
31.诺氟沙星滴眼液,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.03g、磷酸二氢钠6.62g、磷酸氢二钠1.81g、玻璃酸钠1.02g,余量为注射用水。
32.一种制备诺氟沙星滴眼液的方法,包括以下步骤:
33.a.精密称取诺氟沙星3.03g、磷酸二氢钠6.62g、磷酸氢二钠1.81g、玻璃酸钠1.02g,加入600ml注射用水溶解,搅拌均匀后,再加入注射用水定容至 1000ml,得药液;
34.b.将上述药液用0.45μm微孔滤膜过滤1次,在百级环境下,再用0.22μm 微孔滤膜过滤2次;
35.c.将步骤b所得药液进行热压灭菌;
36.d.灭菌后的药液检验合格后,在百级环境下,灌装0.5ml此药液至1ml单剂量包装塑料容器中,封口,即得成品诺氟沙星滴眼液。
37.实施例3
38.诺氟沙星滴眼液,每1000ml滴眼液由下述物质制备而成:诺氟沙星 3.06g、磷酸二氢钠6.67g、磷酸氢二钠1.80g、玻璃酸钠1.06g,余量为注射用水。
39.一种制备诺氟沙星滴眼液的方法,包括以下步骤:
40.a.精密称取诺氟沙星3.06g、磷酸二氢钠6.67g、磷酸氢二钠1.80g、玻璃酸钠1.06g,加入600ml注射用水溶解,搅拌均匀后,再加入注射用水定容至 1000ml,得药液;
41.b.将上述药液用0.45μm微孔滤膜过滤1次,在百级环境下,再用0.22μm 微孔滤膜过滤2次;
42.c.将步骤b所得药液进行热压灭菌;
43.d.灭菌后的药液检验合格后,在百级环境下,灌装0.5ml此药液至1ml单剂量包装塑料容器中,封口,即得成品诺氟沙星滴眼液。
44.实施例4
45.诺氟沙星滴眼液,每1000ml滴眼液由下述物质制备而成:诺氟沙星3.0g,氯化钠2.0g,硼酸6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,余量为注射用水。
46.一种制备诺氟沙星滴眼液的方法,包括以下步骤:
47.a.精密称取诺氟沙星3.0g,氯化钠2.0g,硼酸6.6g,磷酸氢二钠1.8g,玻璃酸钠1.0g,加入溶解当量的注射用水溶解,搅拌均匀后,再加入注射用水定容至1000ml,得药液;
48.b.将上述药液用0.45μm微孔滤膜过滤1次,在百级环境下,再用0.22μm 微孔滤膜过滤2次;
49.c.将步骤b所得药液进行热压灭菌;
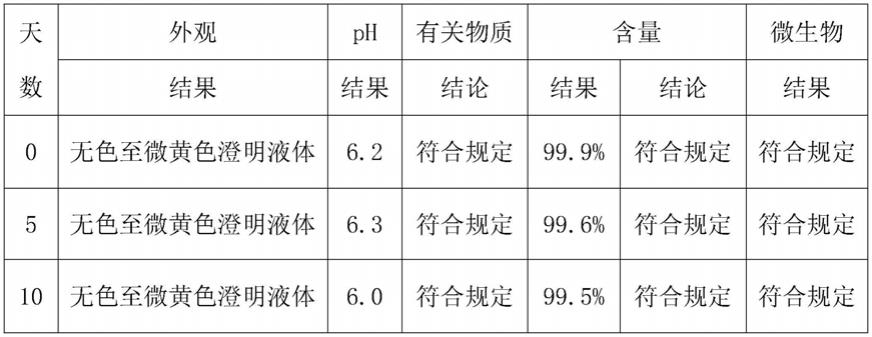
50.d.灭菌后的药液检验合格后,在百级环境下,灌装0.5ml此药液至1ml单剂量包装塑料容器中,封口,即得成品诺氟沙星滴眼液。
51.采用单剂量独立包装的不含抑菌剂的诺氟沙星滴眼液的体积范围为0.01~ 5.0毫升/支,每个单剂量独立小包装在每次使用完后,不再重复使用。
52.影响因素及稳定性实验:
53.一、诺氟沙星滴眼液的影响因素实验
54.1.影响因素实验
55.a.高温实验:取实施例2中制得的样品在恒温箱中于60℃条件下放置10天,分别于5天、10天取样检验,结果如表1所示:
56.表1高温实验结果
[0057][0058]
由上述结果可以看出:样品在60℃条件下放置10天,所考察项目无明显变化。
[0059]
2.光照实验:取实施例2的样品置于有日光灯的光照箱中(4500lx)放置10 天,分别于5天、10天取样检验,结果如表2所示:
[0060]
表2光照实验结果
[0061][0062]
由上述结果可以看出:样品在光照条件下放置10天,所考察项目无明显变化。
[0063]
3.高湿度实验:取实施例2的样品置于高湿度环境中放置10天,分别于5 天、10天取样检验,结果如表3所示:
[0064]
表3高湿度实验
[0065][0066]
由上述结果可以看出:样品在高湿度条件下放置10天,所考察项目无明显变化。
[0067]
二、诺氟沙星滴眼液的稳定性实验
[0068]
加速试验:取实施例2的样品置于温度40℃、相对湿度75%的加速试验箱中放置6个月,分别于1月、2月、3月和6月取样测定,与0月比较,结果如表4所示:
[0069]
表4加速实验结果
[0070][0071][0072]
由上述结果可以看出:样品在加速试验箱放置6个月,所考察项目无明显变化,均符合规定。
[0073]
本发明公开的诺氟沙星滴眼液,可用于由敏感致病菌引起的外眼感染,如:结膜炎,角膜炎,泪囊炎,眼睑炎,睑板腺炎等。本发明处方科学、工艺先进、安全有效,质量稳定,为临床上提供了安全、有效、质量可靠、使用方便的药品;本发明所述诺氟沙星滴眼液稳定性强,其溶液与机体渗透压接近接近,耐受性好,能够在有效地减少交叉污染的同时提高其稳定性。
[0074]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1