一种硫酸软骨素钠缓释片的制备方法与流程
1.本发明涉及药物制剂技术领域,具体涉及一种硫酸软骨素钠缓释片的制备方法。
背景技术:
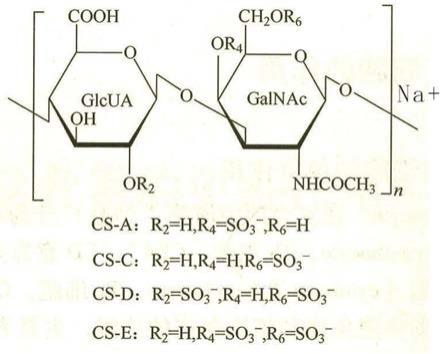
2.硫酸软骨素(cs),是共价连接在蛋白质上形成蛋白聚糖的一类糖胺聚糖。硫酸软骨素广泛分布于动物组织的细胞外基质和细胞表面,糖链由交替的葡萄糖醛酸和n-乙酰半乳糖胺(又称n-乙酰氨基半乳糖)二糖单位组成,通过一个似糖链接区连接到核心蛋白的丝氨酸残基上。
3.虽然多糖的主链结构并不复杂,但就硫酸化程度、硫酸基和两种差异向异构糖醛酸再链内的分布来说,呈现高度的不均一性。硫酸软骨素的精细结构决定着功能的特异性和与多种蛋白质分子的相互作用。
4.在医学上主要的应用途径是作为治疗关节疾病的药品,与氨基葡萄糖配合使用,具有止痛,促进软骨再生的功效,可以从根本上改善关节问题。
5.随机安慰剂对照的临床试验已经证明,硫酸软骨素能够减少骨关节炎患者疼痛,改善关节功能、减少关节肿胀和积液防止膝关节和手关节部位的间隙狭窄。
1.提供垫衬作用,缓和行动时的冲击和摩擦,能将水分吸入蛋白多糖分子内,使软骨变厚,并增加关节内的滑液量。软骨素的重要功能之一就是作为输送管道,把重要的氧供和营养素输送至关节,帮助清除关节内的废物,同时把二氧化碳和废物加以排除。由于关节软骨并无血液供应,因此所有的充氧、滋养及润滑作用皆来自滑液。
6.本发明专利对硫酸软骨素钠缓释片的研究,减少了普通剂型给药所呈现血药浓度的峰谷现象,使血药浓度保持在比较平稳持久的有效范围内,减少了给药次数,提高了药物的安全性。
技术实现要素:
7.针对上述现有技术,本发明的目的是提供一种硫酸软骨素缓释片的制备方法为实现上述目的,本发明采用如下技术方案:
8.本发明的第一方面,提供一种硫酸软骨素钠缓释片,由如下重量百分比的原料制成:
9.硫酸软骨素钠18-22%、盐酸氨基葡萄糖28-32%,碳酸钙26-30%,崩解剂2
‑ꢀ
5%、骨架型缓释材料10-20%、助流剂0.8-1.2%。
10.优选的,所述硫酸软骨素钠缓释片,由如下重量百分比的原料制成:
11.硫酸软骨素钠20%、盐酸氨基葡萄糖30%,碳酸钙28%,崩解剂5%、骨架型缓释材料16%、助流剂1%。
12.优选的,所述崩解剂选自交联羧甲基纤维素钠、淀粉或羧甲基淀粉钠中的一种或多种。
13.优选的,所述骨架型缓释材料选自亲水凝胶骨架、生物溶蚀性骨架或不溶性骨架;
所述亲水凝胶骨架为羟丙甲纤维素、卡波姆、海藻酸钠、甲基纤维素、羧甲基纤维素钠中的一种或多种,所述生物溶蚀性骨架为蜡质材料、胃溶或肠溶材料,所述不溶性骨架为乙基纤维素或渗透性丙烯酸树脂。
14.更优选的,所述骨架型缓释材料为乙基纤维素。本发明基于乙基纤维素具有水不溶性的特点,乙基纤维素在形成不溶性骨架的同时,可在药物释放上起到骨架(主要作用)和膜控(次要作用)双重缓释作用。因此,优选乙基纤维素作为主要关键性缓释辅料。
15.优选的,所述助流剂选自二氧化硅、硬脂酸镁、微粉硅胶、滑石粉、氢化植物油、聚乙二醇中的一种或多种。
16.优选的,所述填充剂选自乳糖、淀粉、糖粉、糊精、乳精、可压性淀粉、微晶纤维素、无机盐类中的一种或多种。
17.本发明的第二方面,提供上述硫酸软骨素钠缓释片的制备方法,包括以下步骤:
18.(1)将硫酸软骨素钠、盐酸氨基葡萄糖、碳酸钙、崩解剂、填充剂和部分骨架型缓释材料进行预混,得到预混料;
19.(2)将剩余骨架型缓释材料和粘合剂用水溶解,配成溶液,喷雾加入到预混料中,制粒;
20.(3)制粒后进行湿整粒、干燥,得到干颗粒;
21.(4)将干颗粒进行干整粒,再加入助流剂进行总混;
22.(5)将总混后的物料进行压片;
23.(6)对压片后的片剂进行包衣处理,即制备得到硫酸软骨素钠缓释片。
24.7.根据权利要求6所述的制备方法,其特征在于,步骤(1)中,预混时的搅拌速度为300-400rpm,剪切速度为1800-2100rpm。
25.8.根据权利要求6所述的制备方法,其特征在于,步骤(3)中,所述干燥条件为:流化床进风温度60℃,物料温度35~45℃,干燥至水分2.0%~3.0%。9.根据权利要求6所述的制备方法,其特征在于,步骤(5)中,压片时控制硬度 4kgf~10kgf。
26.10.根据权利要求6所述的制备方法,其特征在于,步骤(6)中,所述包衣处理的条件为:进风温度55℃,出风温度35~40℃,物料温度38~42℃,包衣控制包衣增重在1.5%~3%。
27.本发明的有益效果:
28.本发明制备的硫酸软骨素钠缓释片,工艺稳定,能很好起到缓释的作用,24h 内的释放稳定,无突释和难以溶出的现象出现,经放大至2~4万片,结果均良好,符合要求;本发明所制备的硫酸软骨素钠缓释片能够提供平稳、持久的有效血药浓度,避免或减少峰谷现象,有效提高了药物的使用安全性,减少了药物的不良反应。
附图说明
29.图1:1000片自制缓释制剂溶出图(ph值1.0介质中)
30.图2:工艺放大至2万片、4万片ph1.0介质中的溶出对比图。
31.图3:工艺放大至2万片、4万片ph4.5介质中的溶出对比图。
32.图4:工艺放大至2万片、4万片ph6.8介质中的溶出对比图。
33.图5:工艺放大至2万片、4万片水介质中的溶出对比图。
34.图6:硫酸软骨素钠分子式
具体实施方式
35.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
36.本发明的硫酸软骨素钠缓释片剂重量约700~750mg,硫酸软骨素钠20%、盐酸氨基葡萄糖30%,碳酸钙28%,崩解剂5%、骨架型缓释材料16%、助流剂 1%。
37.骨架型缓释材料包括不限于其他材料,如:亲水凝胶骨架(如不同规格的羟丙甲纤维素、卡波姆、海藻酸钠、甲基纤维素、羧甲基纤维素钠等)、生物溶蚀性骨架(蜡质材料、胃溶或肠溶性材料)和不溶性骨架(乙基纤维素、渗透性丙烯酸树脂等)。可以以干粉形式在预混时加入,或者部分干粉形式预混时加入,部分溶解在润湿剂中加入,干粉加入的比例在0%~100%。
38.崩解剂其用量在2%~5%,包括但不限于干淀粉、羧甲基淀粉钠等,崩解剂可全部内加,或者按照比例内加(预混时加入)和外加(总混时加入),内外加比例范围为:5:1~1:5。
39.助流剂其用量在0.8%~2.8%,在总混时加入,包括但不限于硬脂酸镁、微粉硅胶、滑石粉、氢化植物油、聚乙二醇类等。
40.包衣采用常规薄膜包衣预混剂,包衣增重为1.5%~2.5%。
41.采用湿法制粒工艺,步骤分为:预混、湿法制粒、湿整粒、干燥、干整粒、总混、压片、包衣等步骤。
42.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
43.本发明实施例中所用的未进行具体说明试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
44.实施例1:
45.规格:750mg,批量为1000片。处方信息如下:
46.制备工艺如下:
47.1、预混:硫酸软骨素钠原料150g、盐酸氨基葡萄糖225g、碳酸钙210g、乙基纤维素120g、羧甲淀粉钠37.5g,硬脂酸镁7.5g.湿法制粒机内,搅拌速度 300rpm,剪切速度1800rpm,预混7min;
48.2、制粒:乙基纤维素120g,溶解于180g纯化水中,配成溶液,喷雾加入到预混料,要求再1min内喷雾完毕,后制粒4min;
49.3、湿整粒:湿颗粒摇摆颗粒机20目筛网湿整粒;
50.4、干燥:流化床进风温度60℃,物料温度35~45℃,干燥至水分2.0%~ 3.0%;
51.5、干整粒:干燥颗粒过20目筛网进行干整粒;
52.6、总混:根据干燥颗粒的收率折算外加硬脂酸镁和羧甲基淀粉钠的量,手动混合10min;
53.7、压片:6.5mm圆形冲压片,控制硬度:4kgf~10kgf;
54.8、包衣:进风温度55℃,出风温度35~40℃,物料温度38~42℃,包衣控制包衣增重在1.5%~2.5%。
55.实施例2:
56.处方信息如下:
57.批量为20000片。
58.制备工艺如下:
59.1、预混:硫酸软骨素钠原料3000g、盐酸氨基葡萄糖4500g、碳酸钙4200g、乙基纤维素2400g、羧甲淀粉钠750g,湿法制粒机内,搅拌速度400rpm,剪切速度2100rpm,预混7min;
60.2、制粒:乙基纤维素750g,溶解于1200g纯化水中,配成溶液,喷雾加入,要求再3min内喷雾完毕,后制粒3min;
61.3、湿整粒:湿颗粒摇摆颗粒机20目筛网湿整粒;
62.4、干燥:流化床进风温度60℃,物料温度35~45℃,干燥至水分2.0%~ 3.0%;
63.5、干整粒:干燥颗粒过20目筛网进行干整粒;
64.6、总混:根据干燥颗粒的收率折算外加硬脂酸镁和羧甲基淀粉钠的量,三维混合机混合10min;
65.7、压片:6.5mm圆形冲压片,控制硬度:4kgf~10kgf;
66.8、包衣:进风温度55℃,出风温度35~40℃,物料温度38~42℃,包衣控制包衣增重在1.5%~2.5%。
67.实施例3:
68.处方信息如下:
69.批量为40000片。
70.制备工艺如下:
71.1、预混:硫酸软骨素钠原料6000g、盐酸氨基葡萄糖9000g、碳酸钙8400g、乙基纤维素4800g、羧甲淀粉钠1500g,湿法制粒机内,搅拌速度400rpm,剪切速度2100rpm,预混7min;
72.2、制粒:乙基纤维素240g,溶解于1440g纯化水中,配成溶液,喷雾加入,要求再3min内喷雾完毕,后制粒3min;
73.3、湿整粒:湿颗粒摇摆颗粒机20目筛网湿整粒;
74.4、干燥:流化床进风温度60℃,物料温度35~45℃,干燥至水分2.0%~ 3.0%;
75.5、干整粒:干燥颗粒过20目筛网进行干整粒;
76.6、总混:根据干燥颗粒的收率折算外加硬脂酸镁和羧甲基淀粉钠的量,三维混合机混合10min;
77.7、压片:6.5mm圆形冲压片,控制硬度:4kgf~10kgf;
78.8、包衣:进风温度55℃,出风温度35~40℃,物料温度38~42℃,包衣控制包衣增重在1.5%~2.5%。
79.试验例:溶出试验
80.溶出试验方法:
81.国家颁布的《普通口服固体制剂溶出度试验技术指导原则》内对溶出介质有详细规定:体积一般为500、900或1000ml,溶出介质的体积最好能满足漏槽条件,一般应采用ph值1.2~6.8的水性介质。可采用不含酶的ph1.2、6.8的溶出介质作为人工胃液和人工肠液。
特殊情况下,可采用高ph的溶出介质,但一般不应超过ph8.0。同时参照fda规定,本发明选择的介质为:ph1.0、 ph4.5、ph6.8、水,搅拌方式为:桨法,转速为:50rpm,介质体积:900ml,取样点设置为:0.5h、1h、2h、4h、6h、12h、24h。
82.工艺放大至2万片、4万片在不同ph的溶出介质的溶出对比如图1-图4所示。
83.以上所述仅为本发明申请的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1