草本抗炎透皮吸收微乳凝胶及其制备方法与流程
1.本发明涉及药物制剂技术领域,尤其涉及一种草本抗炎透皮吸收微乳凝胶及其制备方法。
背景技术:
2.京尼平苷又称栀子苷,是从茜草科植物栀子(gardenia jasminoides ellis)的干燥成熟果实中提取的一种环烯醚萜苷类物质。京尼平苷易溶于水,对消化系统、心血管系统和中枢神经系统疾病均有显著疗效,临床上常用于急慢性肝损伤、慢性肝炎、肝纤维化、肝功能衰竭、肝癌等肝脏疾病的治疗;此外,京尼平苷还具有抗炎和治疗软组织损伤的效果。京尼平苷的主要通过尿液及粪便的形式排出体外,口服后活性成分使用率较低,难以发挥预计的抗炎效果;此外,京尼平苷在经口服后在肠道中转化为京尼平,京尼平与体内的氨基酸结合形成栀子蓝类物质,栀子蓝类物质或其转化物可能是导致毒性的物质基础,对人体可能具有潜在的伤害。因此,为了更优地发挥京尼平苷的抗炎效果,以京尼平苷为活性成分并将其负载于微乳凝胶,通过透皮吸收的形式以对患处发挥抗炎效果是一种有利可行的方法。
3.专利cn 102462723 a提供了一种含雷公藤多苷的微乳凝胶透皮制剂及其制备方法,通过将含雷公藤多苷的微乳凝胶分散形成粒径在10-100nm的微乳,以减少对皮肤的刺激,促进药物透皮吸收性能,能进一步提高雷公藤的临床疗效。专利cn 106176603 a公开了一种植物精油微乳凝胶及其制备方法和应用,利用天然的植物精油,以卡波姆为基材,制备用于治疗细菌性和真菌性皮肤炎的微乳凝胶;该发明原料来源天然、成本低,且制备的微乳凝胶抑菌效果好,加工工艺简单,成本低,基本无毒副作用,制备的微乳凝胶具有很好的治疗效果。上述专利都没有对微乳凝胶的延展性能进行优化提升,实际使用中可能存在与皮肤贴合不够紧密导致有效成分的释放收到限制的技术问题。
技术实现要素:
4.有鉴于现有技术的上述缺陷,本发明所解决的技术问题是:(1)提供一种草本抗炎透皮吸收微乳凝胶,所述微乳凝胶具有良好的透皮效果,使抗炎活性物质能够有效通过皮肤角质层;(2)提升草本抗炎透皮吸收微乳凝胶的力学性能及延展性,使其与皮肤的贴合更加紧密,进而有利于抗炎活性物质的释放;(3)提升草本抗炎活性成分京尼平苷在微乳凝胶中的稳定性,使其能够长期有效地从微乳凝胶中释放,延长抗炎的有效时间。
5.京尼平苷的透皮吸收主要面临几个问题,首先是基材和京尼平苷结合后要具有良好的稳定性和延展性;稳定性的提升有利于保证京尼平苷在不同使用环境下抗炎效果的统一;延展性则能够使基材具有一定形变能力,与皮肤患处的贴合更加紧密,利于京尼平苷的释放及吸收。
6.现有技术中制备微乳凝胶的基体材料通常可选择卡波姆、壳聚糖、海藻酸钠和羟丙基甲基纤维素;上述材料的生物相容性好,同时具有良好的水溶性,但是制备的微乳凝胶
普遍具有延展性较差的技术问题;在实际使用中,抗炎活性物质的透皮吸收效果与微乳凝胶和皮肤的有效接触息息相关,延展性较差的基材存在难以随皮肤形状变化而紧密贴合的缺点,尤其在关节运动部位,抗炎成分的吸收将大打折扣。针对这一技术问题,发明人使用了一种杂化聚合物溶液,并与包覆有抗炎成分的乳液发生胶凝进而制备了一种草本抗炎透皮吸收微乳凝胶;所述草本抗炎透皮吸收微乳凝胶具有三维网络状结构,延展性良好,同时该结构具有多孔的特质,能够为抗炎成分的释放提供足够的通路。
7.一种草本抗炎透皮吸收微乳凝胶的制备方法,包括下述步骤:使用蔗糖-椰油酸酯与肉豆蔻酸异丙酯对京尼平苷进行包覆并形成京尼平苷乳液;将海藻酸钠经醛化处理后,通过羰基与含有氨基的硅烷发生亲核加成反应以制得杂化聚合物溶液;将所述京尼平苷乳液与所述杂化聚合物溶液在酸性条件下经冷却胶凝制得所述草本抗炎透皮吸收微乳凝胶。
8.皮肤表层的角质层为京尼平苷的透皮吸收提供了一层天然屏障,活性成分的透皮吸收效果和其粒径大小及皮肤的水合作用有关。为了让京尼平苷更加有效地穿透皮肤到达炎症处,发明人使用蔗糖-椰油酸酯与肉豆蔻酸异丙酯对京尼平苷进行包覆,得到载药微粒;相比于未经包覆的京尼平苷,载药微粒的稳定性得到提升;经包覆的京尼平苷相比与直接分散于水中的京尼平苷,活性成分的释放更加均一平稳,能够降低药物快速释放造成局部浓度过高带来的不利影响。
9.优选的,一种草本抗炎透皮吸收微乳凝胶的制备方法,包括下述步骤:
10.(1)将蔗糖-椰油酸酯与肉豆蔻酸异丙酯混合,得到油相混合物;将京尼平苷溶于水,得到京尼平苷水溶液;将所述油相混合物和京尼平苷水溶液混合,经超声处理后得到京尼平苷乳液;
11.(2)将高碘酸钠溶于水,得到高碘酸钠水溶液;向所述高碘酸钠水溶液中加入海藻酸钠及乙二醇,无光条件下进行反应;反应产物经过滤得滤液、冷冻干燥,得到醛化海藻酸钠;
12.(3)将所述醛化海藻酸钠溶于磷酸盐缓冲液,继续加入γ-氨丙基三乙氧基硅烷及正硅酸乙酯,进行杂化反应,得到杂化反应液;
13.(4)向所述杂化反应液中加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及n-羟基丁二酰亚胺,混合,得到杂化聚合物溶液;
14.(5)将所述京尼平苷乳液与所述杂化聚合物溶液混合后使用盐酸调节溶液的ph,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
15.发明人对海藻酸钠经醛化处理后,通过羰基与含有氨基的硅烷发生亲核加成反应以制得杂化聚合物溶液,最终制得的草本抗炎透皮吸收微乳凝胶与血小板的结合能力强于传统的海藻酸钠基材;因此微乳凝胶与伤口出血处贴合后,更利于结痂的形成,使微乳凝胶和伤口的贴合紧密,进一步地防止外界污染成分对伤口的感染。
16.进一步优选的,一种草本抗炎透皮吸收微乳凝胶的制备方法,包括下述步骤,以重量份计:
17.s1将7.5~10份蔗糖-椰油酸酯与7.5~12.5份肉豆蔻酸异丙酯混合,得到油相混合物;将0.16~0.36份京尼平苷溶于12~18份水,得到京尼平苷水溶液;将所述油相混合物和京尼平苷水溶液混合,经超声处理后得到京尼平苷乳液;
18.s2将0.25~0.5份高碘酸钠溶于15~30份水,得到高碘酸钠水溶液;向所述高碘酸
钠水溶液中加入4.8~9份海藻酸钠及1.5~3份乙二醇,无光条件下进行反应;反应产物经过滤得滤液、冷冻干燥,得到醛化海藻酸钠;
19.s3将所述醛化海藻酸钠溶于30~50份磷酸盐缓冲液,继续加入2.2~3.3份γ-氨丙基三乙氧基硅烷及2~3份正硅酸乙酯,进行杂化反应,得到杂化反应液;
20.s4向所述杂化反应液中加入0.12~0.3份1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及0.08~0.15份n-羟基丁二酰亚胺,混合,得到杂化聚合物溶液;
21.s5将所述京尼平苷乳液与所述杂化聚合物溶液混合后使用盐酸调节溶液的ph为5~5.8,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
22.优选的,步骤s1及步骤s5中所述超声处理的参数各自独立地为:超声功率为550~800w,超声频率为28~40khz,超声处理15~45min。
23.优选的,步骤s2中所述反应的反应温度为38~42℃,反应时间为3~9h。
24.优选的,步骤s3中所述磷酸盐缓冲液的配制方法为:取250ml摩尔浓度为0.2mol/l磷酸二氢钾水溶液和118ml摩尔浓度为0.2mol/l氢氧化钠水溶液混合,用水稀释至1000ml,摇匀后即得ph为7.0的磷酸盐缓冲液。
25.优选的,步骤s3中所述杂化反应的反应温度为32~40℃,反应时间为6~18h。
26.优选的,步骤s5中所述盐酸的浓度为0.5~2mol/l。
27.优选的,步骤s5中所述冷却胶凝的温度为0~4℃,时间为2~6h。
28.在符合本领域常识的基础上,上述各优选条件,可以任意组合,即得本发明各较佳实施例。
29.本发明配方中部分原料的介绍及作用如下:
30.京尼平苷:一种环烯醚萜葡萄糖苷,易溶于水,是栀子的主要药效成分;京尼平苷对消化系统、心血管系统和中枢神经系统疾病均有显著疗效,此外,京尼平苷还有一定的抗炎和治疗软组织损伤的作用。本发明中作为草本抗炎活性成分。
31.1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐:作为半抗原的偶联剂的化学试剂;极易吸潮,可溶于乙醇、水。
32.n-羟基丁二酰亚胺:白色至类白色结晶,用于合成氨基酸保护剂。
33.本发明的有益效果:
34.与现有技术相比,本发明使用蔗糖-椰油酸酯与肉豆蔻酸异丙酯对京尼平苷进行包覆,得到载药微粒;相比于未经包覆的京尼平苷,载药微粒的稳定性得到提升;经包覆的京尼平苷相比与直接分散于水中的京尼平苷,活性成分的释放更加均一平稳,能够降低药物快速释放造成局部浓度过高带来的不利影响。
35.相比于现有技术,本发明使用杂化聚合物溶液与包覆有抗炎成分的乳液发生胶凝进而制备了一种草本抗炎透皮吸收微乳凝胶;所述草本抗炎透皮吸收微乳凝胶具有三维网络状结构,延展性良好,同时该结构具有多孔的特质,能够为抗炎成分的释放提供足够的通路。
36.与现有技术相比,本发明制备的草本抗炎透皮吸收微乳凝胶与血小板的结合能力强于传统的海藻酸钠基材;因此微乳凝胶与伤口出血处贴合后,更利于结痂的形成,使微乳凝胶和伤口的贴合紧密,进一步地防止外界污染成分对伤口的感染。
具体实施方式
37.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
38.本发明对照例及实施例中部分原材料参数如下:
39.京尼平苷,cas号:24512-63-8;
40.蔗糖-椰油酸酯,cas号:91031-88-8;
41.肉豆蔻酸异丙酯,cas号:110-27-0;
42.1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐,cas号:25952-53-8;
43.n-羟基丁二酰亚,cas号:6066-82-6。
44.实施例1
45.一种草本抗炎透皮吸收微乳凝胶,采用如下方法制备而成:
46.s1将3g京尼平苷溶于120g水,得到京尼平苷水溶液;
47.s2将54g海藻酸钠及溶于300g磷酸盐缓冲液,加入2.5g 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及1.2g n-羟基丁二酰亚胺,混合,得到海藻酸钠溶液;
48.s3将所述京尼平苷水溶液与所述海藻酸钠溶液混合后使用盐酸调节溶液的ph为5.8,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
49.步骤s2中所述磷酸盐缓冲液的配制方法为:取250ml摩尔浓度为0.2mol/l磷酸二氢钾水溶液和118ml摩尔浓度为0.2mol/l氢氧化钠水溶液混合,用水稀释至1000ml,摇匀后即得ph为7.0的磷酸盐缓冲液。
50.步骤s3中所述盐酸的浓度为1mol/l。
51.步骤s3中所述超声处理的参数为:超声功率为550w,超声频率为40khz,超声处理30min。
52.步骤s3中所述冷却胶凝的温度为4℃,时间为3h。
53.实施例2
54.一种草本抗炎透皮吸收微乳凝胶,采用如下方法制备而成:
55.s1将80g蔗糖-椰油酸酯与120g肉豆蔻酸异丙酯混合,得到油相混合物;将3g京尼平苷溶于120g水,得到京尼平苷水溶液;将所述油相混合物和京尼平苷水溶液混合,经超声处理后得到京尼平苷乳液;
56.s2将54g海藻酸钠及溶于300g磷酸盐缓冲液,加入2.5g 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及1.2g n-羟基丁二酰亚胺,混合,得到海藻酸钠溶液;
57.s3将所述京尼平苷乳液与所述海藻酸钠溶液混合后使用盐酸调节溶液的ph为5.8,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
58.步骤s1及步骤s3中所述超声处理的参数均为:超声功率为550w,超声频率为40khz,超声处理30min。
59.步骤s2中所述磷酸盐缓冲液的配制方法为:取250ml摩尔浓度为0.2mol/l磷酸二氢钾水溶液和118ml摩尔浓度为0.2mol/l氢氧化钠水溶液混合,用水稀释至1000ml,摇匀后即得ph为7.0的磷酸盐缓冲液。
60.步骤s3中所述盐酸的浓度为1mol/l。
61.步骤s3中所述冷却胶凝的温度为4℃,时间为3h。
62.实施例3
63.一种草本抗炎透皮吸收微乳凝胶,采用如下方法制备而成:
64.s1将3g京尼平苷溶于120g水,得到京尼平苷水溶液;
65.s2将3.5g高碘酸钠溶于150g水,得到高碘酸钠水溶液;向所述高碘酸钠水溶液中加入54g海藻酸钠及15g乙二醇,无光条件下进行反应;反应产物经过滤得滤液、冷冻干燥,得到醛化海藻酸钠;
66.s3将所述醛化海藻酸钠溶于300g磷酸盐缓冲液,继续加入22gγ-氨丙基三乙氧基硅烷及20g正硅酸乙酯,进行杂化反应,得到杂化反应液;
67.s4向所述杂化反应液中加入2.5g 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及1.2g n-羟基丁二酰亚胺,混合,得到杂化聚合物溶液;
68.s5将所述京尼平苷水溶液与所述杂化聚合物溶液混合后使用盐酸调节溶液的ph为5.8,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
69.步骤s2中所述反应的反应温度为42℃,反应时间为4.5h。
70.步骤s3中所述磷酸盐缓冲液的配制方法为:取250ml摩尔浓度为0.2mol/l磷酸二氢钾水溶液和118ml摩尔浓度为0.2mol/l氢氧化钠水溶液混合,用水稀释至1000ml,摇匀后即得ph为7.0的磷酸盐缓冲液。
71.步骤s3中所述杂化反应的反应温度为32℃,反应时间为9h。
72.步骤s5中所述盐酸的浓度为1mol/l。
73.步骤s5中所述超声处理的参数为:超声功率为550w,超声频率为40khz,超声处理30min。
74.步骤s5中所述冷却胶凝的温度为4℃,时间为3h。
75.实施例4
76.一种草本抗炎透皮吸收微乳凝胶,采用如下方法制备而成:
77.s1将80g蔗糖-椰油酸酯与120g肉豆蔻酸异丙酯混合,得到油相混合物;将3g京尼平苷溶于120g水,得到京尼平苷水溶液;将所述油相混合物和京尼平苷水溶液混合,经超声处理后得到京尼平苷乳液;
78.s2将3.5g高碘酸钠溶于150g水,得到高碘酸钠水溶液;向所述高碘酸钠水溶液中加入54g海藻酸钠及15g乙二醇,无光条件下进行反应;反应产物经过滤得滤液、冷冻干燥,得到醛化海藻酸钠;
79.s3将所述醛化海藻酸钠溶于300g磷酸盐缓冲液,继续加入22gγ-氨丙基三乙氧基硅烷及20g正硅酸乙酯,进行杂化反应,得到杂化反应液;
80.s4向所述杂化反应液中加入2.5g 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐及1.2g n-羟基丁二酰亚胺,混合,得到杂化聚合物溶液;
81.s5将所述京尼平苷乳液与所述杂化聚合物溶液混合后使用盐酸调节溶液的ph为5.8,经超声处理、冷却胶凝,得到所述草本抗炎透皮吸收微乳凝胶。
82.步骤s1及步骤s5中所述超声处理的参数均为:超声功率为550w,超声频率为40khz,超声处理30min。
83.步骤s2中所述反应的反应温度为42℃,反应时间为4.5h。
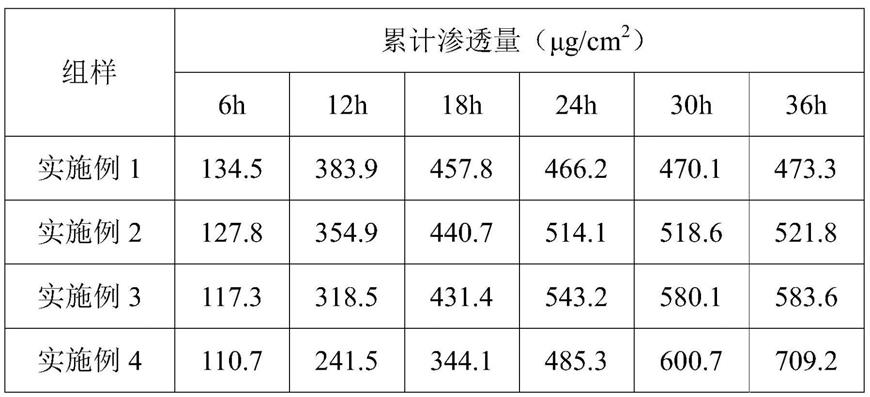
84.步骤s3中所述磷酸盐缓冲液的配制方法为:取250ml摩尔浓度为0.2mol/l磷酸二氢钾水溶液和118ml摩尔浓度为0.2mol/l氢氧化钠水溶液混合,用水稀释至1000ml,摇匀后即得ph为7.0的磷酸盐缓冲液。
85.步骤s3中所述杂化反应的反应温度为32℃,反应时间为9h。
86.步骤s5中所述盐酸的浓度为1mol/l。
87.步骤s5中所述冷却胶凝的温度为4℃,时间为3h。
88.测试例1
89.草本抗炎透皮吸收微乳凝胶透皮释放测试方法采用franz扩散池法。将各实施例制得的微乳凝胶涂覆于医用胶布,制得测试用样品,所述测试用样品中京尼平苷的载药量为250μg/cm2。测试采用rt800自动取样透皮扩散系统(深圳市锐拓仪器设备有限公司提供)进行;每组设置6个扩散池,扩散池体积为7.5ml,选用0.9%的生理盐水作为接收液;透皮测试选用乳猪腹部皮肤作为渗透皮肤,去除皮下脂肪,经无菌生理盐水清洗后置于扩散池,渗透皮肤与测试用样品的接触面积为3cm2;透皮测试温度为37℃,总测试时常为36h。测试数据以样品的算术平均值计。草本抗炎透皮吸收微乳凝胶的渗透量测试结果见表1。
90.表1
[0091][0092]
京尼平苷累计渗透量越高则代表对应实施例的透皮吸收效果越好。通过上述各实施例间的对比可以看出,实施例4具有最佳的透皮吸收效果;产生这种现象的原因可能在于,使用蔗糖-椰油酸酯与肉豆蔻酸异丙酯对京尼平苷进行包覆后形成的乳液微粒粒径小,同时实施例4与被测皮肤的贴合要更为紧密,有助于京尼平苷的释放和渗透。此外,从表1中还可以看出,相比于其他实施例,实施例4中累计渗透量的增值较为均一,累计渗透量随时间变化呈线性增加;产生这种现象的原因可能在于,京尼平苷乳液与杂化聚合物溶液在酸性条件下经冷却胶凝制得的草本抗炎透皮吸收微乳凝胶具有多孔结构的特质,能够为抗炎成分的释放提供适当通路,使活性成分的释放更加均一平稳,能够降低药物快速释放造成局部浓度过高带来的不利影响,有利于保持抗炎活性成分的长期有效。
[0093]
测试例2
[0094]
为了测试草本抗炎透皮吸收微乳凝胶在皮肤弯曲状态下的贴附释放效果,采用如测试例1中所述方法对京尼平苷累计渗透量进行测试。本测试的区别在于,将测试例1中草本抗炎透皮吸收微乳凝胶与渗透皮肤在水平面上的贴附替换为:草本抗炎透皮吸收微乳凝
胶与渗透皮肤在从中心弯折90
°
的平面上进行贴附,以模拟皮肤的弯曲状态。本测试总贴附面积、测试步骤及结果处理和测试例1保持一致,以测试例1中最终累计渗透量结果为每实施例的对照组,草本抗炎透皮吸收微乳凝胶在皮肤弯曲状态下的贴附释放测试结果见表2。
[0095]
表2
[0096][0097][0098]
通过上述各实施例的对比可以看出,测试用渗透皮肤的弯折将影响京尼平苷的累计渗透量,与水平贴附相比,各实施例测试结果均观察到下降;其中,实施例4的下降幅度最低,基本能够和对照组保持较小的波动。产生这种现象的原因可能在于,将海藻酸钠经醛化处理后,通过羰基与含有氨基的硅烷发生亲核加成反应以制得杂化聚合物溶液,再与京尼平苷乳液制得所述草本抗炎透皮吸收微乳凝胶内部具有三维网络状结构,分子间通过共价键连接,增强了力学性能,使其延展性得到提升;能够随随皮肤形状变化而紧密贴合,利于京尼平苷的释放及吸收。
[0099]
测试例3
[0100]
草本抗炎透皮吸收微乳凝胶与血小板的结合能力通过血小板体外粘附试验进以体现,所述试验方法参考《血小板粘附试验(玻珠柱法)正常值及临床病例观察》(第二军医大学学报1982年第4期)中的具体方法进行;使用普通玻璃珠作为对照组,测试组采用各实施例制得的微乳凝胶对玻璃珠进行包覆,包覆层的厚度为0.05mm。试验使用的富血小板血浆由江苏科晶生物科技有限公司提供,试验的玻璃珠直径0.8mm,每组测试重复4次,结果取平均值。血小板体外粘附试验结果见表3。
[0101]
表3
[0102]
[0103][0104]
通过上述各实施例的对比可以看出,实施例4制得的微乳凝胶与血小板的结合能力优于其他实施例。产生这种现象的原因可能在于,海藻酸钠经醛化处理后,通过羰基与含有氨基的硅烷发生亲核加成反应以制得杂化聚合物,使微乳凝胶的理化性能发生变化,在作用于皮肤创口时有助于血小板的聚集,从而更利于结痂的形成,使微乳凝胶和伤口的贴合紧密,进一步地防止外界污染成分对伤口的感染。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1