用于治疗实体肿瘤的免疫治疗组合药物
1.本技术属于生物医药技术领域,尤其涉及用于治疗实体肿瘤的免疫治疗组合药物和免疫组合疗法。
背景技术:
2.免疫疗法对于不能手术、或是转移后复发的恶性肿瘤来说是一种新兴的有效治疗策略,但是对于免疫微环境耐受的胰腺癌等实体瘤,单用pd-1抗体(如αpd-1)药物通常临床疗效不明显或基本无效。
3.胰腺导管腺癌(pancreatic ductal adenocarcinoma,pdac)占胰腺癌(pancreatic cancer pc)的90%以上,其预后极差,5年整体生存率不到10%,预计到2030年在全球的死亡率将位居第二位。由于pdac缺乏早期症状且容易发生局部浸润和远处转移,易对化疗药物产生耐药性,pdac仍然是一种具有挑战性的疾病。pdac(胰腺癌)和肝癌等实体瘤由于其肿瘤常处于免疫抑制的微环境,即肿瘤组织内极低的免疫细胞浸润等免疫抑制微环境因素,癌细胞对宿主的免疫系统和治疗药物产生免疫耐受和抗药性,使得当前的主流免疫治疗药物(如αpd-1)无法应用在pdac等免疫耐受肿瘤患者中。美国食品和药物协会(fda)批准的pembrolizumab(pd-1抑制剂)只能用于治疗局部晚期和转移性微卫星不稳定性高(msi-h)的pdac患者,但msi-h表型的pdac非常罕见(约1%-2%的pdac病例)。
4.综上所述,现有的αpd-1药物只适用于错配修复缺陷(dmmr)或是msi-h的癌患者,而这类患者只占所有患者的1-2%。现有的免疫检查点抑制剂pd-1/pd-l1抗体对pan02类型的免疫耐受胰腺癌实体瘤几无效果。目前,仍迫切需要进一步挖掘可有效促进αpd-1药物治疗效果并可应用于免疫耐受实体肿瘤治疗的新免疫组合疗法/药物。
技术实现要素:
5.本技术提供了用于治疗实体肿瘤的免疫治疗组合药物,本技术发现无毒弓形体或/和减毒弓形体与pd-1/pd-l1抑制剂联用,可有效治疗免疫耐受的实体肿瘤,扩大pd-1/pd-l1抑制剂的使用疗效和应用范围。
6.本技术第一方面提供了用于治疗实体肿瘤的免疫治疗组合药物和免疫联合治疗,由pd-1/pd-l1抑制剂和弓形体疫苗组成;
7.所述弓形体疫苗包括无毒弓形体或/和减毒弓形体;
8.所述实体肿瘤为免疫耐受实体肿瘤。
9.具体的,所述免疫治疗组合药物联合使用治疗免疫耐受实体肿瘤。
10.另一实施例中,所述pd-1/pd-l1抑制剂选自αpd-1抗体或/和pd-l1抗体。
11.优选的,所述pd-1/pd-l1抑制剂为αpd-1抗体。
12.另一实施例中,所述无毒弓形体为非复制尿嘧啶营养缺陷型弓形体nrtua;所述减毒弓形体选自δgra17基因缺失弓形体、cps基因缺失弓形体和δompdc基因缺失弓形体中的一种或多种。
13.优选的,所述弓形体疫苗的弓形体为非复制尿嘧啶营养缺陷型弓形体(nrtua虫株)。
14.另一实施例中,所述非复制尿嘧啶营养缺陷型弓形体nrtua的制备方法包括:
15.将所述非复制尿嘧啶营养缺陷型弓形体nrtua虫株接种在含有宿主细胞的培养瓶中进行寄生培养;待所述非复制尿嘧啶营养缺陷型弓形体nrtua虫株破壁后,收集所述非复制尿嘧啶营养缺陷型弓形体nrtua虫株;
16.所述培养瓶的培养基含有维持所述宿主细胞生长的培养基和尿嘧啶。
17.具体的,维持所述宿主细胞生长的培养基包括dmem、fbs和双抗溶液。
18.另一实施例中,所述宿主细胞选自人包皮成纤维细胞hff或/和hela细胞。
19.具体的,所述非复制尿嘧啶营养缺陷型弓形体nrtua的制备方法包括:
20.将所述非复制尿嘧啶营养缺陷型弓形体nrtua虫株接种在含有人包皮成纤维细胞培养瓶中进行寄生培养;待所述非复制尿嘧啶营养缺陷型弓形体nrtua破壁后,收集得到所述非复制尿嘧啶营养缺陷型弓形体nrtua;接着pbs重悬所述非复制尿嘧啶营养缺陷型弓形体nrtua虫株;
21.所述培养瓶的nrtua寄生培养基含尿嘧啶。
22.优选的,本技术发现利用非复制型尿嘧啶营养缺陷型弓形体(nrtua)和αpd-1联用,形成免疫联合药物,具有更强的肿瘤杀伤作用,可以显著抑制pan02胰腺癌皮下瘤的生长;非复制尿嘧啶营养缺陷型弓形体nrtua和αpd-1联用形成的免疫联合疗法能够激起免疫耐受肿瘤组织中免疫微环境的抗肿瘤反应。
23.具体的,所述非复制尿嘧啶营养缺陷型弓形虫nrtua可通过同源重组基因敲除技术构建的一种非复制尿嘧啶营养缺陷型无毒弓形体、其不能在宿主细胞中复制、在动物上无毒。其构建和毒性分析方法可参照本专利申请人周兴旺以通讯作者发表的论文:《一种非复制尿嘧啶营养缺陷型弓形虫的构建及其表型鉴定》,热带医学杂志,2021,21(12):1502-1508。
24.具体的,所述cps基因缺失弓形体可通过同源重组基因敲除技术改造的弓形虫cps基因缺失弱毒株(详见本技术人周兴旺的已授权发明专利:一种无毒株弓形体和中药多糖佐剂组合物的用途、疫苗及制备方法,专利号:zl201710408550.0,授权公告日:2020年7月14日(cn 107007830b);所述δompdc基因缺失弓形虫可通同源重组基因敲除改造的弓形虫δompdc基因缺失弱毒株(详见本技术人周兴旺发表在《热带医学杂志》2021,21(12):1502-1508的论文);所述δgra17基因缺失弓形体可通过crispr-cas9基因编辑技术改造的弓形虫δgra17基因缺失弱毒株等弓形体减毒虫株。
25.具体的,所述非复制尿嘧啶营养缺陷型弓形体nrtua为活体物,在缓冲液环境中存在,可制备成口服液或注射剂等使用。
26.另一实施例中,所述免疫治疗组合药物的剂型为混悬剂、糖浆剂、口服液、注射剂或它们的任意形式组合。
27.另一实施例中,所述免疫耐受实体肿瘤为胰腺癌、肝癌、结直肠癌、肾癌和胃癌中的一种或多种。
28.优选的,所述免疫耐受实体肿瘤为胰腺癌。
29.本技术第二方面提供了所述的免疫治疗组合药物在制备治疗免疫耐受实体肿瘤
药物中的应用。
30.另一实施例中,所述pd-1/pd-l1抑制剂和所述弓形体疫苗的弓形体的用量为现有有效的治疗剂量。
31.具体的,所述αpd-1抗体和所述无毒弓形体的用量为现有有效的治疗剂量。
32.另一实施例中,所述pd-1/pd-l1抑制剂的用量为1~100mg/kg,每周2~3次给药;所述弓形体疫苗的弓形体的用量为1~50
×
105/次,每周2~3次给药。
33.另一实施例中,所述pd-1/pd-l1抑制剂的用量为10mg/kg,每周2次给药,最好每3天给药一次;所述弓形体疫苗的弓形体的用量为2
×
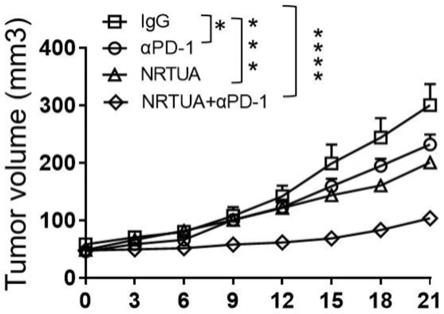
106个/次,每周2次给药,最好每3天给药一次。
34.具体的,所述αpd-1抗体的用量为10mg/kg,每周2次给药,最好每3天给药一次;所述非复制尿嘧啶营养缺陷型弓形体nrtua的用量为2
×
106个/次,每周2次给药,最好每3天给药一次
35.另一实施例中,所述治疗免疫耐受实体肿瘤药物包括所述免疫治疗组合药物和药学上可接受的辅料。
36.另一实施例中,所述治疗免疫耐受实体肿瘤药物的应用包括抑制所述免疫耐受实体肿瘤生长,促进cd8
+
t细胞浸润和cd8
+
t细胞分泌ifn-γ。
37.具体的,所述治疗免疫耐受实体肿瘤药物的应用包括:抑制胰腺癌的生长,且能够促进cd8
+
t细胞浸润、提高针对所述胰腺癌特异性的cd8
+
t细胞分泌的ifn-γ的分泌。
38.现有的pd-1等单免疫抑制剂单用治疗尽管在黑色素瘤、肺癌和淋巴癌等肿瘤有很好疗效,但对免疫耐受的恶性肿瘤不敏感。本技术发现无毒弓形体或/和减毒弓形体既能够激起宿主强烈的抗肿瘤免疫反应,又不会对宿主有病理损伤,将无毒弓形虫或/和减毒弓形体和pd-1/pd-l1抑制剂联用作为肿瘤免疫联合用药可克服原有pd-1抗体药物的原发性耐药(例如胰腺癌肿瘤),具有明显的抗免疫耐受型实体肿瘤效果,能有效扩大pd-1/pd-l1抗体的使用疗效和应用范围。本技术的试验数据证实无毒弓形虫nruta和αpd-1联用能够有效抑制胰腺癌小鼠皮下瘤的生长,且能够促进cd8
+
t细胞浸润、提高针对胰腺癌特异的cd8
+
t细胞分泌的ifn-γ的分泌,从而发挥更好的肿瘤杀伤效应。说明nrtua和αpd-1联用能有效重塑肿瘤免疫耐受型肿瘤组织中的抗肿瘤免疫微环境,促进抗肿瘤的特异cd8
+
t细胞的浸润和分泌ifn-γ,进而发挥更好的抗肿瘤效应。
附图说明
39.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
40.图1为本技术实施例提供的c57bl/6j小鼠皮下接种pan02细胞后,经过不同处理后,瘤体到30mm3后,开始检测瘤体体积的变化情况的统计图;
41.图2为本技术实施例提供的c57bl/6j小鼠皮下接种pan02细胞后,经过不同处理后,收集的瘤体重量统计的结果;
42.图3为本技术实施例提供的c57bl/6j小鼠皮下接种pan02细胞后,经过不同处理后,收集的瘤体进行ihc检测cd8
+
t的浸润情况;
43.图4为本技术实施例提供的c57bl/6j小鼠皮下接种pan02细胞后,经过不同处理
后,收集的瘤体进行流式检测cd8
+
t细胞分泌ifn-γ情况。
具体实施方式
44.本技术提供了涉及用于治疗实体肿瘤的免疫治疗组合药物和免疫联合疗法,用于解决现有技术中αpd-1抗体对免疫耐受胰腺癌实体瘤无治疗效果的技术缺陷。
45.下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
46.其中,以下实施例所用原料或试剂均为市售或自制。
47.实施例1
48.本技术实施例提供了hff(人包皮成纤维细胞)和pan02胰腺癌肿瘤细胞的培养传代,具体包括:
49.1、复苏hff和pan02细胞,分别利用完全培养基(质量分数为10%dmem+质量分数为10%fbs+质量分数为1%青霉素/链霉素溶液)37℃,5%co2培养箱中培养;
50.2、hff或是pan02汇合度达到90%,加入适量的0.25%胰酶-edta覆盖培养瓶底面细胞层,37℃,消化4min;
51.3、细胞悬浮脱壁后添加完全培养基终止胰酶消化,然后将两种细胞转移到新的15ml离心管中,1000rpm离心5min,弃上清;
52.4、然后分别加入完全培养基重悬细胞沉淀,按照比例稀释细胞悬液,传入细胞培养瓶、细胞培养板等不同规格的细胞培养皿中供下一步实验用。
53.实施例2
54.本技术实施例提供了非复制尿嘧啶营养缺陷型弓形体(nrtua虫株)的传代培养和制备,具体包括:
55.1、复苏非复制尿嘧啶营养缺陷型弓形体(nrtua无毒株),待用;当hff细胞汇合度达到90%以上时,更换hff细胞的培养基,换成含有250μm尿嘧啶的维持培养基(质量分数为3%dmem+质量分数为10%fbs+质量分数为1%青霉素/链霉素溶液),然后将50
×
104个nruta虫株加入到hff细胞培养瓶中;
56.2、接种了nruta的含有hff细胞的培养基放入37℃,5%co2培养箱培养,每4~5天nrtua完全破壁传代;
57.3、破壁后的nruta利用3μm直径的过滤筛过滤掉细胞碎片,收集过滤的nrtua速殖子,利用pbs重悬将nrtua速殖子浓度调整至1
×
107个/ml,用于后续实验。
58.实施例3
59.本技术实施例提供了pan02肿瘤细胞同源小鼠皮下成瘤实验,动物分组和不同药物的给药策略,具体包括:
60.一、pan02肿瘤细胞同源小鼠皮下成瘤实验:
61.1)购买动物:在北京维通利华实验动物技术有限公司购买足够数量的4-6周龄c57bl6/j雌性小鼠;
62.2)动物饲养:中山大学北校区spf级动物房a区;
63.3)收集对数生长期的pan02细胞,用pbs洗涤两次,0.25%胰酶-edta消化,pbs重悬细胞并计数,用pbs调整活细胞密度为1
×
107cells/ml,用1ml的注射器将0.2ml的pan02细胞悬液接种于c57bl6/j小鼠腹部右侧翼皮下;
64.4)每隔三日用游标卡尺测量小鼠肿瘤的体积,小鼠肿瘤体积计算公式:肿瘤体积(mm3)=0.5
×
长径(mm)
×
(短径(mm))2;
65.5)自肿瘤接种之日起约过2周,当注射部位可明显触及一质硬包块,观察肿瘤体积达到30mm3左右,将成功荷瘤的小鼠随机分为4组,分组情况如下述的(动物分组和给药策略),每组小鼠只数大于等于4只;
66.6)小鼠皮下成瘤后按照给药策略进行体内单抗或联用药物处理,每三天监测小鼠的肿瘤体积变化;
67.7)给药3周后,将小鼠颈椎脱臼处死,取出肿瘤拍照记录和肿瘤称重。
68.二、动物分组和给药策略:
69.对于上述的实验动物进行如下分组和给药:
70.1、igg对照组:anti-igg 250μg/dose(2a3 clone,bioxcell)利用200μl的pbs重悬,在小鼠皮下成瘤后第3、6、10、13、17、20天腹腔注射给药。
71.2、nrtua单用组:将实施例2制得的2
×
106个nrtua速殖子利用200μl的pbs重悬,在小鼠皮下成瘤后第0、4、7、14天腹腔注射,同时在第3、6、10、13、17、20天腹腔注射给250μg/dose的igg抗体。
72.3、αpd-1单用组:αpd-1250μg/dose(rmp1-14 clone,bioxcell)利用200μl的pbs重悬,在小鼠皮下成瘤后第3、6、10、13、17、20天腹腔注射给药。
73.4、nrtua+αpd-1联用组:将2
×
106个nrtua速殖子利用200μl的pbs重悬,在小鼠皮下成瘤后第0、4、7、14天腹腔注射,同时在第3、6、10、13、17、20天腹腔注射给250μg/dose的pd-1抗体(αpd-1)。
74.c57bl/6j小鼠皮下接种pan02细胞后,当四组小鼠的瘤体达到30mm3后,经过上述四种给药处理后开始定期检测瘤体体积,以及在第21天时,收集统计瘤体体积的变化情况(图1),统计瘤体重量的变化情况(图2)。
75.igg组为对照组,αpd-1组为pd-1抗体单用组,nruta组为非复制型尿嘧啶营养缺陷型弓形体处理组,nrtua+αpd-1组为nruta和pd-1抗体联用组。每组小鼠n》4,每个统计数据有3个重复。定量数据以均数
±
标准差表示,*p《0.05,**p《0.01,***p《0.001vs igg组。
76.从图1~图2结果可知:和igg组相比,nrtua+αpd-1组的小鼠瘤体生长显著受到抑制,nrtua+αpd-1组的抑制效果比αpd-1单用组的效果好。
77.实施例4
78.本技术实施例提供了分离肿瘤组织单细胞进行ihc检测cd8
+
t的浸润情况,具体包括:
79.一、分离肿瘤组织以及肿瘤组织单细胞:
80.1)分别将实施例3中四组小鼠颈椎脱臼处死后用75%酒精浸泡10s,用两套剪刀和镊子(一套剪皮、一套取肿瘤组织)分离小鼠肿瘤组织;
81.2)后续步骤都放到生物安全柜中操作;
82.3)将小鼠肿瘤组织尽量剪碎成1mm3的小块,加入含200u/ml胶原酶iv的hbss液,37
℃消化2h,期间应搅拌数次,或者在搅拌器缓慢搅拌下消化;
83.4)在孵育结束时,组织块利用带有大口径针(18-20g)的10ml注射器吸入5-7次,打碎剩余的组织,获得单个细胞悬液;
84.5)将消化后的肿瘤组织在70μm细胞过滤筛上用5ml的注射器头轻轻研磨,收集到的细胞悬液转移到15ml离心管中;
85.6)用pbs洗涤细胞,500g离心5min,弃上清;
86.7)加入ack红细胞裂解液10ml,涡旋3s,室温孵育3-5min,500g,离心5min,弃上清,若细胞沉淀为红色,重复该步骤;
87.8)利用pbs液洗涤细胞,500g离心5min,弃上清;
88.9)分离好的肿瘤细胞以适量细胞分离缓冲液(pbs、rpmi1640、流式检测buffer)充分重悬后冰上放置备用。
89.二、免疫组织化学(ihc)检测肿瘤组织中cd8
+
t免疫细胞的浸润情况:
90.1)将上述方法分离得到的小鼠肿瘤组织于4%多聚甲醛4℃固定24h;
91.2)组织包埋:在模具中加入液态石蜡,稍冷却,将组织完全埋入石蜡液中,自然冷却使石蜡凝固;
92.3)组织切片:将包埋好的组织块放入石蜡切片机切片,切片厚度为5μm。60℃烤片30min,使切片充分附着在载玻片上;
93.4)脱蜡水化:依次将石蜡切片放入二甲苯ⅰ15min
→
二甲苯ⅱ15min
→
无水乙醇ⅰ5min
→
无水乙醇ⅱ5min
→
95%酒精5min
→
85%酒精5min
→
75%酒精5min
→
蒸馏水洗;
94.5)抗原修复:盛有枸橼酸抗原修复缓冲液(ph 6.0)的修复盒放入微波炉内,微波炉火力调至中档,先把溶液加热至沸(4min),放入切片,继续加热10min,注意液面是否下降,如果下降补加液体,再加热10min;
95.6)室温自然冷却后将载玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
96.7)切片放入3%双氧水甲醇溶液,室温避光孵育20min,将载玻片置于pbs(ph 7.4)中在脱色摇床上晃动洗涤3次,每次5min;
97.8)在组化圈内滴加3%bsa均匀覆盖组织,室温封闭30min;
98.9)轻轻甩掉封闭液,在切片上滴加一抗(cst,cd8 antibody,#98941,1:400稀释),切片平放于湿盒内4℃孵育过夜,湿盒内加少量水,防止抗体蒸发;
99.10)载玻片置于pbs(ph 7.4)中在脱色摇床上晃动洗涤3次,每次5min。载玻片用吸水纸尽量拍干后在圈内滴加与二抗(gene tech,通用hrp标记的二抗,#gk600710a)覆盖组织,室温孵育50min;
100.11)载玻片置于pbs(ph 7.4)中在脱色摇床上晃动洗涤3次,每次5min。玻片用吸水纸尽量拍干后在圈内滴加新鲜配制的dab显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色;
101.12)将载玻片放入苏木素复染3min左右,接着自来水洗,苏木素分化液分化数秒,自来水冲洗,再苏木素返蓝液返蓝,流水冲洗;
102.13)将切片依次放入75%酒精5min
→
85%酒精5min
→
无水乙醇ⅰ5min
→
无水乙醇ⅱ5min
→
二甲苯ⅰ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片;
103.14)显微镜镜检,图像采集分析。将c57bl/6j小鼠皮下接种pan02细胞后,经过四种不同处理后(igg、nrtua单用、αpd-1单用、nrtua+αpd-1联用),收集的瘤体进行ihc检测cd8
+
t的浸润情况。结果如图3,igg组为对照组,αpd-1组为pd-1抗体单用组,nruta组为非复制型尿嘧啶营养缺陷型弓形体处理组,nrtua+αpd-1组为nruta和pd-1抗体联用组。每组小鼠n》4,每个统计数据有3个重复。定量数据以均数
±
标准差表示,*p《0.05,**p《0.01,***p《0.001vs igg组。
104.从图3结果可知:和igg组相比,nrtua+αpd-1组的小鼠瘤体的cd8
+
t的浸润显著增加,nrtua+αpd-1组的效果比αpd-1单用组的效果好。
105.实施例5
106.本技术实施例提供了流式检测肿瘤组织中cd8
+
t细胞分泌的ifn-γ情况,具体包括:
107.1)分别收集实施例4中四组肿瘤组织单细胞以rmpi 1640完全培养基调整细胞浓度至1
×
107/ml,每ml加入2μl 500
×
cell stimulation cocktail(ebioscience),37℃,5%co2孵育4h;
108.2)收集刺激好的淋巴细胞,计数活细胞,加入anti-mouse cd16/32抗体混匀后4℃静置15min。每管以500g离心5min弃上清,用染色缓冲液洗一遍;
109.3)加入50μl流式染色缓冲液(2%fbs inpbs)重悬细胞,用荧光素标记的流式抗体染色细胞表面抗原(fitc-cd45,brilliant violet 421-cd3,pe-cd8),4℃避光孵育30min;
110.4)加入2ml流式染色缓冲液,500g离心5min,弃上清;
111.5)每个样品管中加入250μl固定/通透液(bd cytofix/cytoperm
tm
fixation/permeablizationkit,#554714),涡旋样品(《5s)使细胞充分重悬,4℃避光孵育30min;
112.6)每管加入1ml 1
×
通透/洗涤缓冲液,涡旋样品(《5s)使细胞充分重悬,4℃500g离心5min,弃上清,重复该步骤一遍;
113.7)加入50μl 1
×
通透/洗涤缓冲液重悬细胞,用荧光素标记的流式抗体染色胞浆中的细胞因子(pe-cy7-ifn-γ),4℃避光孵育30min;
114.8)用2ml 1
×
流式通透缓冲工作液洗细胞样品,500g室温离心5min,弃上清;
115.9)每管加入2ml流式染色缓冲液,500g离心5min,弃上清;
116.用200μl流式染色缓冲液重悬细胞,流式细胞仪分析染色结果。
117.c57bl/6j小鼠皮下接种pan02细胞后,经过不同处理后,收集的瘤体进行流式检测cd8
+
t细胞分泌ifn-γ情况。
118.igg组为对照组,αpd-1组为pd-1抗体单用组,nruta组为非复制型尿嘧啶营养缺陷型无毒弓形体处理组,nrtua+αpd-1组为nruta和pd-1抗体联用组。每组小鼠n》4,每个统计数据有3个重复。定量数据以均数
±
标准差表示,*p《0.05,**p《0.01,***p《0.001 vs nrtua+αpd-1组。
119.结果如图4,与igg、αpd-1、nrtua相比,nrtua+αpd-1组的小鼠肿瘤组织中cd8
+
t细胞分泌的ifn-γ显著上升。说明nrtua+αpd-1联合应用能够显著促进肿瘤微环境中cd8
+
t的细胞杀伤效果。
120.综上所述,本技术实施例提供了nrtua和αpd-1联用形成组合的免疫联合治疗药物;nrtua和αpd-1联用对免疫检查点抑制剂不敏感的实体胰腺癌(胰腺瘤)有治疗效果;
nrtua和αpd-1联用对其他免疫耐受或是对免疫检查点抑制剂不敏感的恶性肿瘤有治疗效果。
121.以上所述仅是本技术的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1