一种恩杂鲁胺注射剂及其制备方法和应用与流程
1.本发明涉及药物制剂技术领域,更具体地说,是涉及一种恩杂鲁胺注射剂及其制备方法和应用。
背景技术:
2.新冠肺炎在2019年底开始全球蔓延,累积确诊已达9600万人,死亡病例超过205万人。针对新冠病毒性肺炎的预防和治疗,全球的医药工作研究者开发了疫苗,中和抗体,小分子药物等多种预防和治疗方法。有研究发者现,小分子药物ar(雄激素受体)抑制剂可以在病毒性肺炎治疗中,其通过有效抑制hif-1α与ar相互结合,在成纤维细胞中的低氧环境下,阻止炎症因子风暴相关基因(il6、mmp2、mmp13、adamts4、eln、vcan、col3a1、vegfa)的转录,使相关基因的表达量降低,进而抑制低氧环境下肺部成纤维细胞的活化。ar抑制剂通过抑制肺部成纤维细胞的活化,可以让严重呼吸道感染的急性呼吸窘迫综合征(ards)患者维持肺功能、改善临床疗效。
3.病毒性肺炎,根据症状严重程度,临床分为轻型、中型、重型和危重型。中度病例伴随发烧,呼吸道症状和肺炎影像学表现;重症病例出现低氧血症,且静止时的氧饱和度<93%或pao2/fio2<300mmhg;危重症病例则会需要机械通气或icu重症监护等。对于病毒性肺炎的中度和重度患者,尤其是icu病患,为了保证给药安全,剂量准确,治疗即时,提供一种ar抑制剂——恩杂鲁胺的注射液成为本领域技术人员亟待解决的技术难题。
4.恩杂鲁胺(enzalutamide),是由美国medivation公司和日本安斯泰来(astellas)公司合作开发的新一代抗雄激素药物,可用于治疗已扩散或复发的晚期(转移性)男性去势抵抗性前列腺癌。2012年8月31日经美国食品药品监督管理局(fda)批准上市。上市剂型为明胶软胶囊及片剂,规格为40mg。每日服用一次,每次服用4粒,共计160mg。
5.恩杂鲁胺为白色结晶性固体粉末,水溶性极差。原研厂家安斯泰来公司公开的恩杂鲁胺在水中溶解度仅为2μg/ml,申请号为201380075784.8的中国专利公开的一种非晶型态的恩杂鲁胺在水中的溶解度也仅为7.85μg/ml。
6.安斯泰来公司开发的恩杂鲁胺软胶囊,将原料药溶解于辛酰己酰聚氧甘油酯中,形成溶液,灌装于明胶软胶囊中。但是软胶囊制剂存在一定的局限性,不适合消化道溃疡病人服用。另外,软胶囊中需要有油溶性溶剂加入,容易酸败,稳定性风险较高。软胶囊制备工艺复杂,劳动强度较大,所得包装前产品,易粘连,漏液,成本较高。
7.为了解决恩杂鲁胺溶出度低、生物利用度低的缺点,有研究通过固体分散体等药物制剂技术加以解决。恩杂鲁胺与醋酸羟丙甲纤维素琥珀酸酯溶剂于丙酮中,喷雾干燥,形成固体分散体进行压片。由于工艺中使用丙酮作为溶剂,其环保和有机试剂残留也是需要解决的难题。
8.上述上市恩杂鲁胺产品的制剂技术均为固体口服制剂。如果将恩杂鲁胺应用于病毒性肺炎的中症至重症患者,尤其是icu看护的病患,是无法进行口服给药,且起效也不够快,即使制备成混悬液,依旧无法保证给药剂量的准确性。根据病患应用的实际需要和目前
可应用的药品,恩杂鲁胺注射液具有明确的临床需求。
技术实现要素:
9.有鉴于此,本发明的目的在于提供一种恩杂鲁胺注射剂及其制备方法和应用,本发明针对治疗中重症病毒性肺炎患者,为方便给药,且保证临床给药剂量准确,快速起效,将ar抑制剂恩杂鲁胺制备为注射剂,突破其溶解度差和稳定性挑战;本发明提供的制备方法制备方便,稳定性较好,且工艺简单,可放大生产,具有良好的稳定性;该制备方法制备得到的恩杂鲁胺注射剂能够应用于病毒性肺炎的中度至重度患者,尤其是icu病患,实现方便给药,快速起效,保证给药剂量以达到抑制炎症的效果。
10.本发明提供了一种恩杂鲁胺注射剂的制备方法,包括以下步骤:
11.a)将表面活性剂和溶剂混合均匀后,加入恩杂鲁胺,混合均匀,得到混合溶液;
12.b)将步骤a)得到的混合溶液中加入附加剂,混合均匀,再经过滤除菌,灌装轧盖,得到恩杂鲁胺注射液。
13.优选的,步骤a)中所述表面活性剂选自聚山梨酯、15-羟基硬脂酸聚乙二醇酯和聚氧乙烯蓖麻油中的一种或多种。
14.优选的,步骤a)中所述溶剂选自无水乙醇、聚乙二醇200、聚乙二醇300、聚乙二醇400、异丙醇、丙二醇和甘油中的一种或多种。
15.优选的,步骤a)中所述表面活性剂、溶剂和恩杂鲁胺的质量比为(100~500):(100~500):(1~50)。
16.优选的,步骤b)中所述附加剂为ph调节剂和抗氧剂;所述附加剂的加入量为所述混合溶液质量的0.001%~0.1%。
17.优选的,所述ph调节剂选自枸橼酸、乳酸、富马酸、盐酸、酒石酸、冰醋酸、磷酸氢二钾和无水乙酸钠中的一种或多种。
18.优选的,所述抗氧剂选自亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、丁基羟基茴香醚和二丁基羟基甲苯中的一种或多种。
19.优选的,步骤b)中所述过滤除菌采用0.22μm滤芯进行。
20.本发明还提供了一种恩杂鲁胺注射剂,采用上述技术方案所述的制备方法制备而成。
21.本发明还提供了一种注射剂在治疗病毒性肺炎药物中的应用,所述注射剂为上述技术方案所述的恩杂鲁胺注射剂。
22.本发明提供了一种恩杂鲁胺注射剂及其制备方法和应用;该制备方法包括以下步骤:a)将表面活性剂和溶剂混合均匀后,加入恩杂鲁胺,混合均匀,得到混合溶液;b)将步骤a)得到的混合溶液中加入附加剂,混合均匀,再经过滤除菌,灌装轧盖,得到恩杂鲁胺注射液。本发明针对治疗中重症病毒性肺炎患者,为方便给药,且保证临床给药剂量准确,快速起效,将ar抑制剂恩杂鲁胺制备为注射剂,突破其溶解度差和稳定性挑战;本发明提供的制备方法制备方便,稳定性较好,且工艺简单,可放大生产,具有良好的稳定性;该制备方法制备得到的恩杂鲁胺注射剂能够应用于病毒性肺炎的中度至重度患者,尤其是icu病患,实现方便给药,快速起效,保证给药剂量以达到抑制炎症的效果。
附图说明
23.图1为实施例19溶血实验的稀释倍数与溶血率;
24.图2为实施例20大鼠药代动力学研究中大鼠血药浓度与时间曲线。
具体实施方式
25.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
26.本发明提供了一种恩杂鲁胺注射剂的制备方法,包括以下步骤:
27.a)将表面活性剂和溶剂混合均匀后,加入恩杂鲁胺,混合均匀,得到混合溶液;
28.b)将步骤a)得到的混合溶液中加入附加剂,混合均匀,再经过滤除菌,灌装轧盖,得到恩杂鲁胺注射液。
29.本发明首先将表面活性剂和溶剂混合均匀后,加入恩杂鲁胺,混合均匀,得到混合溶液。在本发明中,所述表面活性剂是指:能够增加恩杂鲁胺和所述溶剂之间的相容效果,同时增加恩杂鲁胺在水中的溶解能力,可以使水难溶性的恩杂鲁胺溶解在临床使用的5%葡萄糖注射液或0.9%氯化钠溶液注射液中的一类物质,优选选自聚山梨酯(如如聚山梨酯20、聚山梨酯60、聚山梨酯80)、kolliphor hs 15(solutol hs 15,15-羟基硬脂酸聚乙二醇酯)和kolliphor elp(cremophor elp,聚氧乙烯蓖麻油)中的一种或多种,更优选为kolliphor hs 15。本发明对所述表面活性剂的来源没有特殊限制,采用本领域技术人员熟知的市售商品即可。
30.在本发明中,所述溶剂是指:能够溶解恩杂鲁胺、并且增加恩杂鲁胺在水中的溶解能力,可用于临床注射的一列物质,优选选自无水乙醇、聚乙二醇200、聚乙二醇300、聚乙二醇400、异丙醇、丙二醇和甘油中的一种或多种,更优选为无水乙醇和聚乙二醇400的混合溶剂,二者的混合比例优选为1:(1~3)。
31.在本发明中,所述表面活性剂、溶剂和恩杂鲁胺的质量比优选为(100~500):(100~500):(1~50),更优选为(300~500):(200~500):10。
32.本发明对所述混合均匀(包括步骤b)中所述的混合均匀)的具体方式没有特殊限制,采用本领域技术人员熟知的搅拌的技术手段即可。
33.得到所述混合溶液后,本发明将得到的混合溶液中加入附加剂,混合均匀,再经过滤除菌,灌装轧盖,得到恩杂鲁胺注射液。
34.在本发明中,所述附加剂优选为ph调节剂和抗氧剂;其中,ph调节剂是指能够调节混合溶液的ph值,并且增加恩杂鲁胺的稳定性,可用于临床注射的一类物质,主要包括一些可注射用的酸,抗氧剂是指能够能延缓氧对药物制剂产生氧化作用的物质。
35.在本发明中,所述ph调节剂优选选自无水枸橼酸、乳酸、富马酸、盐酸、酒石酸、冰醋酸、磷酸氢二钾和无水乙酸钠中的一种或多种。在本发明中,所述抗氧剂优选选自亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、丁基羟基茴香醚(bha)和二丁基羟基甲苯(bht)中的一种或多种。本发明对所述附加剂的来源没有特殊限制,采用本领域技术人员熟知的市售商品即可。
36.在本发明中,所述附加剂的加入量优选为所述混合溶液质量的0.001%~0.1%。
37.在本发明中,所述过滤除菌优选采用0.22μm滤芯进行。
38.本发明还提供了一种恩杂鲁胺注射剂,采用上述技术方案所述的制备方法制备而成。
39.本发明通过研究发现,通过本处方工艺,恩杂鲁胺的稳定性数据得到了很大的提高,尤其表面活性剂为kolliphor hs 15,无水乙醇和聚乙二醇400的混合使用,稳定性最优。表面活性剂为kolliphor hs 15是一种非离子增溶剂和乳化剂,由15摩尔的环氧乙烷和1摩尔的12-羟基硬脂酸反应制得。在外观下,kolliphor hs 15呈浅黄色至白色粘稠状,温度升至约30℃时变为液体。kolliphor hs 15由脂溶性部分(聚乙二醇/12-羟基硬脂酸形成的单酯或二酯)和亲水性部分(约30%的游离聚乙二醇),可溶于水、乙醇及异丙醇。kolliphor hs 15亲脂部分,使其将不易溶于水的恩杂鲁胺包裹起来,其亲水部分,在用0.9%的生理盐水或者5%葡萄糖稀释时,形成澄清透明的胶束溶液。kolliphor hs 15的聚乙二醇酯部分,可与不溶性化合物恩杂鲁胺的酰胺键氢键结合,增强其稳定性。
40.本发明还提供了一种注射剂在治疗病毒性肺炎药物中的应用,所述注射剂为上述技术方案所述的恩杂鲁胺注射剂。本发明成功开发了恩杂鲁胺的注射剂制剂,提高了难溶性恩杂鲁胺的稳定性,及稀释之后的稳定性。恩杂鲁胺注射剂将应用于病毒性肺炎的中度至重度患者,尤其是icu病患,实现方便给药,快速起效,保证给药剂量以达到抑制炎症的效果。
41.与现有技术相比,本发明的有益效果如下:
42.(1)用于治疗中重症肺炎,恩杂鲁胺以注射剂形式给药,治疗方便,起效快,效果显著等优点;
43.(2)通过对表面活性剂,溶剂和潜溶剂的种类和比例的筛选,最终处方具有明显的稳定性优势;
44.(3)开发的恩杂鲁胺注射剂安全性较好。通过体内pk研究,验证项目设计的目的,可以通过静脉注射给药,实现给药起效快,更好的满足icu病人的临床需求,同时保证给药剂量准确,给药方便等。
45.本发明提供了一种恩杂鲁胺注射剂及其制备方法和应用;该制备方法包括以下步骤:a)将表面活性剂和溶剂混合均匀后,加入恩杂鲁胺,混合均匀,得到混合溶液;b)将步骤a)得到的混合溶液中加入附加剂,混合均匀,再经过滤除菌,灌装轧盖,得到恩杂鲁胺注射液。本发明针对治疗中重症病毒性肺炎患者,为方便给药,且保证临床给药剂量准确,快速起效,将ar抑制剂恩杂鲁胺制备为注射剂,突破其溶解度差和稳定性挑战;本发明提供的制备方法制备方便,稳定性较好,且工艺简单,可放大生产,具有良好的稳定性;该制备方法制备得到的恩杂鲁胺注射剂能够应用于病毒性肺炎的中度至重度患者,尤其是icu病患,实现方便给药,快速起效,保证给药剂量以达到抑制炎症的效果。
46.为了进一步说明本发明,下面通过以下实施例进行详细说明。
47.实施例1溶剂的恩杂鲁胺溶解度对比
48.选择溶剂无水乙醇,甘油,peg400,丙二醇,以10mg/ml加入恩杂鲁胺,对比溶剂的溶解能力peg400》无水乙醇》丙二醇,甘油。将这四种溶剂与增溶剂混合溶解恩杂鲁胺进行对比。
49.实施例2增溶剂与溶剂的筛选
50.增溶剂选择:吐温80,kolliphor hs15,cremophor el;
51.溶剂的筛选:无水乙醇,甘油,peg400,丙二醇;
52.将增溶剂与溶剂按照1:1的比例混合均匀,加入一定的恩杂鲁胺观察溶解情况。
53.表1溶剂与增溶剂的组合
54.溶剂/增溶剂吐温80kolliphor hs15cremophor el乙醇√√√丙二醇√√(常温下固态)√peg400√√(常温下固态)√甘油
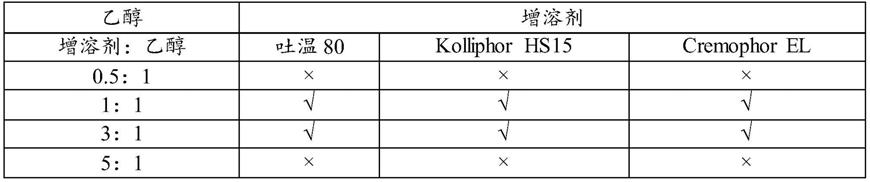
×××
55.备注:√——可以溶解,
×
——不能溶解。
56.结论:(1)乙醇组较优,可快速溶解药物,溶液的流动性及粘性表现最好,最大可溶解50mg/ml;
57.(2)丙二醇/peg400与kolliphor hs15呈现半固体状态;在37℃水浴下呈液态,最大可溶解恩杂鲁胺至20mg/ml,溶解效果、粘性及流动性不及乙醇;
58.(3)甘油与这三种增溶剂分层,且溶解效果流动性都较差;
59.经过筛选对比,乙醇作为溶剂较优。
60.实施例3增溶剂与溶剂比例的筛选
61.增溶剂与溶剂的比例筛选,按照0.5:1,1:1,3:1及5:1的比例混合,加入原料药20-50mg/ml,观察药物的溶解情况。
62.表2增溶剂与溶剂的比例筛选
[0063][0064]
备注:√——可以溶解,
×
——不能溶解。
[0065]
溶剂与增溶剂的比例筛选,乙醇:增溶剂的比例在1:1-3之间增容效果最好,可以溶解药物20-50mg/ml,且观察溶液的流动性较好,未出现溶液粘稠且无法定量的现象。
[0066]
实施例4恩杂鲁胺注射剂的制备
[0067][0068]
制备方法:将处方量的吐温80和无水乙醇混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;混合均匀后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0069]
实施例5增溶剂、溶剂与潜溶剂的比例筛选
[0070]
表3处方筛选
[0071]
处方序号吐温乙醇peg40010.10.30.620.10.60.330.30.10.640.30.60.150.60.10.360.60.30.17na0.50.5
[0072]
在实施例4(吐温80和无水乙醇1:1基础处方)上,选择加入潜溶剂peg400增加其溶解恩杂鲁胺的能力和稀释后的稳定性。筛选其比例,通过0.1(低),0.3(中),0.6(高)三个维度分别组合,找到其关键影响因素。实验设计如处方1-处方7,通过与实施例4比较其溶解度和稀释后稳定性。
[0073]
(1)处方3和处方5溶解恩杂鲁胺的能力较低,吐温和peg400的粘性较大,乙醇太少溶液的流动性差,溶液的溶解度差。
[0074]
(2)处方1,2,4,6,7溶解能力与实施例4相当,以相同的母液浓度稀释相同倍数,观察其澄清度,处方1和处方7为乳浊液,处方组成中peg400比例大时,稀释后其粒径较大,容易聚集沉淀。
[0075]
(3)对比处方2,4,6溶解度及稀释后溶液澄清稳定状态,实施例4筛选了增溶剂与溶剂的比例,以1:1为最优,综合考虑,吐温:乙醇:peg400=5:2-4:3-1,后续以吐温:乙醇:peg400=5:2:3为实施例比例筛选。
[0076]
实施例6恩杂鲁胺注射剂的制备
[0077][0078]
制备方法:将处方量的吐温80,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;混合均匀后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0079]
实施例7恩杂鲁胺注射剂的制备
[0080][0081]
制备方法:将处方量的吐温80,无水乙醇,peg400和peg200混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;混合均匀后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0082]
实施例8(实施例4,实施例6~7在室温,40℃,60℃放置不同时间的稳定性数据)
[0083]
将实施例4和实施例6-7所得制剂产品,取相同体积不同条件下密封保存,分别在第0天、7天、14天记录各实施例稳定性实验数据。
[0084]
实施例对比说明:(1)通过对注射剂常用溶剂溶解恩杂鲁胺的能力筛选对比,peg400和无水乙醇的溶解效果最好。(2)吐温为注射剂常用增溶剂,通过对比考察吐温和溶剂的混合溶液溶解恩杂鲁胺的能力,发现其与无水乙醇的混合后的增溶能力较高。(3)通过对比吐温与溶剂乙醇,增溶剂peg400各个比例混合,筛选出较优的比例为5:2:3。进行溶解度和稳定性对比。稳定性结果见表4。
[0085]
表4稳定性数据
[0086][0087][0088]
实验结果分析:
[0089]
实施例4和实施例6在室温下(7天和14天)其最大单杂低于0.5%,总杂低于1%。40℃条件比室温条件杂质明显增加。
[0090]
实施例7的最大单杂和总杂0天条件下明显高于实施例4和实施例6,在高温下杂质增长的更快。可见加入的peg200并没有起到保护剂的作用,反而引入了更多杂质问题,后续实施例不加入peg200。从稳定性数据看来,吐温的稳定性结果并不理想,接下来通过筛选更多的增溶剂种类来提高其稳定性。增溶剂和溶剂及潜溶剂的比例为5:2:3,通过对比不同增溶剂,考察其稳定性结果。
[0091]
实施例9恩杂鲁胺注射剂的制备
[0092][0093]
制备方法:将处方量的kolliphor hs 15,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;混合均匀后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0094]
实施例10恩杂鲁胺注射剂的制备
[0095][0096]
制备方法:将处方量的kolliphor elp,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;混合均匀后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0097]
实施例11(实施例9~10在室温,40℃,60℃放置不同时间的稳定性数据)
[0098]
将实施例9-10所得制剂产品,取相同体积不同条件下密封保存,分别在第0天、7天、14天记录各实施例稳定性实验数据。
[0099]
实施例对比说明:在实施例6的基础上,对比不同增溶剂(吐温80,kolliphor hs 15,kolliphor elp),其稳定性结果见表5。
[0100]
表5稳定性数据
[0101][0102]
实验结果分析:
[0103]
由表5可见,更换了增溶剂的种类后,其稳定性结果有明显改善。尤其是增溶剂kolliphor hs 15,其在室温条件下的最大单杂低于0.1%,总杂低于0.2%。在40℃条件下14天稳定性数据,最大单杂和总杂都低于1.0%,明显优于另外两组。在60℃条件下最大单杂和总杂都有增加,可见温度对杂质的增长影响最大,后续样品应常温或冷藏保存。
[0104]
较优的处方为实施例9,根据已有的稳定性数据推测,增溶剂kolliphor hs15与无水乙醇的单独组合,应与实施例9稳定性结果相似,具体待进一步考察。
[0105]
实施例12恩杂鲁胺注射剂的制备-加ph调节剂
[0106][0107]
制备方法:将处方量表面活性剂,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;加入ph调节剂无水枸橼酸,完全溶解后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0108]
实施例13恩杂鲁胺注射剂的制备-加抗氧剂
[0109][0110]
制备方法:将处方量表面活性剂,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;加入抗氧剂bha和bht,完全溶解后通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0111]
实施例14恩杂鲁胺注射剂的制备-加ph调节剂和抗氧剂
[0112][0113]
制备方法:将处方量表面活性剂,无水乙醇和peg400混合均匀;将处方量的恩杂鲁胺加入混合溶液中,搅拌溶解;加入ph调节剂无水枸橼酸,待完全溶解后再加入抗氧剂bha和bht,通过0.22μm滤芯过滤除菌,灌装轧盖,即得恩杂鲁胺注射剂。
[0114]
实施例15恩杂鲁胺注射剂的制备(实施例9和12~14在室温,40℃,60℃放置不同时间的稳定性数据)
[0115]
由于恩杂鲁胺在碱性条件下易降解,也容易氧化降解,为了增强其稳定性,加入无水枸橼酸形成酸性环境,加入抗氧剂bha和bht,增强其稳定性。其稳定性数据如表6。
[0116]
表6附加调节剂对恩杂鲁胺的稳定性研究
[0117][0118][0119]
实验结果分析:实施例12为实施例9加入ph调节剂后,其稳定性更差,由于ph调节剂的加入使溶液局部酸性环境,对ph调节剂的加入方式有待进一步考察。实施例13为加入抗氧剂后,处方稳定性并没有明显提高。实施例14为加入ph调节剂和抗氧剂的处方,其稳定性略有提高。在基础处方单独加入ph调节剂或者抗氧剂,其稳定性没有明显提高,处方加入ph调节剂和抗氧剂两项附加调节剂后,7天的高温条件下其稳定性有提高,后续随着时间的增加,其稳定性优势更明显。
[0120]
实施例16溶液稀释稳定性考察
[0121]
将实施例4,6,7和实施例9稀释不同倍数进行考察,两个浓度2.5mg/ml和10mg/ml,分别稀释5倍,10倍,20倍,静止观察析出时间,结果见表7和表8。
[0122]
表7母液浓度2.5mg/ml析出情况
[0123][0124]
表8母液浓度10mg/ml析出情况
[0125]
[0126][0127]
结果分析:(1)溶液浓度不同,稀释相同倍数,其析出情况不一致,浓度越大,稀释倍数越大,其溶液体系越不稳定,容易析出。(2)不同处方,相同浓度稀释相同倍数,其析出情况不同。实施例6和实施例9的稀释稳定性较好。
[0128]
综合杂质稳定性数据和稀释稳定性数据,实施例9(kolliphor hs 15:乙醇:peg400=5:2:3)为最优处方,具有较优的样品稳定性数据,较好的稀释稳定性。
[0129]
实施例17稀释方式对稀释稳定性的影响
[0130]
稀释方式对溶液稳定性的影响的考察,将实施例9的10mg/ml的溶液,稀释至1mg/ml及0.5mg/ml考察其稳定性。
[0131]
稀释方法一:将10mg/ml母液用0.9%的生理盐水直接稀释至1mg/ml及0.5mg/ml,放至不同时间观察析出沉淀情况。
[0132]
稀释方法二:将10mg/ml母液用0.9%的生理盐水稀释至5mg/ml后,再分别稀释至1mg/ml及0.5mg/ml,放置不同时间观察析出沉淀情况。
[0133]
表9溶液稳定性
[0134][0135]
由稀释后溶液稳定性结果可见,稀释后溶液稳定性与稀释方式有一定的关系。稀释方法一,其形成的胶束稳定性较差,容易团聚析出。稀释方法二,逐步稀释其粒径更小,溶液稳定性更好,更加的澄清透明。
[0136]
实施例18稀释溶液对稀释稳定性影响
[0137]
不同稀释剂溶液对稳定性的影响的考察,将实施例9的10mg/ml的溶液,稀释至1mg/ml及0.5mg/ml考察其稳定性。
[0138]
稀释剂0.9%的生理盐水:将10mg/ml恩杂鲁胺溶液用0.9%的生理盐水稀释至1mg/ml及0.5mg/ml,放至不同时间观察析出情况。
[0139]
稀释剂5%的葡萄糖:将10mg/ml恩杂鲁胺溶液用5%的葡萄糖稀释至1mg/ml及0.5mg/ml,放至不同时间观察析出情况。
[0140]
表10溶液稳定性
[0141][0142]
恩杂鲁胺溶液使用两种稀释剂,其析出情况不同,使用0.9%的生理盐水其稳定性较差,一个小时后有析出现象;使用葡萄糖其溶液体系相对较好,在4个小时左右有析出。
[0143]
实施例19溶血实验
[0144]
溶血是指红细胞破裂、溶解的一种现象,有些药物含有溶血成分或物理、化学、生物等方面的原因,在直接注射入血管后可产生溶血现象。溶血实验是血液学检测项非常有意义的筛选实验,是药物进入市场前进行的安全评价中重要的部分,因此相关实验的探究和讨论至关重要。
[0145]
受试品为下列四个处方,处方一和处方二增溶剂为kolliphor hs 15,处方一为空白处方,处方二为含药处方。处方三和处方四增溶剂为吐温80,处方三为空白处方,处方四为含药处方。
[0146][0147]
以体外溶血试管法进行恩杂鲁胺注射剂体外溶血评价,取洁净试管,编号,分别为受试品管、阴性试管,阳性试管,依次加入2ml受试品处方一至处方四的不同稀释倍数(10倍,20倍,50倍,100倍,200倍,500倍,1000倍,2000倍),0.9%的生理盐水和蒸馏水,分别加入0.5ml的5%的兔红细胞混悬液混合。各试管摇匀后置于37℃恒温孵育3h,孵育结束后以1000r/min,离心5min。以紫外分光光度法测定上层吸光度值(a),波长545nm,按以下公式计算溶血率:溶血率(%)=(a受试品-a阴性)/(a阳-a阴)
×
100%,溶血率高于5%即为溶血阳性。实验结果参见表11及图1。
[0148]
表11处方溶血率
[0149][0150]
结论:(1)对比处方一和处方三,不同增溶剂的溶血情况不同,kolliphor hs 15的处方比吐温80的处方在稀释相同倍数情况下,使用相同浓度,溶血率明显较低,具有更好的安全性;(2)处方一和处方二,处方三和处方四溶血结果对比可得,同一处方的空白溶剂和含药组其溶血情况相似,表明恩杂鲁胺原料药对红细胞的溶血情况没有影响;(3)处方一和处方二在稀释500倍后,其溶血率低于5%,其安全性较为可靠。
[0151]
实施例20大鼠药代动力学研究
[0152]
恩杂鲁胺注射剂(实施例9,即kolliphor hs 15作为增溶剂组)和口服恩杂鲁胺混悬液给药后,进行大鼠的体内药代动力学评价。健康雄性大鼠,分为三个注射组(三个剂量组)和一个口服组,每组3只,注射组分为三个剂量10mg/kg,30mg/kg,50mg/kg,给药体积为10ml/kg的恩杂鲁胺注射剂,在给药后0.083h,0.25h,0.5h,1h,3h,6h,8h,12h,24h取血样样本检测。口服组剂量为30mg/kg,给药体积为10ml/kg的恩杂鲁胺混悬液,在给药后1h,2h,3h,5h,6h,8h,12h,24h取血样样本检测。
[0153]
恩杂鲁胺血药浓度与时间曲线如图2,计算下列参数的值,c0为大鼠静脉注射的最高血药浓度,cmax为大鼠口服给药的最高血药浓度,t
1/2
为血药浓度降低一半所需要的时间,auc为血药浓度与时间的曲线下面积。大鼠的药代动力学参数见下表12,表13及图2。
[0154]
表12大鼠静脉注射药代动力学数据
[0155][0156]
表13大鼠口服药代动力学数据
[0157][0158]
备注:iv为静脉注射给药,po为口服给药。
[0159]
由大鼠体内药代动力学结果可见,(1)相同剂量条件下,恩杂鲁胺注射剂的最高血药浓度是口服恩杂鲁胺混悬液的19倍,auc为口服组的5倍,注射剂比口服恩杂鲁胺的起效快,生物利用度高。(2)相同剂型,不同剂量组,恩杂鲁胺注射剂的三个剂量组结果对比,其c0和auc成线性比例,随着给药剂量的增加,血药浓度成比例增加。
[0160]
由此可见,开发的恩杂鲁胺注射剂比口服恩杂鲁胺制剂具有明显的药代动力学优势,且治疗病毒性肺炎的中症至重症患者,起效快,适应性高等优点,满足临床需求。
[0161]
所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1