一种能够逆转肿瘤相关免疫衰老的唾液酸协助递送药物组合物及其制备方法和应用
1.本发明属于医药技术领域,尤其涉及一种药物组合物及其制备方法和应用。
背景技术:
2.全球老年人口比例逐年增加,人口老龄化问题日益严重。随着年龄的增长,免疫系统在多种因素的长期共同作用下逐渐产生一系列的退行性变化,称为免疫衰老。t淋巴细胞老化是免疫衰老的主要表现。临床资料表明,人体的健康与t淋巴细胞密切相关,t淋巴细胞老化是老年人患病的主要原因。t淋巴细胞具有年龄依赖性,识别和清除有害元素(如微生物或恶性细胞)的能力随着年龄的增长而显着降低。免疫衰老引起的cd8
+
t细胞衰老使肿瘤细胞更容易逃避和增殖,增加治疗后癌症复发的可能性。此外,先天免疫细胞(例如,中性粒细胞、单核细胞、nk细胞)会受到免疫衰老的影响。目前对免疫衰老的研究主要集中在发现免疫系统本身的衰老及其机制。免疫衰老对一些与年龄相关的疾病(尤其是癌症)治疗效果的影响被完全忽略了。在临床前抗肿瘤治疗研究中,4-8周大的小鼠(相当于人类1-16岁)被用作试验动物;这个年龄与临床患者的年龄不符。临床资料表明,50-70岁是癌症发生发展的高峰期。免疫衰老将严重影响与免疫系统密切相关的纳米药物的分布;因此,免疫衰老的疏忽严重影响了纳米药物的递送系统和癌症治疗效果。
技术实现要素:
3.为了解决上述问题,本发明提供了一种唾液酸协助递送的药物组合物,充分考虑了免疫衰老因素对治疗效果的影响,使其对不同年龄段的患者均具有良好的治疗效果。
4.为了实现上述目的,本发明提供如下技术方案:
5.本发明提供了一种唾液酸协助递送的药物组合物,包括唾液酸衍生物、花青染料和弱碱性化疗药物;所述唾液酸衍生物、花青染料和弱碱性化疗药物的质量比为1:(1~50):(1~50)。
6.优选的,还包括磷脂和胆固醇;所述唾液酸衍生物、磷脂和胆固醇的质量比为1:(1~500):(1~150)。
7.优选的,所述唾液酸衍生物包括sa-oda、sa-ch、mt-18、mt-16,et-18、et-16和sa-18中的一种或多种;所述花青染料包括磺化花青染料和/或非磺化花青染料;所述弱碱性化疗药物包括多柔比星、表柔比星、伊立替康和拓扑替康中的一种或多种。
8.优选的,所述磷脂包括hspc、dppc、dope和dopc中的一种或多种。
9.优选的,所述药物组合物的剂型包括液体剂型、固体剂型或半固体剂型。
10.本发明提供了上述技术方案中所述的药物组合物的制备方法,以被动载药法装载花青染料,主动载药法装载弱碱性药物。
11.优选的,将唾液酸衍生物、花青染料、胆固醇和磷脂溶于有机溶剂中,旋转蒸发去除有机溶剂;加入含有体积百分数0~10%甲醇的100~400mm硫酸铵溶液,超声处理后得到
脂质体粗品;将脂质体粗品过阴阳离子混合纤维柱,得到纯化的脂质体;将纯化的脂质体与弱碱性化疗药物混合、孵育,得到所述药物组合物。
12.优选的,所述有机溶剂包括乙醇、甲醇和氯仿中的一种或多种。
13.本发明提供了上述技术方案中所述的药物组合物在制备抗癌症药物中的应用,所述癌症的种类包括乳腺癌、肺癌、卡波西肉瘤和黑色素瘤。
14.优选的,所述花青染料的鼠用给药剂量为1~50mg/kg,人用给药剂量为0.1~5.5g/kg,所述弱碱性化疗药物的鼠用给药剂量为1~50mg/kg,人用给药剂量为0.1~5.5g/kg。
15.有益效果:
16.本发明提供了一种唾液酸协助递送的药物组合物,包括唾液酸衍生物、花青染料和弱碱性化疗药物;所述唾液酸衍生物、花青染料和弱碱性化疗药物的质量比为1:(1~50):(1~50)。本发明唾液酸衍生物可以与中性粒细胞的l-selectin受体结合,通过中性粒细胞的肿瘤趋向性,将唾液酸修饰制剂递送到肿瘤部位;本发明通过光热和光动力学疗法使肿瘤部位局部升温,增加中性粒细胞对肿瘤的浸润和加速弱碱性化疗药在肿瘤部位的释放;提高了弱碱性化疗药杀伤肿瘤相关巨噬细胞和降低肿瘤细胞的活性,打破肿瘤免疫抑制的壁垒,使“冷”肿瘤“热”起来,可以有效地提高免疫衰老患者的治疗效果,使其对不同年龄段的患者均具有良好的治疗效果。本发明提供的药物组合物针对由衰老导致的抗肿瘤治疗效果下降,尤其是免疫低下的高龄肿瘤患者具有显著的治疗效果,在16月龄s180荷瘤昆明小鼠、12月龄mcf-7荷瘤babl/c裸鼠、12月龄a549荷瘤babl/c裸鼠和16月龄的b16/f10荷瘤c57/6j小鼠的抗肿瘤治疗中均取得较好的治疗效果。
附图说明
17.图1为sa-oda、sa-ch、mt-18、mt-16、et-18、et-16和sa-18的化学结构式;
18.图2为本发明的药物组合物的制备流程图;
19.图3为不同处理的脂质体的透射电镜图;
20.图4为实施例3中2h后,b16/f10细胞的共聚焦荧光图像;
21.图5为实施例3中倒置显微镜在0、6、12和24h拍摄的细胞之间划痕的宽度;
22.图6为实施例3中12h后,b16/f10细胞的共聚焦荧光图像,以及crt
+
/pi-在b16/f10细胞内的比例;
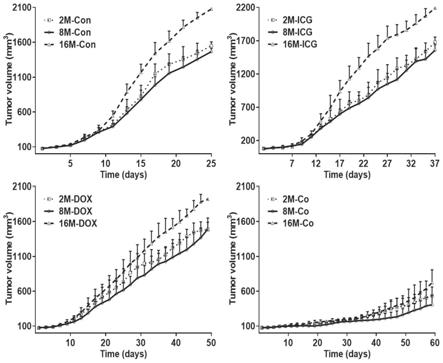
23.图7为实施例4中不同处理组肿瘤的体积;其中a为2月龄,8月龄和16月龄小鼠注射5%葡萄糖组;b为2月龄,8月龄和16月龄小鼠注射sl-icg组;c为2月龄,8月龄和16月龄小鼠注射sl-dox组;d为2月龄,8月龄和16月龄小鼠注射sl-co组;
24.图8为实施例4中不同处理组的生存分析结果;
25.图9为8月龄小鼠接受唾液酸修饰脂质体治疗后发生肿瘤脱落和复发情况;
26.图10为各治疗组内小鼠的tdlns、心、肝、肺、肾、胸腺和皮肤的病理切片;
27.图11为各治疗组内小鼠的tdlns的免疫荧光切片;其中,a为tdlns的免疫荧光切片;b为tdlns的免疫荧光切片中荧光的定量检测;
28.图12为各治疗组内小鼠的肿瘤的免疫荧光切片;其中,a为肿瘤的免疫荧光切片;b为肿瘤的免疫荧光切片中荧光的定量检测。
具体实施方式
29.本发明提供了一种唾液酸协助递送的药物组合物,包括唾液酸衍生物、花青染料和弱碱性化疗药物;所述唾液酸衍生物、花青染料和弱碱性化疗药物的质量比为1:(1~50):(1~50)。
30.在本发明中,所述唾液酸衍生物优选包括sa-oda、sa-ch、mt-18、mt-16、et-18、et-16和sa-18中的一种或多种。在本发明中,所述sa-oda、sa-ch、mt-18、mt-16、et-18、et-16和sa-18的化学结构式如图1所示。在本发明中,所述唾液酸衍生物进一步优选包括sa-oda、sa-ch、mt-18和et-18中的一种或多种。本发明所述唾液酸衍生物进一步优选含有18碳链或胆固醇的唾液酸衍生物,包括sa-oda、sa-ch和mt-18中的一种或多种;更进一步优选包括sa-oda和/或sa-ch;更进一步优选包括sa-oda。本发明所述唾液酸衍生物可以将花青素和弱碱性化疗药物共载结合并递送到肿瘤部位,使花青素和弱碱性化疗药物相互协同,进一步提高抗肿瘤效果,尤其是提高免疫衰老患者的治疗效果。
31.本发明所述花青染料优选包括磺化花青染料和/或非磺化花青染料。在本发明中,所述花青染料进一步优选包括吲哚菁绿及同分异构体中的一种或多种;更进一步优选为吲哚菁绿。本发明对花青染料的来源没有特殊要求,所述花青染料达到药用注射级别即可。
32.本发明所述弱碱性化疗药物优选包括多柔比星、表柔比星、伊立替康和拓扑替康中的一种或多种;更进一步优选为多柔比星。本发明对弱碱性化疗药物的来源没有特殊要求,采用市售商品即可。在本发明中,所述弱碱性化疗药物的纯度优选≥99.0%。
33.本发明通过将花青染料与弱碱性化疗药物通过唾液酸衍生物共载结合,实现了光热和光动力学疗法的结合,可以使肿瘤部位局部升温,增加中性粒细胞对肿瘤的浸润,并加速了弱碱性化疗药在肿瘤部位的释放;提高了弱碱性化疗药杀伤肿瘤相关巨噬细胞和降低肿瘤细胞的活性,打破肿瘤免疫抑制的壁垒,使“冷”肿瘤“热”起来,可以有效地提高免疫衰老患者的治疗效果,使其对不同年龄段的患者均具有良好的治疗效果。
34.本发明所述唾液酸衍生物、花青染料和弱碱性化疗药物的质量比为1:(1~50):(1~50);进一步优选为1:(1~20):(1~20);更进一步优选为1:(1~10):(1~10);更进一步优选为1:2:5。在本发明中,所述药物组合物还优选包括磷脂和胆固醇。在本发明中,所述唾液酸衍生物、磷脂和胆固醇的质量比优选为1:(1~500):(1~150);进一步优选为1:(10~200):(5~100);更进一步优选为1:(10~60):(10~40);更进一步优选为1:25:25。
35.本发明所述药物组合物的剂型优选包括液体剂型、固体剂型或半固体剂型。在本发明中,所述液体剂型包括但不限于溶液剂、混悬剂或注射剂;注射剂进一步包括但不限于水针剂、粉针剂或输液。在本发明中,固体剂型包括但不限于片剂、胶囊剂、颗粒剂、散剂、微丸或滴丸;所述片剂进一步包括但不限于普通片、肠溶片、含片、分散片、咀嚼片、泡腾片或口腔崩解片;所述胶囊剂包括但不限于硬胶囊、软胶囊或肠溶胶囊。在本发明中,所述半固体剂型包括但不限于软膏剂、凝胶剂或糊剂。
36.本发明提供的一种唾液酸协助递送的药物组合物针对由衰老导致的抗肿瘤治疗效果下降,尤其是免疫低下的高龄肿瘤患者具有显著的治疗效果,在16月龄s180荷瘤昆明小鼠、12月龄mcf-7荷瘤babl/c裸鼠、12月龄a549荷瘤babl/c裸鼠和16月龄的b16/f10荷瘤c57/6j小鼠的抗肿瘤治疗中均取得较好的治疗效果。
37.本发明提供了上述技术方案中所述的药物组合物的制备方法,以被动载药法装载
花青染料,主动载药法装载弱碱性药物。本发明的制备方法优选包括如下步骤:将唾液酸衍生物、花青染料、胆固醇和磷脂溶于有机溶剂中,旋转蒸发去除有机溶剂;加入含有体积百分数0~10%甲醇的100~400mm硫酸铵溶液,超声处理后得到脂质体粗品;将脂质体粗品过阴阳离子混合纤维柱,得到纯化的脂质体;将纯化的脂质体与弱碱性化疗药物混合、孵育,得到所述药物组合物。
38.本发明将唾液酸衍生物、花青染料、胆固醇和磷脂溶于有机溶剂中,旋转蒸发去除有机溶剂。在本发明中,所述磷脂膜材的总质量与与有机溶剂的体积比优选为(100~500)mg:(1~10)ml;进一步优选为(400~500)mg:(1~5)ml;更进一步优选为500mg:1ml。在发明中,所述有机溶剂的种类优选包括乙醇、甲醇和氯仿中的一种或多种;进一步优选为甲醇。本发明优选将溶于有机溶剂的唾液酸衍生物和花青染料在水浴中利用旋转蒸发仪去除有机溶剂。在本发明中,所述水浴的温度优选为40~70℃;进一步优选为40~65℃;更进一步优选为60℃。去除有机溶剂后,本发明进一步优选真空干燥去除残留甲醇。
39.去除有机溶剂后,本发明加入含有体积百分数0~10%甲醇的100~400mm硫酸铵溶液,超声处理后得到脂质体粗品。在本发明中,所述甲醇的体积百分数进一步优选为5%;所述硫酸铵溶液的浓度进一步优选为200mm。在本发明中,所述超声处理优选采用超声波细胞粉碎机进行处理,所述超声处理的条件优选为100~200w条件下2~6min,然后300~500w条件下4~10min;进一步优选为200w条件下2min,然后400w条件下8min。在本发明中,所述超声处理前,还包括搅拌步骤。本发明所述搅拌的转速优选为10~2000rpm;进一步优选为1000rpm。本发明所述搅拌的温度优选为40~70℃;进一步优选为60℃。本发明所述搅拌的时间优选为10~60min;更进一步优选为20min。
40.得到脂质体粗品后,本发明将脂质体粗品过阴阳离子混合纤维柱,得到纯化的脂质体。在本发明实施例中,所述阴阳离子混合纤维柱购自桂林正汉科技发展有限公司,型号为弱酸弱碱型。本发明阴阳离子混合纤维柱可以去除游离药物,纯化脂质体。在本发明中,所述过柱的条件优选为:静置时间1~6min,离心力100~2000g,离心时间1~10min;进一步优选为静置时间2min,离心力500g,离心时间4min。离心后,本发明优选用水进行洗脱,所述洗脱的次数优选为2次。洗脱后,本发明优选用微孔滤膜过滤;所述微孔滤膜的直径依次优选为0.80μm、0.45μm、0.22μm。过微孔滤膜后,得到纯化的脂质体。
41.得到纯化的脂质体后,本发明将纯化的脂质体与弱碱性化疗药物混合、孵育,得到所述药物组合物。在本发明中,所述弱碱性化疗药物的浓度优选为10~100mg/ml;进一步优选为20mg/ml。在本发明中,所述溶解弱碱性化疗药物的溶剂优选为蒸馏水、生理盐水或5%的葡萄糖;进一步优选为蒸馏水。在本发明中,所述孵育的温度优选为40~70℃;进一步优选为60℃。在本发明中,所述孵育的时间优选为10~60min;进一步优选为20min。水浴后,本发明优选将水浴后的产物过阴阳离子混合纤维柱,去除游离药物。过柱后,即得到唾液酸衍生物(san)修饰的花青染料、弱碱性化疗药物共载脂质体,制备步骤见图2。
42.本发明的制备方法采用改良薄膜蒸发法制备了唾液酸衍生物(san)修饰的花青染料、弱碱性化疗药物共载脂质体,本发明的共载脂质体方式进一步提高了抗肿瘤的效果。
43.本发明提供了上述技术方案中所述的药物组合物在在制备抗癌症药物中的应用,所述癌症的种类包括乳腺癌、肺癌、卡波西肉瘤和黑色素瘤。在本发明中,所述花青染料的鼠用给药剂量优选为1~50mg/kg,人用给药剂量优选为0.1~5.5g/kg;进一步优选为鼠用
给药剂量为1~20mg/kg,人用给药剂量优选为0.1~2.2g/kg;更进一步优选为为鼠用给药剂量为1~10mg/kg,人用给药剂量优选为0.1~1.1g/kg。在本发明中,所述弱碱性化疗药物的鼠用给药剂量优选为1~50mg/kg,人用给药剂量优选为0.1~5.5g/kg;进一步优选为鼠用给药剂量为1~20mg/kg,人用给药剂量优选为0.1~2.2g/kg;更进一步优选为为鼠用给药剂量为1~10mg/kg,人用给药剂量优选为0.1~1.1g/kg。本发明实施例的结果表明,在16月龄s180荷瘤昆明小鼠,12月龄mcf-7荷瘤babl/c裸鼠,12月龄a549荷瘤babl/c裸鼠和16月龄的b16/f10荷瘤c57/6j小鼠的抗肿瘤治疗中均取得较好的治疗效果。
44.为了进一步说明本发明,下面结合实施例对本发明提供的一种药物组合物及其制备方法和应用进行详细地描述,但不能将它们理解为对本发明保护范围的先定。
45.实施例1唾液酸修饰的吲哚菁绿和多柔比星的共载脂质体
46.一种唾液酸协助递送的药物组合物,由唾液酸衍生物sa-oda、hspc(氢化大豆磷脂)、dppc(二棕榈酰磷脂酰胆碱)、ch(胆固醇)、吲哚菁绿(icg)和表柔比星(dox)组成;其中sa-oda、hspc、dppc、ch、icg和dox的质量比为1:25:25:15:2:5。其中,sa-oda(自主合成,cn 104031097 b专利内的化合物);hspc、dppc和胆固醇(ch)购自艾伟拓(上海)医药科技有限公司;吲哚菁绿(icg)购自大连美仑生物有限公司;多柔比星(dox,hplc测定纯度为99.0%)购自奥林匹克之星制药有限公司。
47.制备方法:
48.采用改良薄膜蒸发法制备了sa-oda修饰的dox和icg共载脂质体。将sa-oda、hspc、dppc、ch和icg溶于500μl无水甲醇中。在60℃水浴中,利用re-501旋转蒸发仪(郑州科达机械仪表设备有限公司,中国)去除有机溶剂。使用dzf-6020台式真空干燥箱(上海捷成试验仪器有限公司,中国)去除残留甲醇。加入含有5%甲醇的200mm硫酸铵溶液并在60℃下搅拌20min。使用scientz-950e超声波细胞粉碎机(宁波新智生物科技有限公司,中国)处理,处理条件为200w 2min,400w 8min,获得脂质体粗品。将100μl脂质体粗品加入阴阳离子混合纤维柱(1:1,v/v,桂林正汉科技发展有限公司,中国)顶部去除游离药物,静置2min,l 530离心机(中国湘仪离心仪器有限公司)500g离心4min,加入50μl灭菌注射用水,用水重复洗脱两次。产物通过0.80μm、0.45μm、0.22μm微孔滤膜后,与1ml的dox溶液混合,其中dox溶液的浓度为10mg/ml,60℃水浴载药20min,重复上述过阴阳离子混合纤维柱的过程用于去除游离药物,即获得了sa-oda修饰的dox和icg共载脂质体(sl-co)。使用前,将制备好的共载脂质体1ml加入10kda透析袋(上海元业生物科技有限公司,中国)中,在500ml5%蔗糖溶液中透析4h,每2h更换一次透析液。
49.对比例1唾液酸修饰的多柔比星脂质体
50.一种唾液酸协助递送的药物组合物,由唾液酸衍生物sa-oda、hspc、dppc、ch和dox组成;其中sa-oda、hspc、dppc、ch和dox的质量比为1:25:25:15:5。其中,上述组分的来源同实施例1。
51.制备方法同实施例1,不同之处在于,不加入icg,制备得到sa-oda修饰的dox脂质体(sl-dox)。
52.对比例2唾液酸修饰的吲哚菁绿脂质体
53.一种唾液酸协助递送的药物组合物,由唾液酸衍生物sa-oda、hspc、dppc、ch和吲哚菁绿(icg)组成;所述sa-oda、hspc、dppc、ch和icg的质量比为1:25:25:15:2。其中,上述
dox,sl-icg和sl-co滴于200目铜网上,静置5min,加入2%磷钨酸溶液,染色3min,结果见图3。由图3的结果可知,各脂质体的粒径分布与粒度测定仪所测数据相同,并可以清晰的观察到脂质体的形态,确定脂质体制备成功。
64.实施例3体外细胞试验
65.b16/f10和s180细胞的cck8试验
66.采用rpmi 1640培养基稀释b16/f10和s180细胞,调整悬液中细胞浓度至1
×
105cells/ml。然后移取悬液至培养板中(100μl/well),并用100μl无菌pbs填充边缘孔。将接种好的细胞培养板在培养箱中静置4h,将sl-dox、sl-icg、sl-co和sl-dox与sl-icg的混合物(sl-mix)加入不同浓度梯度的药物10μl,dox终浓度分别为0μg/ml、1μg/ml、10μg/ml、20μg/ml、50μg/ml和100μg/ml,icg终浓度分别为0μg/ml、0.4μg/ml、4μg/ml、8μg/ml、20μg/ml和40μg/ml,另设对照孔(有细胞无试剂),相应调零孔(有试剂无细胞)。置于培养箱中培养30min。加cck-8溶液,测定加入cck-8溶液10μl/well,继续置于培养箱中培养3h。采用酶标仪(波长450nm)测得各样品od值。细胞存活率的计算公式为:细胞存活率=(试验孔od值-相应调零孔od值)/(对照孔od值-相应调零孔od值)
×
100%,由od值计算药物组合物对b16/f10和s180细胞的体外抑制能力,结果见表2。
67.表2不同脂质体的ic
50
和复合指数ci
[0068][0069]
由表2的结果可知,sl-mix和sl-co的ic
50
值小于sl-icg和sl-dox,并且它们的ci值小于1,说明该组合方式在抗肿瘤细胞方面具有协同作用。sl-co的细胞毒性强于sl-mix,说明此组合物的共载给药的细胞毒性强于混合给药。
[0070]
b16/f10和s180细胞的摄取和icd试验
[0071]
b16/f10细胞的icd和摄取通过clsm(zeiss lsm 800,zeiss,德国)和流式细胞术测试。将1ml细胞悬液(1
×
106个细胞/ml)加入含有细胞载玻片的6孔板中,在37℃、5%co2的细胞培养箱中培养4h。加入1ml含脂质体的无血清培养基(dox终浓度:50μg/ml,icg终浓度:20μg/ml),808nm激光(2w/cm2)照射3min,置于培养箱中。2h后在用于摄取试验的6孔板中吸取培养基。12h后,将含有1μlfitc偶联抗小鼠crt抗体的200μlpbs加入用于icd试验的6孔板中,孵育30min。用于摄取和icd试验的6孔板中加入500μl4%多聚甲醛,dapi染色10min(50μ
g/ml),取出细胞载玻片,倒置置于10μl抗荧光淬灭玻片上溶液,并通过clsm观察。重复加入细胞和制剂的过程,12h后加入含有1μlfitc偶联抗小鼠crt抗体和1μlpi的200μlpbs,孵育30min。用200μlpbs重悬细胞,并通过流式细胞术测定crt
+
/pi-细胞的比例。取细胞培养基上清液1ml,1000g离心20min,atp检测试剂盒,hmgb-1elisa试剂盒测定相关因子。b16/f10细胞的摄取、迁移能力和icd结果见图4~图6。图4为2h后,b16/f10细胞的共聚焦荧光图像(红色:dox,绿色:icg,蓝色:dapi),标尺=30μm。图5为倒置显微镜在0、6、12和24h拍摄的细胞之间划痕的宽度。图6为12h后,b16/f10细胞的共聚焦荧光图像(红色:crt,蓝色:dapi)以及crt
+
/pi-在b16/f10细胞内的比例,标尺=30μm。
[0072]
由图3~5的结果可知,唾液酸修饰吲哚菁绿和多柔比星共载脂质体可以加速诱导肿瘤免疫原性死亡,降低肿瘤细胞的迁移能力。
[0073]
实施例4
[0074]
不同月龄荷f10/b16的c57bl/6jnifdc小鼠的药效试验
[0075]
2月龄,8月龄和16月龄的雌性c57bl/6jnifdc小鼠从北京维通利华试验动物技术有限公司(中国,北京)购买。
[0076]
试验步骤
[0077]
取出液氮中保种的f10/b16细胞(中国科学院上海细胞库)冻存管,迅速置于37℃水浴中复苏。将复苏的f10/b16细胞培养和传代。当肿瘤细胞数量达到需求(活度大于95%),将细胞消化下来,并且用生理盐水重悬细胞配成细胞混悬液,使混悬液的细胞数为1.8
×
107cells
·
ml-1
。用碘伏对c57bl/6jnifdc小鼠的右后腿部上方的皮肤进行消毒,将f10/b16细胞混悬液接种于消毒部位的皮下组织,接种剂量为0.2ml/只。
[0078]
对2月龄、8月龄和16月龄小鼠(n=24)的腿背部皮肤进行脱毛、消毒,并注射200μlb16/f10细胞悬液(107cells/ml)。当肿瘤体积增大到100cm3时,将荷瘤小鼠随机分为12组(n=6),即2月龄小鼠注射5%葡萄糖组(2m-con),2月龄小鼠注射sl-icg组(2m-icg),2月龄小鼠注射sl-dox组(2m-dox),2月龄小鼠注射sl-co组(2m-co),8月龄小鼠注射5%葡萄糖组(8m-con),8月龄小鼠注射sl-icg组(8m-icg),8月龄小鼠注射sl-dox组(8m-dox),8月龄小鼠注射sl-co组(8m-co),16月龄小鼠注射5%葡萄糖组(16m-con),16月龄小鼠注射sl-icg组(16m-icg),16月龄小鼠注射sl-dox组(16m-dox),16月龄小鼠注射sl-co组(16m-co)。在分组后第1d、4d和7d将脂质体注入尾静脉(dox:5mg/kg,icg:2mg/kg)。给药后6h麻醉,808nm激光照射每只小鼠肿瘤部位3min。每天观察生存状态,测量体重,测量肿瘤长短径,计算肿瘤体积和抑制肿瘤衰老率,其试验结果见图7~图9。
[0079]
图7为不同处理组肿瘤的体积,其中a为2月龄,8月龄和16月龄小鼠注射5%葡萄糖组,b为2月龄,8月龄和16月龄小鼠注射sl-icg组,c为2月龄,8月龄和16月龄小鼠注射sl-dox组,d为2月龄,8月龄和16月龄小鼠注射sl-co组。
[0080]
图8为不同处理组的生存分析结果。
[0081]
图9为8月龄小鼠接受唾液酸修饰脂质体治疗后发生肿瘤脱落和复发情况。2月龄小鼠,8月龄小鼠和16月龄小鼠在接受唾液酸修饰icg脂质体治疗后出现不同程度的肿瘤复发。
[0082]
由图7~图9的结果可知,在60d的治疗过程中,相同年龄小鼠的各制剂的疗效:sa-oda修饰的dox和icg共载脂质体>sa-oda修饰的dox脂质体>sa-oda修饰的icg脂质体。对
于注射sa-oda修饰的dox脂质体或sa-oda修饰的icg脂质体的不同年龄小鼠的治疗效果随年龄变化而变化,其治疗效果严重地受到年龄的影响。而注射sa-oda修饰的dox和icg共载脂质体的治疗效果却不受年龄的影响。sa-oda修饰的dox和icg共载脂质体治疗组小鼠的肿瘤在第9d结痂,第13d脱落,第25d毛发开始正常生长。而sa-oda修饰的icg脂质体治疗组小鼠的肿瘤在结痂后复发。所以sa-oda,dox和icg的组合使用可以有效提高16月龄小鼠的抗肿瘤治疗效果,消除年龄对于肿瘤治疗的影响。
[0083]
实施例5
[0084]
免疫衰老小鼠的肿瘤内淋巴细胞浸润量的改变
[0085]
根据药效试验的分组方法和给药方法,在第15天将0.2ml水合氯醛溶液(350mg/ml)注射到小鼠(n=3)腹腔中。tdlns、心、肝、脾、肺、肾、胸腺、脊髓、脑、皮肤和肿瘤(n=3)置于4%聚亚甲基固定和蜡块包埋;使用超薄切片制备5μm标本并进行h&e染色。在倒置显微镜下观察切片。此外,对包埋肿瘤的蜡块切片进行tunel和免疫荧光染色(cd4
+
t细胞、cd8
+
t细胞和中性粒细胞)。嵌入肿瘤引流淋巴结的蜡块切片用免疫荧光染色(cd4
+
t细胞、cd8
+
t细胞)染色。在荧光显微镜(nikon eclipse ti-sr,tokyo,japan)下观察所有荧光切片。按照过筛寄出的方法分离不同年龄小鼠tdlns中的t细胞,并通过流式细胞术(cd3
+
t细胞、cd8
+
t细胞)测定tdlns中cd8
+
t细胞的变化。检测结果见图10~图12。
[0086]
图10为各治疗组内小鼠的tdlns、心、肝、肺、肾、胸腺和皮肤的病理切片;其中,肿瘤转移(黑色箭头),炎症细胞浸润(红色箭头)。
[0087]
图11为各治疗组内小鼠的tdlns的免疫荧光切片;其中,a为tdlns的免疫荧光切片;b为tdlns的免疫荧光切片中荧光的定量检测;
[0088]
图12为各治疗组内小鼠的肿瘤的免疫荧光切片;其中,a为肿瘤的免疫荧光切片;b为肿瘤的免疫荧光切片中荧光的定量检测。
[0089]
由图10~图12的结果可知,唾液酸修饰共载脂质体可以提高免疫衰老小鼠肿瘤内淋巴细胞和中性粒细胞的浸润,提高免疫衰老小鼠的抗肿瘤治疗效果。
[0090]
实施例6
[0091]
唾液酸协助递送药物组合物的混合与共载给药的抗肿瘤疗效差异
[0092]
取出液氮中保种的f10/b16细胞(中国科学院上海细胞库)冻存管,迅速置于37℃水浴中复苏。将复苏的f10/b16细胞培养和传代。当肿瘤细胞数量达到需求(活度大于95%),将细胞消化下来,并且用生理盐水重悬细胞配成细胞混悬液,使混悬液的细胞数为1.8
×
107cells
·
ml-1
。用碘伏对c57bl/6jnifdc小鼠的右后腿部上方的皮肤进行消毒,将f10/b16混悬液接种于消毒部位的皮下组织,接种剂量为0.2ml/只。
[0093]
对16月龄小鼠(n=30)的腿背部皮肤进行脱毛、消毒,并注射200μlb16/f10细胞悬液(107cells/ml)。当肿瘤体积增大到100cm3时,将荷瘤小鼠随机分为5组(n=6),即16月龄小鼠注射5%葡萄糖组(16m-con),16月龄小鼠注射sl-icg组(16m-icg),16月龄小鼠注射sl-dox组(16m-dox),16月龄小鼠注射sl-icg与sl-dox混合给药组(16m-mix),16月龄小鼠注射sl-co组(16m-co)。在分组后第1d、4d和7d将脂质体注入尾静脉(dox:5mg/kg,icg:2mg/kg)。给药后6h,808nm激光照射每只小鼠肿瘤部位3min(35mg/ml水合氯醛溶液麻醉0.2ml,2w/cm2),每天测量体重和瘤体积,计算抑瘤率和抑瘤指数,其试验结果见表3。
[0094]
表3不同处理组16月龄小鼠肿瘤抑制指数和肿瘤抑制率
[0095][0096][0097]
由表3的结果可知,唾液酸协助递送的药物组合物可以提高16月龄小鼠的抗肿瘤治疗效果,其中唾液酸修饰的吲哚菁绿和多柔比星共载脂质体注射给药的治疗效果优于唾液酸修饰的吲哚菁绿脂质体和唾液酸修饰的多柔比星脂质体的混合注射的治疗效果。
[0098]
实施例7
[0099]
唾液酸与peg协助递送药物组合物的抗肿瘤治疗差异
[0100]
取出液氮中保种的s180细胞(中国科学院上海细胞库)冻存管,迅速置于37℃水浴中复苏。将复苏的s180细胞悬液接种于昆明小鼠腹腔内(0.5ml/只)。一周后在无菌条件下抽取乳白色粘稠腹水,在倒置显微镜下计数,当肿瘤细胞活度大于95%时加生理盐水稀释成细胞混悬液,调整稀释倍数,使混悬液的瘤细胞数为1.8
×
107cells
·
ml-1
。用碘伏对昆明小鼠的右前腋下皮肤进行消毒,将s180细胞混悬液接种于消毒部位的皮下组织,接种剂量为0.2ml/只。
[0101]
18只昆明小鼠(16月龄)的左腋下接种1
×
107个悬浮s180细胞。分为3组,每组由6只小鼠组成:对照组(16m-con)、唾液酸修饰共载脂质体注射组(16m-sl)和peg修饰共载脂质体注射组(16m-pl)。每三天注射一次,总共注射五次(dox,5mg/kg,icg:2mg/kg)。在治疗期间,每隔1d测量肿瘤的长径(a)和短径(b)、体重、存活率和肿瘤体积(v
t
=0.5
×a×
b2)。检测结果见表4。
[0102]
表4不同处理组荷有s180细胞的16月龄昆明小鼠抑制指数和肿瘤抑制率
[0103][0104][0105]
由表4的结果可知,16m-sl组小鼠的抑瘤指数和抑瘤率高于16m-pl组的小鼠,说明
唾液酸协助递送的药物组合物的治疗效果优于peg协助递送的药物组合物的治疗效果。
[0106]
实施例8
[0107]
唾液酸修饰的吲哚菁绿和伊立替康共载脂质体
[0108]
一种唾液酸协助递送的药物组合物共载脂质体的制备,由唾液酸衍生物sa-ch、hspc、dppc、ch、icg和伊立替康(cpt-11)组成;所述sa-ch、hspc、dppc、ch、icg和cpt-11的质量比为1:25:25:15:2:5。
[0109]
制备方法:
[0110]
采用改良薄膜蒸发注入法制备了sa-ch修饰的icg和cpt-11共载脂质体。将sa-ch、hspc、dppc、ch和icg溶于500μl无水乙醇中。在60℃水浴中,利用re-501旋转蒸发仪(郑州科达机械仪表设备有限公司,中国)去除有机溶剂。使用dzf-6020台式真空干燥箱(上海捷成试验仪器有限公司,中国)去除残留甲醇。加入含有5%甲醇的200mm硫酸铵溶液并在60℃下搅拌20min。使用scientz-950e超声波细胞粉碎机(宁波新智生物科技有限公司,中国)处理,处理条件为200w 2min,400w 8min,获得脂质体粗品。将100μl脂质体粗品加入阴阳离子混合纤维柱(1:1,v/v,桂林正汉科技发展有限公司,中国)顶部去除游离药物,静置2min,l 530离心机(中国湘仪离心仪器有限公司)500g离心4min,加入50μl灭菌注射用水,用水重复洗脱两次。产物通过0.80μm、0.45μm、0.22μm微孔滤膜后,与1ml的cpt-11溶液混合,其中cpt-11溶液的浓度为10mg/ml,60℃水浴载药20min,重复上述过阴阳离子混合纤维柱的过程用于去除游离药物,即获得了sa-ch修饰的cpt-11和icg共载脂质体(sl-ci)。使用前,将制备好的共载脂质体1ml加入10kda透析袋(上海元业生物科技有限公司,中国)中,在500ml 5%蔗糖溶液中透析4h,每2h更换一次透析液。
[0111]
对比例5唾液酸修饰的吲哚菁绿的脂质体
[0112]
一种唾液酸协助递送的药物组合物共载脂质体的制备,由sa-ch、hspc、dppc、ch和icg组成;所述sa-ch、hspc、dppc、ch和icg的质量比为1:25:25:15:2。
[0113]
制备方法同实施例8,不同之处在于,不加入cpt-11,制备得到sa修饰的icg脂质体(sl-icg-2)。
[0114]
对比例6唾液酸修饰的伊立替康的脂质体
[0115]
一种唾液酸协助递送的药物组合物共载脂质体的制备,由sa-ch、hspc、dppc、ch和伊立替康(cpt-11)组成;所述sa-ch、hspc、dppc、ch和cpt-11的质量比为1:25:25:15:5。
[0116]
制备方法同实施例8,不同之处在于,不加入icg,制备得到sa修饰的cpt-11脂质体(sl-cpt)。
[0117]
sl-ci的粒径:100nm,电位:-15.4mv,伊立替康包封率:91%,吲哚菁绿包封率:21%。
[0118]
sl-cpt的粒径:102nm,电位:-18.3mv,伊立替康包封率:95%。
[0119]
sl-icg-2的粒径:101nm,电位:-16.4mv,吲哚菁绿包封率:25%。
[0120]
实施例9
[0121]
12月龄荷a549的balb/c裸鼠的药效试验
[0122]
取出液氮中保种的a549细胞冻存管,迅速置于37℃水浴中复苏。将复苏的a549细胞培养和传代。当肿瘤细胞数量达到需求(活度大于95%),将细胞消化下来,并且用生理盐水重悬细胞配成细胞混悬液,使混悬液的细胞数为1.8
×
107cells
·
ml-1
。用碘伏对12月龄
2min,400w 8min,获得脂质体粗品。将100μl脂质体粗品加入阴阳离子混合纤维柱顶部去除游离药物,静置2min,l 530离心机500g离心4min,加入50μl灭菌注射用水,用水重复洗脱两次。产物通过0.80μm、0.45μm、0.22μm微孔滤膜后,与1ml cpt-11溶液混合,其中cpt-11溶液的浓度为10mg/ml,60℃水浴载药20min,重复上述过阴阳离子混合纤维柱的过程用于去除游离药物,即获得mt-18修饰的cpt-11和icg共载脂质体(sl-ci-2)。使用前,将制备的共载脂质体1ml加入10kda透析袋中,在500ml 5%蔗糖溶液中透析4h,每2h更换一次透析液。
[0132]
对比例7唾液酸修饰的吲哚菁绿脂质体
[0133]
一种唾液酸协助递送的药物组合物共载脂质体的制备,由mt-18、hspc、dppc、ch和icg组成;所述mt-18、hspc、dppc、ch和icg的质量比为1:25:25:15:2。
[0134]
制备方法同实施例10,不同之处在于,不加入cpt-11,制备得到sa修饰的icg脂质体(sl-icg-3)。
[0135]
对比例8唾液酸修饰的伊立替康脂质体
[0136]
一种唾液酸协助递送的药物组合物共载脂质体的制备,由mt-18、hspc、dppc、ch和伊立替康(cpt-11)组成;所述mt-18、hspc、dppc、ch和cpt-11的质量比为1:25:25:15:5。
[0137]
制备方法同实施例10,不同之处在于,不加入icg,制备得到sa修饰的cpt-11脂质体(sl-cpt-2)。
[0138]
sl-ci-2的粒径:105nm,电位:-14.5mv,伊立替康包封率:92.3%,吲哚菁绿包封率:22.3%。
[0139]
sl-cpt-2的粒径:104nm,电位:-16.3mv,伊立替康包封率:94.5%。
[0140]
sl-icg-3的粒径:102nm,电位:-14.8mv,吲哚菁绿包封率:24.8%。
[0141]
实施例11
[0142]
12月龄荷mcf-7的balb/c裸鼠的药效试验
[0143]
取出液氮中保种的mcf-7细胞(中国科学院上海细胞库)冻存管,迅速置于37℃水浴中复苏。将复苏的mcf-7细胞培养和传代。当肿瘤细胞数量达到需求(活度大于95%),将细胞消化下来,并且用生理盐水重悬细胞配成细胞混悬液,使混悬液的细胞数为1.8
×
107cells
·
ml-1
。用碘伏对12月龄balb/c裸鼠的右后腿部上方的皮肤进行消毒,将mcf-7细胞混悬液接种于消毒部位的皮下组织,接种剂量为0.2ml/只。
[0144]
用碘伏对12月龄balb/c裸鼠的右后腿部上方的皮肤进行消毒,将mcf-7细胞混悬液接种于消毒部位的皮下组织,接种剂量为0.2ml/只。当肿瘤体积达到100cm3时,将荷瘤小鼠随机分为5组(n=6),即12月龄小鼠注射5%葡萄糖组(12m-con),12月龄小鼠注射sl-icg-3组(12m-icg),12月龄小鼠注射sl-cpt-2组(12m-cpt),12月龄小鼠注射sl-icg-3与sl-cpt-2混合给药组(12m-mix-3),12月龄小鼠注射sl-ci-2组(12m-ci)。在分组后第1、4和7天将脂质体注入尾静脉(dox:5mg/kg,icg:2mg/kg)。给药后6h,808nm激光照射每只小鼠肿瘤部位3min(35mg/ml水合氯醛溶液麻醉0.2ml,2w/cm2),每天测量体重和瘤体积,计算抑瘤率和抑瘤指数,其试验结果见表6。
[0145]
表6不同处理组荷有mcf-7细胞的12月龄balb/c裸鼠抑制指数和肿瘤抑制率。
[0146]
[0147][0148]
由表6的结果可知,唾液酸协助递送的药物组合物可以提高荷有mcf-7细胞的12月龄balb/c裸鼠的抗肿瘤治疗效果,其中唾液酸修饰的吲哚菁绿和多柔比星共载脂质体注射给药的治疗效果优于唾液酸修饰的吲哚菁绿脂质体和唾液酸修饰的多柔比星脂质体的混合注射的治疗效果。
[0149]
由上述实施例的结果可知,本发明的药物组合物针对由衰老导致的抗肿瘤治疗效果下降,尤其是免疫低下的高龄肿瘤患者具有显著的治疗效果。
[0150]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1