一种纳米粒及其制备方法和用途与流程
1.本发明涉及生物医药领域,具体涉及一种纳米粒及其制备方法和用途。
背景技术:
2.基因转染是一种将具有生物功能的核酸转移或运送到细胞内并使核酸在细胞内维持其生物功能的技术。基因载体是指将外源的治疗性基因导入生物细胞内的一种工具。目前国际上具有产业转化潜力的基因载体主要是病毒载体和非病毒载体。
3.病毒载体是利用病毒具有传送其基因组进入其他细胞进行感染的一种基因递送工具,目前应用前景较好的有慢病毒、腺病毒、逆转录病毒载体和腺相关病毒载体等。然而病毒载体由于其固有的理化性质和生物活性,具有较为严重的缺点,比如具有生产成本高、包载量有限、靶向性差、具有插入整合与致畸致癌致突变等,不利于开发普适性和通用型的疗法。
4.非病毒载体主要包括:脂质体纳米粒、复合物纳米粒、阳离子聚合物纳米粒、多肽纳米粒等。其中脂质体纳米粒是目前应用于rna药物开发的主要非病毒载体,目前已有首款rnai药物(patisiran)和首款mrna药物(bnt162b2,comirnaty)相继上市,充分验证了脂质体纳米粒(lnp)的临床应用价值。与病毒载体比较,脂质体纳米粒具有生产成本低、化学结构明确、便于质量控制、可通过靶向性修饰实现靶向给药、理论上包载量不受限制等优点,但大部分脂质体脂质材料不可降解,毒性较大,因此难以满足重复给药的临床需求,另外,还存在体内转染效果较差,核酸在血清内被代谢或清除,生物利用度差等问题。
5.因此,仍亟需一种毒性小,转染效果好,生物利用度好的纳米粒。
技术实现要素:
6.发明概述
7.本发明的目的是提供一种能够包载核酸,并且具有毒性小,包封率高,转染效果好,生物利用度好的纳米粒。为实现该目的,本发明提供了以下技术方案。
8.第一方面,本发明提供一种纳米粒。所述纳米粒包括如式i所示化合物和辅助材料。
9.第二方面,本发明提供一种纳米颗粒复合物,其包括核酸和第一方面所述纳米粒。
10.第三方面,本发明提供一种药物组合物,其包括第二方面所述纳米颗粒复合物和药学上可接受的辅料。
11.第四方面,本发明提供第一方面所述纳米粒的制备方法。
12.第五方面,本发明提供一种第一方面所述纳米粒或第二方面所述纳米颗粒复合物的用途。
13.发明详述
14.为解决上述问题,本发明提供以下技术方案。
15.第一方面,本发明提供一种纳米粒。
16.一种纳米粒,其包括:如式i所示化合物和辅助材料,
[0017][0018]
其中,n选自5-20的整数。
[0019]
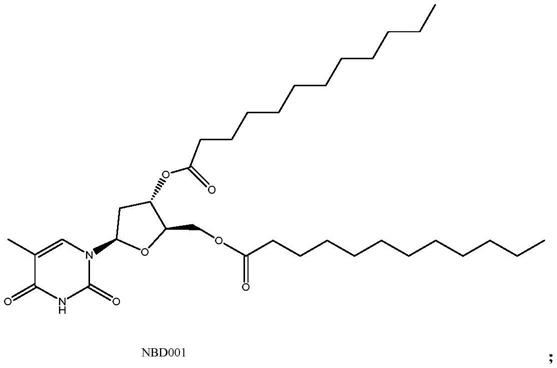
在一些实施例中,所述式i所示化合物为如nbd001所示化合物,
[0020][0021]
所述辅助材料包括选自:peg衍生物、脂质、类脂质、醇或无机盐中的至少一种。在一些实施例中,所述辅助材料包括选自:peg衍生物、脂质和类脂质中的至少一种。在一些实施例中,所述辅助材料包括选自:peg衍生物、脂质和类脂质中的至少两种。在一些实施例中,所述辅助材料包括peg衍生物、脂质和类脂质。在一些实施例中,所述辅助材料包括peg衍生物和脂质。在一些实施例中,所述辅助材料包括脂质和类脂质。
[0022]
所述peg衍生物可以包括选自peg修饰的磷脂酰乙醇胺、peg修饰的磷脂酸、peg修饰的神经酰胺、peg修饰的二烷基胺、peg修饰的二酰基甘油、peg修饰的二烷基甘油中的至少一种。在一些实施例中,所述peg衍生物包括选自1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇(dmg-peg)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[氨基(聚乙二醇)](peg-dspe)、二月桂酰磷脂酰乙醇胺-聚乙二醇(peg-dlpe)、二肉豆蔻酰基磷脂酰乙醇胺-聚乙二醇(peg-dmpe)、二棕榈酰磷脂酰胆碱聚乙二醇(peg-dppc)、二棕榈酰磷脂酰乙醇胺-聚乙二醇(peg-dppe)、peg-二硬脂醇甘油(peg-dsg)、peg-二棕榈油基、peg-二油基、peg-二硬脂基、peg-二酰基甘油酰胺(peg-dag)、peg-二棕榈酰基磷脂酰乙醇胺(peg-dppe)或peg-1,2-二肉豆蔻醇氧丙-3-胺(peg-c-dma)。
[0023]
peg修饰的神经酰胺可以包括选自peg-cerc
14
或peg-cerc
20
。
[0024]
所述1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇(dmg-peg)可以包括选自1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇2000(dmg-peg 2000)。
[0025]
所述脂质可以包括选自选自卵磷脂(pc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱
(dspc)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(dlpc)、1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱(dmpc)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-双十一碳酰基-sn-甘油-磷酸胆碱(dupc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc),胆固醇(chol)、(2,3-二油酰基-丙基)-三甲胺硫酸盐(dotap)、粪甾醇、谷甾醇、麦角甾醇、菜油甾醇、豆甾醇、菜籽甾醇、番茄碱、熊果酸或α-生育酚中的至少一种。在一些实施例中,所述脂质包括选自卵磷脂(pc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(dlpc)、1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱(dmpc)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-双十一碳酰基-sn-甘油-磷酸胆碱(dupc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc),胆固醇(chol)、(2,3-二油酰基-丙基)-三甲胺硫酸盐(dotap)中的至少一种或至少两种或至少三种。
[0026]
所述类脂质可以包括选自泊洛沙胺或泊洛沙胺衍生物。
[0027]
所述泊洛沙胺可以包括选自304、701、704、707、803、901、904、908、1107、1301、1304、1307、90r4或150r1中的至少一种。
[0028]
所述泊洛沙胺衍生物可以包括选自泊洛沙胺衍生物t304-t、泊洛沙胺衍生物t304-d、泊洛沙胺衍生物t304-rt、泊洛沙胺衍生物t304-rc、泊洛沙胺衍生物t701-r、泊洛沙胺衍生物t901-c、泊洛沙胺衍生物t803-rt、泊洛沙胺衍生物t304-rt、泊洛沙胺衍生物t704-m、泊洛沙胺衍生物t704-rt、泊洛沙胺衍生物t704-rc、泊洛沙胺衍生物t901-c、泊洛沙胺衍生物t904-cr、泊洛沙胺衍生物t904-rc、泊洛沙胺衍生物t904-rt、泊洛沙胺衍生物t90r4-r、泊洛沙胺衍生物t90r4-rt中的至少一种(各泊洛沙胺衍生物的结构式可见cn111285845b)。所述醇包括浓度大于2%vol的醇的水溶液。在一些实施例中,所述醇包括选自乙醇或浓度大于2%vol(例如≥10%vol、≥20%vol、≥27%vol或者20%vol-30%vol)的乙醇的水溶液。
[0029]
以所述纳米粒的总质量计算,所述式i所示化合物的含量可以为5wt%-15wt%。在一些实施例中,以所述纳米粒的总质量计算,所述式i所示化合物的含量为5wt%、6wt%、6.3wt%、6.5wt%、7wt%、7.8wt%、8wt%、9wt%、10wt%、11wt%、12wt%、12.5wt%、12.7wt%、13wt%、14wt%或15wt%。
[0030]
以所述纳米粒的总质量计算,所述peg衍生物的含量可以为0-20wt%。在一些实施例中,以所述纳米粒的总质量计算,所述peg衍生物的含量为0、1wt%、2wt%、3wt%、4wt%、5wt%、6wt%、7wt%、8wt%、9wt%、10wt%、11wt%、12wt%、13wt%、14wt%、15wt%、15.6wt%、16wt%、17wt%、18wt%、19wt%或20wt%。
[0031]
以所述纳米粒的总质量计算,所述脂质的含量可以为35wt%-85wt%。在一些实施例中,以所述纳米粒的总质量计算,所述脂质的含量为65wt%-85wt%。在一些实施例中,以所述纳米粒的总质量计算,所述脂质的含量为35wt%、40wt%、41wt%、42wt%、43wt%、44wt%、45wt%、46wt%、47wt%、48wt%、49wt%、50wt%、55wt%、60wt%、65wt%、70wt%、75wt%、80wt%、81wt%或85wt%。
[0032]
以所述纳米粒的总质量计算,所述类脂质的含量可以为0-71wt%。在一些实施例
中,以所述纳米粒的总质量计算,所述类脂质的含量可以为0、5wt%、10wt%、15wt%、20wt%、25wt%、30wt%、35wt%、40wt%、45wt%、50wt%、55wt%、60wt%、65wt%、70wt%或71wt%。
[0033]
在一些实施例中,以所述纳米粒的总质量计算,所述式i所示化合物的含量为0-15wt%,所述peg衍生物的含量为0-20wt%,所述脂质的含量为35wt%-85wt%,所述类脂质的含量为0-71wt%。
[0034]
在一些实施例中,所述纳米粒含式i所示化合物、peg衍生物和脂质;所述式i所示化合物:所述脂质:所述peg衍生物的质量比为(90-110):(800-1100):(120-200)。在一些实施例中,所述纳米粒含式i所示化合物、peg衍生物和脂质;所述式i所示化合物:所述脂质:所述peg衍生物的质量比为(95-105):(809-1350):(129-189)。在一些实施例中,所述纳米粒含式i所示化合物、peg衍生物和脂质;所述式i所示化合物:所述式i所示化合物:所述脂质:所述peg衍生物的质量比为100:(809-1350):(129-189)。
[0035]
在一些实施例中,所述纳米粒含式i所示化合物和peg衍生物,以及两种以上或三种以上脂质;所述式i所示化合物:所述脂质的总质量:所述peg衍生物的质量比为(90-110):(800-1100):(120-200)。在一些实施例中,所述纳米粒含式i所示化合物和peg衍生物,以及两种以上或三种以上脂质;所述式i所示化合物:所述脂质的总质量:所述peg衍生物的质量比为(95-105):(809-1350):(129-189)。在一些实施例中,所述纳米粒含式i所示化合物和peg衍生物,以及两种以上或三种以上脂质;所述式i所示化合物:所述脂质的总质量:所述peg衍生物的质量比为100:(809-1350):(129-189)。在一些实施例中,所述纳米粒含式i所示化合物和peg衍生物,以及两种以上或三种以上脂质;所述式i所示化合物:所述脂质的总质量:所述peg衍生物的质量比为100:820:129。在一些实施例中,所述纳米粒含式i所示化合物和peg衍生物,以及两种以上或三种以上脂质;所述式i所示化合物:所述脂质的总质量:所述peg衍生物的质量比为100:(919-1035):189、100:919:189、100:995:189或100:1035:189。
[0036]
在一些实施例中,所述纳米粒含式i所示化合物和类脂质,以及两种以上或三种以上脂质,所述式i所示化合物:所述脂质的总质量:所述类脂质的质量比为(80-100):(260-320)(290-350)。在一些实施例中,所述纳米粒含式i所示化合物和类脂质,以及两种以上或三种以上脂质,所述式i所示化合物:所述脂质的总质量:所述类脂质的质量比为(85-95):(270-310)(300-340)。在一些实施例中,所述纳米粒含式i所示化合物和类脂质,以及两种以上或三种以上脂质,所述式i所示化合物:所述脂质的总质量:所述类脂质的质量比为89:291:320。
[0037]
在一些实施例中,所述纳米粒含式i所示化合物和类脂质,以及两种以上或三种以上脂质,所述式i所示化合物:所述脂质的总质量:所述类脂质的质量比为(90-110):(700-900):(550-670)。在一些实施例中,所述纳米粒含式i所示化合物和类脂质,以及两种以上或三种以上脂质,所述式i所示化合物:所述脂质的总质量:所述类脂质的质量比为100:809:(569-669)。
[0038]
第二方面,本发明提供一种纳米颗粒复合物。
[0039]
一种纳米颗粒复合物,其包括核酸和第一方面所述纳米粒。
[0040]
所述纳米粒与所述核酸的重量比可以为1:1-10:1。在一些实施例中,所述纳米粒
与所述核酸的重量比为1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1、5:1、5.5:1、6:1、6.5:1、7:1、7.5:1、8:1、8.5:1、9:1、9.5:1、或10:1。
[0041]
碱基互补配对是指核酸分子中各核苷酸残基的碱基按a与t、a与u和g与c的对应关系互相以氢键相连的现象。本发明所述式i所示化合物(例如nbd001化合物)可以与核酸中的腺嘌呤a形成碱基对,a与t通过2个氢键相连,互补碱基的胺和羰基之间形成双氢键,如式ii所示:
[0042][0043]
或者,式i所示化合物与核酸中其他共轭基团通过π-π堆叠效应形成两亲性的组合物,从而在一定条件下自组装形成核碱基衍生物纳米粒。具体地,本发明所述核碱基衍生物主要通过碱基互补配对(氢键)与核酸作用,或通过π-π堆叠效应与核酸形成两亲性的组合物,在水溶液中疏水部分在纳米粒的中间,亲水的核酸与亲水部分在纳米粒的表面,通过亲疏水作用力组装形成核碱基衍生物纳米颗粒复合物。
[0044]
所述核酸可以为经化学修饰的dna或未经化学修饰的dna、单链或双链dna、编码或非编码dna,其任选地选自质粒,寡脱氧核苷酸,基因组dna,dna引物,dna探针,免疫刺激性dna,适体或其任何组合。在一些实施例中,所述核酸为信使rna(mrna)、寡核糖核苷酸、病毒rna、复制子rna、转移rna(trna)、核糖体rna(rrna)、免疫刺激性rna(isrna)、微小rna、小干扰rna(sirna)、小核rna(snrna)、环状rna(circrna或orna)、小发夹rna(shrna)或核糖开关、rna适体、rna诱饵、反义rna、核酶、或其任何组合,优选经化学修饰的信使rna(mrna)。
[0045]
所述rna的核酸序列可以包括专利us9254311b2所列的所有核酸序列,还包括该专利的长序列附录中所列的所有序列。在一些实施例中,本发明所述rna序列可以通过专利us9254311b2或cn106659803a所列的核酸合成方法获得。
[0046]
在一些实施例中,所述纳米粒可以包载待被递送到细胞内部的生物活性物,或任
选地可向将受益于其给药的动物或人类患者给药。在一些示例性但非限制性的实施例中,适合用于本发明的优选的生物活性物分子包括核酸分子,如rna分子,优选mrna分子或sirna分子。
[0047]
在一些实施例中,所述生物活性物优选核酸,如例如脱氧核糖核酸(dna)和核糖核酸(rna),如例如脱氧核糖核酸(dna)和核糖核酸(rna)。在一些实施例中,优选的生物活性物可以是dna分子。dna可以是线性dna或环状dna,如呈环状质粒、游离基因或表达载体形式的dna。在其它实施例中,优选的生物活性物可以是rna分子。rna分子可以是任何类型的rna分子(但不限于此),包括(但不限于)mrna、sirna、mirna、反义rna、核糖核酸酶或所属领域的技术人员熟悉的任何其它类型或种类的rna分子(但不限于此),其将需要递送到细胞内部,在一些实施例中,优选的生物活性物可以是mrna。
[0048]
第三方面,本发明提供一种药物组合物。
[0049]
一种药物组合物,其包括第二方面所述纳米颗粒复合物和药学上可接受的辅料。
[0050]
所述药物组合物的剂型可以为注射剂,栓剂,滴眼剂,片剂,胶囊剂,混悬剂或吸入剂等剂型。
[0051]
在一些实施例中,所述药物组合物至少含有一种rna,其用于治疗或预防疾病。所述含有rna的组合物至少含有编码rna和非编码rna的部分;所述编码rna包括编码至少一种治疗性蛋白或多肽和免疫原性蛋白或肽的至少一个编码区;所述编码rna是mrna。
[0052]
所述治疗性蛋白或多肽可以是细胞因子、趋化因子、自杀基因产物、免疫原性蛋白质或肽、细胞凋亡诱导剂、血管生成抑制剂、热休克蛋白、肿瘤抗原、β-联蛋白抑制剂、sting途径活化剂、检查点调节剂、先天性免疫活化剂、抗体、显性负性受体和诱饵受体、骨髓源性抑制细胞(mdscs)抑制剂、ido途径抑制剂和与细胞凋亡抑制剂结合的蛋白质或肽;
[0053]
所述免疫原性蛋白质或肽可以是来自下列的一种病毒或细菌的至少一种蛋白质或肽的全长序列或部分序列:新型冠状病毒(sars-cov-2)、人乳头瘤状病毒(human papillomavirus,hpv)、a或b型流感病毒或任何其它正粘病毒(c型流感病毒);小核糖核酸病毒,诸如鼻病毒或a型肝炎病毒;披膜病毒,诸如α病毒或风疹病毒,例如辛德毕斯病毒、塞姆利基森林病毒或麻疹病毒;风疹病毒;冠状病毒,尤其是sars-cov-2、hcv-229e或hcv-oc43亚型;棒状病毒,诸如狂犬病病毒;副粘病毒,诸如腮腺炎病毒;呼肠孤病毒,诸如a、b或c组轮状病毒;嗜肝dna病毒,诸如b型肝炎病毒;乳多泡病毒,诸如任何血清型的人类乳头瘤病毒;腺病毒,尤其1至47型;疱疹病毒,诸如单纯疱疹病毒1、2或3;巨细胞病毒,优选cmvpp65;eb病毒;牛痘病毒;细菌肺炎嗜衣原体(chlamydophila pneumoniae);黄病毒,诸如1至4型登革热病毒、黄热病毒、西尼罗河病毒、日本脑炎病毒;c型肝炎病毒;杯状病毒;丝状病毒,诸如埃博拉病毒;博尔纳病毒;布尼亚病毒,诸如裂谷热病毒;沙粒病毒,诸如淋巴细胞性脉络丛脑膜炎病毒或出血热病毒;逆转录病毒,诸如hiv;细小病毒。
[0054]
第四方面,本发明提供一种制备第一方面所述纳米粒的方法。
[0055]
一种制备第一方面所述纳米粒的方法,其包括:将式i所示化合物溶于溶剂a中,得到溶液1,再将辅助材料溶解于溶剂b中,得到溶液2,将溶液1和溶液2混匀,低温旋转蒸发,水浴除去溶剂a,过滤,得到所述纳米粒。
[0056]
所述溶剂a可以包括选自乙醇、二氯甲烷或氯仿。
[0057]
所述溶剂b可以包括选自甲醇、乙醇或氯仿。
[0058]
所述低温可以为-10℃及以下。在一些实施例中,所述低温为-15℃及以下。
[0059]
所述水浴可以为在35℃-65℃进行水浴。在一些实施例中,所述水浴为在35℃、36℃、37℃、38℃、39℃、40℃、41℃、42℃、43℃、44℃、45℃、50℃、55℃、60℃或65℃进行水浴。
[0060]
第五方面,本发明提供一种制备第二方面所述纳米颗粒复合物的方法。
[0061]
一种制备第二方面所述纳米颗粒复合物的方法,其包括:将第一方面所述纳米粒与核酸于溶剂c中混合,得到所述纳米颗粒复合物。
[0062]
所述溶剂c可以为水。
[0063]
第五方面,本发明提供一种第一方面所述纳米粒或第二方面所述纳米颗粒复合物的用途。
[0064]
一种第一方面所述纳米粒或第二方面所述纳米颗粒复合物或第三方面所述药物组合物在制备用于体内递送核酸的药物中的用途。
[0065]
本发明提供可安全地诱导机体天然存在的特异性免疫系统产生几乎任何目标蛋白或其片段的以rna(如信使rna(mrna))为核心、以第一方面所述纳米粒为递送载体的核糖核酸疫苗,包括细菌、病毒等传染性病原体疫苗和肿瘤疫苗。在一些实施方案中,rna是经过修饰的。本发明公开的rna疫苗可用于诱导针对传染性病原体或癌症的免疫应答,包括细胞免疫应答与体液免疫应答,而无例如可能导致插入诱变的风险。取决于传染病病原体和癌症的发病率,以第一方面所述纳米粒为递送载体的rna疫苗可用于各种环境中。该rna疫苗可用于预防和/或治疗传染性病原体或各种转移阶段或程度的癌症。以第一方面所述纳米粒为递送载体的rna疫苗具有优越性质,因为它有针对dc细胞的选择性转染特征性质,在转染率相同或较低时可获得较高的转染效率和转染表达量,产生更高的抗体效价。
[0066]
本发明提供一种基于以下知识构建的核糖核酸(rna)疫苗,即rna(例如,信使rna(mrna))可以安全地引导身体的细胞机制产生几乎任何目的蛋白,从天然蛋白到抗体以及在细胞内外可具有治疗活性的其它完全新颖的蛋白。rna(例如,mrna)疫苗根据感染的盛行率或未满足的医学需要的程度或水平而可用在各种情境中。
[0067]
本发明第一方面所述纳米粒或第二方面纳米颗粒复合物用于预防、治疗和/或改善选自下列的疾病:癌症或肿瘤疾病,传染病,如(病毒、细菌或原生动物学)传染病,自体免疫病,变态反应或变应性疾病,单基因病,即(遗传性)疾病,或一般的遗传病,具有基因遗传背景和典型地由确定的基因缺陷引起并且按照孟德尔法则遗传的疾病,心血管疾病,神经元疾病,呼吸系统疾病,消化系统疾病,皮肤疾病,肌骨骼病症,结缔组织病症,瘤,免疫缺陷,内分泌、营养和代谢疾病,眼病和耳病。
[0068]
本发明所述核酸疫苗可以通过产生治疗有效结果的任何途径来施用。所述途径包括(但不限于)通过皮内、皮下、腹腔、口服、肌肉内、鼻内、眼内、上呼吸道、静脉、阴道、直肠给药。在一些实施例中,本发明所述核酸疫苗采用注射剂进行给药。
[0069]
有益效果
[0070]
相比现有技术,上述技术方案中的一个至少具有包括以下有益技术效果中的一种:
[0071]
(1)本发明创新性地采用式i所示的化合物用于纳米粒的制备,式i所示的化合物通过碱基互补配对(氢键)与核酸作用,或通过π-π堆叠效应与核酸形成两亲性的组合物,在水溶液中疏水部分在纳米粒的中间,亲水的核酸与亲水部分在纳米粒的表面,通过亲疏水
作用力组装形成核碱基衍生物纳米粒。所得纳米粒能在体内有效转染,能够携带编码免疫原性肽或蛋白的mrna进入细胞,并且有效地释放mrna,表达抗原并有效实现免疫治疗或免疫预防的目的。本发明所述核碱基衍生物纳米粒或纳米颗粒复合物能够携带编码多肽或蛋白的mrna进入细胞,并且有效地释放mrna,表达多肽并有效实现治疗疾病的目的。
[0072]
(2)本发明所提供的纳米粒粒径范围在108nm至245nm之间,具有较好的分散性,包载核酸的纳米粒表面电荷在-20mv至-7mv之间。
[0073]
(3)本发明所提供的纳米粒细胞毒性小,具有很好的生物相容性。
[0074]
(4)本发明所提供的纳米粒具有压缩并保护核酸不被降解、促进核酸穿透细胞膜、在体内外实现高效转染、生物相容性好等优点。
[0075]
(5)以纳米粒的总重量计算(不计核酸重量),式i所示化合物(如nbd001化合物)的含量为约为6.34wt%-12.71wt%时(处方rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11),优选为约7.79wt%-12.71%,更优选为约12.71wt%,所得纳米粒有利于核酸的体内和体外转染以及有利于提高的血清转化效率和体液免疫活化功能,有利于转染更多的细胞系,且有利于提高包载核酸的纳米颗粒复合物的体内活性(例如提高包载ova-mrna的纳米颗粒复合物的抗肿瘤效果)。
[0076]
(6)所述纳米粒中采用两种以上或三种以上的脂质(例如dspc、dotap或dope),如处方rp.08,有利于降低转染时载体重量,提高纳米粒的包载量。
[0077]
(7)采用本发明所提供的各辅助材料的比例,有利于提高所得纳米粒有利于核酸的体内和体外转染以及有利于提高的血清转化效率和体液免疫活化功能,有利于转染更多的细胞系,且有利于提高包载核酸的纳米颗粒复合物的体内活性。
[0078]
(8)所述纳米粒的制备方法操作简单,成本低,环境友好,有利于产业化生产。
附图说明
[0079]
图1示实施例四中载fluc-mrna的纳米颗粒复合物在dc2.4细胞中的转染统计图;图中横坐标代表不同的处方的纳米颗粒复合物组合物,纵坐标为转染含同剂量的fluc-mrna的纳米颗粒复合物组合物24h后表达的相对荧光强度。
[0080]
图2示实施例四中不同处方处理后dc2.4细胞的存活率统计图;横坐标代表不同的纳米颗粒复合物处方,纵坐标表示细胞活力,细胞活性越高,显示细胞毒性越小。
[0081]
图3示实施例四中载luc-pdna的纳米颗粒复合物在dc2.4细胞中的转染统计图;横坐标代表不同的处方,纵坐标为转染同剂量的luc-pdna后24h(day1)、48h(day2)、72h(day3)、96h(day4),dc2.4细胞表达的相对荧光强度。
[0082]
图4示实施例四中载fluc-mrna的纳米颗粒复合物在不同细胞中的转染统计图;图中横坐标代表不同的处方的纳米颗粒复合物组合物,纵坐标为转染含同剂量的fluc-mrna的纳米颗粒复合物组合物在不同细胞转染24h后表达的相对荧光强度。
[0083]
图5示实施例四中不同处方处理不同细胞后细胞的存活率统计图;横坐标代表不同的纳米颗粒复合物处方,纵坐标表示细胞活力,细胞活性越高,显示细胞毒性越小。
[0084]
图6示实施例四中载egfp-sirna的纳米颗粒复合物在hela-egfp细胞中的转染统计图;图中横坐标代表不同的处方的纳米颗粒复合物组合物,纵坐标为转染含同剂量的egfp-sirna的纳米颗粒复合物组合物在hela-egfp转染24h后,egfp阳性细胞的百分比。
[0085]
图7示实施例四中载egfp-sirna的纳米颗粒复合物在hela-egfp细胞中的转染统计图;图中横坐标代表不同的处方的纳米颗粒复合物组合物,纵坐标为转染含同剂量的egfp-sirna的纳米颗粒复合物组合物在hela-egfp转染24h后,荧光强度中位数。
[0086]
图8示实施例五中ivis检测载fluc-mrna的纳米颗粒复合物在小鼠体内荧光素酶的表达的体内成像生物发光图。
[0087]
图9示实施例六中载新冠s-mrna的纳米颗粒复合物免疫后小鼠的血清igg抗体水平统计图;横坐标代表不同处方在第一次免疫后的第28天和第49天,纵坐标代表光密度在两个波长处的od值差值,od值是判断血清中igg抗体水平的指标,反映血清中抗s蛋白igg的水平。
[0088]
图10示实施例六中载新冠s-mrna的纳米颗粒复合物免疫后小鼠的血清igg抗体滴度统计图;横坐标代表不同处方在第一次免疫后的49天后血清的不同稀释倍数,纵坐标代表两个波长处的od值(光密度值)差值。以2x baseline(本底的二倍)作为区分阳性和阴性结果的分界值,od值高于此值的最大稀释倍数为滴度。
[0089]
图11示实施例七中在黑色素瘤小鼠小鼠皮下注射载ova-mrna的纳米颗粒复合物疫苗的操作流程图。
[0090]
图12示实施例七中在黑色素瘤小鼠皮下注射载ova-mrna的不同处方纳米颗粒复合物疫苗对小鼠存活率的影响统计图。
[0091]
图13示实施例七中在黑色素瘤小鼠皮下注射载ova-mrna的不同处方纳米颗粒复合物疫苗对肿瘤体积的影响统计图。
[0092]
术语定义:
[0093]
本发明中,“室温”表示环境温度,可以为20℃-30℃;在一些实施例中,为22℃-28℃;在一些实施例中,为24℃-26℃;在一些实施例中,为25℃。
[0094]
术语“peg-cerc
14”或“peg-cerc
20”的结构式如专利申请cn107441506a中的“peg-cerc
14”或“peg-cerc
20”所述。
[0095]
在本发明的上文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值。基于公开的数字,每一个数字的数值有可能会出现
±
10%以下的差异或者本领域人员认为的合理的差异,如
±
1%、
±
2%、
±
3%、
±
4%或
±
5%的差异。
[0096]
术语“任选”、“任选的”或“任选地”是指随后描述的事件或情形可以但不一定出现。例如,“任选的表面活性剂”是指表面活性剂可以存在或可以不存在。
[0097]
术语“重量百分比”或“以重量计的百分比”或“wt%”定义为组合物中单个组分的重量除以组合物所有组分的总重量然后乘以100%。
[0098]
术语"以上"、"以下"、"以内"等理解为包括本数,例如两种以上是指≥两种。
[0099]
术语“%vol”表示体积百分比。
[0100]
术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或多项的组合。
[0101]
在本文中,术语“治疗”指意欲改变正在接受治疗的个体中疾病之天然过程的临床介入。想要的治疗效果包括但不限于防止疾病出现或复发、减轻症状、减小疾病的任何直接或间接病理学后果、防止转移、降低病情进展速率、改善或缓和疾病状态,以及缓解或改善预后。
[0102]
本发明所用术语“核酸”或“核苷酸”或“多核苷酸”或“核酸序列”可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。
[0103]“药学可接受的”意为:在充分的医学判断范围内,适于与人和低等动物组织接触而不存在不适宜的毒性、刺激性、过敏反应及类似反应、而且具有相当的合理获益/风险比率的物质或化合物。
[0104]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0105]
在本技术中,“组合物”可以方便地表现为单位剂量形式并且可以通过制药领域中熟知的方法的任何一种进行制备。所有的方法包括使活性成分与构成一种或多种附属成分的载体相结合的步骤。通常,通过均匀并充分地使活性化合物与液体载体、细碎固体载体或这两者相结合,制备组合物。
具体实施方式
[0106]
为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例以对本发明作进一步的详细说明。
[0107]
本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
[0108]
术语
“×
g”表示多少倍重力加速度的离心加速度,例如“5000
×
g”表示5000倍重力加速度的离心加速度。
[0109]
dmg-peg表示1,2-二肉豆蔻酰基-sn-甘油甲氧基聚乙二醇;peg-dmpe表示二肉豆蔻酰基磷脂酰乙醇胺-聚乙二醇;peg-dppc表示二棕榈酰磷脂酰胆碱聚乙二醇;dotap表示(2,3-二油酰基-丙基)-三甲胺硫酸盐;dope表示1,2-二油酰基-sn-甘油-3-磷酸乙醇胺;dspc表示1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱;chol表示胆固醇;dope表示1,2-二油酰基-sn-甘油-3-磷酸乙醇胺;dmpc表示1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱;pc表示卵磷脂;l64表示泊洛沙姆l64;20表示吐温20;dppc表示1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱;80表示司盘80;t904-rt表示洛沙胺衍生物t904-rt;t904-rc表示洛沙胺衍生物t904-rc;t90r4-r表示洛沙胺衍生物t90r4-r。
[0110]
实施例一:核碱基衍生物的合成
[0111]
本发明所述核碱基衍生物通过所属领域的普通技术人员已知的任何先前已知合成方法来产生。本发明所述核碱基衍生物nbd001的简易合成方法和具体工艺描述如下:
[0112][0113]
将胸苷(242.3mg,1mmol),月桂酸(400.64mg,2mmol),edci(1-乙基-3(3-二甲基丙胺)碳二亚胺,498.4mg,2.6mmol)和dmap(4-二甲氨基吡啶,48.87mg,0.4mmol)混合,溶于8ml n,n-二甲基甲酰胺和10ml二氯甲烷,室温搅拌20h。
[0114]
反应结束后,tlc(石油醚:醋酸乙酯=1:1(v/v))显示有新点生成,将反应溶液转移至250ml分液漏斗中,分别加入100ml二氯甲烷和40ml水,萃取分液,收集下层有机相转移至烧瓶内,加入无水硫酸钠干燥,重复以上萃取操作三次。得到的有机相抽滤并旋干,通过柱层析法(100%pe~pe:ea=1:1(v/v))分离,得到化合物nbd001(黄色油状液体,产率88%(533.29mg,0.88mmol))。取所得化合物nbd001,检测氢谱和质谱,结果如下:
[0115]1h nmr(500mhz,chloroform-d)δ9.91(m,1h),7.69(q,j=1.5hz,1h),5.34(td,j=6.3,4.6hz,1h),4.32(dd,j=11.7,4.7hz,1h),4.28(dt,j=6.5,4.7hz,1h),4.07(dd,j=11.7,4.8hz,1h),2.50
–
2.39(m,2h),2.39
–
2.27(m,2h),1.76(d,j=1.6hz,3h),1.62
–
1.44(m,4h),1.33
–
1.27(m,4h),1.27(ddd,j=7.5,3.7,1.8hz,28h),0.94
–
0.85(m,6h)。
[0116]
nbd001:hrms(esi)m/z calcd for c
34h59
n2o
7+
(m+h)
+
=607.35,found 607.35。
[0117]
实施例二:纳米颗粒复合物的制备
[0118]
1)处方rp.01:nbd001:dmg-peg:dspc:chol:核酸质量比为100:129:320:500:200
[0119]
先将nbd001、dmg-peg、dspc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dspc:chol:核酸质量比为100:129:320:550:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dmg-peg、dspc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、dspc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶液,使样品在圆底烧瓶壁上形成一层脂质薄膜,2h后加入搅拌子以1500rpm/min(转/分钟)的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.01的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0120]
2)处方rp.02:nbd001:peg-dmpe:dope:chol:核酸质量比为100:189:369:550:200
[0121]
先将nbd001、peg-dmpe、dope、chol从-20℃冰箱取出平衡至室温,按nbd001:peg-dmpe:dope:chol:核酸质量比为100:189:369:550:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取peg-dmpe、dope、chol并加乙醇溶解;将溶解后的nbd001、peg-dmpe、dope、chol加入1.5ml离心管中混匀,通过使用胰岛素注射器将混合液滴
加到含有10ml去核酸酶超纯水的圆底烧瓶中,在滴加的过程中将圆底烧瓶放入超声仪超声,40℃水浴条件下,边超声边滴加混合溶液。超声20min后在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶剂,并用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.02的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0122]
3)处方rp.03:nbd001:peg-dppc:dmpc:chol:核酸质量比为100:189:345:650:200
[0123]
先将nbd001、peg-dppc、dmpc、chol从-20℃冰箱取出平衡至室温,按nbd001:peg-dppc:dmpc:chol:核酸质量比为100:189:345:650:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取peg-dppc、dmpc、chol并加乙醇溶解;将溶解后的nbd001、peg-dppc、dmpc、chol加入1.5ml离心管中混匀,通过使用胰岛素注射器将混合液滴加到含有10ml去核酸酶超纯水的圆底烧瓶中,在滴加前加入搅拌子以1500rpm/min的转速进行搅拌,在40℃水浴条件下边搅拌边滴加混合溶液。搅拌20min后在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶剂,并用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.03的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0124]
4)处方rp.04:nbd001:dmg-peg:dspc:chol:核酸质量比为100:129:120:119:200
[0125]
先将nbd001、dmg-peg、dspc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dspc:chol:核酸质量比为100:29:120:119:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dmg-peg、dspc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、dspc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶液,使样品在圆底烧瓶壁上形成一层脂质薄膜,2h后加入搅拌子以1500rpm/min(转/分钟)的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.04的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0126]
5)处方rp.05:nbd001:dmg-peg:dspc:chol:核酸质量比为100:29:120:450:200
[0127]
先将nbd001、dmg-peg、dspc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dspc:chol:核酸质量比为100:29:120:450:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dmg-peg、dspc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、dspc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶液,使样品在圆底烧瓶壁上形成一层脂质薄膜,2h后加入搅拌子以1500rpm/min(转/分钟)的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.05的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0128]
6)处方rp.06:nbd001:90r4:dppc:chol:核酸质量比为100:669:359:450:200
[0129]
按nbd001:90r4:dppc:chol:核酸质量比为100:669:359:450的处方比例,在室温下称取90r4并加去核酸酶的超纯水溶解,用斡旋仪充分振荡5min,静置过夜得到储备液a;再将nbd001、dppc、chol从-20℃冰箱取出平衡至室温,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dppc、chol并加乙醇溶解;将溶解后的
nbd001、dppc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶剂,使样品在圆底烧瓶壁上形成一层脂质薄膜,加入储备液a充分水化脂质薄膜,2h后加入搅拌子以1500rpm/min的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.06的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0130]
7)处方rp.07:nbd001:90r4:dppc:chol:核酸质量比为100:569:359:450:200
[0131]
按nbd001:90r4:dppc:chol:核酸质量比为100:569:359:450的处方比例,在室温下称取90r4并加去核酸酶的超纯水溶解,用斡旋仪充分振荡5min,静置过夜得到储备液a;再将nbd001、dppc、chol从-20℃冰箱取出平衡至室温,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dppc、chol并加乙醇溶解;将溶解后的nbd001、dppc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶剂,使样品在圆底烧瓶壁上形成一层脂质薄膜,加入储备液a充分水化脂质薄膜,2h后加入搅拌子以1500rpm/min的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.07的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0132]
8)处方rp.08:nbd001:t904-rt:dspc:dotap:dope:核酸质量比为89:320:111:61:119:200
[0133]
按nbd001:t904-rt:dspc:dotap:dope:核酸质量比为89:320:111:61:119:200的处方比例,先将t904-rt从-20℃冰箱取出平衡至室温,在室温下称取,加去核酸酶的超纯水溶解,用斡旋仪充分振荡5min,得到储备液a;再将nbd001、dspc、dotap、dope从-20℃冰箱取出平衡至室温,在室温下分别称取nbd001、dspc、dotap、dope用氯仿溶解于圆底烧瓶中,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,除去氯仿,使材料混合组分紧贴于烧瓶内壁,然后将储备液a加入旋干的烧瓶中,持续超声10min;用高速剪切机剪切5min,继续以超声3秒暂停3秒的方式超声,持续超声5min;转入mwco为10000的透析袋中,用去核酸酶的超纯水透析24小时,每6小时跟换一次透析液。透析完后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.08的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0134]
9)处方rp.09:nbd001:t904-rc:t90r4-r:核酸质量比为100:89:89:200
[0135]
按nbd001:t904-rc:t90r4-r:核酸质量比为100:89:89:200的处方比例,先将t904-rc和t90r4-r从-20℃冰箱取出平衡至室温,在室温下称取,加去核酸酶的超纯水溶解混合,用斡旋仪充分振荡5min,得到储备液a;再将nbd001从-20℃冰箱取出平衡至室温,在室温下称取nbd001用乙醇溶解于圆底烧瓶中,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,除去乙醇,使材料紧贴于烧瓶内壁,然后将储备液a加入旋干的烧瓶中,持续超声10min;用高速剪切机剪切5min,继续以超声3秒暂停3秒的方式超声,持续超声5min;转入mwco为10000的透析袋中,用去核酸酶的超纯水透析24小时,每6小时跟换一次透析液。透析完后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.09的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0136]
10)处方rp.10:nbd001:dmg-peg:dspc:chol:核酸质量比为100:189:385:650:200
[0137]
先将nbd001、dmg-peg、dspc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dspc:chol:核酸质量比为100:189:385:650:200的处方比例,在室温下分别称取nbd001、dmg-peg、dspc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、pc、chol加入1.5ml离心管中混匀,通过使用胰岛素注射器将混合液滴加到含有10ml去核酸酶超纯水的圆底烧瓶中,在滴加前加入搅拌子以1500rpm/min的转速进行搅拌,在40℃水浴条件下边搅拌边滴加混合溶液。搅拌20min后用0.22μm滤膜过滤并与核酸水溶液混合,即得到处方rp.10的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0138]
11)处方rp.11:nbd001:dmg-peg:dspc:chol:核酸质量比为100:189:385:650:200
[0139]
先将nbd001、dmg-peg、dspc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dspc:chol:核酸质量比为100:189:385:650:200的处方比例,在室温下分别称取nbd001、dmg-peg、dspc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、pc、chol加入1.5ml离心管中混匀,通过使用胰岛素注射器将混合液滴加到含有10ml ph为6.4的柠檬酸钠缓冲液的圆底烧瓶中,在滴加前加入搅拌子以1500rpm/min的转速进行搅拌,在40℃水浴条件下边搅拌边滴加混合溶液。搅拌20min后用0.22μm滤膜过滤并与核酸水溶液混合,即得到处方rp.11的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0140]
12)处方rp.12:nbd001:dmg-peg:dppc:chol:核酸质量比为15:179:28:350:200
[0141]
先将nbd001、dmg-peg、dppc、chol从-20℃冰箱取出平衡至室温,按nbd001:dmg-peg:dppc:chol:核酸质量比为15:179:28:350:200的处方比例,在室温下称取nbd001并加二氯甲烷溶解;在室温下分别称取dmg-peg、dppc、chol并加乙醇溶解;将溶解后的nbd001、dmg-peg、dppc、chol加入圆底烧瓶中混匀,在-15℃的冷凝循环条件下减压,并用旋转蒸发仪将含有样品的圆底烧瓶置于40℃水浴条件下进行旋蒸,去除样品中的有机溶剂,使样品在圆底烧瓶壁上形成一层脂质薄膜,加入20mm kcl水溶液充分水化脂质薄膜,2h后加入搅拌子以1500rpm/min的转速进行搅拌。搅拌2h后用0.22μm水性滤膜过滤并与核酸水溶液混合,即得到处方rp.12的纳米颗粒复合物溶液,并保存于4℃冰箱中待用。
[0142]
实施例三:本发明所述纳米颗粒复合物的表征
[0143]
粒径与电位:按实施例二所述制备方法制备纳米颗粒复合物,采用马尔文纳米粒度仪(malvern zetasizer nano zse)在25℃下测试纳米颗粒复合物的动态光散射粒径大小(size)、表面电位(zeta potential)及多分散性(pdi)。
[0144]
结果如表1所示,结果表明本发明所述纳米颗粒复合物粒径范围在108nm至245nm之间,具有较好的分散性,纳米粒表面电荷在-20mv至-7mv之间。
[0145]
包封率:以fluc-mrna为模型mrna(即各处方所述核酸为fluc-mrna),按实施例二所述制备方法制备纳米颗粒复合物,使用quant-it ribogreen rna检测试剂盒(thermofische公司)测定各处方对mrna的包封率,具体方法参考试剂盒说明书,本发明的简要处理方法为:使用低温高速离心机将各处方在4℃,20000rpm条件下离心2h,收集上清液并用移液器定量其体积,记为v1;用quant-it ribogreen rna检测试剂盒测量上清中的mrna的浓度,记为c1;将离心后的沉淀加25ul色谱纯dmso溶解,继续加入0.9%生理盐水注射液混合均匀,25℃静置2h后,记录总体积v2并用quant-it ribogreen rna检测试剂盒测定mrna的浓度,记为c2;各处方的包载率计算公式如下:包封率=100%-(v1c1)/(v1c1+v2c2)
×
100%,结果如表1所示,处方对mrna均具有较好的包封效果,包封率均在98.0%以
上。
[0146]
表1:纳米颗粒复合物的表征
[0147][0148]
实施例4:纳米颗粒复合物的体外细胞转染实验及细胞毒性考察
[0149]
1)包载fluc-mrna的纳米颗粒复合物体外转染dc2.4细胞实验:将对数生长期dc2.4细胞悬液以4
×
104个细胞每孔的密度分装至96孔板,放入37℃、5%co2培养箱中静置培养。24h后将浓度为1μg/μl的fluc-mrna用无核酸酶的超纯水稀释至0.1μg/μl,取fluc-mrna分别按实施例二所述不同处方的制备方法制备纳米颗粒复合物,再分别用无核酸酶的超纯水稀释至88μl含10ng/μl fluc-mrna的纳米颗粒复合物混合液,静置10min后,以每孔20μl的体积分别加至每孔含180μl opti-mem培养基的96孔板中,每个样品重复4个孔。给药4h后,用完全培养基替换吸出96孔板中的培养液。继续培养24h,将完全培养基吸出,并用pbs润洗一遍,将100μl d-luciferin工作溶液(工作浓度为250μg/ml)加入各96孔板,继续在37℃孵育箱中培养5min,用omega-fluostar酶标仪成像测试fluc-mrna的荧光表达强度。其中按文献“efficient delivery of therapeutic small nucleic acids to prostate cancer cells using ketal nucleoside lipid nanoparticles.”(delphine,luvino等,《journal of controlled release:official journal of the controlled release society》2013年172卷3期954-61页,doi:10.1016/j.jconrel.2013.09.006)所述方式制备knl作为对照。
[0150]
结果如图1所示。
[0151]
结论:由图1所示,在细胞转染方面,rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11优于其他处方。
[0152]
2)包载fluc-mrna的纳米颗粒复合物体外转染dc2.4细胞的细胞毒性实验:将对数生长期的dc2.4细胞悬液以4
×
104个细胞每孔的密度分装至96孔板,放入37℃、5%co2培养箱中静置培养。24h后将浓度为1μg/μl的fluc-mrna用无核酸酶的超纯水稀释至0.1μg/μl,取fluc-mrna分别按实施例二所述不同处方的制备方法制备纳米颗粒复合物,再分别用无核酸酶的超纯水稀释至88μl含10ng/μl fluc-mrna的纳米颗粒复合物混合液,静置10min后,以每孔20μl的体积分别加至每孔含180μl opti-mem培养基的96孔板中,每个样品重复4个孔。给药4h后,用完全培养基替换吸出96孔板中的培养液。继续培养48h,将完全培养基吸出,并用pbs润洗三遍,以不加处方的细胞孔作阴性对照,不含细胞的cck-8培养基孔作空白对照,向每孔加入90μl不含血清培养基和10μl cck-8溶液,继续在培养箱内孵育2h。用omega-fluostar酶标仪测定在450nm处的吸光度。细胞活力计算公式:
[0153]
细胞活力(%)=[a(加药)-a(空白)]/[a(不加药)-a(空白)]
×
100%;
[0154]
a(加药):每孔加有dc2.4细胞、处方溶液和cck-8溶液的吸光度;
[0155]
a(空白):每孔仅加有cck-8溶液的吸光度;
[0156]
a(不加药):每孔加有dc2.4细胞和cck-8溶液的吸光度;
[0157]
细胞活力:细胞增殖活力或细胞毒性活力。
[0158]
结果如图2所示。结论:结果表明,细胞的存活率都在90%以上,说明本发明所提供的纳米颗粒复合物的各处方均无明显细胞毒性,具有很好的生物相容性,可以进行后续的动物体内实验。
[0159]
3)包载luc-pdna的纳米颗粒复合物体外转染dc2.4细胞实验:将对数生长期的dc2.4细胞悬液以4
×
104个细胞每孔的密度分装至96孔板,放入37℃、5%co2培养箱中静置培养。24h后将浓度为1μg/μl的luc-pdna用无核酸酶的超纯水稀释至0.1μg/μl。取luc-pdna分别按实施例二所述不同处方的制备方法纳米颗粒复合物,再分别用无核酸酶的超纯水稀释至88μl含15ng/μl luc-pdna的纳米颗粒复合物组合物混合液,静置30min后,以每孔20μl的体积分别加至每孔含180μl opti-mem培养基的96孔板中,每个样品重复4个孔。给药4h后,用完全培养基替换吸出96孔板中的培养液。继续培养24h,将完全培养基吸出,将100μl工作浓度为250μg/ml的d-luciferin溶液加入各96孔板,继续在37℃孵育箱中培养5min,最后用omega-fluostar酶标仪成像,以knl为对照组,测试luc-pdna的荧光表达强度,每24小时重复测试一次,每次测试完后将含d-luciferin的培养基吸出,加入新鲜完全培养基继续培养24小时后加d-luciferin测试,重复四天。结果如图3所示,横坐标代表不同的处方,纵坐标为转染24h、48h、72h、96h后同剂量的luc-pdna表达的相对荧光强度。
[0160]
结果如图3所示。
[0161]
结论:由图3所示,包载luc-pdna的纳米颗粒复合物在细胞水平显示出较好的表达量,第二天或第三天表达量最高,其中rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11优于其他处方。
[0162]
4)包载fluc-mrna的纳米颗粒复合物体外转染不同细胞实验:分别将实施例二所述不同处方与fluc-mrna以每孔200ng fluc-mrna参照前述体外细胞转染方式给药,以knl为对照组,测试实施例二所述处方在293t(人胚胎肾细胞)、hela(人宫颈癌细胞)、hl7702(人肝正常细胞)、细胞中的转染实验。
[0163]
结果如图4所示。结论:由图4所示,本发明所提供的各处方包载fluc-mrna的纳米颗粒复合物在293t细胞、hela细胞hl7702细胞中显示出较好的表达量,其中rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11优于其他处方。
[0164]
5)包载fluc-mrna的纳米颗粒复合物体外转染不同细胞的细胞毒性实验:实施例二所述不同处方与fluc-mrna以每孔200ng fluc-mrna参照前述体外细胞转染方式给药,以knl为对照组,测试实施例二所述处方在293t(人胚胎肾细胞)、hela(人宫颈癌细胞)、hl7702(人肝正常细胞)转染中的细胞毒性实验。取对数生长期细胞在计数板上计数后,将细胞悬液加至96孔板,使每孔的细胞浓度为4
×
104个细胞。分别用处方组给药,以不加处方的细胞孔作阴性对照,不含细胞的cck-8培养基孔作空白对照。继续培养48h后,吸出供试品溶液,用pbs润洗三遍,向每孔加入90ul不含血清培养基和10ul cck-8溶液,继续在培养箱内孵育2h。用omega-fluostar酶标仪测定在450nm处的吸光度。
[0165]
结果如图5所示。
[0166]
结论:结果表明,细胞的存活率都在90%以上,说明本发明所提供的纳米颗粒复合
物各处方无明显细胞毒性,具有很好的生物相容性,可以进行后续的动物体内实验。
[0167]
6)包载egfp-sirna(以egfp-sirna为模型sirna)的纳米颗粒复合物体外转染hela-egfp细胞(稳定表达egfp荧光蛋白的多克隆细胞株)的实验:将对数生长期稳定表达egfp的hela细胞悬液以4
×
104个细胞每孔的密度分装至96孔板,放入37℃、5%co2培养箱中静置培养。24h后将浓度为1μg/μl的egfp-sirna用无核酸酶的超纯水稀释至0.1μg/μl,取egfp-sirna分别按实施例二所述处方的制备方法制备纳米颗粒复合物,以knl为对照组,再分别用无核酸酶的超纯水稀释至88μl含10ng/μl egfp-sirna的纳米颗粒复合物混合液,静置10min后,以每孔20μl的体积分别加至每孔含180μl opti-mem培养基的96孔板中,每个样品重复4个孔。给药4h后,用完全培养基替换吸出96孔板中的培养液。继续培养24h,将完全培养基吸出,并用pbs润洗一遍,采集细胞,用bekcman coulter cytoflex流式细胞仪检测每个孔活细胞fitc通道荧光强度,并计算复孔egfp阳性细胞的比例和荧光强度中位数。
[0168]
结果如图6、图7所示。结论:结果表明,egfp阳性细胞比例越低,荧光强度中位数数值越低表明转染效果越好,其中rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11优于其他处方。
[0169]
实施例五:小动物荧光成像检测各处方的纳米颗粒复合物在小鼠体内的转染
[0170]
每组三只雌性balb/c小鼠,以fluc-mrna为模型mrna,按实施例二所述处方rp.01、rp.03、rp.05、rp.06、rp.08、rp.09、rp.11、rp.12的制备方法制备包含fluc-mrna的纳米颗粒复合物。实验组使用胰岛素针分别向每只小鼠注射75μl含有5μg fluc-mrna的纳米颗粒复合物的各处方。给药方式为肌肉注射,注射部位为小鼠大腿肌肉。以nc表示空白对照组,胰岛素针肌内注射75μl pbs缓冲液,以knl为对照组。给药6小时后,取适量底物d-luciferin,由pbs稀释配制成浓度为25mg/ml的溶液,避光备用,每只小鼠腹腔注射125μl底物,将小鼠置于小动物麻醉箱中,打开通气阀,释放异氟烷麻醉小鼠。底物注射5min后使用小动物活体成像系统(perkinelmer,ivis lumina seriesⅲ)对小鼠进行全身体内成像生物发光图像检测。拍摄小鼠背部生物发光图像。结果如图7所示,每一组取有代表性的小鼠一只,实验组纳米颗粒复合物处方在全身体内成像中均显示荧光素酶的表达,荧光强度越大,荧光素酶表达越多。
[0171]
结论:如图8所示,包载fluc-mrna的各实验组纳米颗粒复合物在小鼠体内均具有较好的荧光素酶表达。实验组处方中,rp.01、rp.03、rp.06、rp.08荧光素酶的表达明显高于knl组,rp.05、rp.09、rp.11、rp.12荧光素酶的表达略高于knl组。
[0172]
实施例六:纳米颗粒复合物在小鼠体内的体液免疫效果评价
[0173]
以新冠s-mrna为模型mrna,新冠s-mrna由上海兆维科技发展有限公司(hongene biotech corporation)提供。
[0174]
s-mrna储备液具体信息为:
[0175]
产品名称:covid-19spike protein,full length-mrna;
[0176]
产品描述:4088个核苷酸的长度;
[0177]
modifications(修饰):fully substituted with n1-me-pseudo utp;(全部用n1-me-pseudo utp替代);
[0178]
浓度:1.0mg/ml;
[0179]
储存环境:ph6.4的1mm柠檬酸钠;
[0180]
储存要求:-40℃或以下。
[0181]
实验过程:
[0182]
步骤1:小鼠第一次免疫:第0天,5-6周雌性balb/c小鼠分为8组(每组5只),分别肌肉注射75μl pbs(空白对照)、5μg裸s-mrna和5μg s蛋白的组合(阳性对照)、包载了5μg s-mrna的knl对照组和包载了5μg s-mrna的纳米颗粒复合物处方rp.01、rp.02、rp.03、rp.04、rp.05、rp.06、rp.07、rp.08、rp.09、rp.10、rp.11、rp.12各75μl。
[0183]
步骤2:第一次血清采集:第28天,对小鼠进行外眦取血。血清在4℃凝固1h后,以5000
×
g转速,4℃条件下离心5分钟,取上清液,再以10000
×
g转速,4℃条件下离心5分钟,取上清液加入到八连排pcr管中分装,-20℃冻存备用。
[0184]
步骤3:小鼠第二次免疫:第28天,小鼠经外眦取血后,分别肌肉注射75μl pbs(空白对照)、5μg裸s-mrna和5μg s蛋白的组合(阳性对照)、包载了5μg s-mrna的knl对照组和包载了5μg s-mrna的纳米颗粒复合物处方rp.01、rp.02、rp.03、rp.04、rp.05、rp.06、rp.07、rp.08、rp.09、rp.10、rp.11、rp.12各75μl。重复第一次免疫的过程。
[0185]
步骤4:第二次血清采集:第二次免疫21天后,对小鼠进行外眦取血。血清在4℃凝固1h后,以5000
×
g(5000倍重力加速度)转速,4℃条件下离心5分钟,取上清,再以10000
×
g转速,4℃条件下离心5分钟,取上清加入到八连排pcr管中分装,-20℃冻存备用。
[0186]
步骤5:elisa检测血清igg含量:将s蛋白稀释于pbs中,以每孔100μl稀释液(含1μg s蛋白)包被elisa酶标板,4℃包被6h。弃去板中液体,每孔加入200μl pbst洗板3次后,每孔加入200μl含5%bsa的pbs封闭液25℃摇床封闭2h。弃去封闭液,每孔200μl pbst洗板1次后,加入用pbs稀释200倍后的血清100μl,25℃摇床孵育2h。弃去血清,每孔200μl pbst洗板3次后,每孔加入抗体(抗体与pbs以1:1000比例稀释)100μl,25℃摇床孵育1h。弃去抗体,每孔200μl pbst洗板3次后,加入每孔50μl tmb显色液避光反应,待阳性对照孔变深蓝或反应10分钟后,每孔再加入50μl 2m硫酸终止反应,酶标仪检测450nm和630nm波长处的光密度,并计算od值差值以反映血清中抗s蛋白igg的水平。结果如图9所示。
[0187]
结论:如图9所示,rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11对应的od值均高于knl组,表示rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11有较强的血清转化效率和体液免疫活化功能。
[0188]
步骤6:elisa检测血清igg滴度:将s蛋白稀释于pbs中,以每孔100μl稀释液(含1μg s蛋白)包被elisa酶标板,4℃包被6h。弃去板中液体,每孔加入200μl pbst洗板1次后,每孔加入200μl含5%bsa的pbs封闭液25℃摇床封闭2h。弃去封闭液,每孔200μl pbst洗板3次后,加入用pbs以1:3倍比稀释50、250、1250、6250、31250、156250、781250、3906250倍的血清,25℃摇床孵育2h。弃去血清,每孔200μl pbst洗板3次后,每孔加入抗体(抗体与pbs以1:1000比例稀释)100μl,25℃摇床孵育1h。弃去抗体,每孔200μl pbst洗板3次后,加入每孔50μl tmb显色液避光反应,待阳性对照孔变深蓝或反应10分钟后,每孔再加入50μl 2m硫酸终止反应,酶标仪检测450nm和630nm处的光密度。结果如图9所示。
[0189]
结论:如图10所示,本发明以pbs组的平均od值的2倍为基线,rp.01、rp.02组在稀释至156250倍时od值仍高于基线2倍,rp.03、rp.06组在稀释至31250倍时od值仍高于基线2倍,提示处方rp.01、rp.02、rp.03、rp.06有较强的血清转化效率和体液免疫活化功能。
[0190]
实施例七:纳米颗粒复合物-ova-mrna疫苗对荷瘤小鼠模型的治疗效果评价
[0191]
1)b16-ova黑色素瘤小鼠模型的建立:将鼠源淋巴瘤细胞b16-ova在体外扩增培养,得到b16-ova细胞系,用dpbs稀释备用,每只小鼠打5
×
105个肿瘤细胞。在第0天将7周龄的雌性c57bl/6j小鼠侧腹部脱毛,收集培养的b16-ova肿瘤细胞,将b16-ova肿瘤细胞皮下注射到小鼠的侧腹部,建立皮下b16-ova肿瘤模型。
[0192]
2)纳米颗粒复合物-ova-mrna疫苗的制备:将处方rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11分别与ova-mrna(从美国trilink公司购买获得)简单轻轻混合30分钟后分别得到由处方rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、rp.11制备的八种纳米颗粒复合物-ova-mrna疫苗;
[0193]
3)对c57bl/6j小鼠用纳米颗粒复合物-ova-mrna疫苗(每次每只注射含有5μg治疗剂mrna-ova的纳米粒疫苗)分别在第10天、第13天和第16天通过脚掌注射的方式接种疫苗,同时将接种等体积pbs缓冲溶液、稀释后同体积等量的ova-mrna溶液和包载ova-mrna的knl溶液的小鼠设定为对照组,平行每组5只小鼠。
[0194]
4)从接种肿瘤后第10天开始,每天测量肿瘤垂直直径。按下述公式计算c57bl/6j小鼠的肿瘤体积:v(mm3)=x
×
y2/2,单位为mm,其中v代表肿瘤体积,x表示肿瘤长径,y表示肿瘤短径。同时每天用电子天平记录c57bl/6j小鼠体重的变化,并统计存活率。
[0195]
其考察结果如图11所示,在第0天皮下接种b16-ova黑色素瘤细胞,分别在接种肿瘤后第10天、第13天和第16天接种疫苗。
[0196]
结果:如图11所示,
[0197]
从第10天起pbs对照组和裸mrna组开始可见肉瘤,从第11天起rp.03实验组、rp.08实验组和knl对照组开始可见肉瘤,从第12天起rp.01实验组、rp.07实验组、rp.10实验组、rp.11实验组和ova蛋白对照组开始可见肉瘤,从第13天起rp.02实验组和rp.06实验组开始可见肉瘤。与pbs对照组和裸mrna组相比,由rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10和rp.11制备得到的纳米颗粒复合物-ova-mrna疫苗组显示出明显的肿瘤生长延迟。在第15天,各处方的纳米颗粒复合物-ova-mrna疫苗组的肿瘤大小均小于pbs对照组和裸mrna组。
[0198]
pbs对照组、裸mrna组和knl组的小鼠分别从接种肿瘤后第21天、第23天和第23天开始牺牲,pbs对照组、裸mrna组和knl组的小鼠分别在第30天、第32天和第35天全部牺牲。由rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10和rp.11制备得到的纳米颗粒复合物-ova-mrna疫苗组的小鼠分别从第28天、第30天、第25天、第27天、第24天、第27天、第26天和第26天开始牺牲。处方rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10和rp.11制备得到的纳米颗粒复合物-ova-mrna疫苗组的小鼠分别在第38天、第39天、第37天、第38天、第37天、第40天、第38天和第39天全部牺牲。
[0199]
结论:以本发明所提供的纳米粒为载体的疫苗相比knl组,能更好地保护核酸,有利于核酸在体内的递送,促进核酸穿透细胞膜,具有明显的提高mrna在体内的活性的效果;而且,以处方rp.08的纳米粒为载体的疫苗优于以rp.02、rp.11的纳米粒为载体的疫苗,更优于以rp.01、rp.03、rp.06、rp.07和rp.10的纳米粒为载体的疫苗。
[0200]
综合上述实施例的结果,由各处方的比例分析,
[0201]
(1)以纳米粒的总重量计算(不计核酸重量),式i所示化合物(如nbd001化合物)的含量为约为6.34wt%-12.71wt%时(处方rp.01、rp.02、rp.03、rp.06、rp.07、rp.08、rp.10、
rp.11),优选为约7.79wt%-12.71%,更优选为约12.71wt%,所得纳米粒所得纳米粒有利于核酸的体内和体外转染以及有利于提高的血清转化效率和体液免疫活化功能,有利于转染更多的细胞系,且在包载ova-mrna后具有良好的抗肿瘤效果。
[0202]
(2)所述纳米粒中采用两种以上或三种以上的脂质(例如dspc、dotap或dope),如处方rp.08,有利于降低转染时载体重量,提高纳米粒的包载量。
[0203]
(3)另外,以纳米粒的总重量计算(不计核酸重量),peg衍生物的含量可以约为0-20wt%,脂质的含量可以约为35wt%-85wt%,类脂质的含量可以约为0-71wt%。
[0204]
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1