一种共载多粘菌素E和姜黄素的脂质体的制备方法及其应用
一种共载多粘菌素e和姜黄素的脂质体的制备方法及其应用
技术领域
1.本发明属于生物医药技术领域。更具体地,涉及一种共载多粘菌素e和姜黄素的脂质体的制备方法及其应用。
背景技术:
2.全球范围内的抗生素的滥用导致了多药耐药(multidrug-resistant,mdr)和广泛耐药(extensively drug-resistant,xdr)的革兰氏阴性菌的产生和传播,而临床上对此类细菌造成的相关感染缺乏有效治疗方法,这对国际公共卫生构成了严重的威胁。多粘菌素e是被作为治疗多重耐药性革兰氏阴性菌感染的最后一道防线的抗生素。临床上主要用于治疗革兰阴性菌相关的细菌感染,特别是绿脓杆菌和大肠杆菌引起的各种细菌感染。但近期出现了多种多粘菌素e耐药菌,极大的降低了多粘菌素e对这些耐药菌的疗效。因此,迫切需要一种能够有效克服多粘菌素e耐药性的方法。此外,由于多粘菌素e结构中含有5个氨基,生理条件下具有强的正电荷,导致其具有较大的肾毒性和神经毒性,因此如何降低多粘菌素e的毒性对于其临床应用也具有重要意义。
3.姜黄素是从姜黄的块根中提取出来的一种天然多酚,具有抗肿瘤、抗菌、抗炎、抗氧化等药理活性,在生物医药领域得到广泛的研究和应用,其中神威药业集团的降脂通络软胶囊(国药准字z20040032)中的主要成分就是姜黄素类化合物。有研究发现姜黄素能够在一定程度上提高多粘菌素e对耐药鲍曼不动杆菌的抗菌性能。姜黄素不仅作为促氧化剂与多粘菌素e协同作用加剧了ros的产生,还作为外排泵抑制剂抑制了细菌对多粘菌素e的外排,显著降低了细菌的存活率和耐药性(amanjot kaur,prince sharma,neena capalash.curcumin alleviates persistence of acinetobacter baumannii against colistin[j].sci.rep.2018,8,11029)。但该研究仅涉及姜黄素与多粘菌素e对鲍曼不动杆菌耐药性滞留菌的抗菌性能研究,这一组合是否对其他耐药菌也有协同抗菌作用仍需要进一步研究。而且尽管姜黄素和多粘菌素e对鲍曼不动杆菌显示了一定的协同抗菌作用,这两种药物在溶解性和药代动力学性质上都存在较大的差异,如何将两种药物足量地共同递送到感染部位是这一药物组合实现临床转化必须解决的关键问题。
[0004]
目前,现有技术中有用于细菌感染的共载送抗生素的中性粒细胞,也有单独用于载送姜黄素脂质体或单独载送多粘菌素的脂质体;也有将两种药物进行简单地共混使用。由于这两种药物在溶解性和药代动力学性质上都存在较大的差异,因此,如果通过简单共混注射到感染的人体或者动物体内的话,很难保证两种药物能够同时足量地到达病灶位置,从而发挥协同抗菌作用。
技术实现要素:
[0005]
本发明要解决的技术问题是克服上述问题的缺陷和不足,提供一种共载多粘菌素e和姜黄素的脂质体的制备方法及其应用。
[0006]
本发明的第一个目的是提供一种共载多粘菌素e和姜黄素的脂质体。
[0007]
本发明第二个目的是提供一种共载多粘菌素e和姜黄素的脂质体的制备方法。
[0008]
本发明第三个目的是提供所述共载多粘菌素e和姜黄素的脂质体的一种潜在应用。
[0009]
本发明第四个目的是提供一种治疗革兰氏阴性菌感染药物。
[0010]
本发明上述目的通过以下技术方案实现:
[0011]
一种共载多粘菌素e和姜黄素的脂质体,包含脂质体及包载在脂质体疏水层磷脂层的姜黄素和亲水内核及脂质体表面的多粘菌素e。
[0012]
本发明采用脂质体载药技术,制备得到了一种能够同时包载多粘菌素e和姜黄素药物的脂质体递送系统。在保证稳定性和安全性的前提下,使得这两种药物能够足量地到达感染部位,与细菌结合,从而实现这两种药物在体内的协同抗菌作用。
[0013]
优选地,所述脂质体表面有带负电荷的聚乙二醇修饰。通过聚乙二醇(peg)修饰,使脂质体表面电位偏电中性,将有利于纳米粒子在体内的稳定性,实现较长的循环时间。
[0014]
优选地,所述脂质体粒径为195.3
±
3.8nm。
[0015]
优选地,所述脂质体分散系数pdi为0.237
±
0.032。
[0016]
本发明提供一种共载多粘菌素e和姜黄素的脂质体的制备方法,通过薄膜水化法,将脂质体膜材和姜黄素进行自组装,随后包载多粘菌素e,制备得到共载多粘菌素e和姜黄素的脂质体。
[0017]
优选地,姜黄素与脂质体膜材的质量比为0.5~2:10~20。
[0018]
更优选地,姜黄素与脂质体膜材的质量比为1:15。
[0019]
优选地,所述脂质体膜材包括氢化大豆卵磷脂、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000。
[0020]
优选地,所述氢化大豆卵磷脂、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000的摩尔比为1~3:0.5~1.5:0.1~0.5。
[0021]
更优选地,所述氢化大豆卵磷脂、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000的摩尔比为2:1:0.2。
[0022]
本发明提供所述脂质体在制备治疗细菌感染药物中的应用。
[0023]
优选地,所述细菌为革兰氏阴性菌。
[0024]
更优选地,所述革兰氏阴性菌为多重耐药性革兰氏阴性菌。
[0025]
进一步优选地,多重耐药性革兰氏阴性菌为对多粘菌素e耐药的大肠杆菌和/或对多粘菌素e耐药的肺炎克雷伯菌。
[0026]
特别地,本发明通过体外药物联用抗菌效果的研究,表明姜黄素与多粘菌素e两种药物联用具有显著的协同抗菌性能,姜黄素能够逆转耐药菌对多粘菌素e的耐药性,还能降低多粘菌素e的肾毒性和神经毒性;本发明对脂质体的膜材原料的摩尔比进行配方优化,通过优化后制备得到的共载多粘菌素e和姜黄素的脂质体粒径分散性和稳定性好,通过脂质体的包裹有助于增强两种药物与细菌的相互作用,具有非常强的杀菌作用;在口服耐药试验中也表明,共载多粘菌素e和姜黄素的脂质能够通过杀死大肠杆菌从而缓解炎症,减小了对小肠的损害;并通过体内安全性验证,具有较好的体内生物安全性。
[0027]
本发明还提供一种治疗多重耐药性革兰氏阴性菌感染的药物,即上述共载多粘菌素e和姜黄素的脂质体。
[0028]
本发明具有以下有益效果:
[0029]
本发明提供了一种能够同时包载多粘菌素e和姜黄素两种药物的脂质体,成功实现多粘菌素e和姜黄素两种药物的共同递送,所述脂质体在保证稳定性和安全性的前提下,使得这两种药物能够足量地到达感染部位,与细菌结合,从而实现这两种药物在体内的协同抗菌作用。本发明共同包载多粘菌素e和姜黄素的脂质体在体外和体内均显示出对多种多粘菌素e耐药菌株具有优异的抗菌性能,且姜黄素与多粘菌素e两种药物联用能降低多粘菌素e的肾毒性和神经毒性,姜黄素能够逆转耐药菌对多粘菌素e的耐药性。这种同时包载多粘菌素e和姜黄素的脂质体可以用于制备治疗革兰氏阴性菌感染的药物尤其是多重耐药性革兰氏阴性菌感染的药物。
附图说明
[0030]
图1为多粘菌素e(colistin)其分子结构;
[0031]
图2为姜黄素(curcumin)其分子结构;
[0032]
图3为多粘菌素e和姜黄素对耐药性革兰氏阴性菌的协同抗菌作用(a、b:对多粘菌素e耐药的临床分离的大肠杆菌(mcr-1阳性)的协同抗菌作用;c:对多粘菌素e耐药的临床分离的肺炎克雷伯菌(mcr-1阳性)的协同抗菌作用;d、e:对多粘菌素e耐药的临床分离的大肠杆菌(mcr-1阴性)的协同抗菌作用,图中颜色越深的区域表明细菌密度越高);
[0033]
图4为姜黄素降低多粘菌素e对细胞的毒性作用;hek293t和sh-sy5y细胞在不同样品处理24小时的细胞活力(组别信息:a.空白对照,b.1μg/ml的姜黄素,c.500μg/ml的多粘菌素e,d.1μg/ml的姜黄素+500μg/ml的多粘菌素e。n=6);
[0034]
图5为共同包载多粘菌素e和姜黄素的脂质体的合成与表征(a:载药脂质体的制备示意图;b:载药脂质体的透射电镜图;c:均匀分散的载药脂质体的图片及其粒径分布;d:载药脂质体的ζ电位);
[0035]
图6为载药脂质体在不同液体环境中的稳定性结果(a:载药脂质体在不同介质中的粒径;b、c:pdi和ζ电位在37℃条件下的变化情况,n=3);
[0036]
图7为共同包载多粘菌素e和姜黄素的脂质体的抑菌动力学和杀菌动力学(a、c:大肠杆菌的工程耐药菌株;b、d:临床分离的多粘菌素e耐药菌株,在与不同药物或者脂质体(纯多粘菌素e:col、纯姜黄素:cur、多粘菌素e和姜黄素的混合物:col+cur、纯脂质体:lip-blank、包载多粘菌素e的脂质体:lipo-col、包载姜黄素的脂质体:lipo-cur、共同包载多粘菌素e和姜黄素的脂质体:lipo-cc,共孵育0h、4h、6h、8h和24h后的在600nm的吸光值以及菌落数,n=3;图a和图c中多粘菌素e浓度为0.1625μg/ml,姜黄素浓度为0.3313μg/ml,图b和图d中多粘菌素e浓度为0.4875μg/ml,姜黄素浓度为0.9938μg/ml);
[0037]
图8为活死细菌染色研究结果(a:大肠杆菌的mcr-1工程耐药菌株,b:临床耐药菌株(108cfu/ml)在与不同药物和脂质体共同处理0.5h);
[0038]
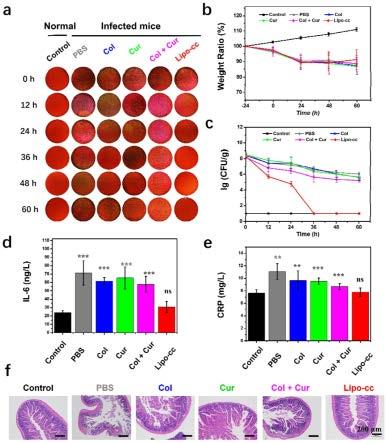
图9为共同包载药物的脂质体对耐药性大肠杆菌诱导的肠道感染的治疗作用(a、b:肠道感染的小鼠在给药后不同时间粪便中的细菌在伊红-亚甲基蓝琼脂板涂板后生长24小时后的菌落照片和计数情况;c、d:感染小鼠在不同给药处理后血清中炎症因子crp和il-6的水平;e:不同药物处理组的感染小鼠在治疗后的体重变化情况;f:不同药物处理后的感染小鼠的小肠在h&e染色后的组织显微图片,标尺为200μm,n=6);
[0039]
图10为口服载药脂质体的小鼠的血液生化分析(小鼠血清的血液化学中ast,alp,bun和cre水平,n=6)。
具体实施方式
[0040]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0041]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0042]
以下实施例中采用的药物均为:
[0043]
多粘菌素e硫酸盐(colistin)其分子结构如图1所示,购买自源叶生物;
[0044]
姜黄素(curcumin)其分子结构如图2所示,购买自源叶生物;
[0045]
氢化大豆卵磷脂(hspc)、胆固醇(chol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000),以上试剂均购于源叶生物;
[0046]
二甲基亚砜(dmso)购自西格玛奥德里奇上海贸易有限公司;
[0047]
dmem培养基、无菌磷酸缓冲液(pbs)、胎牛血清(fbs)、青霉素-链霉素溶液,以上试剂均购于美国gibco公司;
[0048]
cell counting kit-8(cck-8)均购自美国thermo fisher scientific;
[0049]
lb培养基、dmem培养基、无菌磷酸缓冲液(pbs)均购自biosharp公司。
[0050]
以下实施例中采用的菌株为:
[0051]
本实验共使用6种菌株,均为革兰氏阴性菌。分别是工程化colistin耐药且表达mcr-1的大肠杆菌(mcr-1)、临床分离的colistin耐药且表达mcr-1的大肠杆菌(ec-1、ec-2)、临床分离的colistin耐药且不表达mcr-1的大肠杆菌(cdc30、ry171)、colistin耐药的肺炎克雷伯菌(kp-1),此六株临床分离的耐药菌株为中山大学中山医学院田国宝教授的馈赠。
[0052]
以下实施例中采用的细胞株为:
[0053]
人胚肾细胞株(hek293t)、人神经母细胞瘤细胞株(sh-sy5y),两种细胞的原代细胞来源于美国菌种保藏中心(american type culture collection,atcc)。
[0054]
以下实施例中采用的实验动物为:
[0055]
本研究采用balb/c小鼠(5-8周,雄性,体重20-25克,spf级)作为动物实验对象,购买自中山大学(实验动物中心东校园),动物生产许可证号:scxk(粤)2019-0029,动物合格证编号:44008500026742。实验期间小鼠可自由饮水,饲养于洁净区。
[0056]
实施例1多粘菌素e和姜黄素体外药物联用抗菌效果试验
[0057]
1、供试材料:
[0058]
工程化colistin耐药且表达mcr-1的大肠杆菌(mcr-1)、临床分离的colistin耐药且表达mcr-1的大肠杆菌(ec-1、ec-2)、临床分离的colistin耐药且不表达mcr-1的大肠杆菌(cdc30、ry171)、colistin耐药的肺炎克雷伯菌(kp-1)。多粘菌素e硫酸盐(colistin),姜黄素(curcumin)。
[0059]
2、试验方法:
[0060]
(1)将细菌冻存液取5μl于10ml的无菌lb细菌培养基中复苏,充分混合后,置于恒
温振荡器(37℃,150rpm)中培养过夜生长。将菌液稀释涂盘在无菌lb的琼脂板上37℃过夜生长。用接种环挑取一个细菌菌落,接种到无菌lb液体培养基中,于恒温振荡器(37℃,150rpm)中培养。
[0061]
(2)取对数生长期的mcr-1和ec-2菌株,将姜黄素和多粘菌素e分别用dmso和纯化水配置5mg/ml的母液,用lb液体培养基依次稀释成不同浓度的溶液,分别加50μl/孔至96孔板中。将过夜培养的菌液稀释为~108cfu/ml(使用酶标仪读数od
600
=0.07),再稀释至~105cfu/ml,每个孔中加入100μl菌液。37℃培养18~24h,记录每个孔对应的od
600
数值。
[0062]
(3)通过计算联合抑菌指数(fractional inhibitory concentration index,fici)来判别两种药物的相互作用。
[0063]
fici根据以下公式进行计算:
[0064]
fici=fica+ficb[0065]
其中,fica=组合中药物a的最低抑菌浓度(mic)值/单独应用时药物a的mic值;
[0066]
ficb=组合中药物b的mic值/单独应用时药物b的mic值。
[0067]
两种药物相互作用的判定标准如下:fici≤0.5,表示协同作用;0.5《fici≤4.0,表示无关作用;fici》4,表示拮抗作用。
[0068]
3、试验结果:
[0069]
结果如图3所示,表明两种药物联合用药时对于所测试的细菌的fici全部小于0.5(分别为0.135、0.135、0.165、0.19、0.417),这表明两种药物对所测细菌均具有显著的协同抗菌性能,两种药物联用能够显著降低多粘菌素e的最低抑菌浓度(mic)。其中对于临床分离的三株耐药菌株ec-1、ec-2和kp-1,多粘菌素e的mic下降尤为明显。相对于单独使用多粘菌素e,联用时多粘菌素e的mic最低降低超过32倍。
[0070]
更为重要的是,在与姜黄素联用后,多粘菌素e的最低mic均低于美国临床和实验室标准协会(clsi)界定的敏感/耐药的分界线(4μg/ml),表明这些耐药菌在药物联用后均转变为对多粘菌素e敏感。本实施例研究结果表明姜黄素能够逆转耐药菌对多粘菌素e的耐药性,显著降低多粘菌素e的最低抑菌浓度。
[0071]
实施例2姜黄素与多粘菌素e体外药物联用的生物毒性
[0072]
1、试验方法:
[0073]
采用cell counting kit-8(cck-8)的方法来评价姜黄素与多粘菌素e联用的生物毒性。将人胚肾细胞(hek293t)、人神经母细胞瘤细胞(sh-sy5y)两种细胞分别以5
×
103个/孔接种于两个96孔板,并在37℃中培养过夜使细胞完全贴壁。待细胞数量长至~70%覆盖率的时候,依次向每个孔中加入含有不同样品的培养基处理(分别是浓度为500μg/ml的多粘菌素e,浓度为1μg/ml的姜黄素,浓度为500μg/ml的多粘菌素e与1μg/ml的姜黄素混合液),将未处理的细胞当阴性对照。37℃共孵育24h后,弃去培养基,每个孔加入90μl的空白培养基和10μl的cck-8,37℃避光孵育2h,通过酶标仪测定各孔在450nm处的吸收强度,计算细胞活力,每个样品浓度重复6次。
[0074]
细胞活力的计算方法为:
[0075]
细胞活力=(ods/odc)
×
100%
[0076]
其中,ods:样品的od
450
值;odc:对照组的od
450
值。
[0077]
2、试验结果:
[0078]
我们分别用两种细胞探究姜黄素对降低多粘菌素e引发的肾毒性和神经毒性作用。如图4a所示可以发现单独用药多粘菌素e时,hek293t细胞活力为53.88%,但与姜黄素联用时,细胞活力提升到了87.67%。同样地,在图4b中,sh-sy5y细胞分别与单独多粘菌素e和两种药物联合共同孵育时细胞活力分别为60.38%和82.7%。此外,这两种细胞与浓度为1μg/ml的姜黄素共培养24小时没有明显的毒性产生,细胞活力仍有98%以上。这说明在体外实验中,两种药物联用可有效降低多粘菌素e的肾毒性和神经毒性。
[0079]
实施例3共载多粘菌素e和姜黄素的脂质体的制备及优化
[0080]
1、供试材料:
[0081]
氢化大豆卵磷脂(hspc)、胆固醇(chol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、多粘菌素e硫酸盐(colistin)、姜黄素(curcumin)和ec-2菌株。
[0082]
2、纳米脂质体的制备:
[0083]
将制备脂质体的脂质体膜材原料按摩尔比进行配方优化,分别按不同的按摩尔比2:1:0.1、2:1:0.2、2:1:0.5,精确称取各脂质体膜材原料(hspc:chol:dspe-peg2000),分别制备脂质体。
[0084]
姜黄素按药脂质量比为1:15称取,将脂质体材料和姜黄素溶解在4ml配置好的有机溶液(氯仿:甲醇=4:1)中,在55℃、100r/min旋转蒸发得到薄膜。将多粘菌素e超声溶解在pbs中,将多粘菌素e水溶液加入旋蒸瓶中,超声水化30min,探超处理5min,挤压通过0.45μm微孔滤膜得到载药的脂质体。所制备得到的脂质体在4℃冰箱进行保存。
[0085]
3、试验方法:
[0086]
(1)将上述制备得到的脂质体悬液,分别采用用纯化水稀释至50μg/ml,用马尔文动态光散射粒度仪测定其粒径分布及ζ电位,测定粒径变化,每个样品测定3次。
[0087]
(2)多粘菌素e载药量,使用hplc高效液相的方法进行测定。使用梯度泵sr-3000、自动进样器wps-3000、紫外检测器dad-3000组成的ultimate3000高效液相色谱系统(德国thermo science)对多粘菌素e的标准曲线进行测量。采用sharpsil-h c18柱(250mm
×
4.6mm,5μm)为液相色谱柱,流动相为0.05%三氟乙酸—乙腈(77%:23%);运行时间:20min;流速:1ml/min;检测波长:214nm;柱温:30℃。将乙腈:水=1:1作为溶剂,配置多粘菌素e母液1mg/ml,依次用50%乙腈稀释至500、250、125、62.5、31.25μg/ml,以浓度为横坐标,吸光度为纵坐标建立标准曲线,得到线性回归方程。载药量=脂质体中多粘菌素e的质量/脂质体的质量
×
100%
[0088]
(3)抗菌性能,将10μg/ml的脂质体悬液用lb培养基依次稀释浓度为250、125、62.5、31.25、15.6、7.8μg/ml的溶液,分别加入96孔板中(100μl),每个样品3个重复。同时将空白lb培养基作为空白对照。取对数生长期的临床耐药菌株ec-2,分别稀释为~108cfu/ml,使用酶标仪读数od
600
=0.07,再稀释至~105cfu/ml,每个孔中加入100μl菌液。将上述药物处理的细菌置于恒温振荡器(37℃,150rpm)中培养,在18至24h观察孔中od
600
数值,孔内澄清且od
600
数值与0h的od
600
数值一致时,该浓度则为对应脂质体的mic(最低抑菌浓度)。将澄清的孔中分别取10μl进行涂板,在37℃培养箱培养过夜,若没有菌落长出,则该浓度则为对应脂质体的mbc(最低杀菌浓度)。
[0089]
4、试验结果:
[0090]
通过对共载多粘菌素e和姜黄素的脂质体的制备中采用的脂质体膜材原料不同的
摩尔比进行配方优化,通过粒径变化、多粘菌素e(colistin)载药量、抗菌性能这三个方面对不同的摩尔比脂质体膜材原料制备得到的脂质体进行表征,结果如下表1所示,对脂质体膜材原料进行几个不同比例的优化,可以看出随着dspe-peg2000的摩尔比例增加,制备所得的脂质体对应的抗菌临床耐药大肠杆菌ec-2菌株性能有所增加,其最低杀菌浓度(mbc)由62.5μg/ml降低到31.25μg/ml。同时,多粘菌素e的载药量与粒径均先增加后降低。由此可见,在脂质体膜材原料的摩尔比为2:1:0.2时,综合制备得到的共载多粘菌素e和姜黄素的脂质体的粒径变化、多粘菌素e(colistin)载药量、抗菌性能等都是较好的。因此,选用脂质体膜材原料的摩尔比为2:1:0.2用于制备共载多粘菌素e和姜黄素的脂质体,用于后续试验的评价与测试中。
[0091]
表1脂质体膜材原料不同原料的摩尔比配方优化
[0092][0093][0094]
实施例4共载多粘菌素e和姜黄素的脂质体的表征
[0095]
选用实施例3中优化后的脂质体膜材原料摩尔比2:1:0.2对制备得到的脂质体各种性能进一步的表征。
[0096]
1、供试材料:
[0097]
氢化大豆卵磷脂(hspc)、胆固醇(chol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、多粘菌素e硫酸盐(colistin)和姜黄素(curcumin)。
[0098]
2、纳米脂质体的制备:
[0099]
精确称取各脂质体膜材原料(hspc:chol:dspe-peg2000),脂质体膜材原料摩尔比2:1:0.2,姜黄素按药脂质量比为1:15称取,将脂质体材料和姜黄素溶解在4ml配置好的有机溶液(氯仿:甲醇=4:1)中,在55℃、100r/min旋转蒸发得到薄膜。将多粘菌素e超声溶解在pbs中,将多粘菌素e水溶液加入旋蒸瓶中,超声水化30min,探超处理5min,挤压通过0.45μm微孔滤膜得到载药的脂质体。所制备得到的脂质体在4℃冰箱进行保存。
[0100]
3、试验方法:
[0101]
(1)将脂质体悬液用纯化水稀释至50μg/ml,用马尔文动态光散射粒度仪测定其粒径分布及ζ电位,每个样品测定3次。
[0102]
(2)脂质体的形貌通过透射电镜进行观察研究。首先将脂质体悬液稀释液取8μl滴在铜网上,静置3min,然后用滤纸小心吸走液体,重复滴样3次;滴一滴磷钨酸溶液(8μl,1%(w/v))进行负染,静置三分钟后用滤纸吸走,自然晾干。最终在透射电镜下观察脂质体形貌并拍摄照片。
[0103]
(3)姜黄素的含量测定采用紫外-可见分光光度法(uv-vis)进行测定。将乙腈作为
溶剂,配置姜黄素母液1mg/ml,依次用50%乙腈稀释至32、16、8、4、2、1μg/ml,用光谱仪测定样品在430nm条件下的吸收。以浓度为横坐标,吸光度为纵坐标建立标准曲线,得到线性回归方程。
[0104]
(4)载药量测定根据实施例3试验方法中高效液相色谱(hplc)的方法进行测定。载药量=脂质体中多粘菌素e的质量/脂质体的质量
×
100%
[0105]
(5)最后再通过透射电镜(tem)观察制备得到同时包载了两种药物的纳米脂质体。
[0106]
4、试验结果:
[0107]
在确定了多粘菌素e与姜黄素对耐药性革兰氏阴性菌的协同抗菌作用后,本实施例通过薄膜水化法合成了共载药姜黄素和多粘菌素e的脂质体,结果如图5所示。在图5a中,姜黄素和多粘菌素e分别包载在脂质体的疏水层磷脂层和亲水内核及脂质体表面。
[0108]
通过紫外分光光度计和高效液相色谱研究结果表明姜黄素和多粘菌素e的载药量分别为3.18%和1.56%。经过透射电镜(tem)的成像观察,在图5b中表明制备的脂质体呈囊泡状,且粒径均一,干燥情况下粒径为~100nm。
[0109]
随后,对脂质体的粒径、分散性和表面电荷进行了定量分析,利用马尔文粒径仪测量,在图5c中结果表明载药脂质体的水合粒径为195.3
±
3.8nm,分散系数pdi为0.237
±
0.032,进一步表明脂质体粒径分散性较好。由于脂质体表面带负电荷的peg部分被阳离子多粘菌素e中和,其表面电位偏电中性,为-7.6
±
3.4mv,如图5d所示,这将有利于纳米粒子在体内的稳定性,实现较长的循环时间。
[0110]
实施例5共载多粘菌素e和姜黄素的脂质体的稳定性试验
[0111]
1、供试材料:
[0112]
fassgf(模拟胃液)、fassif(模拟肠液)、10%(v/v)的血清(用pbs稀释至10%)、ph7.4的磷酸缓冲液pbs和lb培养基。
[0113]
2、试验方法:
[0114]
为了验证载药脂质体在不同环境下的稳定性,分别将脂质体分散在在水、fassgf(模拟胃液)、fassif(模拟肠液)、10%(v/v)的血清、lb培养基、ph7.4的磷酸缓冲液pbs这六种溶液中,在37℃进行共孵育。每天用马尔文动态光散射粒度仪测定其粒径分布及ζ电位,每个样品测定3次,连续测量三天。对水合粒径、pdi和ζ电位的变化情况进行跟踪测量。
[0115]
3、试验结果:
[0116]
结果如图6所示,表明载药脂质体在三天内的粒径和分散情况都能够维持稳定,具有稳定的表面电荷,没有明显的聚集现象。这说明peg修饰的载药脂质体具有良好的稳定性。脂质体的稳定性,尤其是在模拟胃肠液中的稳定性为后续口服给药奠定了基础。
[0117]
实施例6共载多粘菌素e和姜黄素的脂质体的体外抗菌试验
[0118]
1、供试材料:
[0119]
工程化colistin耐药且表达mcr-1的大肠杆菌(mcr-1)、临床分离的colistin耐药且表达mcr-1的大肠杆菌(ec-1、ec-2)、临床分离的colistin耐药且不表达mcr-1的大肠杆菌(cdc30、ry171)、colistin耐药的肺炎克雷伯菌(kp-1)。
[0120]
采用live/baclight
tm
染色验证,染色试剂盒购置于thermo fisher公司(赛默飞)。该染色试剂盒包括对所有细菌细胞进行染色的绿色荧光染料(syto9)和仅能够对膜结构受损的细菌染色红色染料(pi)。
[0121]
2、处理组:
[0122]
(1)共载多粘菌素e和姜黄素的脂质体(lipo-cc)制备方法同实施例3;
[0123]
(2)单独的药物(col、cur)组,分别为多粘菌素e(col)和姜黄素(cur);
[0124]
(3)纯脂质体(lipo-blank)组,为不包载任何药物的脂质体,其制备方法同实施例2中去除多粘菌素e(col)和姜黄素(cur)后的脂质体;
[0125]
(4)包载单一药物的脂质体(lipo-col、lipo-cur),为只包载一种药物的脂质体,其制备方法同实施例3中,单独包载其中一种要的脂质体;
[0126]
(5)两种药物通过简单物理共混(col+cur)组,为将多粘菌素e(col)和姜黄素(cur)进行简单混合即可。
[0127]
3、试验方法:
[0128]
(1)用lb培养基将上述溶液稀释为含药量一致的溶液,分别加入96孔板中(100μl),每个样品3个重复。同时将空白lb培养基作为空白对照。取对数生长期的工程耐药菌株mcr-1和临床耐药菌株ec-2,分别稀释为~108cfu/ml,使用酶标仪读数od
600
=0.07,再稀释至~105cfu/ml,每个孔中加入100μl菌液。将上述药物处理的细菌置于恒温振荡器(37℃,150rpm)中培养,分别记录每个孔在0、4、6、8、24h对应的od
600
数值。绘制抑菌动力曲线。
[0129]
mcr-1菌株中多粘菌素e浓度为0.1625μg/ml,姜黄素浓度为0.3313μg/ml。ec-2菌株中多粘菌素e为0.4875μg/ml、姜黄素浓度为0.99μg/ml。
[0130]
并在每个时间点将每个孔的菌液用无菌pbs进行稀释,再取稀释液进行涂盘,过夜生长后计数cfu值,绘制杀菌动力曲线。
[0131]
(2)采用live/baclight
tm
细菌生存力试剂盒,检测mcr-1、ec-2两种细菌在经不同样品处理后的生存活力,试剂盒中的syto9是能对所有细菌细胞进行染色的荧光核酸染色剂,并发出绿色荧光,碘化丙啶pi染料仅能对膜受损的细菌细胞进行染色,发出红色荧光。
[0132]
(3)取对数生长的菌液,稀释为~108cfu/ml,使用酶标仪读数od
600
=0.07,再稀释至~105cfu/ml,将500μl的col+cur、lipo-blank和lipo-cc这三种药液,与500μl的稀释菌液混合均匀。同时将未经任何处理的样品作为空白对照。37℃共孵育30min,用无菌磷酸缓冲液pbs在6500rpm、4℃条件下离心5min,重悬于100μl的pbs中,加入两种染料,避光孵育20min。取10μl滴加到载玻片上,盖上盖玻片,静置30s,倒置于共聚焦显微镜,用63
×
倍物镜观察显色。
[0133]
3、试验结果:
[0134]
为了研究共载多粘菌素e和姜黄素的脂质体的抗菌作用,我们分别将工程耐药菌株和临床耐药菌株与载药脂质体进行共孵育,检测了载药脂质体对多粘菌素e耐药菌株的抑菌和杀菌作用。
[0135]
结果如图7所示,表明共载多粘菌素e和姜黄素的脂质体(lipo-cc)能够完全抑制工程耐药菌株和临床耐药菌株的生长,而单独的药物(col、cur)、纯脂质体(lipo-blank)或者包载单一药物的脂质体(lipo-col、lipo-cur)均无法抑制细菌生长,如图7a和图7b所示。此外,两种药物通过简单物理共混(col+cur)也无法抑制细菌的生长,这表明脂质体的包裹可能有助于增强两种药物与细菌的相互作用。
[0136]
随后,针对两种细菌的杀菌实验结果也表明同时包载多粘菌素e和姜黄素的脂质
体具有非常强的杀菌作用,在6小时内能够将细菌完全杀灭,如图7c和图7d所示。但其他药物或者脂质体处理组均没有表现出任何杀菌能力,进一步体现了脂质体对于实现两种药物的协同抗菌作用并提高这一药物组合的抗菌作用的必要性。
[0137]
共同包载多粘菌素e和姜黄素的脂质体(lipo-cc)的杀菌活性,通过live/baclight
tm
染色进一步验证,再通过激光共聚焦显微镜对染色细菌的观察,结果如图8所示,表明共同包载两种药物的脂质体(lipo-cc)会造成更多细菌的细胞膜被破坏,从而导致更多细菌呈现红色荧光。而其他药物和脂质体组处理的细菌的红色荧光信号较弱,这一结果也与杀菌动力学结果相符,证明了共载药脂质体的优异杀菌性能。此外,荧光染料染色结果也反映了共同包载两种药物的脂质体的杀菌机制与破坏细菌细胞膜相关。
[0138]
实施例7共载多粘菌素e和姜黄素的脂质体的体内抗菌试验
[0139]
1、供试材料:临床耐药菌株(ec-2)。
[0140]
2、小鼠肠道感染模型的建立:
[0141]
选取体重在20-25g的balb/c雄鼠,在实验室适应3天后,空腹6h后,每只小鼠灌胃300μl、~109cfu/ml处于对数生长期的ec-2菌液,感染24h后进行口服给药治疗。
[0142]
3、处理组:
[0143]
(1)正常小鼠:不进行任何处理,让其自然生长;
[0144]
(2)小鼠感染组:balb/c雄鼠,空腹6h处理后,每只小鼠灌胃300μl、~109cfu/ml处于对数生长期的ec-2菌液。感染24h后进行口服给药治疗。此时。在感染基础上分别进行给药:游离多粘菌素e、游离姜黄素、游离多粘菌素e和姜黄素物理混合、共载两种药物的脂质体组、给无菌的ph7.4的磷酸盐缓冲液pbs。其中,脂质体给药剂量为53.04mg/kg,不同感染组中含有的多粘菌素e和姜黄素的量分别为0.83mg/kg、1.68mg/kg,其他游离药物组的药物用量与之保持一致。
[0145]
4、试验方法:
[0146]
(1)每天记录小鼠体重变化,小鼠分为6组,分别是正常小鼠、游离多粘菌素e处理的感染组、游离姜黄素组处理的感染组、游离多粘菌素e和姜黄素组处理的感染组、给共载药脂质体处理的感染组、pbs组,每组6只重复。分别在给药治疗0、12、24、24、36、48、60h这几个时间点,用无菌ep管接取每只小鼠的新鲜粪便,加入冷的无菌pbs,研磨震荡使之分散,低速离心,取上层溶液在emb培养基上进行涂板。过夜生长后拍照记录菌落生长情况,并计算粪便中所含菌落数量。
[0147]
(2)同时,在60h时处死小鼠取血,静置30min,3500rpm离心5min,得到小鼠血清。用elisa试剂盒测血清中il-6、crp两种炎症因子的变化。同时取出各组中的小肠组织,在4%的多聚甲醛中固定,脱水,包埋制成蜡块后,切成厚度为3μm薄片,并用组织病理切片苏木素-伊红(h&e)染色以进行组织学分析。
[0148]
5、试验结果:
[0149]
为了探究载药脂质体在体内的抗菌效果,我们通过口服耐药大肠杆菌,成功建立了小鼠肠道感染模型。在感染24h后口服共同包载多粘菌素e和姜黄素的脂质体进行治疗。
[0150]
结果如图9所示,表明通过单次口服载药脂质体能够在24小时后杀灭大部分大肠杆菌(粪便中的大肠杆菌由1.5
×
108cfu/g降至5.4
×
104cfu/g),在36小时完全清除大肠杆菌,如图9a和图9c所示。而单独用药和两种药物共同给药的小鼠和服用磷酸缓冲液pbs的对
照组小鼠在粪便中大肠杆菌数量上并没有明显区别。
[0151]
进一步通过小鼠血清中炎症因子(il-6、crp)水平的分析评估了脂质体对肠道感染的治疗作用。在给药处理60h时,用elisa试剂盒检测结果发现共同包载多粘菌素e和姜黄素的脂质体处理后的小鼠的体内炎症因子均恢复到接近正常小鼠水平,而其他感染组的小鼠的炎症因子的表达仍处于较高水平,如图9d和图9e所示。同时,肠道感染的小鼠均出现了相似程度体重的下降,仅有载药脂质体处理的小鼠出现了体重的增加,这也表明了脂质体对肠道感染的优异治疗效果,如图9b所示。
[0152]
进一步的小肠组织病理切片研究结果表明载药脂质体处理的小鼠与正常小鼠物的小肠组织完整,小肠黏膜无明显损伤,绒毛也未出现脱落现象,如图9f所示。而感染对照pbs组和其他给药组的小鼠的小肠绒毛严重的脱落情况,小肠粘膜也出现明显损伤。这说明载药脂质体(lipo-cc)能够通过杀死大肠杆菌从而缓解炎症,减小了对小肠的损害。
[0153]
实施例8共载多粘菌素e和姜黄素的脂质体的体内安全性试验
[0154]
1、试验方法:
[0155]
将健康的balb/c小鼠(雄性,5-8周,20-25g)随机分为3组(n=6),以评估脂质体的生物安全性,分别是对照组、lipo-cc组(口服载药脂质体的浓度为53.04mg/kg)。每隔1日口服给药,连续3次给药后,停药观察3天后用无菌ep管收集小鼠血液,静置30min后,3500rpm离心5min,得到小鼠血清。将血清样品送往中山大学动物实验中心(东校区)用生化分析仪进行生化分析。分析血液中天冬氨酸转氨酶(aspartate aminotransferase,ast),碱性磷酸酶(alkaline phosphatase,alt),尿素氮(urea nitrogen,bun)和肌酐(creatinine,cre)的水平分别评估小鼠肝和肾的功能。
[0156]
2、试验结果:
[0157]
结果如图10所示,表明脂质体处理组的小鼠血清中的天冬氨酸氨基转移酶(ast),碱性磷酸酶(alp),尿素氮(bun)和肌酐(cre)与健康小鼠均没有显著性差别,表明载药脂质体具有较好的体内生物安全性,通过口服给药不会引起显著的肝毒性或肾毒性。
[0158]
综上可知,本发明提供一种共同包载多粘菌素e与姜黄素两种药物的脂质体,经过对脂质体的膜材原料配比进行优化后制备得到的脂质体的分散性和稳定性好。采用本发明制备得到的共同包载多粘菌素e与姜黄素两种药物的脂质体,通过体外药物联用抗菌效果的研究,表明姜黄素与多粘菌素e两种药物联用具有显著的协同抗菌性能,还能有效降低多粘菌素e的肾毒性和神经毒性,姜黄素能够逆转耐药菌对多粘菌素e的耐药性;通过脂质体的包裹有助于增强两种药物与细菌的相互作用,具有非常强的杀菌作用;在动物实验中也表明,共载多粘菌素e和姜黄素的脂质能够通过杀死大肠杆菌从而缓解炎症,减小了对小肠的损害;并通过体内安全性验证,具有较好的体内生物安全性。
[0159]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1