作为人免疫蛋白酶体的抑制剂的二肽模拟物
作为人免疫蛋白酶体的抑制剂的二肽模拟物
1.本技术是申请号为201580056519.4、申请日为2015年8月12日、发明名称为“作为人免疫蛋白酶体的抑制剂的二肽模拟物”的中国发明专利申请的分案申请,原申请为国际申请号为pct/us2015/044876的国家阶段申请,该国际申请要求2014年8月18日提交的系列号为62/038,636的美国临时专利申请的权益,该申请的内容据此以引用的方式整体并入。
2.本发明是根据由美国国立卫生研究院颁发的第5r21ai101393号基金在美国政府的支持下完成的。美国政府对本发明享有一定的权利。
技术领域
3.本发明涉及人免疫蛋白酶体的抑制剂。
背景技术:
4.蛋白酶体是存在于真核细胞的细胞溶质和细胞核中的大的atp依赖性多亚基筒形n-末端亲核体水解酶,并且负责大多数细胞蛋白质的降解(baumeister等人,“the proteasome:paradigm of a self-compartmentalizing protease,”cell 92:367-380(1998);goldberg,a.l.,“functions of the proteasome:from protein degradation and immune surveillance to cancer therapy,”biochemical society transactions 35:12-17(2007))。蛋白酶体不仅通过降解控制许多关键的细胞检查点,而且还产生用于抗原呈递的肽(goldberg,a.l.,“functions of the proteasome:from protein degradation and immune surveillance to cancer therapy,”biochemical society transactions 35:12-17(2007);rock等人,“inhibitors of the proteasome block the degradation of most cell proteins and the generation of peptides presented on mhc class i molecules,”cell 78:761-771(1994))。高度特异性蛋白酶体抑制剂可显著地限制对mhc i类分子的肽的总供给,从而阻断抗原呈递(rock等人,“protein degradation and the generation of mhc class i-presented peptides,”advances in immunology 80:1-70(2002))。组成性蛋白酶体核心颗粒由于其沉降性质而被称为20s(c-20s)。c-20s核心内部存在具有不同特异性的三种蛋白酶(β1(半胱天冬酶样)、β2(胰蛋白酶样)和β5(胰凝乳蛋白样))的每一者的两个拷贝(bedford等人,“ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets,”nature reviews.drug discovery 10:29-46(2011))。然而,已对干扰素-γ应答的淋巴细胞和细胞表达称为免疫蛋白酶体(i-20s)的不同蛋白酶体,其中相应的蛋白酶是不同基因的产物:β1i、β2i和β5i。含有混合β亚基的中间蛋白酶体见于许多细胞中,例如在结肠和小肠的粘膜中(guillaume等人,“two abundant proteasome subtypes that uniquely process some antigens presented by hla class i molecules,”proc.nat’l acad.sci.usa 107:18599-18604(2010))。由免疫-β亚基置换组成性亚基的影响包括蛋白水解活性提高和活性位点的肽偏好改变(rock等人,“proteases in mhc class i presentation and cross-presentation,”journal of immunology 184:9-15d(2010))。例如,胱天蛋白酶样β1置换β
1i优先在小的疏水残基之后而不是在天冬氨酸之后裂解(huber等人,“immuno-and constitutive proteasome crystal structures reveal differences in substrate and inhibitor specificity,”cell 148:727-738(2012))。这导致肽产物改变,使得组合缺乏β1i、β2i和β5i的小鼠能存活、生育且健康,但表达与野生型小鼠不同的抗原肽库,这由它们排斥同基因野生型脾细胞得到证明(kincaid等人,“mice completely lacking immunoproteasomes show major changes in antigen presentation,”nature immunology 13:129-135(2012))。hu c-20s和i-20s似乎通过不同的途径调节细胞因子产生(muchamuel等人,“a selective inhibitor of the immunoproteasome subunit lmp7 blocks cytokine production and attenuates progression of experimental arthritis,”nature medicine 15:781-787(2009))。hu c-20s经由iκb(细胞溶质中的nf-κb的结合配偶体)控制nf-κb的活化(perkins,n.d.,“integrating cell-signalling pathways with nf-[kappa]b and ikk function,”nat.rev.mol.cell biol.8:49-62(2007)),且c-20s的抑制阻断nf-κb的活化(meng等人,“epoxomicin,a potent and selective proteasome inhibitor,exhibits in vivo antiinflammatory activity,”proc.nat’l acad.sci.usa 96:10403-10408(1999))。就其本身而言,在其它潜在途径当中,i-20s似乎控制tlr9和unc93b1(内质网(er)-驻留蛋白)共易位至核内体(hirai等人,“bortezomib suppresses function and survival of plasmacytoid dendritic cells by targeting intracellular trafficking of toll-like receptors and endoplasmic reticulum homeostasis,”blood 117:500-509(2011))。蛋白酶体控制不同的细胞功能,它们当中包括炎性细胞因子释放的信号转导、抗原呈递和浆细胞分泌抗体而不会由于错误折叠的免疫球蛋白积累而死亡的能力(goldberg,a.l.,“functions of the proteasome:from protein degradation and immune surveillance to cancer therapy,”biochemical society transactions 35:12-17(2007);bedford等人,“ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets,”nature reviews.drug discovery 10:29-46(2011);neubert等人,“the proteasome inhibitor bortezomib depletes plasma cells and protects mice with lupus-like disease from nephritis,”nature medicine 14:748-755(2008))。因此蛋白酶体可以是治疗自身免疫性和炎性疾病的靶标。例如,抑制浆细胞样树突细胞(pdc)中的蛋白酶体阻止tlr的输运,导致irf-7的核易位阻断,从而抑制ifnα的产生(hirai等人,“bortezomib suppresses function and survival of plasmacytoid dendritic cells by targeting intracellular trafficking of toll-like receptors and endoplasmic reticulum homeostasis,”blood 117:500-509(2011)),后者是全身性红斑狼疮(sle)中牵涉的一种细胞因子。然而,由于同样的原因,预期蛋白酶体的广泛抑制可能是有毒的并且在临床上已证明是有毒的。
[0005]
经fda批准用于治疗恶性肿瘤的两种蛋白酶体抑制剂(硼替佐米和卡非佐米)抑制c-20sβ5c和i-20sβ5i两者(huber等人,“inhibitors for the immuno-and constitutive proteasome:current and future trends in drug development,”angewandte chemie 51:8708-8720(2012))。硼替佐米(一种二肽基硼酸盐)是一种慢结合共价但可逆的抑制剂,而卡菲佐米是具有环氧酮弹头的肽,其不可逆地抑制蛋白酶体。除了治疗恶性肿瘤外,已报
道硼替佐米对炎症性肠病(ibd)、sle、移植物抗宿主病、抗体介导的移植排斥、类风湿性关节炎(ra)及其它免疫、自身免疫性和/或炎症性病状有效。然而,这种广谱抑制剂对于非恶性疾病的慢性治疗毒性太大。onx 0914(另一种肽环氧酮)对于i-20sβ5i具有适度的选择性(muchamuel等人,“a selective inhibitor of the immunoproteasome subunit lmp7 blocks cytokine production and attenuates progression of experimental arthritis,”nature medicine 15:781-787(2009)),并且据报道对类风湿性关节炎(muchamuel等人,“a selective inhibitor of the immunoproteasome subunit lmp7 blocks cytokine production and attenuates progression of experimental arthritis,”nature medicine 15:781-787(2009))、sle(ichikawa等人,“beneficial effect of novel proteasome inhibitors in murine lupus via dual inhibition of type i interferon and autoantibody-secreting cells,”arthritis and rheumatism 64:493-503(2012))、实验性结肠炎(basler等人,“prevention of experimental colitis by a selective inhibitor of the immunoproteasome,”journal of immunology 185:634-641(2010))和多发性硬化症(basler等人,“inhibition of the immunoproteasome ameliorates experimental autoimmune encephalomyelitis,”embo mol.med.6:226-238(2014))具有功效。尽管如此,其作用也是不可逆的,并且具有相当大的毒性。
[0006]
本发明旨在克服本领域中的这些及其它缺点。
技术实现要素:
[0007]
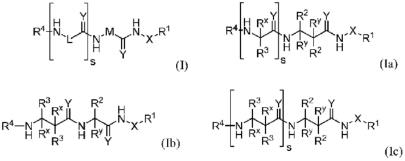
本发明的一方面涉及式(i)的化合物:
[0008][0009]
其中
[0010]
l是—(cr3r
x
)
p
—;
[0011]
m是—(cr2ry)r—;
[0012]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0013]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0014]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0015]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷
基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0016]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0017]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0018]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0019]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0020]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0021]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0022]
x是—(ch2)q—、—o—或—(cd2)q—;
[0023]
y是o或s;
[0024]
k是1、2或3;
[0025]
m是0、1、2、3、4或5;
[0026]
n是0、1、2或3;
[0027]
p是1或2;
[0028]
q是0、1或2;
[0029]
r是1或2;且
[0030]
s是0或1;
[0031]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3,
[0032]
或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0033]
本发明的另一方面涉及治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法。这种方法包括对有需要的受试者施用式(i)的化合物:
[0034][0035]
其中
[0036]
l是—(cr3r
x
)
p
—;
[0037]
m是—(cr2ry)r—;
[0038]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0039]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0040]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0041]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0042]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0043]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0044]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0045]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0046]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0047]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0048]
x是—(ch2)q—、—o—或—(cd2)q—;
[0049]
y是o或s;
[0050]
k是1、2或3;
[0051]
m是0、1、2、3、4或5;
[0052]
n是0、1、2或3;
[0053]
p是1或2;
[0054]
q是0、1或2;
[0055]
r是1或2;且
[0056]
s是0或1;
[0057]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3。
[0058]
本发明的另一方面涉及式(ia)、式(ib)或式(ic)的化合物:
[0059][0060]
其中
[0061]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0062]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0063]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0064]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0065]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0066]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0067]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0068]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0069]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0070]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0071]
x是—(ch2)q—、—o—或—(cd2)q—;
[0072]
y是o或s;
[0073]
k是1、2或3;
[0074]
m是0、1、2、3、4或5;
[0075]
n是0、1、2或3;
[0076]
q是0、1或2;且
[0077]
s是0或1;
[0078]
或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0079]
本发明的又一方面涉及治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法。这种方法包括对有需要的受试者施用式(ia)、式(ib)或式(ic)的化合物:
[0080][0081]
其中
[0082]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0083]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0084]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0085]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0086]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0087]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0088]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0089]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0090]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0091]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0092]
x是—(ch2)q—、—o—或—(cd2)q—;
[0093]
y是o或s;
[0094]
k是1、2或3;
[0095]
m是0、1、2、3、4或5;
[0096]
n是0、1、2或3;
[0097]
q是0、1或2;且
[0098]
s是0或1。
[0099]
据信i-20s的选择性抑制影响免疫系统,但会以其它方式比组成性蛋白酶体和免疫蛋白酶体的组合抑制毒性低得多。这里提出的抑制剂的作用对hu i-20sβ5i具有相比于hu c-20s的高选择性以及完全的可逆性。预期对i-20sβ5i具有选择性的抑制剂在治疗自身免疫性疾病中如果不是更有效的话也是同等有效的,且毒性较低。这些抑制剂可开辟治疗免疫、自身免疫性、炎症性、神经变性及某些肿瘤性病症的新途径,如:全身性红斑狼疮、慢性类风湿性关节炎、炎症性肠病、溃疡性结肠炎、克罗恩氏病、多发性硬化症、肌萎缩性侧索硬化症(als)、动脉粥样硬化、硬皮病、全身性硬化症、自身免疫性肝炎、斯耶格伦综合征(sjogren syndrome)、狼疮性肾炎、肾小球性肾炎、类风湿性关节炎、银屑病、重症肌无力、免疫球蛋白a肾病、动脉粥样硬化、血管炎、肾纤维化、肺纤维化、肝纤维化、移植排斥、特发性肺纤维化、哮喘和炎症驱动性癌症,如:三阴性乳腺癌。
附图说明
[0100]
图1是显示通过选定的二肽模拟物(dipeptidomimetics)抑制人i-20sβ5i和c-20sβ5c的曲线图。
具体实施方式
[0101]
本发明的一方面涉及式(i)的化合物:
[0102][0103]
其中
[0104]
l是—(cr3r
x
)
p
—;
[0105]
m是—(cr2ry)r—;
[0106]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环
和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0107]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0108]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0109]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0110]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0111]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0112]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0113]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0114]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0115]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0116]
x是—(ch2)q—、—o—或—(cd2)q—;
[0117]
y是o或s;
[0118]
k是1、2或3;
[0119]
m是0、1、2、3、4或5;
[0120]
n是0、1、2或3;
[0121]
p是1或2;
[0122]
q是0、1或2;
[0123]
r是1或2;且
[0124]
s是0或1;
[0125]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3,
[0126]
或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0127]
如上文及本文描述的通篇中所用,除另有说明外,以下术语应被理解为具有以下含义。如果本文中未另外定义,则本文所用的所有技术及科学术语具有与本技术所属领域的普通技术人员通常所理解的相同的含义。在本文的术语有多个定义的情况下,除另有说明外,以本节中的定义为准。
[0128]
术语“烷基”意指可以是直链或支链的链中具有约1至约6个碳原子的脂族烃基团。支链意指一个或多个诸如甲基、乙基或丙基的低级烷基基团连接于直链烷基链。示例性烷基基团包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、正戊基和3-戊基。
[0129]
术语“环烷基”意指约3至约7个碳原子、优选约5至约7个碳原子的非芳族单环或多环体系。示例性单环环烷基包括环戊基、环己基、环庚基等。
[0130]
术语“芳基”意指6至约14个碳原子、优选6至约10个碳原子的芳族单环或多环体系。代表性的芳基基团包括苯基和萘基。
[0131]
术语“杂芳基”意指约5至约14个环原子、优选约5至约10个环原子的芳族单环或多环体系,其中环体系中的一个或多个原子是碳以外的元素,例如氮、氧或硫。在多环体系的情况下,对于被定义为“杂芳基”的环体系,仅需要一个环是芳族的。优选的杂芳基含有约5至6个环原子。杂芳基前面的前缀氮杂、氧杂、硫杂或硫代意指分别存在至少氮、氧或硫原子作为环原子。杂芳基的氮原子任选被氧化成相应的n-氧化物。代表性的杂芳基包括吡啶基、2-氧代-吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、呋喃基、吡咯基、噻吩基、吡唑基、咪唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、三唑基、噁二唑基、噻二唑基、四唑基、吲哚基、异吲哚基、苯并呋喃基、苯并噻吩基、二氢吲哚基、2-氧代二氢吲哚基、二氢苯并呋喃基、二氢苯并噻吩基、吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、苯并异噁唑基、苯并异噻唑基、苯并三唑基、苯并[1,3]二氧杂环戊烯基、喹啉、异喹啉基、喹唑啉基、噌啉基、酞嗪基、喹喔啉基、2,3-二氢-苯并[1,4]二氧杂环己烯基、苯并[1,2,3]三嗪基、苯并[1,2,4]三嗪基、4h-色烯基、吲嗪基、喹嗪基、6ah-噻吩并[2,3-d]咪唑基、1h-吡咯并[2,3-b]吡啶基、咪唑并[1,2-a]吡啶基、吡唑并[1,5-a]吡啶基、[1,2,4]三唑并[4,3-a]吡啶基、[1,2,4]三唑并[1,5-a]吡啶基、噻吩并[2,3-b]呋喃基、噻吩并[2,3-b]吡啶基、噻吩并[3,2-b]吡啶基、呋喃并[2,3-b]吡啶基、呋喃并[3,2-b]吡啶基、噻吩并[3,2-d]嘧啶基、呋喃并[3,2-d]嘧啶基、噻吩并[2,3-b]吡嗪基、咪唑并[1,2-a]吡嗪基、5,6,7,8-四氢咪唑并[1,2-a]吡嗪基、6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪基、2-氧代-2,3-二氢苯并[d]噁唑基、3,3-二甲基-2-氧代二氢吲哚基、2-氧代-2,3-二氢-1h-吡咯并[2,3-b]吡啶基、苯并[c][1,2,5]噁二唑基、苯并[c][1,2,5]噻二唑基、3,4-二氢-2h-苯并[b][1,4]噁嗪基、5,6,7,8-四氢-[1,2,4]三唑并[4,3-a]吡嗪基、[1,2,4]三唑并[4,3-a]吡嗪基、3-氧代-[1,2,4]三唑并[4,3-a]吡啶-2(3h)-基等。
[0132]
如本文所用,“杂环基”或“杂环”是指由碳原子和一至五个选自氮、氧和硫的杂原子组成的稳定的3至18元环(基)。处于本技术的目的,杂环可以是单环或多环体系,其可包括稠合、桥接或螺环体系;并且杂环中的氮、碳或硫原子可任选被氧化;氮原子可任选被季铵化;并且环可以是部分或完全饱和的。这类杂环的实例包括但不限于氮杂环庚三烯基、氮杂环辛基、吡喃基二噁烷基、二噻烷基、1,3-二氧戊环基、四氢呋喃基、二氢吡咯烷基、十氢异喹啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、2-氧代氮杂环庚三烯基、噁唑烷基、环氧乙烷基(oxiranyl)、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、噻唑烷基、四氢吡喃基、硫代吗啉基、硫代吗啉基亚砜和硫代吗啉基砜。进一步的杂环及杂芳基描述于katritzky等人编著的comprehensive heterocyclic chemistry::the structure,reactions,synthesis and use of heterocyclic compounds,第1-8卷,pergamon press,n.y.(1984)中,该文献的内容据此以引用的方式整体并入。
[0133]
术语“非芳族杂环”意指含有3至10个原子、优选4至约7个碳原子的非芳族单环体系,其中环体系中的一个或多个原子是碳以外的元素,例如氮、氧或硫。代表性的非芳族杂
环基团包括吡咯烷基、2-氧代吡咯烷基、哌啶基、2-氧代哌啶基、氮杂环庚烷基、2-氧代氮杂环庚烷基、2-氧代噁唑烷基、吗啉代、3-氧代吗啉代、硫代吗啉代、1,1-二氧代硫代吗啉代、哌嗪基、四氢-2h-噁嗪基等。
[0134]
本文所用的术语“单环”表示具有一个环的分子结构。
[0135]
本文所用的术语“多环”(polycyclic/multi-cyclic)表示具有两个或更多个环的分子结构,包括但不限于稠合、桥接或螺环。
[0136]
与“保护”、“脱保护”和“受保护的”官能团相关的术语出现在本技术通篇中。这种术语是本领域技术人员熟知的,并且用在涉及用一系列试剂连续处理的过程的情况下。在这种情况下,保护基团是指在过程步骤期间用于掩蔽官能团的基团,否则该官能团将会起反应,但反应是不期望的。保护基团防止在该步骤中发生反应,但可随后被去除以暴露初始官能团。去除或“脱保护”是在其中官能团将会干扰的反应完成后进行的。因此,当如在本文描述的方法中指定一系列试剂时,普通技术人员可以很容易地设想出适合作为“保护基团”的那些基团。用于该目的的合适基团在化学领域的标准教科书中有讨论,如greene,protective groups in organic synthesis,john wiley&sons,new york(1991),该文献的内容据此以引用的方式整体并入。
[0137]
术语“烷氧基”意指通过氧连接于母体结构的直链、支链或环状构型及其组合的1至8个碳原子的基团。实例包括甲氧基、乙氧基、丙氧基、异丙氧基、环丙基氧基、环己基氧基等。低级烷氧基是指含有一至四个碳的基团。处于本专利申请的目的,烷氧基还包括亚甲二氧基和亚乙二氧基,其中每个氧原子与亚甲二氧基或亚乙二氧基基团侧接的原子、链或环键合以便形成环。因此,例如,被烷氧基取代的苯基可以是例如
[0138]
具有在杂环上的氮旁边引出的羟基基团的化合物可以“酮基”形式存在。例如,3-(2-羟基-[1,2,4]三唑并[1,5-a]吡啶-6-基)丙酸可存在为3-(2-氧代-2,3-二氢-[1,2,4]三唑并[1,5-a]吡啶-6-基)丙酸。
[0139]
术语“卤代”或“卤素”意指氟代、氯代、溴代或碘代。
[0140]
术语“取代的”或原子的“取代”意指指定原子上的一个或多个氢被选定的指定基团置换,条件是不超出指定原子的正常价态。
[0141]“未取代的”原子带有由其价态决定的所有氢原子。当取代基是酮基(即,=0)时,则原子上的两个氢被置换。取代基和/或变量的组合只有在这类组合导致产生稳定化合物的情况下才是允许的;所谓“稳定化合物”或“稳定结构”意指稳固性足以经受由反应混合物分离至有用的纯净程度并配制成有效的治疗剂的化合物。
[0142]
术语“任选取代的”用来表示基团可以在该基团的每个可取代的原子上具有取代基(包括单个原子上的不止一个取代基),条件是不超出指定原子的正常价态,且每个取代基的特质(identity)独立于其它取代基。每个残基中至多三个h原子被烷基、卤素、卤代烷基、羟基、低级烷氧基、羧基、烷氧碳酰基(也被称为烷氧基羰基)、甲酰氨基(也被称为烷基氨基羰基)、氰基、羰基、硝基、氨基、烷基氨基、二烷基氨基、巯基、烷硫基、亚砜、砜、酰基氨基、脒基、苯基、苄基、杂芳基、苯氧基、苄氧基或杂芳基氧基置换。“未取代的”原子带有由其
价态决定的所有氢原子。当取代基是酮基(即,=0)时,则原子上的两个氢被置换。取代基和/或变量的组合只有在这类组合导致产生稳定化合物的情况下才是允许的;所谓“稳定化合物”或“稳定结构”意指稳固性足以经受由反应混合物分离至有用的纯净程度并配制成有效的治疗剂的化合物。
[0143]
术语“治疗的方法”意指减轻或缓解与本文描述的病症相关的症状和/或影响。如本文所用,提及患者的“治疗”旨在包括预防。
[0144]
术语“本发明的化合物”及其等同表述旨在包括如上文描述的通式(i)、式(ia)、式(ib)和式(ic)的化合物,在允许的情况下,该表述包括前药、药学上可接受的盐和溶剂合物,例如水合物。类似地,提及中间体(无论其本身是否是要求保护的)在允许的情况下旨在包括其盐和溶剂合物。为了清楚起见,有时在允许的情况下在文中指出特定的实例,但这些实例纯粹是说明性的,并不旨在当情况允许时排除其它实例。
[0145]
术语“药学上可接受的盐”意指本发明的化合物的相对无毒的无机和有机酸加成盐和碱加成盐。这些盐可在化合物的最终分离和纯化期间原位制备。特别地,可通过单独地使游离碱形式的纯化化合物与合适的有机或无机酸反应并分离由此形成的盐来制备酸加成盐。示例性酸加成盐包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、磷酸盐、硝酸盐、乙酸盐、草酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐、甲磺酸盐、葡糖庚酸盐、乳糖醛酸盐、氨基磺酸盐、丙二酸盐、水杨酸盐、丙酸盐、亚甲基-双-b-羟基萘酸盐、龙胆酸盐、羟乙磺酸盐、二对甲苯酰酒石酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、环己基氨基磺酸盐和奎尼酸十二烷基磺酸盐等(参见例如berge等人,“pharmaceutical salts,”j.pharm.sci.,66:1-9(1977)和remington's pharmaceutical sciences,第17版,mack publishing company,easton,pa.,1985,第1418页,该文献的内容据此以引用的方式整体并入)。也可以通过单独地使酸形式的纯化化合物与合适的有机或无机碱反应并分离由此形成的盐来制备碱加成盐。碱加成盐包括药学上可接受的金属盐和胺盐。合适的金属盐包括钠、钾、钙、钡、锌、镁和铝盐。钠和钾盐是优选的。由金属碱制备合适的无机碱加成盐,所述金属碱包括例如氢化钠、氢氧化钠、氢氧化钾、氢氧化钙、氢氧化铝、氢氧化锂、氢氧化镁和氢氧化锌。由具有足以形成稳定盐的碱性的胺制备合适的胺碱加成盐,且所述胺优选包括在药物化学中经常使用的那些胺,因为它们毒性低且可接受用于医疗用途,如氨、乙二胺、n-甲基-葡糖胺、赖氨酸、精氨酸、鸟氨酸、胆碱、n,n'-二苄基乙二胺、氯普鲁卡因、二乙醇胺、普鲁卡因、n-苄基苯乙胺、二乙胺、哌嗪、三(羟甲基)-氨基甲烷、四甲基氢氧化铵、三乙胺、二苄基胺、二苯羟甲胺、脱氢枞胺、n-乙基哌啶、苄胺、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、乙胺、碱性氨基酸例如赖氨酸和精氨酸、二环己基胺等。
[0146]
如本文所用的术语“药学上可接受的前药”意指根据本发明适用的化合物的那些在合理的医学判断范围内适合与人及低等动物的组织接触使用而有不适当的毒性、刺激性、过敏反应等、与合理的有益效果/风险比相称且对于其预期用途有效的前药以及在可能的情况下本发明的化合物的两性离子形式。术语“前药”意指例如通过在血液中水解而快速体内转化以产生上式的母体化合物的化合物。可通过体内代谢裂解快速转化的官能团构成与本发明的化合物的羧基基团反应性的一类基团。它们包括但不限于诸如烷酰基(如乙酰基、丙酰基、丁酰基等)、未取代及取代的芳酰基(如苯甲酰基和取代的苯甲酰基)、烷氧基羰
基(如乙氧基羰基)、三烷基甲硅烷基(如三甲基甲硅烷基和三乙基甲硅烷基)、与二羧酸(如琥珀酰基)形成的单酯等的基团。由于根据本发明适用的化合物的可代谢裂解基团容易在体内裂解,带有这类基团的化合物充当前药。带有可代谢裂解基团的化合物具有的优点是,由于因可代谢裂解基团的存在而赋予母体化合物溶解度和/或吸收速率增加的原因,它们可表现出提高的生物利用度。以下文献中提供了前药的详尽讨论:design of prodrugs,h.bundgaard编著,elsevier(1985);methods in enzymology,k.widder等人编著,academic press,42,第309-396页(1985);a textbook of drug design and development,krogsgaard-larsen和h.bundgaard编著,第5章;“design and applications of prodrugs”第113-191页(1991);advanced drug delivery reviews,h.bundgard,8,第1-38页(1992);j.pharm.sci.,77:285(1988);nakeya等人,chem.pharm.bull.,32:692(1984);higuchi等人,“pro-drugs as novel delivery systems,”a.c.s.symposiumseries的第14卷,以及bioreversible carriers in drug design,edward b.roche编著,american pharmaceutical association and pergamon press(1987),上述文献的内容以引用的方式整体并入本文。前药的实例包括但不限于本发明的化合物中的醇和胺官能团的乙酸酯、甲酸酯和苯甲酸酯衍生物。
[0147]
术语“溶剂合物”是指固体状态的式(i)、式(ia)、式(ib)和式(ic)的化合物,其中合适溶剂的分子结合在晶格中。用于治疗性施用的合适溶剂在所施用的剂量下是生理上可耐受的。乙醇和水是用于治疗性施用的合适溶剂的实例。当水是溶剂时,溶剂合物被称为水合物。一般来说,通过将化合物溶解在适当溶剂中并通过冷却或使用抗溶剂分离溶剂合物的方式来形成溶剂合物。通常在环境条件下将溶剂合物干燥或共沸。
[0148]
术语“治疗有效量”意指描述有效产生所需治疗效果的本发明的化合物的量。所述的量通常根据适当地在普通技术人员鉴于本文提供的描述以确定和考虑范围内的若干因素而变化。这些包括但不限于:具体的受试者以及其年龄、体重、身高、一般身体状况和病史;所用的具体化合物以及配制化合物的载体和为化合物选定的施用途径;及所治疗的病状的性质和严重程度。
[0149]
术语“药物组合物”意指包含式(i)、式(ia)、式(ib)和式(ic)的化合物和至少一种组分的组合物,所述至少一种组分包括药学上可接受的载体、稀释剂、佐剂、赋形剂或媒介物,如防腐剂、填充剂、崩解剂、润湿剂、乳化剂、悬浮剂、甜味剂、调味剂、芳香剂、抗菌剂、抗真菌剂、润滑剂和分散剂,这取决于施用方式的性质和剂型。悬浮剂的实例包括乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶或这些物质的混合物。可通过各种抗菌剂和抗真菌剂确保防止微生物的作用,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等。还可取的是包括等渗剂,例如糖、氯化钠等。可通过使用延迟吸收的试剂来延长可注射药物形式的吸收,例如使用单硬脂酸铝和明胶。合适载体、稀释剂、溶剂或媒介物的实例包括水、乙醇、多元醇、其合适的混合物、植物油(如橄榄油)和可注射的有机酯,如油酸乙酯。赋形剂的实例包括乳糖、牛奶糖、柠檬酸钠、碳酸钙和磷酸二钙。崩解剂的实例包括淀粉、藻酸和某些复合硅酸盐。润滑剂的实例包括硬脂酸镁、月桂基硫酸钠、滑石以及高分子量聚乙二醇。
[0150]
术语“药学上可接受的”意指在合理的医学判断范围内适合与人和低等动物的细胞接触使用而没有不适当的毒性、刺激性、过敏反应等并且与合理的有益效果/风险比相
称。
[0151]
术语“药学上可接受的剂型”意指本发明的化合物的剂型,并且包括例如片剂、糖衣丸、粉剂、酏剂、糖浆剂、液体制剂,包括悬浮液、喷雾剂、吸入剂片剂、锭剂、乳液、溶液、颗粒、胶囊和栓剂,以及用于注射的液体制剂,包括脂质体制剂。技术和制剂通常可见于remington's pharmaceutical sciences,mack publishing co.,easton,pa.,最新版。
[0152]
本文描述的化合物可含有一个或多个不对称中心,因此可产生对映异构体、非对映异构体及其它立体异构形式。每个手性中心可按绝对立体化学定义为(r)-或(s)-。此技术旨在包括所有这些可能的异构体以及它们的混合物,包括外消旋和光学纯形式。光学活性的(r)-和(s)-、(-)-和(+)-或(d)-和(l)-异构体可使用手性合成子或手性试剂制备或采用常规的技术拆分。当本文描述的化合物含有烯属双键或其它几何不对称中心时,除另有说明外,化合物旨在包括e和z几何异构体两者。同样,也旨在包括所有的互变异构形式。
[0153]
此技术还设想了本文公开的化合物的任何含碱性氮的基团的“季铵化”。碱性氮可用本领域普通技术人员已知的任何试剂季铵化,包括例如低级烷基卤化物,如甲基、乙基、丙基和丁基氯化物、溴化物和碘化物;硫酸二烷基酯,包括硫酸二甲酯、硫酸二乙酯、硫酸二丁酯和硫酸二戊酯;长链卤化物,如癸基、月桂基、肉豆蔻基和硬脂基氯化物、溴化物和碘化物;和芳烷基卤化物,包括苄基和苯乙基溴化物。可通过这种季铵化获得水或油溶性或可分散产物。
[0154]
在一些取代基的表征中叙述到,某些取代基可组合以形成环。除另有说明外,这类环旨在可表现出各种不饱和度(从完全饱和到完全不饱和),可包括杂原子,并且可被低级烷基或烷氧基取代。
[0155]
可根据已知的方法制备本发明的化合物。例如,可根据下面概述的方案1和方案2制备其中s为0的本发明的化合物。
[0156]
方案1
[0157][0158]
羧酸衍生物(1)与胺r1x-nh2(2)的反应导致形成化合物(3)。该反应可在多种溶剂中进行,例如在二氯甲烷(ch2cl2)、四氢呋喃(thf)、二甲基甲酰胺(dmf)或其它这类溶剂中或在这类溶剂的混合物中进行。在反应过程期间,可通过合适的保护基团保护氨基酸或肽片段的反应组上的不参与的羧酸或胺,如果需要的话可在稍后的时间将所述保护基团选择性地除去。这些基团及其选择和化学性质的详细描述包括在“the peptides,第3卷”,gross
和meinenhofer编著,academic press,new york,1981中,该文献的内容据此以引用的方式整体并入。因此,适用于氨基基团的保护性基团为苄氧羰基(cbz)、叔丁氧羰基(t-boc)、2,2,2-三氯乙氧羰基(troc)、叔戊氧羰基、4-甲氧基苄氧羰基、2-(三氯甲硅烷基)乙氧羰基、9-芴基甲氧羰基(fmoc)、邻苯二甲酰基、乙酰基(ac)、甲酰基、三氟乙酰基等。脱保护后,胺(4)与r
4-lg(5)(其中lg是合适的离去基团)反应,形成最终产物(6)。
[0159]
方案2
[0160][0161]
或者,可首先将带有保护基团(pg)的羧酸衍生物(1)脱保护,然后与r
4-lg(5)反应(其中lg是合适的离去基团)形成化合物(8)。然后可使化合物(8)与胺(2)(即r1x-nh2)反应,形成最终产物(6)。
[0162]
可根据下面概述的一般方案(方案3-7)制备其中s为1的本发明的化合物。
[0163]
方案3
[0164][0165]
可通过氨基酸的逐步偶联来制备本发明的化合物。偶联反应在诸如二氯甲烷(ch2cl2)、四氢呋喃(thf)、二甲基甲酰胺(dmf)的溶剂或其它这类溶剂中进行。在偶联过程期间,可通过合适的保护基团保护氨基酸或肽片段的反应组上的不参与的羧酸或胺,如果
需要的话可在稍后的时间将所述保护基团选择性地除去。这些基团及其选择和化学性质的详细描述包括在“the peptides,第3卷”,gross和meinenhofer编著,academic press,new york,1981中,该文献的内容据此以引用的方式整体并入。因此,适用于氨基基团的保护性基团为苄氧羰基(cbz)、叔丁氧羰基(t-boc)、2,2,2-三氯乙氧羰基(troc)、叔戊氧羰基、4-甲氧基苄氧羰基、2-(三氯甲硅烷基)乙氧羰基、9-芴基甲氧羰基(fmoc)、邻苯二甲酰基、乙酰基(ac)、甲酰基、三氟乙酰基等。带有保护基团(pg)的羧酸(9)与胺(4)偶联,形成化合物(10)。脱保护反应后,使化合物(11)与r
4-lg(5)反应,形成最终产物(12)。
[0166]
方案4
[0167][0168]
或者,可首先使带有保护基团(pg)的羧酸(13)与r
4-lg(其中lg是合适的离去基团)(5)反应,形成化合物(14)。然后,在脱保护反应后,可使酸(15)与胺(4)偶联,形成最终产物(12)。
[0169]
方案5
[0170][0171]
或者,可首先使酸(15)与氨基酸(16)偶联,形成化合物(17)。脱保护反应后,可使酸(18)与胺(2)(即r1x-nh2)反应,形成最终产物(12)。
[0172]
方案6
[0173][0174]
或者,可使氨基酸(9a)与氨基酸(16a)偶联,形成化合物(19)。在脱保护反应之后,可使酸(20)与r
4-lg(其中lg是合适的离去基团)(5)反应,形成化合物(21)。在脱保护反应之后,可使酸(22)与胺(2)(即r1x-nh2)偶联,形成最终产物(12)。
[0175]
方案7
[0176][0177]
或者,在脱保护反应之后,可使酸(23)与胺(2)(即r1x-nh2)偶联,形成化合物(10a)。在脱保护反应之后,然后可使胺(11)与r
4-lg(其中lg是合适的离去基团)(5)反应,形成最终产物(12)。
[0178]
根据已知的方法可以很容易地将其中y是o的本发明的化合物转化为其中y是s的其类似物。例如通过使用劳森试剂(lawesson’s reagent)。
[0179]
本发明的另一方面涉及式(ia)、式(ib)或式(ic)的化合物:
[0180][0181]
其中
[0182]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0183]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0184]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0185]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0186]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0187]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0188]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0189]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0190]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0191]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0192]
x是—(ch2)q—、—o—或—(cd2)q—;
[0193]
y是o或s;
[0194]
k是1、2或3;
[0195]
m是0、1、2、3、4或5;
[0196]
n是0、1、2或3;
[0197]
q是0、1或2;且
[0198]
s是0或1;
[0199]
或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0200]
根据本发明的化合物包括式(i)、式(ia)、式(ib)和式(ic)的化合物。在一个实施方案中,根据本发明的化合物是式(i)的化合物。在另一实施方案中,根据本发明的化合物是式(ia)、式(ib)或式(ic)的化合物。
[0201]
在一个实施方案中,化合物具有下式:
[0202][0203]
在另一实施方案中,化合物具有下式
[0204][0205]
一个实施方案涉及本发明的化合物,其中r1选自选自
且
[0206]r11
选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基。
[0207]
另一实施方案涉及本发明的化合物,其中r2选自h、me、
[0208]
另一实施方案涉及本发明的化合物,其中r2选自me、
[0209]
一个实施方案涉及本发明的化合物,其中r3选自—ch2ome、—ch2c(o)oh、—ch2c(o)obn、—(ch2)2c(o)obn、—(ch2)2c(o)oh、
[0210]
另一实施方案涉及本发明的化合物,其中r3选自—ch2ome、
[0211]
另一实施方案涉及本发明的化合物,其中r4选自h、三氟乙酰基、选自h、三氟乙酰基、
[0212]
l是0、1、2、3或4;
[0213]
m是0、1、2、3、4或5;
[0214]
n是0、1、2或3;且
[0215]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0216]
又一实施方案涉及本发明的化合物,其中r4选自三氟乙酰基、
[0217][0218]
l是0、1、2、3或4;
[0219]
m是0、1、2、3、4或5;
[0220]
n是0、1、2或3;且
[0221]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0222]
一个实施方案涉及本发明的化合物,其中所述化合物具有选自以下的结构:
[0223]
[0224]
[0225]
[0226]
[0227][0228]
另一实施方案涉及本发明的化合物,其中所述化合物具有选自以下的结构:
[0229]
[0230][0231]
虽然有可能将本发明的化合物作为原料化学品施用,但通常优选将它们作为药物组合物的一部分提供。因此,本发明的另一方面是含有治疗有效量的本发明的化合物或其药学上可接受的盐或溶剂合物和药学上可接受的载体的药物组合物。载体在与制剂的其它成分相容的意义上必须是“可接受的”,并且对其接受者无害。
[0232]
根据本发明的化合物包括式(i)、式(ia)、式(ib)和式(ic)的化合物。在一个实施方案中,根据本发明的化合物是式(i)的化合物。在另一实施方案中,根据本发明的化合物是式(ia)、式(ib)或式(ic)的化合物。
[0233]
在实施本发明的方法中,可采用本领域中标准的任何方法施用适合于治疗受试者的药剂。药剂可以其适当的递送形式口服、皮内、肌内、腹膜内、静脉内、皮下或鼻内施用。本发明的组合物可单独施用或与合适的药物载体一起施用,并且可以是固体或液体形式的,如片剂、胶囊、粉剂、溶液、悬浮液或乳液。
[0234]
本发明的药剂可口服施用,例如与惰性稀释剂一起或与可吸收的食用载体一起口服施用,或者可以将其包封在硬或软壳胶囊中,或者可以将其压制成片剂,或者可以将其直接与饮食的食品合并。也可将本发明的药剂掺入诸如经时释放胶囊或纳米管的装置内以经
时释放方式施用。这类装置提供了相对时间和剂量的灵活性。对于口服治疗施用,可将本发明的药剂与赋形剂掺在一起并以片剂、胶囊、酏剂、悬浮液、糖浆剂等形式使用。这类组合物和制剂应含有至少0.1%的药剂,尽管较低的浓度可以是有效的,并且实际上是最佳的。当然,药剂在这些组合物中的百分比是可以变化的,并且可方便地介于单位的重量的约2%至约60%之间。本发明的药剂在这类治疗适用的组合物中的量使得将获得合适的剂量。
[0235]
还特别设想了本发明的药剂的口服剂型。可将药剂化学改性以使得衍生物的口服递送有效。一般地,设想的化学改性是将至少一个部分连接于组成分子本身,其中所述部分允许(a)抑制蛋白质水解;和(b)从胃或肠吸收进入血流。还期望提高一种或多种组分的总体稳定性并增加体内循环时间。这类部分的实例包括:聚乙二醇、乙二醇和丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮和聚脯氨酸。(abuchowski和davis,“soluble polymer-enzyme adducts,”enzymes as drugs中,hocenberg和roberts编著,wiley-interscience,new york,n.y.,第367-383页(1981),该文献的内容据此以引用的方式整体并入)。可用的其它聚合物为聚-1,3-二氧戊环和聚-1,3,6-三氧杂环辛烷。如上所指,优选用于药物用途的是聚乙二醇部分。
[0236]
片剂、胶囊等还可含有粘结剂,如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,如磷酸二钙;崩解剂,如玉米淀粉、马铃薯淀粉、海藻酸;润滑剂,如硬脂酸镁;和甜味剂,如蔗糖、乳糖、三氯蔗糖或糖精。当剂量单位形式是胶囊时,除了上述类型的材料之外其还可含有液体载体,如脂肪油。
[0237]
各种其它材料可作为包衣存在或用以改变剂量单位的物理形式。比如,片剂可用虫胶、糖或这两者包衣。除了活性成分外,糖浆剂还可含有作为甜味剂的蔗糖、作为防腐剂的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、染料和诸如樱桃或橙香料的调味剂。
[0238]
也可肠胃外施用本发明的药剂。可在合适地与诸如羟丙基纤维素的表面活性剂混合的水中制备药剂的溶液或悬浮液。也可在甘油、液体聚乙二醇及其在油中的混合物中制备分散体。示例的油为石油、动物、植物或合成来源的那些,例如花生油、大豆油或矿物油。一般来说,水、盐水、葡萄糖水溶液及相关的糖溶液和诸如丙二醇或聚乙二醇的二醇是优选的液体载体,特别是对于可注射溶液来说。在储存和使用的通常条件下,这些制剂含有防腐剂以防止微生物的生长。
[0239]
适合于可注射用途的药物形式包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉剂。在所有情况下,所述形式必须是无菌的并且必须在达到存在能容易注射的程度上是流动性的。其必须在制造和储存条件下稳定并且必须以防止诸如细菌和真菌的微生物的污染作用的方式保存。载体可以是含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇)、其合适的混合物和植物油的溶剂或分散介质。
[0240]
当期望全身性递送本发明的药剂时,可将它们配制成用于通过注射肠胃外施用,例如通过推注或连续输注。可例如在加有防腐剂的安瓿或多剂量容器中以单位剂型提供用于注射的制剂。组合物可采取诸如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且可含有配制剂,如悬浮剂、稳定剂和/或分散剂。
[0241]
也可使用诸如medtronic,northridge,ca描述的输注泵装置实现本发明的药剂的腹膜内或鞘内施用。这类装置允许连续输注所需化合物,从而避免多次注射和多次操作。
[0242]
除了先前描述的制剂外,也可将药剂配制为储药制剂。这类长效制剂可用合适的
聚合物或疏水材料(例如作为可接受的油中的乳液)或离子交换树脂配制,或配制为微溶性衍生物,例如配制为微溶盐。
[0243]
也可以气雾剂的形式对气道直接施用本发明的药剂。为了用作气雾剂,可将溶液或悬浮液中的本发明的药剂与合适的推进剂(例如烃推进剂,如丙烷、丁烷或异丁烷)与常规的佐剂一起包装在加压气雾剂容器中。也可以非加压形式施用本发明的药剂,如在喷雾器或雾化器中施用。
[0244]
用于治疗癌症或病原体感染的本发明的组合物的有效剂量根据许多不同的因素而有所不同,这些因素包括癌症的类型和阶段或病原体感染的类型、施用的方式、靶位点、患者的生理状态、所施用的其它药物或疗法以及相对于其它医疗并发症患者的身体状况。需要滴定治疗剂量以优化安全性和功效。
[0245]
可改变本发明的组合物中活性成分的百分比,有必要使其构成一定的比例,以便获得合适的剂量。显而易见地,可在大致相同的时间施用若干单位剂型。所采用的剂量将由医师确定,且取决于所需的治疗效果、施用途径和治疗的持续时间以及患者的病状。在成人中,剂量通常为通过吸入每天约0.01至约100mg/kg体重、优选约0.01至约10mg/kg体重,通过口服施用每天约0.01至约100mg/kg体重、优选0.1至70mg/kg体重、更具体为0.1至10mg/kg体重,以及通过静脉内施用每天约0.01至约50mg/kg体重、优选0.01至10mg/kg体重。在每种具体情况下,将根据对待治疗的受试者所不同的因素来确定剂量,如年龄、体重、一般健康状况以及能影响药物产品功效的其它特征。
[0246]
为了获得所需的治疗效果,可根据需要频繁施用根据本发明的产品。一些患者可能对较高或较低剂量快速反应,并且可能发现弱得多的维持剂量是足够的。对于其他患者,根据每位具体患者的生理需要,可能需要以每天1至4个剂量的速率进行长期治疗。一般地,可每天1至4次口服施用活性产品。不用说,对于其他患者,将有必要规定每天不超过一或两个剂量。
[0247]
本发明的另一方面涉及治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法。这种方法包括对有需要的受试者施用式(i)的化合物:
[0248][0249]
其中
[0250]
l是—(cr3r
x
)
p
—;
[0251]
m是—(cr2ry)r—;
[0252]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0253]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳
基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0254]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0255]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0256]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0257]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0258]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0259]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0260]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0261]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0262]
x是—(ch2)q—、—o—或—(cd2)q—;
[0263]
y是o或s;
[0264]
k是1、2或3;
[0265]
m是0、1、2、3、4或5;
[0266]
n是0、1、2或3;
[0267]
p是1或2;
[0268]
q是0、1或2;
[0269]
r是1或2;且
[0270]
s是0或1;
[0271]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3。
[0272]
本发明的又一方面涉及治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法。这种方法包括对有需要的受试者施用式(ia)、式(ib)或式(ic)的化合物:
[0273][0274]
其中
[0275]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0276]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0277]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0278]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0279]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0280]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0281]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0282]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0283]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0284]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0285]
x是—(ch2)q—、—o—或—(cd2)q—;
[0286]
y是o或s;
[0287]
k是1、2或3;
[0288]
m是0、1、2、3、4或5;
[0289]
n是0、1、2或3;
[0290]
q是0、1或2;且
[0291]
s是0或1。
[0292]
在一个实施方案中,治疗自身免疫性病症。自身免疫性病症选自关节炎、结肠炎、多发性硬化症、狼疮、全身性硬化症和斯耶格伦综合征(syndrome)。或者,自身免疫性病症选自关节炎、结肠炎、多发性硬化症和狼疮。
[0293]
在另一实施方案中,为移植器官或组织提供免疫抑制。免疫抑制用于预防移植排斥和移植物抗宿主病。
[0294]
在另一实施方案中,治疗炎性病症。炎性病症是克罗恩氏病和溃疡性结肠炎。或者,炎性病症是克罗恩氏病。
[0295]
在又一实施方案中,治疗癌症。癌症选自肿瘤性病症、血液恶性肿瘤和淋巴细胞恶性肿瘤。
[0296]
本文还包括以下实施方案:
[0297]
实施方案1.一种式(i)的化合物:
[0298][0299]
其中
[0300]
l是—(cr3r
x
)
p
—;
[0301]
m是—(cr2ry)r—;
[0302]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0303]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0304]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0305]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0306]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0307]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0308]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0309]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0310]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0311]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0312]
x是—(ch2)q—、—o—或—(cd2)q—;
[0313]
y是o或s;
[0314]
k是1、2或3;
[0315]
m是0、1、2、3、4或5;
[0316]
n是0、1、2或3;
[0317]
p是1或2;
[0318]
q是0、1或2;
[0319]
r是1或2;且
[0320]
s是0或1;
[0321]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3,或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0322]
实施方案2.根据实施方案1所述的化合物,其具有下式:
[0323][0324]
实施方案3.根据实施方案1所述的化合物,其中r1选自选自选自选自且
[0325]r11
选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基。
[0326]
实施方案4.根据实施方案1所述的化合物,其中r2选自h、me、—ch2(me)2、—
ch2ome、
[0327]
实施方案5.根据实施方案1所述的化合物,其中r3选自—ch2ome、—ch2c(o)oh、—(ch2)2c(o)obn、—(ch2)2c(o)oh、—ch2c(o)obn、
[0328]
实施方案6.根据实施方案1所述的化合物,其中r4选自h、三氟乙酰基、选自h、三氟乙酰基、
[0329]
l是0、1、2、3或4;
[0330]
m是0、1、2、3、4或5;
[0331]
n是0、1、2或3;且
[0332]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0333]
实施方案7.根据实施方案1所述的化合物,其中所述式(i)的化合物选自:
[0334]
[0335]
[0336]
[0337][0338]
实施方案8.一种治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法,所述方法包括:
[0339]
对有需要的所述受试者施用式(i)的化合物:
[0340][0341]
其中
[0342]
l是—(cr3r
x
)
p
—;
[0343]
m是—(cr2ry)r—;
[0344]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0345]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0346]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7、—(ch2)mc(o)oh和—(ch2)mc(o)obn;
[0347]
r4选自h、—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0348]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0349]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0350]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0351]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0352]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0353]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0354]
x是—(ch2)q—、—o—或—(cd2)q—;
[0355]
y是o或s;
[0356]
k是1、2或3;
[0357]
m是0、1、2、3、4或5;
[0358]
n是0、1、2或3;
[0359]
p是1或2;
[0360]
q是0、1或2;
[0361]
r是1或2;且
[0362]
s是0或1;
[0363]
附带条件是当s为0时,则r是2;且当s为1时,则r+p≥3。
[0364]
实施方案9.如实施方案8所述的方法,其中所述式(i)的化合物具有下式:
[0365][0366]
实施方案10.如实施方案8所述的方法,其中r1选自选自
且
[0367]r11
选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基。
[0368]
实施方案11.如实施方案8所述的方法,其中r2选自h、me、—ch2(me)2、—ch2ome、
[0369]
实施方案12.如实施方案8所述的方法,其中r3选自—ch2ome、—ch2c(o)oh、—ch2c(o)obn、—(ch2)2c(o)obn、—(ch2)2c(o)oh、
[0370]
实施方案13.如实施方案8所述的方法,其中r4选自h、三氟乙酰基、选自h、三氟乙酰基、
[0371]
l是0、1、2、3或4;
[0372]
m是0、1、2、3、4或5;
[0373]
n是0、1、2或3;且
[0374]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0375]
实施方案14.如实施方案8所述的方法,其中所述式(i)的化合物选自:
[0376]
[0377]
[0378]
[0379][0380]
实施方案15.如实施方案8所述的方法,其中治疗自身免疫性病症,所述自身免疫性病症选自关节炎、结肠炎、多发性硬化症、狼疮、全身性硬化症和斯耶格伦综合征。
[0381]
实施方案16.如实施方案8所述的方法,其中为移植器官或组织提供免疫抑制,所述免疫抑制用于预防移植排斥和移植物抗宿主病。
[0382]
实施方案17.如实施方案8所述的方法,其中治疗炎性病症,所述炎性病症是克罗恩氏病和溃疡性结肠炎。
[0383]
实施方案18.如实施方案8所述的方法,其中治疗癌症,所述癌症选自肿瘤性病症、血液恶性肿瘤和淋巴细胞恶性肿瘤。
[0384]
实施方案19.一种药物组合物,其包含治疗有效量的根据实施方案1所述的化合物和药学上可接受的载体。
[0385]
实施方案20.一种式(ia)、式(ib)或式(ic)的化合物:
[0386][0387]
其中
[0388]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0389]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0390]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0391]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0392]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0393]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0394]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0395]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0396]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0397]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0398]
x是—(ch2)q—、—o—或—(cd2)q—;
[0399]
y是o或s;
[0400]
k是1、2或3;
[0401]
m是0、1、2、3、4或5;
[0402]
n是0、1、2或3;
[0403]
q是0、1或2;且
[0404]
s是0或1;
[0405]
或其氧化物、其药学上可接受的盐、其溶剂合物或其前药。
[0406]
实施方案21.根据实施方案20所述的化合物,其具有下式:
[0407][0408]
实施方案22.根据实施方案20所述的化合物,其中r1选自选自且
[0409]r11
选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基。
[0410]
实施方案23.根据实施方案20所述的化合物,其中r2选自me、—ch2(me)2、—
ch2ome、
[0411]
实施方案24.根据实施方案20所述的化合物,其中r3选自—ch2ome、
[0412]
实施方案25.根据实施方案20所述的化合物,其中r4选自三氟乙酰基、选自三氟乙酰基、
[0413]
l是0、1、2、3或4;
[0414]
m是0、1、2、3、4或5;
[0415]
n是0、1、2或3;且
[0416]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0417]
实施方案26.根据实施方案20所述的化合物,其中所述式(ia)、式(ib)或式(ic)的化合物选自:
[0418]
[0419][0420]
实施方案27.一种治疗受试者中的癌症、免疫病症、自身免疫性病症、神经变性病症或炎性病症或者用于为受试者中的移植器官或组织提供免疫抑制的方法,所述方法包括:
[0421]
对有需要的所述受试者施用式(ia)、式(ib)或式(ic)的化合物:
[0422][0423]
其中
[0424]
r1选自单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环,其中单环和双环芳基、联苯基、单环和双环杂芳基、单环和双环杂环基以及单环和双环非芳族杂环可任选地被在每次出现时独立地选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0425]
r2在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0426]
r3在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5和—(ch2)mc(o)nr6r7;
[0427]
r4选自—c(o)(ch2)nph、—c(o)ch2nr6r7、—so2ar、—so2c
1-6
烷基、—so2c
3-6
环烷基、—c(o)(ch2)nhet、—c(o)c(o)het、—c(o)c
1-6
烷基、—c(o)oc
1-6
烷基、—c(o)cf3、杂芳基和—(ch2)nnr6r7,其中芳基(ar)和杂芳基(het)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0428]
r5选自c
1-6
烷基、c
1-6
烷氧基、非芳族杂环、—nr6r7和—cr8r9;
[0429]
r6、r7、r8和r9各自独立地选自h、d、c
1-6
烷基和—(ch2)koh;
[0430]
或者r6和r7与它们所连接的氮合起来形成吗啉环;
[0431]
或者r8和r9与它们所连接的碳合起来形成氧杂环丁烷环;
[0432]rx
在每次出现时独立地选自h、d、—ch2oc
1-6
烷基、—(ch2)mc(o)nhr5、—(ch2)mc(o)nr6r7和—ch2c(o)r5;
[0433]ry
在每次出现时独立地选自h、d、c
1-6
烷基、—ch2oc
1-6
烷基、—ch2ar和—ch2杂芳基,其中芳基(ar)可任选地被在每次出现时独立地选自卤素、氰基、c
1-6
烷基和c
1-6
烷氧基的取代基取代1至3次;
[0434]
x是—(ch2)q—、—o—或—(cd2)q—;
[0435]
y是o或s;
[0436]
k是1、2或3;
[0437]
m是0、1、2、3、4或5;
[0438]
n是0、1、2或3;
[0439]
q是0、1或2;且
[0440]
s是0或1。
[0441]
实施方案28.如实施方案27所述的方法,其中所述式(ia)、式(ib)或式(ic)的化合物具有下式:
[0442]
[0443]
实施方案29.如实施方案27所述的方法,其中r1选自选自选自且
[0444]r11
选自卤素、氰基、—cf3、c
1-6
烷基和c
1-6
烷氧基。
[0445]
实施方案30.如实施方案27所述的方法,其中r2选自me、—ch2(me)2、—ch2ome、
[0446]
实施方案31.如实施方案27所述的方法,其中r3选自—ch2ome、
[0447]
实施方案32.如实施方案27所述的方法,其中r4选自三氟乙酰基、选自三氟乙酰基、
[0448]
l是0、1、2、3或4;
[0449]
m是0、1、2、3、4或5;
[0450]
n是0、1、2或3;且
[0451]
r选自h、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。
[0452]
实施方案33.如实施方案27所述的方法,其中所述式(ia)、式(ib)或式(ic)的化合物选自:
[0453]
[0454][0455]
实施方案34.如实施方案27所述的方法,其中治疗自身免疫性病症,所述自身免疫性病症选自关节炎、结肠炎、多发性硬化症和狼疮。
[0456]
实施方案35.如实施方案27所述的方法,其中为移植器官或组织提供免疫抑制,所述免疫抑制用于预防移植排斥和移植物抗宿主病。
[0457]
实施方案36.如实施方案27所述的方法,其中治疗炎性病症,所述炎性病症是克罗恩氏病。
[0458]
实施方案37.如实施方案27所述的方法,其中治疗癌症,所述癌症选自肿瘤性病症、血液恶性肿瘤和淋巴细胞恶性肿瘤。
[0459]
实施方案38.一种药物组合物,其包含治疗有效量的根据实施方案20所述的化合物和药学上可接受的载体。
[0460]
实施例
[0461]
提供以下实施例以说明本发明的实施方案,但绝不旨在限制其范围。
[0462]
实施例1
–
hatu偶联的一般程序
[0463]
在氩气氛下将羧酸(1.0当量)、o-(7-氮杂苯并三唑-1-基)-n,n,n,n'-四甲基脲六氟磷酸盐(hatu)(1.2当量)和dmf(1.0当量)中的1-羟基-7-氮杂苯并三唑(hoat)0.6m溶解在dmf中。将溶液冷却到0℃并添加胺。在0℃下搅拌5分钟后,添加h
ü
nig碱(3-4当量)。将反应混合物在0℃下搅拌1小时。反应完成(1小时,通过lcms监测)后,将水(10ml)添加到反应混合物中并搅拌30分钟。通过乙酸乙酯萃取或过滤沉淀物来分离产物。
[0464]
实施例2
–
edc偶联的一般程序
[0465]
在氩气氛下将羧酸(1.0当量)、n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺盐酸盐(edc)(1.2当量)和1-羟基苯并三唑(hobt)(1.3当量)溶解在dmf中。将溶液冷却到0℃并添加叔丁胺。在0℃下搅拌5分钟后,添加h
ü
nig碱(2-3当量)。使反应混合物缓慢升温至室温并在室温下搅拌过夜。
[0466]
实施例3
–
boc-脱保护的一般程序
[0467]
将底物溶解在二氯甲烷中并将溶液冷却到0℃。伴随持续搅拌在0℃下向溶液中滴加三氟乙酸(相对于二氯甲烷为20%v/v)。使混合物缓慢升温至室温(历时1小时)并搅拌,直到反应完成(通过lcms监测)。蒸发过量的三氟乙酸和二氯甲烷并在真空下干燥粗品。
[0468]
实施例4
–
o-脱苄基的一般程序
[0469]
将底物溶解在甲醇中。小心地添加碳载钯(10%)。除去来自烧瓶的残余空气并使用氢气球在氢气氛下将混合物室温搅拌3-4小时。反应完成后,将混合物通过硅藻土过滤。将滤液蒸发并在真空下干燥,得到产物。
[0470]
实施例5
–
胺的n-磺酰胺制备的一般程序
[0471]
将伯胺(通常为tfa盐)溶解在二氯甲烷中。将溶液冷却到0℃并添加三乙胺(2.0-3.0当量)。向溶液中一次性添加磺酰氯(1.5当量)并将反应混合物升温至室温(经15分钟)。反应完成(2-3小时)后,将二氯甲烷蒸发并通过hplc纯化粗品,得到纯产物。
[0472]
实施例6
–
(s)-(4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基甲酸叔丁酯(pks2241,pks2261)的制备
[0473][0474]
以1.5mmol规模按照hatu介导的boc-l-β-高丙氨酸和1-萘甲胺的偶联的一般方案合成标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(490mg,95%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.38(t,j=5.7hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.86
–
7.84(m,1h),7.56
–
7.52(m,2h),7.48
–
7.42(m,2h),6.72(d,j=8.3hz,1h),4.76
–
4.68(m,2h),3.89
–
3.80(m,1h),2.35(dd,j=13.9,5.7hz,1h),2.18(dd,j=13.9,8.2hz,1h),1.37(s,9h),1.01(d,j=6.5hz,3h)。
[0475]
实施例7
–
(s)-3-氨基-n-(萘-1-基甲基)丁酰胺2,2,2-三氟乙酸盐(pks2245,pks2262)的制备
[0476][0477]
按照pks2261(480mg,1.40mmol)的boc-脱保护的一般方案制备标题化合物。将粗黄色糊状物与乙醚一起研磨并保持静置过夜。将白色固体过滤并干燥,得到产物(480mg,96%)。1h nmr(500mhz,dmso-d6)δ8.69(t,j=5.7hz,1h),8.06
–
8.05(m,1h),7.97
–
7.95(m,1h),7.88(dd,j=7.4,2.0hz,1h),7.80(bs,3h),7.58
–
7.53(m,2h),7.50
–
7.45(m,2h),4.79(dd,j=15.0,5.7hz,1h),4.73(dd,j=15.0,5.5hz,1h),3.57
–
3.50(m,1h),2.51
–
2.43(m,2h),1.17(d,j=6.5hz,3h)。
[0478]
实施例8
–
(s)-3-((叔丁氧羰基)氨基)-4-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-4-氧代丁酸苄酯(pks2265)的制备
[0479][0480]
按照hatu介导的boc-asp(obn)-oh(142.3mg,0.44mg)和pks2262(143mg,0.40mmol)的偶联的一般方案合成标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(202mg,92%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.41(t,j=5.8hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.86(d,j=8.3hz,1h),7.84(d,j=7.7hz,1h),7.56
–
7.51(m,2h),7.47
–
7.42(m,2h),7.36
–
7.29(m,5h),7.11(d,j=8.3hz,1h),5.10
–
5.05(m,2h),4.76
–
4.68(m,2h),4.30
–
4.25(m,1h),4.14
–
4.08(m,1h),2.73
–
2.69(m,1h),2.57(dd,j=16.1,8.8hz,1h),2.34(dd,j=14.1,5.6hz,1h),2.23(dd,j=14.1,7.5hz,1h),1.37(s,9h),1.03(d,j=6.6hz,3h)。
[0481]
实施例9
–
(s)-3-((叔丁氧羰基)氨基)-4-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-4-氧代丁酸(pks2267)的制备
[0482][0483]
按照pks2265(202mg,0.37mmol)的o-脱苄基方案合成标题化合物。分离出产物(168mg,定量),为白色固体。1h nmr(500mhz,dmso-d6)δ8.44
–
8.41(m,1h),8.06
–
8.04(m,1h),7.95
–
7.94(m,1h),7.85(d,j=8.0hz,1h),7.81(d,j=8.3hz,1h),7.57
–
7.52(m,2h),7.48
–
7.43(m,2h),7.02(d,j=8.2hz,1h),4.75(dd,j=15.1,5.7hz,1h),4.70(dd,j=15.1,5.7hz,1h),4.21
–
4.16(m,1h),4.13
–
4.08(m,1h),2.58(dd,j=16.4,5.1hz,1h),2.43(dd,j=16.4,8.5hz,1h),2.35(dd,j=14.1,5.4hz,1h),2.23(dd,j=14.1,7.7hz,1h),1.38(s,9h),1.03(d,j=6.6hz,3h)。
[0484]
实施例10
–
制备((s)-4-(叔丁基氨基)-1-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-1,4-二氧代丁烷-2-基)氨基甲酸叔丁酯(pks2247,pks2272)
[0485][0486]
按照edc介导的pks2267(168mg,0.367mmol)和叔丁胺(58μl,0.551mmol)的偶联的一般方案合成标题化合物。出现白色沉淀物,将其过滤,用水洗涤并在空气中干燥,得到产物(170mg,90%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.43(t,j=5.6hz,1h),8.06
–
8.04
(m,1h),7.95
–
7.94(m,1h),7.86
–
7.81(m,2h),7.57
–
7.52(m,2h),7.48
–
7.43(m,2h),7.34(s,1h),6.76(d,j=8.3hz,1h),4.75(dd,j=15.1,5.7hz,1h),4.70(dd,j=15.1,5.5hz,1h),4.19
–
4.07(m,2h),2.36
–
2.21(m,4h),1.37(s,9h),1.22(s,9h),1.03(d,j=6.6hz,3h)。
[0487]
实施例11
–
(s)-2-氨基-n
4-(叔丁基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)琥珀酰胺2,2,2-三氟乙酸盐(pks2248)的制备
[0488][0489]
按照pks2272(62mg,0.12mmol)的boc-脱保护的一般方案制备标题化合物。将粗品用乙醚处理并保持静置3小时。将白色固体过滤并干燥,得到产物(60mg,95%)。1h nmr(500mhz,dmso-d6)δ8.47(t,j=5.6hz,1h),8.32(d,j=7.9hz,1h),8.06
–
8.03(m,4h),7.96
–
7.95(m,1h),7.87
–
7.85(m,1h),7.80(s,1h),7.57
–
7.53(m,2h),7.49
–
7.43(m,2h),4.78(dd,j=15.1,5.8hz,1h),4.69(dd,j=15.1,5.4hz,1h),4.21
–
4.13(m,1h),3.95(m,1h),2.60(dd,j=16.7,4.6hz,1h),2.55
–
2.49(m,1h),2.34(dd,j=14.1,5.7hz,1h),2.26(dd,j=14.1,8.0hz,1h),1.26(s,9h),1.07(d,j=6.6hz,3h)。
[0490]
实施例12
–
(s)-n
4-(叔丁基)-2-(5-甲基异噁唑-3-甲酰氨基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)琥珀酰胺(pks2249)的制备
[0491][0492]
按照hatu介导的5-甲基异噁唑-3-羧酸(5.6mg,0.044mmol)和pks2248(21.1mg,0.04mmol)的偶联的一般方案制备标题化合物。反应完成后,将混合物通过hplc纯化,得到纯的产物(14.4mg,69%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.50(d,j=8.1hz,1h),8.41(t,j=5.7hz,1h),8.05
–
8.03(m,1h),7.99(d,j=8.1hz,1h),7.95
–
7.93(m,1h),7.84(d,j=8.0hz,1h),7.57
–
7.51(m,2h),7.48
–
7.42(m,3h),6.53(s,1h),4.74(dd,j=15.1,5.7hz,1h),4.68(dd,j=15.1,5.5hz,1h),4.63(td,j=8.4,4.8hz,1h),4.16
–
4.08(m,1h),2.54(dd,j=14.3,8.7hz,1h),2.45(s,3h),2.41(dd,j=14.3,4.8hz,1h),2.35(dd,j=14.0,5.7hz,1h),2.25(dd,j=14.0,7.7hz,1h),1.18(s,9h),1.04(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ171.34,169.90,169.22,168.86,158.58,158.24,134.57,133.32,130.89,128.53,127.62,126.25,125.85,125.62,125.43,123.52,101.35,50.51,50.14,
42.57,41.61,40.19,38.33,28.38,19.98,11.86。
[0493]
实施例13
–
(s)-n
4-(叔丁基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)-2-(3-苯基丙酰氨基)琥珀酰胺(pks2251)的制备
[0494][0495]
按照hatu介导的3-苯基丙酸(5.0mg,0.033mmol)和pks2248(15.8mg,0.03mmol)的偶联的一般方案制备标题化合物。反应完成后,将混合物通过hplc纯化,得到纯的产物(14.3mg,88%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.44(t,j=5.7hz,1h),8.06
–
8.04(m,1h),7.99(d,j=8.1hz,1h),7.95
–
7.93(m,1h),7.86
–
7.83(m,2h),7.57
–
7.53(m,2h),7.49
–
7.43(m,2h),7.33(s,1h),7.26
–
7.23(m,2h),7.20
–
7.14(m,3h),4.75(dd,j=15.1,5.7hz,1h),4.71(dd,j=15.1,5.6hz,1h),4.48(td,j=8.2,5.6hz,1h),4.14
–
4.06(m,1h),2.82
–
2.78(m,2h),2.44
–
2.33(m,4h),2.29(dd,j=14.6,8.3hz,1h),2.23(dd,j=14.1,7.8hz,1h),1.21(s,9h),1.03(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ171.10,169.97,169.92,168.75,141.31,134.56,133.28,130.86,128.49,128.25,128.11,127.57,126.19,125.82,125.79,125.56,125.38,123.48,50.10,50.02,42.32,41.50,40.15,38.73,36.89,31.00,28.44,19.87。
[0496]
实施例14
–
(s)-n
4-(叔丁基)-2-((4-甲基苯基)磺酰氨基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)琥珀酰胺(pks2252)的制备
[0497][0498]
按照用甲苯磺酰氯(11.5mg,0.06mmol)的pks2248(21.1mg,0.04mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(12.7mg,56%)。1h nmr(500mhz,dmso-d6)δ8.38(t,j=5.7hz,1h),8.05
–
8.03(m,1h),7.95
–
7.93(m,1h),7.84(d,j=8.1hz,1h),7.78(d,j=8.1hz,1h),7.71(bs,1h),7.65(d,j=8.2hz,2h),7.56
–
7.52(m,2h),7.48
–
7.41(m,2h),7.32
–
7.29(m,3h),4.73(dd,j=15.1,5.7hz,1h),4.68(dd,j=15.1,5.6hz,1h),4.01(m,1h),3.94
–
3.85(m,1h),2.33(s,3h),2.29
–
2.15(m,3h),2.11(dd,j=14.1,8.2hz,1h),1.18(s,9h),0.83(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ169.67,168.87,168.02,142.36,138.33,134.59,133.28,130.86,129.24,128.48,127.57,126.63,126.17,125.79,125.60,125.37,123.50,53.60,50.07,42.18,41.52,40.13,39.39,28.40,20.91,19.43。
[0499]
实施例15
–
(s)-n
5-(叔丁基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)-2-(3-苯基丙酰氨基)戊二酰胺(pks2253)的制备
[0500][0501]
按照hatu介导的phch2ch2c(o)-glu(nhtbu)-oh(18.4mg,0.055mmol)和h-β-高-ala-ch
2-萘tfa盐(17.8mg,0.05mmol)的偶联的一般方案合成标题化合物。通过hplc纯化得到产物(23.5mg,84%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.45(t,j=5.7hz,1h),8.07
–
8.05(m,1h),8.00
–
7.93(m,2h),7.89(d,j=8.1hz,1h),7.85
–
7.83(m,1h),7.57
–
7.51(m,2h),7.48
–
7.43(m,2h),7.34(s,1h),7.27
–
7.23(m,2h),7.21
–
7.14(m,3h),4.77(dd,j=15.1,5.7hz,1h),4.70(dd,j=15.1,5.6hz,1h),4.18
–
4.13(m,2h),2.81(t,j=7.9hz,2h),2.46
–
2.42(m,2h),2.38(dd,j=14.0,5.6hz,1h),2.24(dd,j=14.0,7.8hz,1h),1.99(t,j=8.1hz,2h),1.82
–
1.75(m,1h),1.70
–
1.62(m,1h),1.21(s,9h),1.05(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ171.24,171.08,170.30,169.92,141.35,134.54,133.28,130.85,128.48,128.22,128.16,127.56,126.19,125.80,125.52,125.39,123.49,52.30,49.80,42.27,41.82,40.14,36.78,32.57,31.06,28.54,28.51,20.12。
[0502]
实施例16
–
(s)-n
4-(叔丁基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)-2-(苯基磺酰氨基)琥珀酰胺(pks2260)的制备
[0503][0504]
按照用苯基磺酰氯(4μl,0.028mmol)的pks2248(12.1mg,0.023mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(10.0mg,79%)。1h nmr(500mhz,dmso-d6)δ8.37(t,j=5.7hz,1h),8.04
–
8.02(m,1h),7.95
–
7.93(m,1h),7.85
–
7.81(m,3h),7.77(d,j=7.6hz,2h),7.60
–
7.41(m,7h),7.32(s,1h),4.73(dd,j=15.1,5.8hz,1h),4.68(dd,j=15.1,5.5hz,1h),4.07
–
4.03(m,1h),3.92
–
3.86(m,1h),2.28
–
2.17(m,3h),2.12(dd,j=14.1,8.3hz,1h),1.18(s,9h),0.83(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso-d6)δ169.67,168.85,167.98,141.25,134.59,133.28,132.17,130.86,128.80,128.48,127.57,126.54,126.19,125.80,125.60,125.38,123.50,53.62,50.07,42.16,41.55,40.13,39.69,28.42,19.49。
[0505]
实施例17
–
(s)-n
4-(叔丁基)-2-(环丙烷磺酰氨基)-n
1-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)琥珀酰胺(pks2295)的制备
[0506][0507]
按照用环丙基磺酰氯(6μl,0.06mmol)的pks2248(21.1mg,0.04mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(16.3mg,79%)。1h nmr(500mhz,dmso-d6)δ8.42(t,j=5.6hz,1h),8.06
–
8.04(m,1h),7.97
–
7.94(m,2h),7.85(d,j=7.9hz,1h),7.57
–
7.52(m,2h),7.48
–
7.43(m,2h),7.40(s,1h),7.26(d,j=9.1hz,1h),4.75(dd,j=15.1,5.7hz,1h),4.70(dd,j=15.1,5.5hz,1h),4.17
–
4.06(m,2h),2.50
–
2.46(m,1h),2.41
–
2.32(m,3h),2.25(dd,j=14.1,8.0hz,1h),1.23(s,9h),1.04(d,j=6.6hz,3h),0.90
–
0.82(m,4h)。
13
c nmr(126mhz,dmso-d6)δ169.93,169.75,168.37,134.57,133.28,130.87,128.48,127.58,126.19,125.80,125.62,125.38,123.51,53.71,50.12,42.41,41.59,40.15,39.82,30.28,28.45,19.80,5.13,4.84。
[0508]
实施例18
–
(r)-3-((叔丁氧羰基)氨基)-5-(((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)氨基)-5-氧代戊酸苄酯(pks2266)的制备
[0509][0510]
按照hatu介导的n-boc-l-β-谷氨酸5-苄酯(84mg,0.25mmol)和h-ala-ch
2-萘tfa盐(94mg,0.275mmol)的偶联的一般方案合成标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(115mg,84%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.40(t,j=5.6hz,1h),8.11(d,j=7.4hz,1h),8.04
–
8.02(m,1h),7.95
–
7.93(m,1h),7.83(d,j=7.9hz,1h),7.56
–
7.51(m,2h),7.47
–
7.41(m,2h),7.37
–
7.30(m,5h),6.82(d,j=8.3hz,1h),5.05(s,2h),4.77
–
4.69(m,2h),4.33
–
4.28(m,1h),4.22
–
4.13(m,1h),2.55(dd,j=15.0,5.0hz,1h),2.49
–
2.44(m,1h),2.38(dd,j=14.6,6.3hz,1h),2.32(dd,j=14.6,7.5hz,1h),1.34(s,9h),1.21(d,j=7.1hz,3h)。
[0511]
实施例19
–
(r)-3-((叔丁氧羰基)氨基)-5-(((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)氨基)-5-氧代戊酸(pks2268)的制备
[0512][0513]
按照pks2266(110mg,0.2mmol)的o-脱苄基方案合成标题化合物。分离出产物(92mg,定量),为白色固体。1h nmr(500mhz,dmso-d6)δ8.49(t,j=5.8hz,1h),8.16(d,j=7.4hz,1h),8.04(d,j=7.8hz,1h),7.94(d,j=7.3hz,1h),7.83(d,j=7.8hz,1h),7.56
–
7.51(m,2h),7.48
–
7.42(m,2h),6.74(d,j=8.2hz,1h),4.74
–
4.71(m,2h),4.33
–
4.28(m,
1h),4.11
–
4.04(m,1h),2.41
–
2.29(m,4h),1.35(s,9h),1.23(d,j=7.1hz,3h)。
[0514]
实施例20
–
((r)-1-(叔丁基氨基)-5-(((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)氨基)-1,5-二氧代戊烷-3-基)氨基甲酸叔丁酯(pks2271)的制备
[0515][0516]
按照edc介导的pks2268(92mg,0.2mmol)和叔丁胺(31.5μl,0.3mmol)的偶联的一般方案制备标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(85mg,83%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.44(t,j=5.9hz,1h),8.05
–
8.03(m,2h),7.95
–
7.93(m,1h),7.84(d,j=7.7hz,1h),7.56
–
7.53(m,2h),7.48
–
7.43(m,2h),7.34(s,1h),6.56(d,j=8.4hz,1h),4.78
–
4.69(m,2h),4.34
–
4.28(m,1h),4.10
–
4.00(m,1h),2.36-2.12(m,4h),1.35(s,9h),1.23
–
1.22(m,12h)。
[0517]
实施例21
–
(r)-3-氨基-n
1-(叔丁基)-n
5-((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)戊二酰胺2,2,2-三氟乙酸盐(pks2273)的制备
[0518][0519]
按照pks2271(80mg,0.156mmol)的boc-脱保护的一般方案合成标题化合物。1h nmr(500mhz,dmso-d6)δ8.54(t,j=5.7hz,1h),8.46(d,j=7.3hz,1h),8.05
–
8.03(m,1h),7.96
–
7.94(m,1h),7.89
–
7.82(m,5h),7.56
–
7.54(m,2h),7.49
–
7.43(m,2h),4.78(dd,j=15.4,5.9hz,1h),4.70(dd,j=15.4,5.5hz,1h),4.39
–
4.33(m,1h),3.67
–
3.61(m,1h),2.53
–
2.49(m,2h),2.42(dd,j=15.9,5.8hz,1h),2.36(dd,j=15.9,7.2hz,1h),1.26-1.24(m,12h)。
[0520]
实施例22
–
(r)-n
1-(叔丁基)-n
5-((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)-3-(3-苯基丙酰氨基)戊二酰胺(pks2278)的制备
[0521][0522]
按照hatu介导的3-苯基丙酸(6.6mg,0.044mmol)和pks2273(21.1mg,0.04mmol)的偶联的一般方案合成标题化合物。反应完成后,通过hplc纯化混合物,得到纯的产物
(20.7mg,95%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.44
–
8.42(m,1h),8.07(d,j=7.3hz,1h),8.02
–
8.00(m,1h),7.95
–
7.93(m,1h),7.83(d,j=7.9hz,1h),7.68(d,j=8.1hz,1h),7.54
–
7.52(m,2h),7.45
–
7.39(m,2h),7.37(s,1h),7.24
–
7.21(m,2h),7.16
–
7.13(m,3h),4.71(d,j=5.7hz,2h),4.33
–
4.29(m,2h),2.76
–
2.73(m,2h),2.37
–
2.16(m,6h),1.24
–
1.22(m,12h)。
13
c nmr(126mhz,dmso)δ172.36,170.51,169.71,169.42,141.31,134.41,133.21,130.74,128.46,128.23,128.07,127.39,126.12,125.79,125.73,125.37,124.90,123.32,49.96,48.42,44.21,40.73,40.11,39.75,37.21,31.14,28.45,18.27。
[0523]
实施例23
–
(r)-n
1-(叔丁基)-3-(4-甲基苯基磺酰氨基)-n
5-((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)戊二酰胺(pks2279)的制备
[0524][0525]
按照用甲苯磺酰氯(11.4mg,0.06mmol)的pks2273(21.1mg,0.04mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(17.8mg,78%)。1h nmr(500mhz,dmso-d6)δ8.42(t,j=5.8hz,1h),8.08
–
8.03(m,2h),7.95
–
7.94(m,1h),7.84(d,j=7.9hz,1h),7.66(d,j=8.1hz,2h),7.55
–
7.53(m,2h),7.48
–
7.42(m,3h),7.39(s,1h),7.32(d,j=8.1hz,2h),4.78
–
4.70(m,2h),4.28
–
4.23(m,1h),3.81
–
3.74(m,1h),2.35(s,3h),2.29
–
2.20(m,2h),2.13(d,j=6.6hz,2h),1.20
–
1.18(m,12h)。
13
c nmr(126mhz,dmso)δ172.19,169.22,168.94,142.43,138.54,134.41,133.24,130.77,129.45,128.48,127.46,126.50,126.14,125.77,125.38,125.07,123.37,50.05,48.51,48.30,40.71,40.13,39.95,28.39,20.94,18.26。
[0526]
实施例24
–
(s)-4-((叔丁氧羰基)氨基)-6-(((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)氨基)-6-氧代己酸苄酯(pks2274)的制备
[0527][0528]
按照hatu介导的(s)-3-(boc-氨基)己二酸6-苄酯(23.7mg,0.0675mmol)和h-ala-ch
2-萘tfa盐(23.1mg,0.0675mmol)的偶联的一般方案合成标题化合物。反应完成后,通过hplc纯化混合物,得到产物(23.0mg,61%),为白色固体。1h nmr(500mhz,氯仿-d)δ7.96(d,j=8.3hz,1h),7.86
–
7.84(m,1h),7.78(dd,j=7.3,2.1hz,1h),7.55
–
7.47(m,2h),7.42
–
7.38(m,2h),7.36
–
7.28(m,5h),6.66
–
6.64(m,1h),6.24(d,j=7.2hz,1h),5.13(d,j=8.9hz,1h),5.05
–
5.00(m,2h),4.91(dd,j=14.6,5.6hz,1h),4.84(dd,j=14.6,5.3hz,1h),4.45
–
4.39(m,1h),3.75
–
3.70(m,1h),2.37
–
2.23(m,4h),1.73
–
1.61(m,2h),1.39(s,9h),1.37(d,j=7.0hz,3h)。
[0529]
实施例25
–
(s)-4-((叔丁氧羰基)氨基)-6-(((s)-1-((萘-1-基甲基)氨基)-1-氧
代丙烷-2-基)氨基)-6-氧代己酸(pks2277)的制备
[0530][0531]
按照pks2274(23mg,0.04mmol)的o-脱苄基方案合成标题化合物。通过hplc纯化粗品得到产物(17.5mg,91%),为白色固体。1hnmr(500mhz,dmso-d6)δ8.44(t,j=5.8hz,1h),8.13
–
8.11(m,1h),8.04(d,j=7.9hz,1h),7.95
–
7.93(m,1h),7.84(d,j=7.8hz,1h),7.56
–
7.51(m,2h),7.48
–
7.42(m,2h),6.71(d,j=8.8hz,1h),4.72-4.71(m,2h),4.33
–
4.31(m,1h),3.75(m,1h),2.32
–
2.14(m,4h),1.70
–
1.65(m,1h),1.57
–
1.51(m,1h),1.36(s,9h),1.22(d,j=7.2hz,3h)。
[0532]
实施例26
–
((s)-6-(叔丁基氨基)-1-(((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)氨基)-1,6-二氧代己烷-3-基)氨基甲酸叔丁酯(pks2282)的制备
[0533][0534]
按照edc介导的pks2277(17.5mg,0.037mmol)和叔丁胺(6.0μl,0.056mmol)的偶联的一般方案制备标题化合物。反应完成后,通过hplc纯化混合物,得到产物(6.8mg,35%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.42(t,j=5.8hz,1h),8.07
–
8.03(m,2h),7.95
–
7.93(m,1h),7.84(d,j=7.9hz,1h),7.56
–
7.53(m,2h),7.48
–
7.42(m,2h),7.33(s,1h),6.61(d,j=8.7hz,1h),4.78
–
4.69(m,2h),4.35
–
4.29(m,1h),3.75
–
3.68(m,1h),2.31
–
2.22(m,2h),2.02
–
1.97(m,2h),1.62
–
1.57(m,1h),1.53
–
1.48(m,1h),1.36(s,9h),1.23
–
1.21(m,12h)。
[0535]
实施例27
–
(s)-3-氨基-n
6-(叔丁基)-n
1-((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)己二酰胺2,2,2-三氟乙酸盐(pks2289)的制备
[0536][0537]
按照pks2282(6.8mg,0.013mmol)的boc-脱保护的一般方案合成标题化合物。将产物不经进一步纯化用于下一步骤。1h nmr(500mhz,氯仿-d)δ8.24(s,3h),8.10(m,1h),7.88
–
7.80(m,3h),7.55
–
7.49(m,2h),7.42
–
7.40(m,2h),6.82(m,1h),5.98(s,1h),5.00
–
4.95(m,1h),4.76
–
4.72(m,1h),4.37(m,1h),3.55(m,1h),2.75
–
2.72(m,1h),2.61
–
2.57(m,
1h),2.40(t,j=5.4hz,2h),1.93(m,1h),1.80(m,1h),1.39
–
1.38(m,3h),1.32(s,9h)。
[0538]
实施例28
–
(s)-n
6-(叔丁基)-3-(4-甲基苯基磺酰氨基)-n
1-((s)-1-((萘-1-基甲基)氨基)-1-氧代丙烷-2-基)己二酰胺(pks2290)的制备
[0539][0540]
按照用甲苯磺酰氯(5.0mg,0.026mmol)的pks2289(来自前步的粗品,0.013mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(6.0mg,2步为79%)。1h nmr(500mhz,dmso-d6)δ8.41(t,j=5.8hz,1h),8.10(d,j=7.5hz,1h),8.03
–
8.01(m,1h),7.96-7.94(m,1h),7.84(d,j=8.0hz,1h),7.66(d,j=8.2hz,2h),7.59(d,j=7.8hz,1h),7.55
–
7.52(m,2h),7.47
–
7.40(m,2h),7.35(d,j=8.0hz,2h),7.31(s,1h),4.74(dd,j=15.4,5.8hz,1h),4.70(dd,j=15.4,5.7hz,1h),4.28
–
4.22(m,1h),3.45
–
3.39(m,1h),2.36(s,3h),2.20
–
2.00(m,3h),1.94
–
1.88(m,1h),1.57
–
1.50(m,1h),1.47
–
1.39(m,1h),1.20(s,9h),1.18(d,j=7.4hz,4h)。
13
c nmr(126mhz,dmso)δ172.13,171.40,169.29,142.40,138.78,134.41,133.23,130.76,129.54,128.47,127.44,126.37,126.12,125.76,125.37,124.98,123.35,50.76,49.80,48.19,40.72,40.13,32.47,30.27,28.47,20.96,18.27。
[0541]
实施例29
–
(r)-3-((叔丁氧羰基)氨基)-5-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-5-氧代戊酸苄酯(pks2281)的制备
[0542][0543]
按照hatu介导的n-boc-l-β-谷氨酸5-苄酯(47mg,0.14mmol)和h-高-β-ala-ch
2-萘tfa盐(50mg,0.14mmol)的偶联的一般方案合成标题化合物。通过hplc纯化反应混合物,得到产物(73mg,93%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.39(t,j=5.5hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.84(d,j=7.9hz,1h),7.81(d,j=8.0hz,1h),7.56
–
7.51(m,2h),7.48
–
7.42(m,2h),7.37
–
7.30(m,5h),6.79(d,j=8.5hz,1h),5.05(s,2h),4.76
–
4.68(m,2h),4.16
–
4.09(m,2h),2.55
–
2.43(m,2h),2.36(dd,j=14.0,5.7hz,1h),2.26
–
2.17(m,3h),1.35(s,9h),1.02(d,j=6.0hz,3h)。
[0544]
实施例30
–
(r)-3-((叔丁氧羰基)氨基)-5-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-5-氧代戊酸(pks2285)的制备
[0545][0546]
按照pks2281(73mg,0.13mmol)的o-脱苄基方案合成标题化合物。产量61.0mg(定量)。1h nmr(500mhz,dmso-d6)δ12.12(s,1h),8.39(t,j=5.6hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.85(d,j=8.0hz,1h),7.79(d,j=8.0hz,1h),7.56
–
7.52(m,2h),7.48
–
7.42(m,2h),6.69(d,j=8.4hz,1h),4.77
–
4.68(m,2h),4.15
–
4.01(m,2h),2.38
–
2.34(m,3h),2.26
–
2.16(m,3h),1.36(s,9h),1.02(d,j=6.6hz,3h)。
[0547]
实施例31
–
((r)-1-(叔丁基氨基)-5-(((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)氨基)-1,5-二氧代戊烷-3-基)氨基甲酸叔丁酯(pks2286)的制备
[0548][0549]
按照edc介导的pks2285(61.0mg,0.13mmol)和叔丁胺(20.0μl,0.195mmol)的偶联的一般方案制备标题化合物。反应完成后,通过hplc纯化混合物,得到产物(13.0mg,19%),为白色固体。1hnmr(500mhz,dmso-d6)δ8.41(t,j=5.6hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.84(d,j=7.7hz,1h),7.72(d,j=8.1hz,1h),7.56-7.51(m,2h),7.48
–
7.43(m,2h),7.31(s,1h),6.50(d,j=8.7hz,1h),4.77
–
4.68(m,2h),4.18
–
4.10(m,1h),4.06
–
3.98(m,1h),2.36(dd,j=13.9,5.6hz,1h),2.22
–
2.14(m,5h),1.36(s,9h),1.22(s,9h),1.02(d,j=6.5hz,3h)。
[0550]
实施例32
–
(r)-3-氨基-n
1-(叔丁基)-n
5-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)戊二酰胺2,2,2-三氟乙酸盐(pks2288)的制备
[0551][0552]
按照pks2286(13.0mg,0.025mmol)的boc-脱保护的一般方案合成标题化合物。产量13.5mg(定量)。1h nmr(500mhz,氯仿-d)δ8.65(bs,3h),8.47(d,j=7.9hz,1h),7.94(d,j=8.3hz,1h),7.86(d,j=8.1hz,1h),7.82
–
7.78(m,1h),7.57
–
7.49(m,2h),7.43
–
7.40(m,2h),6.52(t,j=5.3hz,1h),5.98(s,1h),4.81
–
4.74(m,2h),4.35
–
4.30(m,1h),3.86(m,1h),2.73
–
2.68(m,1h),2.64
–
2.58(m,1h),2.46
–
2.36(m,3h),2.30(dd,j=14.2,8.9hz,1h),1.32(s,9h),1.18(d,j=6.6hz,3h)。
[0553]
实施例33
–
(r)-n
1-(叔丁基)-3-(4-甲基苯基磺酰氨基)-n
5-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)戊二酰胺(pks2291)的制备
[0554][0555]
按照用甲苯磺酰氯(4.6mg,0.024mmol)的pks2288(6.5mg,0.012mmol)的n-磺酰胺形成的一般程序制备标题化合物。hplc纯化后分离出产物,为白色固体(5.2mg,74%)。1h nmr(500mhz,dmso-d6)δ8.40(t,j=5.6hz,1h),8.06
–
8.04(m,1h),7.96
–
7.94(m,1h),7.85(d,j=7.8hz,1h),7.74(d,j=8.1hz,1h),7.67
–
7.66(m,2h),7.55
–
7.52(m,2h),7.47-7.42(m,3h),7.37
–
7.33(m,3h),4.74(dd,j=15.2,5.6hz,1h),4.70(dd,j=15.2,5.6hz,1h),4.11
–
4.05(m,1h),3.80
–
3.73(m,1h),2.34(s,3h),2.31(dd,j=13.9,5.5hz,1h),2.18
–
2.08(m,5h),1.18(s,9h),0.98(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ
13
c nmr(126mhz,dmso)δ169.78,168.94,168.36,142.43,138.65,134.60,133.28,130.86,129.47,128.48,127.56,126.49,126.17,125.80,125.56,125.36,123.52,50.02,48.52,42.19,41.93,40.54,40.13,40.09,28.42,20.93,19.98。
[0556]
实施例34
–
(r)-n
1-(叔丁基)-n
5-((s)-4-((萘-1-基甲基)氨基)-4-氧代丁烷-2-基)-3-(3-苯基丙酰氨基)戊二酰胺(pks2292)的制备
[0557][0558]
按照hatu介导的3-苯基丙酸(2.0mg,0.012)和pks2288(6.5mg,0.012mmol)的偶联的一般方案合成标题化合物。通过hplc纯化反应混合物,得到产物(6.0mg,90%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.40(t,j=5.6hz,1h),8.06
–
8.04(m,1h),7.95
–
7.93(m,1h),7.85(d,j=7.8hz,1h),7.73(d,j=8.1hz,1h),7.64(d,j=8.3hz,1h),7.56
–
7.51(m,2h),7.48
–
7.42(m,2h),7.33(s,1h),7.26
–
7.23(m,2h),7.18
–
7.14(m,3h),4.76
–
4.68(m,2h),4.31
–
4.24(m,1h),4.19
–
4.10(m,1h),2.78(t,j=7.9hz,2h),2.38
–
2.30(m,3h),2.23
–
2.17(m,5h),1.22(s,9h),1.02(d,j=6.6hz,3h)。
13
c nmr(126mhz,dmso)δ170.46,169.84,169.42,168.78,141.31,134.61,133.27,130.87,128.47,128.25,128.09,127.56,126.18,125.82,125.79,125.57,125.37,123.51,49.94,44.22,42.16,42.04,40.59,40.13,40.06,37.22,31.19,28.48,20.06。
[0559]
实施例35
–
pks3024的制备
[0560][0561]
按照edc介导的n-boc-l-β-谷氨酸5-苄酯(168mg,0.5mmol)和叔丁胺(80μl,0.75mmol)的偶联的一般程序制备标题化合物。反应完成后,向混合物中添加水并用乙酸乙酯萃取两次。将有机层用1n hcl、水、nahco3水溶液、水和盐水洗涤。经无水硫酸钠干燥有机层并蒸发且干燥,得到产物(196mg,定量)。将产物不经任何进一步纯化用于下一步骤。1h nmr(500mhz,氯仿-d)δ7.38
–
7.30(m,5h),5.72(bs,1h),5.59(bs,1h),5.12(s,2h),4.24
–
4.15(m,1h),2.79(dd,j=16.3,5.2hz,1h),2.58(dd,j=15.7,7.5hz,1h),2.44
–
2.34(m,2h),1.41(s,9h),1.30(s,9h)。
[0562]
实施例36
–
pks3028的制备
[0563][0564]
将pks3024(196mg,0.5mmol)溶解在5ml的4n hcl(二噁烷溶液)中并将混合物在室温下搅拌1小时。反应完成后,将二噁烷蒸发并将混合物用水稀释。将溶液用乙醚洗涤。将水层冷冻并冻干,得到产物(143mg,87%)。由于73:27旋转异构体产生复杂的nmr。1h nmr(500mhz,dmso-d6)δ8.35
–
8.26(m,2.1h),8.17(s,0.9h),7.87(s,1h),7.48
–
7.26(m,4h),5.12(s,2h),3.75
–
3.66(m,0.73h),3.66
–
3.56(m,0.27h),2.83(dd,j=16.7,6.6hz,0.73h),2.75
–
2.65(m,1.27h),2.60
–
2.52(m,2h),1.24(d,j=4.5hz,9h)。
[0565]
实施例37
–
pks3034的制备
[0566][0567]
按照用甲苯磺酰氯(63mg,0.33mmol)的pks3028(72.3mg,0.22mmol)的n-磺酰胺形成的一般程序制备标题化合物。通过二氯甲烷萃取分离出产物并通过柱色谱法纯化,得到为白色固体的产物(50.1mg,51%)。1h nmr(500mhz,dmso-d6)δ7.73(d,j=8.2hz,1h),7.65(d,j=7.8hz,2h),7.44(s,1h),7.41
–
7.29(m,7h),4.98(d,j=12.6hz,1h),4.90(d,j=12.6hz,1h),3.88(dtd,j=13.5,8.0,5.3hz,1h),2.46(dd,j=15.4,5.4hz,1h),2.40
–
2.32(m,4h),2.18(dd,j=14.6,8.2hz,1h),2.12(dd,j=14.6,5.4hz,1h),1.17(s,9h)。
[0568]
实施例38
–
pks3041的制备
[0569][0570]
按照pks3034(14.3mg,0.032mmol)的o-脱苄基的一般方案合成标题化合物。将滤液在真空下蒸发并干燥,得到产物(11.4mg,定量)。1h nmr(500mhz,dmso-d6)δ7.66(d,j=7.9hz,2h),7.42(s,1h),7.35(d,j=7.9hz,2h),3.75
–
3.66(m,1h),2.37(s,3h),2.20
–
2.11(m,4h),1.18(s,9h)。
[0571]
实施例39
–
pks3044的制备
[0572][0573]
按照hatu介导的pks3041(11.4mg,0.032mmol)和h-ala-ch
2-萘tfa盐(13.1mg,0.038mmol)的偶联的一般程序制备标题化合物。通过hplc纯化得到产物(8.0mg,44%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.45(t,j=5.8hz,1h),8.05
–
8.00(m,2h),7.96
–
7.92(m,1h),7.83(d,j=7.9hz,1h),7.67(d,j=8.0hz,2h),7.55
–
7.50(m,2h),7.47
–
7.40(m,3h),7.39(s,1h),7.35(d,j=8.0hz,2h),4.74(dd,j=15.5,5.7hz,1h),4.70(dd,j=15.5,5.6hz,1h),4.28
–
4.18(m,1h),3.86
–
3.76(m,1h),2.37(s,3h),2.22(d,j=6.8hz,2h),2.15
–
2.05(m,2h),1.22
–
1.15(m,12h)。
13
c nmr(126mhz,dmso)δ172.35,169.18,168.95,142.42,138.82,134.39,133.23,130.76,129.48,128.47,127.44,126.44,126.13,125.76,125.38,125.01,123.36,50.08,48.60,48.35,40.75,40.15,40.10,28.40,20.96,18.09。
[0574]
实施例40
–
pks3035的制备
[0575][0576]
按照hatu介导的3-苯基丙酸(40mg,0.264mmol)与pks3028(72.3mg,0.22mmol)的偶联的一般方案合成标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。过滤沉淀物,用水洗涤并在空气中干燥,得到产物(50mg,45%),为白色固体。1h nmr(500mhz,dmso-d6)δ7.82(d,j=8.1hz,1h),7.40(s,1h),7.38
–
7.28(m,5h),7.28
–
7.22(m,2h),7.20
–
7.13(m,3h),5.05(s,2h),4.43
–
4.30(m,1h),2.82
–
2.68(m,2h),2.55(dd,j=15.3,5.6hz,1h),2.41
–
2.08(m,5h),1.22(s,9h)。
[0577]
实施例41
–
pks3038的制备
[0578][0579]
按照pks3035(45mg,0.106mmol)的o-脱苄基的一般方案制备标题化合物。分离出产物,为白色固体(35mg,定量)。1h nmr(500mhz,dmso-d6)δ7.87(d,j=8.0hz,1h),7.44(s,1h),7.29
–
7.22(m,2h),7.21
–
7.12(m,3h),4.30
–
4.20(m,1h),2.77(t,j=7.9hz,2h),2.37
–
2.13(m,6h),1.22(s,9h)。
[0580]
实施例42
–
pks3039的制备
[0581][0582]
按照hatu介导的pks3038(35.0mg,0.032mmol)和h-ala-ch
2-萘tfa盐(40.0mg,0.116mmol)的偶联的一般程序制备标题化合物。通过hplc纯化得到产物(17.6mg,31%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.45(t,j=5.8hz,1h),8.08
–
8.01(m,2h),7.97
–
7.90(m,1h),7.83(dd,j=7.2,2.4hz,1h),7.69(d,j=8.4hz,1h),7.57
–
7.49(m,2h),7.49
–
7.41(m,2h),7.35(s,1h),7.27
–
7.20(m,2h),7.19
–
7.11(m,3h),4.79
–
4.69(m,2h),4.38
–
4.27(m,2h),2.75(t,j=8.0hz,2h),2.35
–
2.27(m,4h),2.20(d,j=6.8hz,2h),1.24
–
1.19(m,12h)。
13
c nmr(126mhz,dmso)δ172.44,170.56,169.71,169.40,141.29,134.44,133.23,130.77,128.47,128.26,128.08,127.43,126.14,125.83,125.76,125.38,124.99,123.36,49.99,48.36,44.32,40.82,40.19,40.01,37.29,31.15,28.46,18.22。
[0583]
实施例43
–
pks3006的制备
[0584][0585]
将劳森试剂(61mg,0.15mmol)悬浮在1ml thf中,并在室温下添加boc-ala-ch
2-萘(98.5mg,0.3mmol)在2ml thf中的溶液。将反应混合物搅拌过夜。反应不完全。另添加30mg的劳森反应物,并将混合物再搅拌18小时。将thf蒸发并通过柱色谱法纯化粗品,得到产物(100mg,97%)。由于旋转异构体产生复杂的nmr。1h nmr(500mhz,氯仿-d)δ8.31(s,1h),7.96
–
7.78(m,3h),7.58
–
7.39(m,4h),5.37
–
5.26(m,1h),5.26
–
5.10(m,2h),4.56
–
4.36(m,1h),1.48
–
1.41(m,3h),1.33
–
1.21(m,9h)。
[0586]
实施例44
–
pks3019的制备
[0587][0588]
在室温下向pks3006(40mg,0.116mmol)在2ml乙酸乙酯中的搅拌溶液中添加sncl4(在庚烷中1m,0.23ml,0.230mmol)。将反应混合物在室温下搅拌过夜。将溶剂蒸发并将粗品与乙醚一起研磨。将固体过滤并干燥,得到为白色固体的产物。将固体溶解在dmf中并用于下一步骤。1h nmr(500mhz,dmso-d6)δ8.01
–
7.91(m,3h),7.63
–
7.46(m,5h),5.25(d,j=15.2hz,1h),5.16(d,j=15.2hz,1h),4.28
–
4.17(m,1h),1.40(d,j=6.6hz,3h)。
[0589]
实施例45
–
pks3020的制备
[0590][0591]
按照hatu介导的phch2ch2c(o)-glu(conhtbu)-oh(18.4mg,0.055)和pks3019(6.5mg,0.05mmol)的偶联的一般方案合成标题化合物。通过hplc纯化反应混合物,得到产物(17.3mg,62%),为白色固体。1h nmr(500mhz,dmso-d6)δ10.50(t,j=5.2hz,1h),8.12(d,j=7.5hz,1h),8.09(d,j=7.7hz,1h),8.00
–
7.93(m,2h),7.89(dd,j=6.5,3.0hz,1h),7.61
–
7.51(m,2h),7.51
–
7.44(m,2h),7.31
–
7.21(m,3h),7.21
–
7.13(m,3h),5.23
–
5.18(m,2h),4.78
–
4.68(m,1h),4.25
–
4.17(m,1h),2.80(t,j=8.0hz,2h),2.49
–
2.38(m,2h),2.05(t,j=8.0hz,2h),1.96
–
1.85(m,1h),1.73
–
1.62(m,1h),1.32(d,j=6.8hz,3h),1.23(s,9h)。
13
c nmr(126mhz,dmso)δ204.98,171.62,171.16,170.69,141.29,133.29,132.10,131.01,128.55,128.26,128.13,127.98,126.42,125.99,125.93,125.83,125.40,123.39,53.87,52.35,49.85,46.77,36.81,32.68,31.06,28.53,27.77,21.40。
[0592]
实施例46
–
pks3021的制备
[0593][0594]
按照hatu介导的ts-glu(conhtbu)-oh(19.6mg,0.055)和pks3019(6.5mg,0.05mmol)的偶联的一般方案合成标题化合物。通过hplc纯化反应混合物,得到产物(15.4mg,53%),为白色固体。1h nmr(500mhz,dmso-d6)δ10.44(t,j=5.2hz,1h),8.18(d,j=7.4hz,1h),7.99
–
7.94(m,1h),7.94
–
7.90(m,1h),7.90
–
7.83(m,2h),7.63(d,j=8.3hz,2h),7.58
–
7.50(m,2h),7.50
–
7.40(m,2h),7.34
–
7.29(m,3h),5.20
–
5.14(m,2h),4.51
–
4.42(m,1h),3.76
–
3.67(m,1h),2.35(s,3h),2.10
–
1.95(m,2h),1.80
–
1.70(m,1h),1.64
–
1.53
(m,1h),1.21(s,9h),1.17(d,j=6.7hz,3h)。
13
c nmr(126mhz,dmso)δ204.82,171.07,169.63,142.42,137.96,133.27,132.07,130.98,129.24,128.53,127.95,126.67,126.40,125.91,125.37,123.37,55.72,53.85,49.86,46.67,32.33,28.77,28.48,20.99,20.96。
[0595]
实施例47
–
pks3049的制备
[0596][0597]
按照hatu介导的3-吲哚乙醛酸(189mg,1.0mmol)和h-asp(conhtbu)-oh tfa盐(432mg,1.1mmol)的偶联的一般方案合成标题化合物。通过乙酸乙酯萃取分离出化合物并通过柱色谱法纯化,得到产物(270mg,60%),为灰白色固体。1h nmr(500mhz,氯仿-d)δ10.14(s,1h),9.13(d,j=3.3hz,1h),8.42
–
8.34(m,2h),7.47(dd,j=6.6,2.3hz,1h),7.34
–
7.23(m,7h),5.54(s,1h),5.23(d,j=12.4hz,1h),5.19
–
5.12(m,1h),5.11
–
5.03(m,1h),2.80(dd,j=15.2,5.8hz,1h),2.74(dd,j=15.2,5.3hz,1h),1.29(s,9h)。
13
c nmr(126mhz,cdcl3)δ179.61,170.76,168.78,162.60,139.33,136.24,135.30,128.72,128.56,128.41,126.86,124.09,123.31,122.44,113.14,112.12,67.73,51.99,49.58,39.23,28.78。
[0598]
实施例48
–
pks3052的制备
[0599][0600]
按照pks3049(265mg,0.59mmol)的o-脱苄基的一般方案合成标题化合物。通过hplc纯化分离的粗品,得到产物(112mg,53%),为灰白色固体。1h nmr(500mhz,dmso-d6)δ12.81(s,1h),12.27(d,j=3.3hz,1h),8.82
–
8.75(m,2h),8.26
–
8.20(m,1h),7.57(s,1h),7.56
–
7.52(m,1h),7.32
–
7.23(m,2h),4.69
–
4.60(m,1h),2.67(dd,j=15.1,7.2hz,1h),2.59(dd,j=15.1,5.0hz,1h),1.22(s,9h)。
13
c nmr(126mhz,dmso)δ181.25,172.26,168.78,162.78,138.64,136.25,126.14,123.53,122.66,121.28,112.60,112.11,50.16,48.97,37.16,28.44。
[0601]
实施例49
–
pks3054的制备
[0602]
[0603]
按照hatu介导的3-ind-乙醛酰基-asp-(conhtbu)-oh(7.2mg,0.02)和h-β-高-ala-ch
2-萘tfa盐(7.8mg,0.022mmol)的偶联的一般方案合成标题化合物。通过hplc纯化反应混合物,得到产物(4.0mg,34%),为白色固体。1h nmr(500mhz,dmso-d6)δ12.24(d,j=3.6hz,1h),8.81(d,j=3.1hz,1h),8.70(d,j=8.4hz,1h),8.41(t,j=5.7hz,1h),8.28
–
8.21(m,1h),8.02(dd,j=6.3,3.4hz,1h),7.98(d,j=8.0hz,1h),7.93(dd,j=6.2,3.4hz,1h),7.83(d,j=8.0hz,1h),7.58
–
7.48(m,4h),7.48
–
7.37(m,2h),7.31
–
7.23(m,2h),4.74(dd,j=15.2,5.7hz,1h),4.67(dd,j=15.2,5.5hz,1h),4.62
–
4.54(m,1h),4.20
–
4.09(m,1h),2.59(dd,j=14.5,8.4hz,1h),2.43(dd,j=14.5,4.7hz,1h),2.36(dd,j=14.0,5.8hz,1h),2.26(dd,j=14.0,7.7hz,1h),1.20(s,9h),1.06(d,j=6.6hz,3h)。
[0604]
实施例50
–
pks3056的制备
[0605][0606]
将boc-ala-osu(600mg,2.10mmol)溶解在10ml二氯甲烷中并将溶液冷却到0℃。在0℃下向溶液中添加苯胺和三乙胺。使反应混合物缓慢(经1小时)升温至室温并搅拌过夜。向反应混合物中添加水并用乙酸乙酯萃取两次。将合并的有机层用1n hcl和盐水洗涤,经无水硫酸钠干燥并蒸发,得到产物468mg(84%)。将产物不经进一步纯化用于下一步骤。1h nmr(500mhz,氯仿-d)δ8.42(s,1h),7.55
–
7.48(m,2h),7.31(td,j=7.5,4.9hz,2h),7.09(t,j=7.4hz,1h),5.14
–
4.99(m,1h),4.39
–
4.24(m,1h),1.46(s,9h),1.43(d,j=7.0hz,3h)。
[0607]
实施例51
–
pks3057的制备
[0608][0609]
按照boc-ala-nhph(468mg,1.77mmol)的boc-脱保护的一般方案合成标题化合物。将获得的粗品悬浮在乙醚中。出现灰白色固体。轻轻倒出乙醚并干燥固体,得到产物(411mg,84%)。将产物不经进一步纯化用于下一步骤。1h nmr(500mhz,dmso-d6)δ10.49(s,1h),8.25(s,3h),7.63
–
7.57(m,2h),7.39
–
7.32(m,2h),7.15
–
7.08(m,1h),4.02(d,j=7.2hz,1h),1.46(d,j=7.0hz,3h)。
[0610]
实施例52
–
pks3061的制备
[0611][0612]
按照hatu介导的n-boc-l-β-谷氨酸5-苄酯(84mg,0.25mmol)和pks3057(83mg 0.3mmol)的偶联的一般方案合成标题化合物。反应完成后,向反应混合物中添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(115mg,95%),为白色固体。1h nmr(500mhz,dmso-d6)δ9.94(s,1h),8.19(t,j=6.2hz,1h),7.59(d,j=8.0hz,2h),
7.44
–
7.21(m,7h),7.04(t,j=7.4hz,1h),6.89
–
6.75(m,1h),5.05(s,2h),4.46
–
4.32(m,1h),4.23
–
4.06(m,1h),2.62
–
2.44(m,2h),2.43
–
2.27(m,2h),1.35(s,9h),1.27(d,j=7.1hz,3h)。
[0613]
实施例53
–
pks3063的制备
[0614][0615]
按照pks3061(115mg,0.24mmol)的o-脱苄基方案合成标题化合物,得到产物(94.4mg,定量),为白色固体。由于0.28:0.72比例的旋转异构体产生复杂的nmr。1h nmr(500mhz,dmso-d6)δ12.15(s,1h),10.01(s,0.28h),9.95(s,0.82h),8.18(d,j=7.1hz,1h),7.62-7.58(m,2h),7.31-7.26(m,2h),7.04(t,j=7.4hz,1h),6.75(d,j=8.5hz,0.28h),6.71(d,j=8.4hz,0.82h),4.49
–
4.31(m,1h),4.16
–
3.97(m,1h),2.42
–
2.26(m,4h),1.39
–
1.32(m,9h),1.28(d,j=7.1hz,3h)。
[0616]
实施例54
–
pks3065的制备
[0617][0618]
按照edc介导的pks3063(94.4mg,0.24mmol)和叔丁胺(38ml,0.36mmol)的偶联的一般方案合成标题化合物。反应完成后添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(85mg,79%),为灰白色固体。1h nmr(500mhz,dmso-d6)δ9.96(s,0.28h),9.93(s,0.82h),8.11(d,j=7.3hz,1h),7.60(d,j=8.0hz,2h),7.35
–
7.26(m,3h),7.04(t,j=7.4hz,1h),6.59
–
6.51(m,1h),4.46
–
4.36(m,1h),4.09
–
4.00(m,1h),2.37
–
2.24(m,2h),2.24
–
2.13(m,2h),1.35和1.34(s,9h),1.31
–
1.25(m,3h),1.23(s,9h)。
[0619]
实施例55
–
pks3069的制备
[0620][0621]
按照boc-脱保护的一般方案合成标题化合物,得到87mg产物(定量)。1h nmr(500mhz,dmso-d6)δ10.05(s,1h),8.57
–
8.51(m,1h),7.85(d,j=6.3hz,3h),7.80(s,0.76h),7.79(s,0.24h),7.59(d,j=8.0hz,2h),7.34
–
7.27(m,2h),7.05(t,j=7.4hz,1h),4.49
–
4.40(m,1h),3.68
–
3.60(m,1h),2.54
–
2.46(m,2h),2.45
–
2.32(m,2h),1.34
–
1.29(m,3h),1.26(s,9h)。
[0622]
实施例56
–
pks3076的制备
[0623][0624]
按照hatu介导的3-苯基丙酸(8.3mg,0.055mmol)和pks3076(23.1mg,0.05mmol)的偶联的一般方案合成标题化合物。通过hplc纯化得到产物(20.0mg,83%),为白色固体。由于0.28:0.72比例的旋转异构体产生复杂的nmr。1h nmr(500mhz,dmso-d6)δ9.97(s,0.28h),9.94(s,0.72h),8.15
–
8.09(m,1h),7.66(t,j=7.8hz,1h),7.62
–
7.57(m,2h),7.36
–
7.29(m,1h),7.29
–
7.21(m,4h),7.21
–
7.12(m,3h),7.07
–
7.00(m,1h),4.46
–
4.38(m,1h),4.34
–
4.26(m,1h),2.82
–
2.72(m,2h),2.40
–
2.26(m,4h),2.24
–
2.18(m,2h),1.30
–
1.25(m,3h),1.22(s,9h)。
13
c nmr(126mhz,dmso)δ171.33,170.49,169.79,169.39,141.32,138.94,128.63,128.23,128.08,125.78,123.26,119.24,49.97,48.97,44.19,40.78,39.70,37.21,31.14,28.47,18.17。
[0625]
实施例57
–
pks3077的制备
[0626][0627]
按照hatu介导的3-吲哚乙醛酸(10.4mg,0.055mmol)和pks3076(23.1mg,0.05mmol)的偶联的一般方案合成标题化合物。通过hplc纯化得到产物(15.0mg,58%),为灰白色固体。由于0.27:0.73比例的旋转异构体产生复杂的nmr。1h nmr(500mhz,dmso-d6)δ12.21(s,1h),9.98(s,0.27h),9.93(s,0.73h),8.81
–
8.77(m,1h),8.64(d,j=8.9hz,1h),8.28
–
8.19(m,2h),7.63
–
7.45(m,4h),7.32
–
7.19(m,4h),7.07
–
6.97(m,1h),4.55
–
4.46(m,1h),4.45
–
4.37(m,1h),2.54
–
2.49(m,1h),2.47
–
2.34(m,2h),2.32
–
2.25(m,1h),1.29(d,j=7.1hz,2.3h),1.24-1.22(m,9.7h)。
13
c nmr(126mhz,dmso)δ181.66,171.23,169.77,169.36,162.07,138.85,138.56,136.18,128.58,126.25,123.38,123.23,122.52,121.26,119.28,112.51,112.10,50.05,49.02,44.19,40.17,39.19,28.43,18.10。
[0628]
实施例58
–
pks3071的制备
[0629][0630]
按照hatu介导的boc-l-β-高丙氨酸(50.8mg,0.25mmol)和1-萘胺盐酸盐(50mg,0.275mmol)的偶联的一般方案合成标题化合物。反应完成后添加水,得到白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(62mg,76%),为白色固体。1h nmr(500mhz,
dmso-d6)δ9.87(s,1h),8.09
–
8.02(m,1h),7.93(dd,j=6.2,3.3hz,1h),7.76(d,j=8.2hz,1h),7.65(d,j=7.3hz,1h),7.57
–
7.51(m,2h),7.51
–
7.44(m,1h),6.86(d,j=8.3hz,1h),4.06
–
3.91(m,1h),2.63(dd,j=13.9,6.7hz,1h),2.57
–
2.51(m,1h),1.38(s,9h),1.16(d,j=6.5hz,3h)。
[0631]
实施例59
–
pks3073的制备
[0632][0633]
按照pks3071(57mg,0.174mmol)的boc-脱保护的一般方案制备标题化合物。将粗品与乙醚一起研磨并过滤。将固体干燥,得到产物(59mg,定量),为棕色固体。1h nmr(500mhz,dmso-d6)δ10.22(s,1h),8.10
–
8.05(m,1h),8.03
–
7.92(m,4h),7.79(d,j=8.2hz,1h),7.69(d,j=7.4hz,1h),7.60
–
7.47(m,3h),3.74
–
3.58(m,1h),2.85(d,j=6.6hz,2h),1.31(d,j=6.6hz,3h)。
[0634]
实施例60
–
pks21012的制备
[0635][0636]
按照hatu介导的3-苯基丙酸(1.68g,11.17mmol)与pks3047(3.98g,10.15mmol)偶联的一般程序合成标题化合物。反应完成后,添加水。形成白色沉淀物。过滤沉淀物并用水洗涤。将沉淀物在空气中干燥,得到产物(3.92g,94%),为白色固体。1h nmr(500mhz,氯仿-d)δ7.39
–
7.29(m,5h),7.29
–
7.23(m,2h),7.21
–
7.14(m,3h),6.88(d,j=8.0hz,1h),5.32(s,1h),5.20(d,j=12.3hz,1h),5.14(d,j=12.3hz,1h),4.84
–
4.77(m,1h),2.95(t,j=7.9hz,2h),2.81(dd,j=15.7,4.4hz,1h),2.61
–
2.47(m,3h),1.28(s,9h)。
[0637]
实施例61
–
pks21013的制备
[0638][0639]
按照pks21012(1.44g,3.50mmol)的o-脱苄基的程序合成标题化合物。分离出产物(1.11g,99%),为白色固体。1h nmr(500mhz,dmso-d6)δ12.54(s,1h),8.04(d,j=8.0hz,1h),7.45(s,1h),7.29
–
7.23(m,2h),7.23
–
7.13(m,3h),4.52
–
4.44(m,1h),2.83
–
2.76(m,2h),2.49
–
2.44(m,1h),2.44
–
2.34(m,3h),1.22(s,9h)。
[0640]
实施例62
–
pks3081的制备
[0641][0642]
按照hatu介导的pks21013(16.0mg,0.05mmol)和pks3073(18.8mg,0.055mmol)的偶联的一般程序合成标题化合物。通过hplc纯化得到产物(21.0mg,79%),为白色固体。1h nmr(500mhz,dmso-d6)δ9.95(s,1h),8.05(d,j=8.0hz,1h),8.00(d,j=8.2hz,1h),7.96
–
7.89(m,2h),7.76(d,j=8.2hz,1h),7.64(d,j=7.4hz,1h),7.58
–
7.50(m,2h),7.48(t,j=7.8hz,1h),7.32(s,1h),7.28
–
7.21(m,2h),7.20
–
7.12(m,3h),4.60
–
4.47(m,1h),4.32
–
4.14(m,1h),2.82
–
2.75(m,2h),2.65(dd,j=14.2,5.9hz,1h),2.58(dd,j=14.2,7.2hz,1h),2.45
–
2.35(m,3h),2.31(dd,j=14.7,8.6hz,1h),1.21(s,9h),1.17(d,j=6.5hz,3h)。
13
c nmr(126mhz,dmso)δ171.15,170.16,169.82,168.77,141.30,133.68,133.44,128.27,128.12,128.07,127.92,125.97,125.83,125.82,125.50,125.32,122.79,122.06,50.11,50.05,42.54,42.29,38.80,36.90,31.00,28.45,20.19。
[0643]
实施例63
–
pks21204的制备
[0644][0645]
将boc-β-ala-osu(286.28mg,1.00mmol)溶解在二氯甲烷(5.00ml)中并添加1-萘甲胺(157.21mg,1.00mmol)。将溶液冷却到0℃并添加三乙胺(101.19mg,1.00mmol)。使反应混合物升温至室温并在室温下搅拌2小时。反应完成后,将二氯甲烷蒸发并添加水。出现白色沉淀物。将沉淀物过滤,用水洗涤并在空气中干燥,得到产物(320mg,97%),为白色固体。将产物不经进一步纯化用于下一步骤。1h nmr(500mhz,氯仿-d)δ7.99(d,j=8.3hz,1h),7.88(d,j=8.0hz,1h),7.85
–
7.78(m,1h),7.59
–
7.48(m,2h),7.45
–
7.40(m,2h),5.90(bs,1h),5.14(bs,1h),4.93
–
4.85(m,2h),3.48
–
3.37(m,2h),2.45
–
2.36(m,2h),1.39(s,9h)。
[0646]
实施例64
–
pks21211的制备
[0647][0648]
按照pks21204(320mg,0.974mmol)的boc-脱保护的一般程序合成标题化合物。反应完成后,将过量的三氟乙酸和二氯甲烷蒸发。将粗品在真空下干燥并与乙醚一起研磨,得到白色固体。将固体过滤并在空气中干燥,得到产物(320mg,96%)。将产物不经进一步纯化用于下一步骤。1h nmr(500mhz,dmso-d6)δ8.63(t,j=5.6hz,1h),8.10
–
8.02(m,1h),7.96(dd,j=6.9,2.2hz,1h),7.87(dd,j=7.0,2.4hz,1h),7.71(bs,3h),7.59
–
7.52(m,2h),
7.51
–
7.44(m,2h),4.76(d,j=5.6hz,2h),3.10
–
2.96(m,2h),2.53(t,j=6.8hz,2h)。
[0649]
实施例65
–
pks21220的制备
[0650][0651]
按照hatu介导的pks21013(16.0mg,50umol)和pks21211(19.6mg,74%)的偶联的一般程序合成标题化合物。反应完成(1h,温度升至10℃)后,将混合物通过制备型lcms纯化,得到产物(19.6mg,74%),为白色固体。1h nmr(500mhz,dmso-d6)δ8.43(t,j=5.7hz,1h),8.04(d,j=8.1hz,1h),7.99(d,j=8.1hz,1h),7.94(d,j=7.8hz,1h),7.84(d,j=8.0hz,1h),7.79(t,j=5.8hz,1h),7.59
–
7.50(m,2h),7.50
–
7.40(m,2h),7.34(s,1h),7.28
–
7.22(m,2h),7.21
–
7.13(m,3h),4.73(d,j=5.6hz,2h),4.55
–
4.45(m,1h),3.31
–
3.21(m,2h),2.80(t,j=8.0hz,2h),2.45
–
2.37(m,3h),2.32(t,j=7.5hz,2h),2.30
–
2.24(m,1h),1.21(s,9h)。
13
c nmr(126mhz,dmso)δ171.17,170.88,170.25,168.76,141.29,134.52,133.27,130.85,128.49,128.27,128.11,127.52,126.22,125.84,125.77,125.45,125.41,123.43,50.09,50.02,40.15,38.69,36.92,35.52,35.09,31.00,28.45。
[0652]
实施例66
–
测量二肽模拟物针对人组成性蛋白酶体和免疫蛋白酶体的胰凝乳蛋白酶活性的ic50
[0653]
在得自molecular devices(sunnyvale,ca)的spectramax gemini读板仪上进行测定。在黑色96孔板中,将含有0.4nm hu i-20s或0.2nm hu c-20s、15μm n-乙酰基-丙氨酸-天冬酰胺-色氨酸-7-氨基-4-甲基香豆素(ac-anw-amc)(i-20s的底物))或25μm n-琥珀酰基-亮氨酸-亮氨酸-缬氨酸-酪氨酸-7-氨基-4-甲基香豆素(suc-llvy-amc)(c-20s的底物)、缓冲液(50mm hepes、0.5mm edta,ph7.4)中的0.02%sds的100μl预温热测定混合物添加到以dmso中100x指示浓度含有1μl抑制剂的孔中。通过在37℃下监测460nm(γ
ex
=360nm)的荧光120分钟来记录每个孔的反应进程。由曲线的初始线性范围导出速度,并且通过抑制剂的百分比对抑制剂浓度作图(图1)获得ic50。
[0654]
实施例67
–
各种n、c封端的二肽模拟物的蛋白酶体抑制研究
[0655]
如实施例1中描述的那样,合成多种二肽模拟物并测试它们抑制蛋白酶体的能力。这些化合物可逆地抑制蛋白酶体。这些化合物针对人免疫蛋白酶体β5i和组成性蛋白酶体β5c的ic50列于表1。ic50曲线示于图1。这些数据表明,具有在天冬酰胺(自c-末端的第二个氨基酸)的酰胺侧链上的取代基和c-末端帽的化合物使所得二肽能相对人组成性蛋白酶体β5c活性位点选择性地抑制人免疫蛋白酶体β5i活性位点。
[0656]
表1.n、c封端的二肽模拟物的动力学参数和计算的logp
[0657]
[0658]
[0659]
[0660][0661]
虽然已经出于说明的目的对本发明进行了详细的描述,但要理解的是,这种细节是用于该目的的,并且本领域技术人员在不背离由以下权利要求限定的本发明的实质和范围的情况下可在其中进行改动。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1