抑制APOE蛋白活性和/或表达量的物质在延缓衰老中的应用
抑制apoe蛋白活性和/或表达量的物质在延缓衰老中的应用
技术领域
1.本发明属于生物医学领域,具体涉及抑制apoe蛋白活性和/或表达量的物质在延缓衰老中的应用。
背景技术:
2.载脂蛋白e(apoe)是脂蛋白复合物的经典成分,在脂质代谢、储存、分泌和递送中起核心作用。apoe是心血管疾病、骨关节炎、脂质营养不良等疾病的关键危险因素。
3.衰老很大程度上被认为是不可逆的过程,由细胞衰老的逐渐积累和随后的器官功能障碍引起。成人间充质祖细胞(hmpcs)会产生不同类型的细胞,如成骨细胞、软骨细胞和脂肪细胞。成人间充质祖细胞衰老能导致许多器官系统的老化,如骨骼系统和血管系统。器官衰老的标志之一是干细胞/祖细胞耗竭,又伴随着表观遗传改变。已有研究表明,在衰老的hmpcs中,lamina相关域(lads)内的染色质与核纤层分离,导致异染色质的无序和染色质结构更易接近,引起基因组不稳定,重复元件的异常激活,和衰老相关的分泌表型(sasp)。相比之下,异染色质稳定性的增强可以延迟hmpc衰老,这表明染色质稳定性的调节剂可能是延缓干细胞衰老的靶点。尽管apoe被认为主要存在于细胞外区室或细胞质中并参与脂质稳态,但一些研究报告apoe能存在细胞核中,但apoe在细胞核中的作用还未知。
技术实现要素:
4.本发明的目的是如何延缓衰老。
5.本发明首先保护抑制apoe蛋白活性和/或表达量的物质在制备产品中的应用;所述产品的功能可为如下c1)至c5)中的至少一种:c1)延缓衰老;c2)预防与衰老相关的疾病;c3)治疗与衰老相关的疾病;c4)抑制异染色质解体;c5)提高异染色质稳定性
6.本发明还保护抑制apoe蛋白活性和/或表达量的物质的应用,可为如下c1)至c5)中的至少一种:c1)延缓衰老;c2)预防与衰老相关的疾病;c3)治疗与衰老相关的疾病;c4)抑制异染色质解体;c5)提高异染色质稳定性。
7.上述任一所述的应用中,所述抑制apoe蛋白活性和/或表达量的物质可为z1)或z2):
8.z1)寡聚核酸sirna;编码所述寡聚核酸sirna的核苷酸序列如seq id no:1所示;
9.z2)以所述寡聚核酸sirna为靶点,由shrna表达系统合成的shrna。
10.上述任一所述的应用中,所述c1)中,延缓衰老可为延缓细胞衰老。所述细胞可为hmpc或人成纤维细胞。
11.本发明还保护apoe蛋白作为药物靶点在制备产品中的应用;所述产品的功能可为如下c1)至c5)中的至少一种:c1)延缓衰老;c2)预防与衰老相关的疾病;c3)治疗与衰老相关的疾病;c4)抑制异染色质解体;c5)提高异染色质稳定性。
12.上述应用中,所述c1)中,延缓衰老可为延缓细胞衰老。所述细胞可为hmpc或人成纤维细胞。
13.本发明还保护apoe蛋白在制备鼠模型中的应用;所述鼠模型具有衰老提前的表型;
14.所述应用是通过在小鼠中过表达apoe蛋白实现的。
15.本发明还保护apoe蛋白在制备产品中的应用;所述产品的功能可为a1)或a2)或a3);
16.a1)促进衰老;
17.a2)研究与衰老相关的疾病;
18.a3)制备具有衰老提前表型的鼠模型。
19.本发明还保护apoe蛋白的应用,可为a1)或a2)或a3);
20.a1)促进衰老;
21.a2)研究与衰老相关的疾病;
22.a3)制备具有衰老提前表型的鼠模型。
23.上述任一所述的应用中,所述a1)中,促进衰老可为促进细胞衰老。所述细胞可为hmpc或人成纤维细胞。
24.本技术的发明人发现病理或生理性衰老的hmpc中apoe蛋白表达量增加。apoe蛋白的过度表达导致hmpc衰老,而apoe蛋白的缺失延迟了hmpc衰老。发明人还发现,细胞核定位的apoe与多种核膜蛋白和异染色质相关蛋白相互作用并促进其不稳定,导致异染色质解体。增加的apoe蛋白通过破坏核膜和异染色质结构来引起hmpc衰老。此外,apoe过表达加速了hmpc和成纤维细胞的衰老。本发明具有重要的应用价值。
附图说明
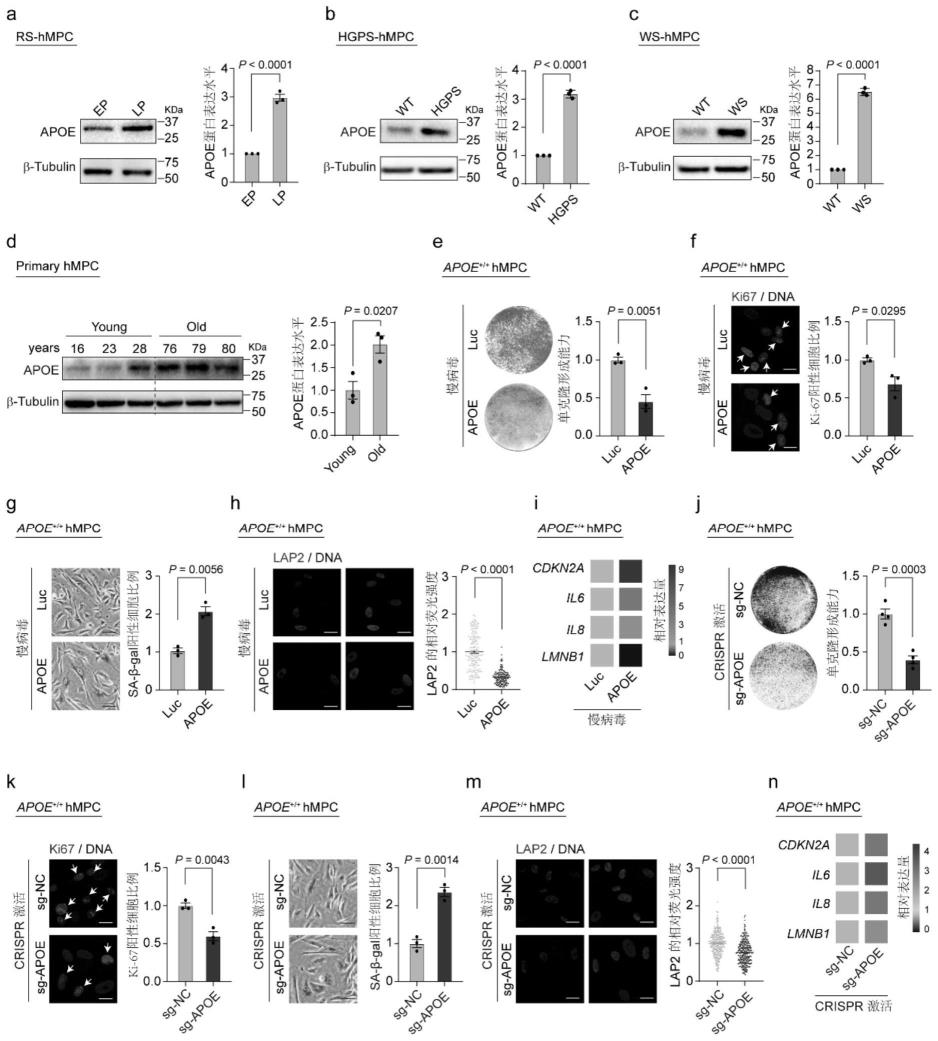
25.图1为apoe蛋白的表达量在衰老的hmpc中增加及强制apoe表达加速hmpc衰老。其中,a为apoe蛋白在复制性衰老的hmpc中表达量升高;b为apoe蛋白在儿童早衰症病人来源的hmpc中表达量升高;c为apoe蛋白在成人早衰症病人来源的hmpc中表达量升高;d为apoe蛋白在健康老年人牙齿来源的hmpc中表达量升高;e为过表达apoe蛋白后wt-hmpc的单克隆形成能力减弱;f为过表达apoe蛋白后wt-hmpc的ki-67阳性细胞比例降低;g为过表达apoe蛋白后wt-hmpc的sa-β-gal阳性细胞比例升高;h为过表达apoe蛋白后wt-hmpc的lap2荧光强度降低;i为过表达apoe蛋白后wt-hmpc的衰老标志物表达量升高;j为内源激活apoe后wt-hmpc的单克隆形成能力减弱;k为内源激活apoe后wt-hmpc的ki-67阳性细胞比例降低;l为内源激活apoe后wt-hmpc的sa-β-gal阳性细胞比例升高;m为内源激活apoe后wt-hmpc的lap2荧光强度降低;n为内源激活apoe后wt-hmpc的衰老标志物表达量升高。
26.图2为apoe蛋白缺失延缓hmpc衰老。其中,a为hesc向hmpc分化的示意图;b为流式筛选cd73、cd90和cd105阳性细胞;c为western blotting检测野生型及apoe-/-hesc中apoe蛋白表达量;d为apoe
+/+
hmpc和apoe-/-hmpc细胞的增殖曲线;e为apoe蛋白缺失的hmpc单克隆形成能力增强;f为apoe蛋白缺失的hmpc的ki-67阳性细胞比例升高;g为apoe蛋白缺失的hmpc的s期增加;h为apoe蛋白缺失的hmpc的sa-β-gal阳性细胞比例降低;i为apoe蛋白缺失的hmpc的lap2荧光强度升高;j为apoe蛋白缺失的hmpc的衰老标志物表达量降低;k为apoe蛋白缺失的hmpc分泌的il6,mcp1量降低;l为apoe蛋白缺失的hmpc的p16,p21蛋白表达量降低;m为apoe蛋白缺失的hmpc体内存留能力增强;n为过表达apoe蛋白后apoe-/-hmpc的单克
隆形成能力减弱;o为过表达apoe蛋白后apoe-/-hmpc的ki-67阳性细胞比例降低;p为过表达apoe蛋白后apoe-/-hmpc的sa-β-gal阳性细胞比例升高;q为过表达apoe蛋白后apoe-/-hmpc的lap2荧光强度降低;r为过表达apoe蛋白后apoe-/-hmpc的衰老标志物表达量升高。
27.图3为apoe促进核层和异染色质蛋白降解。其中,a为蛋白质谱示意图;b为外源免疫共沉淀实验证明apoe蛋白与kap1、lbr、emerin蛋白之间有相互作用;c为内源免疫共沉淀实验证明apoe蛋白与kap1、lbr、emerin蛋白之间有相互作用;d为免疫荧光证明apoe与emerin在核膜共定位。统计图显示了emerin与apoe共定位的百分比(右);e为wb证明在apoe-/-hmpc中kap1,lbr,emerin蛋白表达量升高;f为感染敲低apoe的慢病毒的apoe
+/+
hmpc中kap1、lbr和emerin蛋白的蛋白质稳定性分析;通过wb测定在存在蛋白质合成抑制剂放线菌酮(chx)处理的情况下指定时间点的kap1、lbr和emerin的蛋白质水平;g为用flag标记的apoe、3
×
nls(核定位信号)标记的apoe和3
×
nes(核输出信号)标记的apoe的慢病毒感染apoe-/-hmpcs中apoe(flag)和emerin的免疫荧光分析;统计图显示了emerin与apoe共定位的百分比(右);h为感染flag标记的apoe、3
×
nls(核定位信号)标记的apoe和3
×
nes(核输出信号)标记的apoe的慢病毒的apoe-/-hmpcs中kap1、lbr和emerin蛋白表达量分析;i为感染flag标记的apoe、3
×
nls(核定位信号)标记的apoe和3
×
nes(核输出信号)标记的apoe的慢病毒的apoe-/-hmpcs中sa-β-gal染色;j为wb证明感染apoe过表达病毒的apoe
+/+
hmpc在bfa1处理后kap1、emerin蛋白表达量上调。
28.图4为apoe通过破坏异染色质促进hmpc衰老。其中,a为感染过表达apoe病毒的apoe
+/+
hmpc中lamin a/c的免疫荧光分析;b为感染过表达apoe病毒的apoe
+/+
hmpc中细胞核面积统计;c为感染过表达apoe病毒的apoe-/-hmpc中lamin a/c的免疫荧光分析;d为感染过表达apoe病毒的apoe-/-hmpc中细胞核面积统计;e为apoe
+/+
hmpc和apoe-/-hmpc中lamin a/c的免疫荧光分析;f为apoe
+/+
hmpc和apoe-/-hmpc中细胞核面积统计;g为apoe
+/+
hmpc和apoe-/-hmpc中核周异染色质结构的电镜分析,核外围异染色质富集的细胞百分比显示在左上角;h为apoe
+/+
hmpc和apoe-/-hmpc中lamin a/c和h3k9me3免疫荧光的三维重构;i为chip-qpcr分析显示apoe蛋白在line1,satellite 2和alu区域富集。
29.图5为采用高通量测序研究核膜蛋白和异染色质蛋白与hmpc衰老的关系。其中,a为damid-seq文库制备和测序的工作流程;b为apoe-/-hmpc中lad区域的damid信号相对于所有染色体上apoe
+/+
hmpc中的damid信号增加的象形图。从蓝色到红色的颜色键分别代表apoe-/-hmpc中相对低到高的damid信号;c为线图显示与apoe
+/+
hmpc相比,apoe-/-hmpc中lad区域的damid信号增加;d为小提琴图显示与apoe
+/+
hmpc相比,apoe-/-hmpc中lad定位的line1、satellite和alu区域的damid信号增加;e为线图和热图显示apoe-/-hmpc中lad内的atac信号减少,从浅到深的颜色键分别代表apoe-/-hmpc中相对低到高的atac信号;f为apoe-/-hmpc中开放和紧凑的atac峰的重复元件分布分析;g为小提琴图显示apoe-/-hmpc中lad定位的line1、satellite和alu区域的atac信号减少;h为damid-seq和atac-seq信号的代表性轨迹显示apoe-/-hmpc中lad区域内的damid信号增加以及atac信号减少;i为chip-qpcr分析显示h3k9me3在line1和satellite 2区域内富集;j为rna-seq分析显示在apoe-/-hmpc中重复元件大部分下调;k为rt-pcr显示apoe-/-hmpc中重复元件表达量下调。
30.图6为不同衰老的hmpc模型中,敲低apoe后延缓hmpc细胞衰老。其中,a为感染敲低apoe病毒的rs-hmpcs、hgps-hmpcs、ws-hmpcs和来源老年健康人的hmpcs中h3k9me3荧光强
度增强;b为感染敲低apoe病毒的rs-hmpcs、hgps-hmpcs、ws-hmpcs和来源老年健康人的hmpcs中lap2荧光强度增强;c为感染敲低apoe病毒的rs-hmpcs、hgps-hmpcs、ws-hmpcs和来源老年健康人的hmpcs中衰老标志物表达量降低;d为感染敲低apoe病毒的rs-hmpcs、hgps-hmpcs、ws-hmpcs和来源老年健康人的hmpcs的单克隆形成能力增强。
31.图7为不同形式的细胞应激诱导的hmpc衰老模型中,敲低apoe后延缓hmpc细胞衰老。其中,a为在h2o2诱导衰老的hmpc中敲低apoe蛋白后h3k9me3荧光强度增强;b为在h2o2诱导衰老的hmpc中敲低apoe蛋白后sa-β-gal阳性细胞比例降低;c为在h2o2诱导衰老的hmpc中敲低apoe蛋白后ki-67阳性细胞比例升高;d为在h2o2诱导衰老的hmpc中敲低apoe蛋白后单克隆形成能力增强;e为在uv诱导衰老的hmpc中敲低apoe蛋白后h3k9me3荧光强度增强;f为在uv诱导衰老的hmpc中敲低apoe蛋白后sa-β-gal阳性细胞比例降低;g为在uv诱导衰老的hmpc中敲低apoe蛋白后ki-67阳性细胞比例升高;h为在uv诱导衰老的hmpc中敲低apoe蛋白后单克隆形成能力增强;i为在h-ras
v12
诱导衰老的hmpc中敲低apoe蛋白后h3k9me3荧光强度增强;j为在h-ras
v12
诱导衰老的hmpc中敲低apoe蛋白后sa-β-gal阳性细胞比例降低;k为在h-ras
v12
诱导衰老的hmpc中敲低apoe蛋白后ki-67阳性细胞比例升高;l为在h-ras
v12
诱导衰老的hmpc中敲低apoe蛋白后单克隆形成能力增强。
32.图8为敲低apoe延缓了成纤维细胞的衰老。其中,a为过表达apoe蛋白后成纤维细胞的h3k9me3荧光强度降低;b为过表达apoe蛋白后成纤维细胞的ki-67阳性细胞比例降低;c为过表达apoe蛋白后成纤维细胞的单克隆形成能力降低;d为敲低apoe蛋白后成纤维细胞的h3k9me3荧光强度增强;e为敲低apoe蛋白后成纤维细胞的ki-67阳性细胞比例升高;f为敲低apoe蛋白后成纤维细胞的单克隆形成能力增强;g为在h2o2诱导衰老的成纤维细胞中敲低apoe蛋白后h3k9me3荧光强度增强;h为在h2o2诱导衰老的成纤维细胞中敲低apoe蛋白后ki-67阳性细胞比例升高;i为在h2o2诱导衰老的成纤维细胞中敲低apoe蛋白后单克隆形成能力增强;j为在h-ras
v12
诱导衰老的成纤维细胞中敲低apoe蛋白后sa-β-gal阳性细胞比例降低;k为在h-ras
v12
诱导衰老的成纤维细胞中敲低apoe蛋白后ki-67阳性细胞比例升高;l为在h-ras
v12
诱导衰老的成纤维细胞中敲低apoe蛋白后单克隆形成能力增强。
具体实施方式
33.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
34.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
35.实施例、
36.一、实验方法
37.1、动物实验
38.所有动物实验均在中国科学院动物护理和使用机构委员会的批准下进行。购自spf(北京)生物技术有限公司的nod/scid小鼠(雄性,4周龄)饲养于生物物理研究所免疫缺陷动物实验室,光照/黑暗循环12小时,提供食物和水。
39.对于畸胎瘤形成实验,在小鼠皮下植入重悬于基质胶(bd biosciences):mtesr(1:4)混合物中的apoe
+/+
或apoe-/-的人胚胎干细胞(hesc)。在植入后12周左右,收集畸胎瘤用于进一步分析。
40.对于hmpc存留试验,将感染了表达荧光素酶(luc)病毒的apoe
+/+
或apoe-/-hmpcs注射到雄性裸鼠(6周龄)的胫骨前肌(ta)中,并在注射后0天和7天,使用ivis光谱成像系统检测荧光强度。
41.2、细胞培养
42.apoe
+/+
hesc(来自wicell研究所的h1hesc)和apoe-/-hesc维持在丝裂霉素c灭活的小鼠胚胎成纤维细胞(mef)饲养层上,使用含有dmem/f-12(thermo fisher scientific)、20%基因敲除血清替代品(thermo fisher scientific)、1%glutamax(thermo fisher scientific)、1%非必需氨基酸(neaa、thermo fisher scientific)、1%青霉素-链霉素(ps、thermo fisher scientific)、55μmβ-巯基乙醇和10ng/ml bfgf(joint protein central)的hesc培养基培养,或在matrigel包被的板上用mtesr培养基培养。
43.hmpc培养在明胶涂层板上,使用含有memα基础培养基(thermo fisher scientific)、10%胎牛血清(fbs、gibco、42f9083k)、1%ps、1%neaa和1ng/ml bfgf的hmpc培养基培养。当细胞密度达到95%时,以每孔1
×
105个的密度在6孔板中传代。
44.hek293t和人皮肤成纤维细胞(ag08469)在含有10%fbs和1%ps的高葡萄糖dmem(thermo fisher scientific)中培养。
45.3、apoe-/-hescs的产生
46.(1)使用crispr/cas9系统进行基因敲除。将靶向apoe基因第二个外显子的sgrna(编码sgrna的核苷酸序列为:5
’‑
ggttctgtgggctgcgttgc-3’(seq id no:1))克隆到pcag-mcherry-grna载体(addgene,#87110)中,得到sgrna载体。
47.(2)apoe
+/+
hescs在基质胶包被的板上用补充有rock抑制剂y-27632(selleck)的mtesr培养基培养24小时。
48.(3)使用4d nucleofector(lonza)将sgrna载体和pcag-1bpnls-cas9-1bpnls-2agfp载体(addgene,#87109)质粒电转到apoe
+/+
hesc中。随后将细胞在基质胶包被的板上培养48小时,用荧光激活细胞分选(facs)系统(bd facs aria ii)分选gfp/mcherry双阳性细胞,并在mef饲养层上用hesc培养基培养。
49.(4)进行基因组dna提取和测序分析。
50.4、apoe
+/+
和apoe-/-hmpc的产生与特征分析
51.apoe
+/+
和apoe-/-hmpcs是从apoe
+/+
和apoe-/-hescs分化而来的。
52.(1)胚状体(ebs)来源于hescs,并在有基质胶涂层板上含有memα基础培养基、10%fbs、1%ps、1%neaa、1ng/ml bfgf和5ng/ml tgfβ(人酶)的hmpc分化培养基中培养。
53.(2)大约10天后,将细胞转移到有明胶包被的平板上并在hmpc培养基中培养。
54.(3)使用facs选择cd73、cd90和cd105阳性标记的hmpc,cd34、cd43和cd45用作阴性标记。
55.(4)分别使用von kossa(genmed scientificsinc,usa)染色和骨钙素免疫染色、油红o(sigma)染色和fabp4免疫染色以及甲苯胺蓝(sigma)染色评估hesc衍生的hmpc对成骨细胞、脂肪细胞和软骨细胞的分化潜力。
56.5、原代hmpc的分离和培养
57.原代hmpc来源于志愿者牙龈(志愿者知情同意)。
58.(1)将牙龈组织切成碎片并在trypletm酶(thermo fisher scientific)和dispaseiv(thermo fisher scientific)中37℃消化30分钟。
59.(2)将样品通过70μm细胞过滤器(falcon)过滤并以500g离心10分钟。
60.(3)将所得沉淀物重新悬浮在hmpc培养基中,并种到用明胶包被的平板上进行细胞培养。
61.6、克隆扩增试验
62.(1)在明胶包被的板上培养的细胞用trypletm酶消化成单个细胞。
63.(2)以每孔2000个细胞的密度接种在涂有明胶的12孔板中。
64.(3)培养约12天后,pbs洗涤细胞2次,4%多聚甲醛(pfa)固定30分钟,结晶紫溶液(biohao)室温染色30分钟。
65.(4)用流动的自来水冲洗后,由epson perfection v370 photo或显微镜数码相机(olympus)拍摄图像,并由imagej量化相对细胞密度。
66.7、衰老相关β-半乳糖苷酶(sa-β-gal)染色
67.(1)培养在6孔板上的hmpc用pbs洗涤两次,在固定缓冲液(2%甲醛和0.2%戊二醛)中处理5分钟。
68.(2)向6孔板中加入2ml sa-β-gal染色液(含150mm nacl、2mm mgcl2、5mm k4[fe(cn)6]、5mm k3[fe(cn)6]、40mm柠檬酸/磷酸钠缓冲液和1mg/ml x-gal(amresco)的水溶液),37℃过夜。
[0069]
(3)用数码显微镜相机(olympus)捕获图像,并使用imagej计算sa-β-gal阳性细胞的比例。
[0070]
8、免疫荧光染色
[0071]
(1)将细胞接种在铺有明胶的盖玻片(thermo fisher scientific)上培养至密度为80%,然后用pbs洗涤细胞1次,用4%pfa固定10min,用0.4%triton x-100透化10min。
[0072]
(2)将细胞用10%驴血清(jackson immunoresearch)在室温下封闭1小时,与一抗在4℃下孵育过夜,二抗室温下孵育1小时。
[0073]
(3)通过leicasp5或zeiss-lsm900共聚焦系统捕获图像。
[0074]
(4)使用multi-sim系统进行高分辨率成像。
[0075]
(5)使用imagej确定免疫荧光强度。
[0076]
对于荧光信号密度分析,emerin信号曲线的两个峰值表示外围。为了避免不同细胞大小的干扰,外围之间的距离被归一化。使用r包ggplot2(v3.3.2)计算和绘制平均曲线。
[0077]
9、蛋白质印迹分析
[0078]
(1)将1
×
106个细胞在1
×
sds裂解缓冲液(62.5mm tris-hcl(ph6.8),2%(wt/vol)sds)中105℃的金属浴中裂解10分钟,用bca(二辛可宁酸)试剂盒(鼎果,bca02)进行蛋白质定量。
[0079]
(2)将制备的20μg蛋白质样品用于sds-page分离并电转移到pvdf膜(millipore),在室温下用5%脱脂牛奶(bbi life sciences)封闭1小时后,pvdf膜与一抗在4℃下孵育过夜,并在室温下与辣根过氧化物酶(hrp)偶联的适当二抗孵育1小时。
[0080]
(3)使用chemidoc xrs+系统(bio-rad)获得图像,并使用imagej测量目标蛋白的条带强度。
[0081]
10、蛋白质稳定性分析
[0082]
将放线菌酮(chx,sigma)以20μg/ml的终浓度添加到hmpc中,持续0、2、4、6或8小时,然后通过蛋白质印迹分析确定蛋白质水平。
[0083]
11、crispr/dcas9介导的apoe转录激活
[0084]
在含有dcas9-vp64表达盒的lentisam-v2载体中,用携带sg-nc或sg-aope的慢病毒转导apoe
+/+
hmpc。在转染后48小时,将细胞用杀稻瘟素(invivogen)和潮霉素(invivogen)处理7天。然后检测apoe表达量并进行表型分析。
[0085]
12、免疫共沉淀(co-ip)实验
[0086]
(1)对于外源性co-ip测定,用luc-flag或apoe-flag转染的hek293t细胞在chaps裂解缓冲液(含0.3%chaps、120mm nacl、1mm edta、40mm hepes和1
×
完全蛋白酶抑制剂混合物(roche)的溶液,ph7.5)中4℃下裂解2小时,之后12000g离心30分钟,将所得上清液与抗flag亲和凝胶(sigma,a2220)4℃孵育过夜。使用flag肽竞争性洗脱apoe相互作用蛋白复合物并进行蛋白质印迹分析。
[0087]
(2)对于内源性co-ip,收集apoe
+/+
hmpc和apoe-/-hmpc,重悬在chaps裂解缓冲液中,在冰上裂解2小时,然后在4℃下以12000g离心30分钟,将所得上清液与抗apoe(santa cruz,sc-13521)抗体混合,在4℃下孵育过夜。然后,将蛋白质-抗体混合物与蛋白质a/g-plus琼脂糖珠(santa cruz)一起在4℃下旋转孵育2小时。最后,收集蛋白质样品用于蛋白质印迹分析。
[0088]
13、液相色谱-串联质谱(lc-ms/ms)分析
[0089]
(1)从外源性co-ip分析中洗脱的蛋白质在10%sds-page凝胶上分离,并用考马斯亮蓝染色1小时。
[0090]
(2)从凝胶上切下目标蛋白的条带并用100%乙腈进行脱水、56℃还原(用10mm deloitte溶于25mm nh4hco3)45分钟、室温避光烷基化(用40mm碘乙酰胺溶于25mm nh4hco3)45分钟,然后在37℃下使用胰蛋白酶(worthington)消化过夜。
[0091]
(3)使用nanolc-qexactive质谱仪(thermofisher scientific)溶解肽以进行质谱分析。
[0092]
(4)使用maxquant(版本1.3.0.5)处理原始数据,使用proteomediscoverer(版本)分析生成的峰列表文件1.4.0.288和错误发现率(fdr)使用percolator计算,《1%作为肽置信度的阈值。仅存在于apoe-flag组中的蛋白质被认为是潜在的apoe相互作用蛋白质。
[0093]
(5)从基因本体数据库(http://geneontology.org/)获得核被膜和染色体相关的蛋白质信息。
[0094]
14、透射电子显微镜(tem)
[0095]
(1)apoe
+/+
hmpc和apoe-/-hmpc用trypletm酶消化成单个细胞,室温下500g离心5分钟,收获细胞沉淀。
[0096]
(2)细胞沉淀在4%戊二醛中,4℃固定过夜,用乙醇脱水,用低浓度树脂hm20浸润和包埋。
[0097]
(3)使用leica emuc6超薄切片机切片,然后用醋酸双氧铀和柠檬酸铅染色。
[0098]
(4)由spirit120-kv透射电子显微镜(fei公司)50获得图片。
[0099]
15、oct4启动子区域dna甲基化分析
[0100]
(1)使用dneasy blood&tissue kit(qiagen)提取hesc的基因组dna,并使用ez dna甲基化试剂盒(zymo research)进行亚硫酸氢盐处理。
[0101]
(2)使用la taq dna聚合酶(takara)通过pcr扩增oct4启动子区域的基因组dna片段,然后克隆到pmd20t载体(takara)中。从每个样品中挑选六个克隆,用通用引物m13进行测序。
[0102]
16、细胞周期分析
[0103]
(1)收获细胞并在-20℃下用70%乙醇固定过夜。
[0104]
(2)用pbs洗涤3次后,细胞用0.1%tritonx-100透化,用0.2mg/ml rnase a孵育,并用0.02mg/ml碘化丙啶染色溶液在37℃染色30分钟。
[0105]
(3)使用bd lsr fortessa cell analyzer进行细胞周期分析。
[0106]
17、小干扰rna(sirna)介导的atg5敲低
[0107]
(1)对于sirna介导的基因敲低,由ribobio(中国广州)合成靶向atg5(si-atg5)和非特异性对照sirna(si-nc)的sirna。
[0108]
(2)按照制造商的说明,使用lipofectamine rnaimax转染试剂(thermo fisher scientific)将si-atg5和si-nc单独转染到细胞中。
[0109]
(3)转染后72小时,收集细胞用于下游分析。
[0110]
18、核型分析
[0111]
核型分析由san valley diagnostics(beijing)进行,将hesc在烧瓶中培养至约70%汇合,并用karyomax(r)colcemid solution in hbss(thermo fisher scientific)处理以阻止细胞在m期。然后,通过胰蛋白酶消化收集细胞并使用标准g显带技术进行核型分析。
[0112]
19、慢病毒包装
[0113]
使用lipofectamine 3000转染试剂进行慢病毒包装。在48小时和72小时收集细胞上清,在4℃下以19400g超速离心2.5小时收获慢病毒颗粒。
[0114]
20、cnv分析
[0115]
(1)使用dneasy blood&tissue kit(qiagen)从1
×
106个细胞中提取hesc或hmpc的基因组dna。
[0116]
(2)在illumina hiseq
×
10平台上的dna质量控制、文库制备和测序。
[0117]
(3)使用已发布的r包进行数据分析,原始读数被修剪使用trimgalore,然后与人类hg19基因组对比,并使用hmmcopy_utils(https://github.com/shahcompbio/hmmcopy_utils)中的readcounter函数对每个500-kb窗口进行计数。r/bioconductor包hmmcopy(v1.26.0)用于校正拷贝数、gc含量和可映射性。
[0118]
21、致癌基因、紫外线(uv)和h2o2诱导的细胞衰老
[0119]
对于致癌基因诱导的细胞衰老,apoe
+/+
hmpcs或人成纤维细胞用pbabe-puro-rasv12逆转录病毒转导。对于紫外线诱导的细胞衰老,通xl-1000紫外线交联剂(spectronics corporation)以10j/m2照射apoe
+/+
hmpc。对于h2o2诱导的细胞衰老,将50μm h2o2添加到apoe
+/+
hmpc或人类成纤维细胞中24小时。当细胞达到95%汇合时,继续传代。在
h2o2处理后p2代时的细胞进行表型分析。
[0120]
22、chip-qpcr分析
[0121]
(1)将1
×
106个hmpc在1%甲醛(sigma)中室温交联10分钟,然后在室温下用0.125m甘氨酸(vwr international)中和处理5分钟。
[0122]
(2)将细胞在冰上裂解10分钟,并通过covaris s220聚焦超声仪(covaris)将染色质剪切成目标峰大小为100-500bp的片段。
[0123]
(3)收集上清液并与apoe抗体(santa cruz,sc-13521)或h3k9me3抗体(abcam,ab8898)偶联的dynabeadstm proteina(thermo fisher scientific,10006d)在4℃下孵育过夜。正常小鼠igg(cell signaling technology,3420)或正常兔igg(cell signaling technology,2729s)用作阴性对照。
[0124]
(4)使用热混合器在68℃下进行反向交联2小时,并通过苯酚-氯仿-异戊基提取和乙醇沉淀完成dna分离。然后对获得的dna片段进行qpcr分析。
[0125]
23、damid-seq
[0126]
(1)hek293t细胞分别转染plgw v5-ecodam慢病毒质粒和plgw ecodam-v5-emd慢病毒质粒(plgw v5-ecodam慢病毒质粒和plgw ecodam-v5-emd慢病毒质粒为basvan steensel教授的赠品),48小时后,以19400g超速离心2.5小时,依次收集dam和dam-emd病毒并重悬于pbs中。
[0127]
(2)将在明胶包被的6孔板上培养的2
×
105hmpc用dam或dam-emd病毒感染,每个细胞系三个重复。
[0128]
(3)感染72小时后,收集细胞并使用tianamp基因组dna试剂盒(天根,dp304)提取基因组dna。
[0129]
(4)对获得的基因组dna进行dpni消化、接头连接、dpnii消化、pcr扩增和纯化,之后用alwi(new england biolabs)消化扩增的dna以去除接头,使用ultratm dna library prep kit for illumina(new england biolabs)构建文库,在illumina novaseq平台上进行测序。
[0130]
24、damid-seq数据处理
[0131]
(1)来自dam和dam-emd数据的原始读数由cutadapt(v1.11)软件修剪,干净的读数由bowtie2(v2.2.9)以默认参数映射到ucsc人类hg19基因组。
[0132]
(2)舍弃低映射质量mapq《10)的读数、来自线粒体dna(chrm)的读数和使用samtools和picard软件的重复读数,进一步过滤映射读数。为了减少由测序深度引起的偏差,发明人为每个样本选择了相同数量的读数进行下游分析。使用r/bioconductor包hmmt(v0.1)执行lad调用。dam-emd和dam信号的log2比率[log2(dam-emd/dam)]是通过deeptools(版本3.3.0)软件为每个10个碱基对(bp)箱计算的,用于damid信号的可视化。
[0133]
25、鉴定lad定位的重复元件
[0134]
为了分析lad定位的重复元件,使用r/bioconductor包genomicranges(v1.36.0)中的findoverlappairs函数将重复元素的注释(来自homer)与lad区域相交。缺少测序覆盖的重复元素被丢弃,剩余的重复元素被认为是lad定位的重复元素。
[0135]
26、atac-seq
[0136]
(1)收集50000个细胞并用预冷的pbs洗涤两次。
[0137]
(2)在50μl裂解缓冲液(10mm tris-hcl ph 7.4、3mm mgcl2、10mm nacl、0.1%(v/v)nonidet p-40)中4℃下裂解10分钟。
[0138]
(3)通过与来自trueprep dna library prep kit v2 for illumina(vazyme biotech)37℃下孵育30分钟。pcr扩增、大小选择和质量控制后,文库在illumina novaseq平台上进行测序。
[0139]
27、atac-seq数据处理
[0140]
(1)trimgalore删除了低质量读数和适配器。
[0141]
(2)使用默认参数通过bowtie2(v2.2.9)将清洁读数映射到ucsc人类hg19基因组。映射的读数被过滤并随机采样,如上所述用于接下来分析。
[0142]
(3)为了计算atac-seq信号,使用deeptools(v3.3.0)软件的bam coverage函数将每个read扩展了250个碱基对(bp),并通过rpkm对每10bp的read计数进行了标准化。在使用参数
“‑‑
nomodel
‑‑
shift 0
‑‑
extsize 250”排除黑名单区域后,用macs2(v2.1.2)调峰值。使用homer“annotatepeaks”功能进行基因组注释。使用deseq2的diffbind bioconductor r包(v2.12.0)进行差分atac峰占用率分析。绝对倍数差异》1和fdr《0.05的一致峰被认为是差异富集的峰。剩余的峰被归类为共享峰。
[0143]
二、实验结果
[0144]
1、apoe蛋白的表达量在衰老的hmpc中增加
[0145]
(1)发明人首先检测增殖性早期传代(ep)和复制衰老晚期传代(lp)hmpc之间的apoe表达量。使用定量rt-pcr和蛋白质印迹分析,发现apoe蛋白在复制性衰老的hmpc中上调(见图1中a)。
[0146]
(2)发明人检查了apoe在两种不同的早衰症人类干细胞模型中的表达量。两种不同的早衰症分别为hutchinson-gilford早衰综合症hmpcs(hgps-hmpcs,lmnag608g/+hmpcs)和werner综合症hmpcs(ws-hmpcs,wrn-/-hmpcs),相对于野生型(wt)hmpc,apoe在两种细胞衰老模型中均增加(图1中b-c)。类似地,apoe在来源于老年人的原代hmpc中的表达量高于源自年轻个体的hmpc(图1中d)。
[0147]
上述结果表明,apoe蛋白的表达量在hmpc衰老时增加。
[0148]
2、强制apoe表达加速hmpc衰老
[0149]
为了研究hmpc中apoe过表达的后果,发明人用过表达apoe蛋白的慢病毒和表达荧光素酶(luc)的慢病毒作为对照分别感染年轻的wt hmpc(apoe
+/+
hmpc)。结果发现apoe过表达促进了hmpc的衰老,具体表现为单克隆扩增能力受损,ki67阳性细胞比例降低,sa-β-gal阳性细胞增加(图1中b和e-g)。此外,发明人观察到核层蛋白lap2和lamin b1(lmnb1)的表达降低,衰老标记基因cdkn2a(p16)以及衰老相关分泌表型(sasp)基因il6和il8在apoe过表达的hmpc中表达量增加(图1中h-i)。同样,使用crispr/dcas9系统激活内源性apoe在促进hmpc衰老方面表现出类似的效果(图1中j-n和图1中c-d)。
[0150]
3、apoe蛋白缺失延缓了hmpc衰老
[0151]
(1)发明人检测apoe的缺失是否对hmpc的衰老具有延缓作用。为此,发明人使用crispr/cas9系统敲除人类胚胎干细胞(hescs)中的apoe基因,并经蛋白质印迹分析证实成功获得了apoe缺陷的hescs。
[0152]
产生的apoe-/-hesc能表达胚胎干细胞多能性标记,如nanog、oct4和sox2,并保持
胚层分化潜能;并发现apoe缺陷的hesc不会改变其细胞周期、细胞增殖能力或oct4启动子区域dna甲基化水平。
[0153]
(2)根据核型分析和全基因组拷贝数变异(cnv)分析确定apoe缺乏不影响细胞核型和基因组完整性。
[0154]
上述结果表明,apoe缺失不影响hesc的多能性。
[0155]
(3)为了研究apoe缺乏对hmpc的影响,将apoe
+/+
和apoe-/-hesc分化为hmpc(见图2中a)。apoe
+/+
和apoe-/-hmpc均表达典型的hmpc标志物,包括cd73、cd90和cd105(图2中b),但不表达其他细胞类型的特征性标志物,例如cd34、cd43和cd45(图2中a)。通过蛋白质印迹分析证实了apoe蛋白的丢失(图2中c)。与apoe
+/+
hmpcs类似,apoe-/-hmpcs能够分化为成骨细胞、软骨细胞和脂肪细胞(图2中b-d)并保持基因组完整性(图2中e)。相比之下,通过生长曲线分析和单克隆扩增试验(图2中d-e)证明apoe-/-hmpcs的细胞增殖能力升高。同样,apoe的缺失在连续传代过程中延缓了hmpc衰老,这可以通过apoe-/-hmpc中ki67阳性细胞和s期细胞百分比增加以及sa-β-gal百分比降低来证明(图2中h)。
[0156]
(4)发明人还检测到lap2和lamin b1的表达上调以及apoe-/-hmpc中衰老标志物和sasp基因的下调表达(图2中i-l)。
[0157]
(5)通过将荧光素酶标记的apoe
+/+
和apoe-/-hmpc植入免疫缺陷小鼠的胫骨前肌,评估了apoe-/-hmpc的体内存留能力。相对于apoe
+/+
hmpc,观察到apoe-/-hmpc在体内存留能力更强(图2中m)。相比之下,将apoe重新引入apoe-/-hmpc中消除了对与apoe缺失相关的干细胞自我更新的有益影响(图2中n-r和i)。
[0158]
总之,数据表明apoe是hmpc衰老的驱动因素,并且apoe的缺失对hmpc具有老年保护作用。
[0159]
4、apoe促进核层和异染色质蛋白降解
[0160]
(1)为了研究apoe调节hmpc衰老的分子机制,发明人先进行免疫共沉淀(co-ip)分析,再进行质谱分析。结果鉴定了一系列与apoe相互作用的蛋白,部分蛋白质与染色体和核膜有关(图3中a)。
[0161]
(2)核膜蛋白lbr和emerin被鉴定为新的与apoe相互作用蛋白。apoe与这两种核膜蛋白之间的相互作用通过外源性和内源性co-ip分析得到验证(图3中b-c)。发明人还通过co-ip分析鉴定了核心异染色质成分krab相关蛋白1(kap1)作为apoe相互作用蛋白(图3中b-c)。
[0162]
(3)用慢病毒转导flag标记apoe,超分辨率免疫荧光成像显示apoe与emerin在apoe-/-hmpcs中共定位(图3中c-d),进一步支持核apoe和核膜层之间的相互作用。
[0163]
(4)发明人研究了apoe相互作用蛋白的表达是否可能受到apoe缺失的影响。通过蛋白质印迹,观察到apoe-/-hmpc中kap1、lbr和emerin的蛋白质水平增加(图3中e)。类似地,apoe敲低导致kap1、lbr和emerin的蛋白质稳定性增加(图3中f)。这些结果表明,apoe在核膜和异染色质相关蛋白水平方面的作用。
[0164]
(4)为了进一步剖析核定位和细胞质定位的apoe作用,构建了表达apoe的慢病毒载体,其标记有3
×
nls(核定位信号),以及标记3
×
nes(核输出信号)细胞质中的定向apoe病毒(图3中g)。用这些慢病毒以及表达wtapoe或luc的慢病毒载体转染apoe-/-hmpcs。超分辨率显微镜显示,3
×
nls标记的apoe占据了大部分核区域,近97%共定位于核层,而3
×
nes
标记的apoe几乎不与核膜接触(图3中g)。与wt apoe相比,3
×
nls标记的apoe加剧了异染色质损失并加速了apoe-/-hmpc的衰老(图3中h-i)。这些结果表明,核定位的apoe,尤其是核外围的apoe,是改变异染色质结构并引发hmpc衰老的主要驱动力。
[0165]
(5)探索apoe促进的核膜蛋白和异染色质相关蛋白的降解是否可能由自噬-溶酶体途径介导。用巴弗洛霉素a1抑制自噬降解途径恢复了在apoe过表达hmpc中降低的kap1和emerin的蛋白质水平(图3中j)。暗示apoe促进核层蛋白的降解和通过自噬-溶酶体途径的异染色质相关蛋白。
[0166]
5、apoe通过破坏异染色质促进hmpc衰老
[0167]
(1)核被膜蛋白和异染色质相关蛋白对于维持核稳态至关重要。与发明人的实验结果一致,升高的核apoe促进核层和异染色质蛋白的降解,apoe的过表达破坏了核结构以及异染色质(图4中a-d)。相比之下,apoe缺失导致hmpc的异常的核膜百分比降低和核面积减小,伴随着核外围异染色质域的增加(图4中e-h)。异染色质相关蛋白经常富含基因组重复元件,其中大部分位于lad区域,有助于沉默重复序列转录和sasp的抑制,而核纤层蛋白有助于将lad锚定在核外围。染色质免疫沉淀-定量聚合酶链反应(chip-qpcr)揭示了apoe与位于异染色质区域的基因组重复元件之间的关联,包括长散布重复元件(line1)、卫星序列(卫星2(sat2))和短散布重复元件alu(图4中i),支持apoe在破坏异染色质结构中的作用。
[0168]
(2)进一步,发明人采用高通量测序(damid-seq)鉴定dna腺嘌呤甲基转移酶来表征apoe-/-和apoe
+/+
hmpc中lad之间的差异(图5中a)。结果发现,apoe-/-hmpcs中lad的整个基因组中的damid信号增加(图5中b-c),尤其是在lad定位的重复元件,包括line1、卫星和alu(图5中c-d),表明在缺乏apoe的hmpc中lad区域形成增强。同时,在通过使用测序(atac-seq)分析转座酶可及染色质来评估apoe缺乏对染色体可及性的影响时,发现lad定位重复元件的atac信号在apoe-/-hmpcs中减少,与核膜下方更紧凑的异染色质结构一致(图5中e-h)。此外,异染色质标记h3k9me3在apoe-/-hmpc中重复元素的富集增加(图5中i)。rna-seq和逆转录定量实时pcr(rt-qpcr)分析进一步证明,这些重复元件在apoe-/-hmpcs中转录沉默(图5中j-k)。证实apoe缺乏至少部分通过维持核层稳态和稳定异染色质来发挥其老年保护作用。综上所述,结果表明,积累的apoe通过破坏hmpc中的异染色质,作为介导细胞衰老的驱动力。
[0169]
6、apoe敲低减轻了hmpc和成纤维细胞的衰老
[0170]
(1)为了进一步探索apoe用于延缓hmpc衰老的治疗潜力,发明人通过shrna敲低了复制性衰老hmpc(rs-hmpc)、早衰症来源的hmpc(hgps-hmpc和ws-hmpc)和来自健康的老年人的hmpc中的apoe蛋白。在所有衰老的hmpc模型中,观察到在apoe敲低时h3k9me3、lap2和lamin b1信号升高,核面积减小(图6中a-c)。在所有衰老的hmpc模型中,单克隆扩增能力增强,(图6中d)。apoe蛋白的敲低减轻了由不同形式的细胞应激诱导的hmpc衰老,包括h2o2处理、紫外线辐射和癌基因过表达。在这些hmpc老化模型中,敲低apoe后都能延缓细胞衰老,具体表现如h3k9me3信号增加、sa-β-gal阳性细胞百分比降低、ki67阳性细胞和单克隆扩增能力升高(图7中的a-l)。
[0171]
(2)将apoe在介导细胞衰老方面的范围扩大到人类原代成纤维细胞。与hmpc中的观察结果一致,apoe过表达也促进了人成纤维细胞的细胞衰老,表现为h3k9me3信号减少、
ki67阳性细胞减少和单克隆扩增能力受损(图8中a-c)。相反,apoe的敲低使复制衰老的人成纤维细胞以及致癌基因过表达或h2o2处理诱导的加速衰老的人成纤维细胞恢复活力(图8中d-l)。这些数据共同表明apoe至少在hmpc和人类成纤维细胞中是缓解衰老的潜在靶点。
[0172]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1