一种具备长效缓释的骨修复支架材料及其制备方法及应用与流程
一种具备长效缓释的骨修复支架材料及其制备方法及应用
发明领域
1.本发明属于骨组织修复工程材料领域,尤其涉及一种具备长效缓释的骨修复支架材料及其制备方法和应用。
背景技术:
2.目前骨移植已经成为仅次于输血的人体组织移植,广泛分布于矫形、口腔及颅面等多个领域。美国每年有超过150万人次因严重创伤、肿瘤、畸形等疾病涉及骨移植,在国内,这一数值也在两百万以上,随着现代交通、建筑和制造业的发展,人们生活水平和保健意识的提高,这一数值还将逐年增加。传统骨移植治疗中的自体骨移植由于其来源有限,术后并发症多,因此临床应用有限;异体骨移植虽来源充足,但其外源性易引发机体剧烈的免疫排斥反应,移植成功率亦低。
3.骨组织工程能够为骨缺损的修复提供更加理想的方法。但是在骨组织修复领域,现行的材料都不十分理想,传统的植入材料,例如:金属、陶瓷、高分子植入物等在生物相容性、生物活性、生物可降解性及与宿主骨的力学匹配性等方面都有各自的缺点。因此,全世界都在寻找一种生物相容性好、有足够强度、易塑形的骨缺损修复材料。
4.其中在支架构建材料方面,人们已利用聚乳酸、聚乙醇酸、聚乳酸-羟基乙酸共聚物、聚己内酯(poly-ε-caprolactone,pcl)等高分子材料构建三维骨组织工程多孔支架并获得成功,这些可降解的高分子材料被证明具有良好的生物相容性。pcl是一种生物可降解高分子聚合物,在骨与软骨修复方面有很大的应用潜力。pcl在构建支架所需要的周围条件下更稳定,较其他可降解高分子聚合物费用低。近些年来,国内外已有许多关于使用pcl制备骨组织工程支架的研究报告,表明了其在组织工程方面的良好应用前景。
5.目前骨组织工程中使用的信号分子均为外源性bmp,或采用缓释系统使bmp持续释放促进成骨,但外源性bmp或附着于缓释系统的bmp虽然明显增强成骨活性,但持续时间均不够长,作为缓释剂的材料也是一种异物存在于受区内,不利于骨的愈合和生长。
6.发明目的
7.本发明的目的是为了解决骨组织工程支架材料缓释性能的问题,将聚己内酯的端基用谷胱甘肽改性后与羟基磷灰石混合,得到一种生物相容性好,力学性能佳,且能够长期控制rhbmp-2释放的支架材料,并通过活性保护添加剂和碱性添加剂分别解决了rhbmp-2活性降低和plga酸性降解产物导致的酸性环境问题,最后与支架材料共同制备得到了一种高生物活性的药物缓控释制剂,能够更好地控制rhbmp-2在骨修复过程中的释放。
8.为了达到以上的发明目的,本发明采用了以下的技术方案:
9.一种具备长效缓释的骨修复支架材料,该材料包括改性聚己内酯。
10.作为优选,该材料由改性聚己内酯和纳米羟基磷灰石组成。
11.作为优选,所述改性聚己内酯是谷胱甘肽端基修饰的聚己内酯。
12.作为优选,所述改性聚己内酯的制备方法为:
13.1)端基为巯基的聚己内酯合成:将ε-己内酯,三氟磺酸亚锡加入聚合管中,室温下
搅拌15-30min,再加入巯基乙醇,混合均匀后经过3-4次“液氮冷却-抽真空-解冻”循环操作,真空条件下封管,室温下聚合12-24h,反应结束后将反应液用三氯甲烷稀释,再加入冷甲醇沉淀过滤得到聚合物后进行真空干燥;
14.2)谷胱甘肽与端基为巯基的聚己内酯偶联:将谷胱甘肽和步骤1)得到的聚合物溶解于dmso中,反应物在70-90℃下反应4-8h,。反应结束将反应液在水中沉淀过滤,再用thf溶解并在冷甲醇中沉淀,过滤得到聚合物,真空干燥产物。
15.本技术还提供了一种具有高生物活性的药物缓控释制剂,该制剂包括骨诱导生长因子rhbmp-2,用于维持rhbmp-2活性的活性保护剂和包裹rhbmp-2的plga微球,以及原位中和plga降解产物酸度的碱性添加剂和所述的支架材料。
16.作为优选,所述碱性添加剂是胆固醇改性的海藻酸钠。
17.作为优选,所述改性海藻酸钠的制备方法为:将海藻酸钠加入dmso溶液中并在50~60℃下搅拌至完全溶解,随后降至室温,再将胆固醇溶于三氯甲烷中后缓慢滴加至海藻酸钠溶解液中搅拌均匀,然后加入偶联剂dcc和催化剂dmap的混合溶液,在室温下搅拌反应20~30h,用4~6倍体积无水乙醇沉淀,离心去除上清液后真空干燥而得到。
18.本技术还提供了所述药物缓控释制剂的制备方法,其特征在于,该方法包括以下步骤:1)制备负载rhbmp-2且含活性保护剂的plga微球;2)制备含微球复合支架材料的药物缓控释制剂。
19.作为优选,所述方法的步骤1)具体操作方法为:把rhbmp-2冻干粉溶解在醋酸缓冲溶液中,然后加入活性保护剂,充分搅拌后加入含plga的乙腈,搅拌乳化后,加入液体石蜡和吐温-80的混合乳液中,搅拌完成后静置,再用石油醚和异丙醇交替洗涤后冻干,得到干燥的微球。
20.作为优选,所述方法的步骤2)具体操作方法为:首先把蒸馏水喷液氮中,用分样筛筛分选取110~360μm尺寸范围的冰粒子,储备待用;将改性聚己内酯溶于氯仿中,完全溶解后加入纳米羟基磷灰石干粉,超声波分散30-40min,加入载药微球,在室温下搅拌至混合均匀,在低于冰点温度下预冷,把冰粒子加入混合溶液,混合均匀后倒入模具中,然后将模具置入液氮中深度冷冻,完全冻结后脱模,放入冷冻干燥装置于-70℃~-50℃冷冻干燥48-60h去除氯仿溶剂,再在室温下真空干燥24-36h,以去除残余氯仿和水分,得到的产物溶解于醋酸水溶液,然后添加充分研磨后的碱性添加剂,混合搅拌均匀后得到药物缓控释制剂。
21.本发明的有益效果为:通过将谷胱甘肽作为两亲性聚酯的亲水段,对聚己内酯的端基进行修饰,不仅增加了聚己内酯的亲水性,还提高了聚己内酯的环境响应性,使其具有良好可控的降解速率。进一步添加纳米羟基磷灰石还改善了聚己内酯支架的热稳定性和力学性能。另外,本技术人基于以前的研究,进一步采用了胆固醇改性的海藻酸钠作为碱性添加剂,同时采用吐温-20和β-环糊精组合物作为活性保护剂,使支架材料所负载的rhbmp-2蛋白微球具有较高的生物活性,还具备良好的酸度调节能力和炎症缓解特性,最终复合制备得到具有良好缓控释性能和高rhbmp-2蛋白活性的药物缓控释制剂。
附图说明
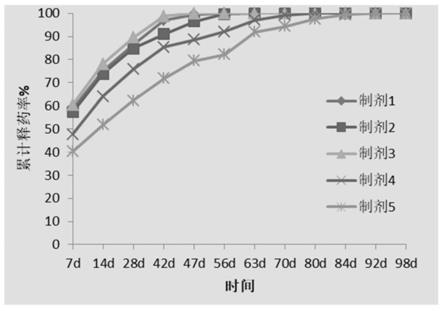
22.图1:含不同支架材料的药物缓控释制剂的释药行为;
23.图2:添加不同碱性添加剂的骨修复材料降解中ph值变化。
具体实施方式
24.下面通过具体实施例对本发明的技术方案作进一步描述说明。
25.本技术中的所有样品以实施例1成品制备方法为例,仅组成成分不同。
26.实施例1骨组织工程支架材料和药物缓控释制剂
27.主要实验材料:rhbmp-2由企业自行生产,具体生产过程参照申请人cn201910030649.0号中国专利申请中的生产方法(大肠杆菌中表达,离子交换层析纯化,检测大肠杆菌宿主残留蛋白《0.005%),抑菌圈法检测抗生素残留《0.1ppm。聚乙丙交酯(plga)由美国durect公司生产。二甲基亚砜(dmso)、n,n
‘‑
二环己烷碳二亚胺(dcc)、4-(n,n
‘‑
二甲胺基)吡啶(dmap)、吐温-20、β-环糊精、海藻酸钠,胆固醇,ε-己内酯,三氟磺酸亚锡,巯基乙醇,三氯甲烷,甲醇,谷胱甘肽,thf和dmso均购自市售产品。
28.制备方法:
29.改性聚己内酯:1)端基为巯基的聚己内酯合成:将ε-己内酯,三氟磺酸亚锡加入聚合管中,室温下搅拌15-30min,再加入巯基乙醇,混合均匀后经过3-4次“液氮冷却-抽真空-解冻”循环操作,真空条件下封管,室温下聚合12-24h,反应结束后将反应液用三氯甲烷稀释,再加入冷甲醇沉淀过滤得到聚合物后进行真空干燥;2)谷胱甘肽与端基为巯基的聚己内酯偶联:将谷胱甘肽和步骤1)得到的聚合物溶解于dmso中,反应物在70-90℃下反应4-8h,。反应结束将反应液在水中沉淀过滤,再用thf溶解并在冷甲醇中沉淀,过滤得到聚合物,真空干燥产物。
30.改性海藻酸钠:将海藻酸钠加入dmso溶液中并在50℃下搅拌至完全溶解,随后降至室温,再将胆固醇溶于三氯甲烷中后缓慢滴加至海藻酸钠溶解液中搅拌均匀,然后加入偶联剂dcc和催化剂dmap的混合溶液,在室温下搅拌反应24h,用4倍体积无水乙醇沉淀,离心去除上清液后真空干燥而得到。
31.药物缓控释制剂:1)制备负载rhbmp-2且含活性保护剂的plga微球:把rhbmp-2冻干粉溶解在醋酸缓冲溶液中,然后加入活性保护剂,充分搅拌后加入含plga的乙腈,搅拌乳化后,加入液体石蜡和吐温-80的混合乳液中,搅拌完成后静置,再用石油醚和异丙醇交替洗涤后冻干,得到干燥的微球;2)制备含微球复合支架材料的药物缓控释制剂:首先把蒸馏水喷液氮中,用分样筛筛分选取110~360μm尺寸范围的冰粒子,储备待用;将改性聚己内酯溶于氯仿中,完全溶解后加入纳米羟基磷灰石干粉,超声波分散30-40min,加入载药微球,在室温下搅拌至混合均匀,在低于冰点温度下预冷,把冰粒子加入混合溶液,混合均匀后倒入模具中,然后将模具置入液氮中深度冷冻,完全冻结后脱模,放入冷冻干燥装置于-70℃~-50℃冷冻干燥48-60h去除氯仿溶剂,再在室温下真空干燥24-36h,以去除残余氯仿和水分,得到的产物溶解于醋酸水溶液,然后添加充分研磨后的碱性添加剂,混合搅拌均匀后得到药物缓控释制剂。
32.实施例2药物缓控释制剂的体外释药行为
33.表1含不同支架材料的药物缓控释制剂
[0034][0035]
注:
“‑“
表示不含有某组分。
[0036]
取不同制剂样品加入到含pbs缓冲液的离心管中,置于恒温水浴摇床中。定期取出适量释药溶液,同时加入等量pbs缓冲液。使用紫外可见分光光度计通过标准曲线测定药物浓度(μg/ml),计算rhbmp-2的累积释放量和累积药物释放百分率。
[0037]
从图1可以看出,制剂5在初期无显著的爆发突释现象,整个释药过程呈现持续恒定的释放速率,且接近线性释放,释放行为直至第92天,更好地适应了骨修复重建的周期。而制剂3初期突释现象明显,释放行为仅维持47天,另外制剂1和制剂2初期也有一定程度的突释,其中制剂2释放周期较制剂1长,达到了63天。制剂4的释放周期达到了80天。说明以聚己内酯和纳米羟基磷灰石制备复合支架,能够较大地提高rhbmp-2的释放周期,其中进一步对聚己内酯进行改性得到的支架材料具有更好的缓控释能力,突释现象也大大降低。
[0038]
实施例3 rhbmp-2蛋白活性测定
[0039]
测定方法:体外碱性磷酸酶法:根据rhbmp-2可诱导c2c12细胞分化为成骨细胞,成骨细胞中的alp(碱性磷酸酶)可催化对硝基酚磷酸二钠盐转化为对硝基酚,而对硝基酚自身可以作为颜色指示剂,其颜色深浅与浓度成正比。本方法采用在37℃时单位质量rhbmp-2每分钟催化生成对硝基酚的量表示rhbmp-2的活性,单位为u/mg rhbmp-2。
[0040]
将各组样品用含有10%青链霉素的pbs缓冲液反复冲洗,放入6孔板中,每孔分别加入1ml样品溶液,每孔加入无血清α-mem培养基5ml,置于37℃5%,co2孵箱孵育。于孵育的第1d、5d、10d、20d分别提取条件培养基,提取完毕后,提取后的条件培养基1000rpm离心10分钟,收取上清,使用0.22μm滤器滤菌,分别标记为α-mem+(1d、5d、10d、20d),然后加入10%胎牛血清以及1%双抗溶液,分别转入50ml无菌离心管,放入-80℃冰箱保存备用。
[0041]
标准品溶液的制备:who生物活性国际标准品(nibsc代码:93/574):10μg/安瓿,每
安瓿5000单位的生物活性。换算生物活性5
×
105u/mg。取rhbmp-2国际标准品用完全培养基溶解,稀释至合适浓度,分装储存于-20℃冰箱中(保质期为2周)。用时取一份在4℃环境中缓慢化开。在96孔细胞培养板中,做2倍系列稀释,共8个稀释度,每个稀释度做2孔,以上操作在无菌条件下进行。
[0042]
样品溶液(供试品溶液)的制备:(1)取1-5号样品,分别加0.5%醋酸溶液完全溶解成约0.5mg/ml的溶液,每份样品分成2份。一份样品溶液用考马斯亮蓝法(bradford法)测定其蛋白质含量。(2)另一份样品溶液保存于2-8℃冰箱,用于换液。按比活性的估计值配成与标准品相当的浓度(约1μg/ml)。在96孔细胞培养板中,加完全培养基做2倍系列稀释,共8个稀释度,每个稀释度做2孔,以上操作在无菌条件下进行。
[0043]
rhbmp-2标准品测定生物学活性方法:
[0044]
(1)细胞培养:
①
用完全培养基,在含5%co2,37℃的二氧化碳培养箱中培养c2c12细胞。细胞以约2
×
104/cm2的密度接种于培养瓶中(加3.5ml细胞液至25cm2培养瓶中)。
②
待细胞汇合度达70%-80%,加胰酶消化液消化细胞。用完全培养基将细胞调成10
×
104/ml的单细胞悬液,以每孔50μl铺于96孔板中,置二氧化碳培养箱中培养。
[0045]
(2)换液:
①
细胞培养24小时后,将旧培养基倒掉,以每孔100μl加入新鲜的完全培养基。
②
分别以每孔100μl加入8个稀释度的标准品溶液和样品溶液,每个稀释度2孔。并以无rhbmp-2的新鲜培养基做空白对照。
③
将96孔板放于二氧化碳培养箱中继续培养46-52小时。
[0046]
(3)细胞裂解处理:培养结束后,弃掉培养基,用100μl/孔冷的生理盐水将细胞洗一遍,吸干残液,置于冰上冷却。每孔加入25μl细胞裂解液。
[0047]
(4)碱性磷酸酶测定:往检测孔中加入25μl检测缓冲液,50μl显色底物,枪头轻轻吹打混匀,用封口膜密封置于37℃水浴锅中反应15min,取出孔板加入100μl反应终止液。在405nm波长处测定吸光度,记录测定结果。若颜色过深,可以将测定液进行适当倍数的稀释。
[0048]
结果计算:
[0049]
试验数据采用计算机程序(如softmax软件)或四参数回归计算法进行处理,并按下式计算结果:
[0050][0051]
式中pr:标准品生物学活性,u/ml;ds:样品预稀释倍数;dr:标准品预稀释倍数;es:供试品相当于标准品半效量的稀释倍数;er:标准品半效量的稀释倍数。
[0052]
实施例4 rhbmp-2活性检测结果
[0053]
样品组:表2不同活性保护添加剂的载药微球
[0054][0055]
注:
“‑“
表示不含有某组分。
[0056]
表3不同活性保护剂和碱性保护剂的骨修复材料
[0057][0058]
注:
“‑“
表示不含有某组分。
[0059]
根据实施例4的检测方法得到如下测定结果:
[0060]
表4 rhbmp-2生物学活性检测结果
[0061][0062][0063]
从表4的实验数据发现,单独仅添加吐温-20或β-环糊精作为活性保护剂的1号样品和2号样品的rhbmp-2蛋白活性较高,活性保护作用均大于吐温-20和β-环糊精合用的3-5号样品。说明在仅添加活性保护剂不含碱性添加剂的情况下,其中当吐温-20和β-环糊精共同作为活性保护剂时,rhbmp-2蛋白的活性反而降低了,比单独使用吐温-20或β-环糊精时的活性保护作用要小,与本技术人推测的不一致。
[0064]
本技术人选择了蛋白保护活性作用较高的吐温-20作活性保护剂,进一步添加三种不同的碱性添加剂,发现对蛋白的活性基本没有影响。同时从9号样品和10号样品的实验数据中发现,在添加有同比例的吐温-20和β-环糊精的情况下,进一步添加碱性添加剂海藻酸钠或赖氨酸,对蛋白质的活性提升效果不佳。但通过添加经胆固醇酯化改性后的海藻酸钠后,得到的11号样品的蛋白活性有了较大的提升,并且高于1号样品。说明改性海藻酸钠、吐温-20和β-环糊精三者的组合使用,能够获得较大的rhbmp-2活性保护作用。
[0065]
实施例5不同碱性添加剂骨修复材料的体外降解行为评价
[0066]
表5不同碱性添加剂的骨修复材料
[0067][0068]
注:
“‑“
表示不含有某组分。
[0069]
取相同质量的9-13号样品,去污、蒸馏水冲洗,干燥后,加入10ml pbs(ph=7.4)缓冲液完全浸润,放入37℃恒温水浴锅内进行降解实验,降解过程中不予任何干预措施,使降解系统保持常态。每周固定时间用ph计测定5种样品的浸泡液的ph值,绘制ph值变化曲线。
[0070]
从图2可以发现,添加了碱性添加剂的骨修复材料可以缓解降解过程中的集酸程度的能力大小。其中,和文献一致的是9号样品对降解过程的ph值调节作用较弱,8号样品的调节作用较强,说明赖氨酸作为碱性添加剂的缓解酸度的能力比海藻酸钠要好,而10号样品的ph下降的幅度接近于9号样品,说明通过酯化改性的海藻酸钠可以达到和赖氨酸相接近的缓解集酸程度的能力。另外,通过不同比例的吐温-20和β-环糊精的组合物,发现11号样品的ph调节作用较强,说明本发明在该含量比的活性保护剂和碱性添加剂下制备得到的骨修复材料的酸度缓解能力较好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1