一种脂肪间充质干细胞分泌因子的制备方法与流程
1.本技术涉及间充质干细胞分泌因子提取领域,更具体地说,它涉及一种脂肪间充质干细胞分泌因子的制备方法。
背景技术:
2.间充质干细胞(mesenchymalstemcell,msc)是属于中胚层的一类多能干细胞,具有强大的增殖能力和多向分化潜能,在适宜的体内或体外环境下不仅可分化为成骨细胞、软骨细胞、脂肪细胞,还具有分化为肌细胞、肝细胞、造血细胞、神经细胞、胰岛细胞等多种细胞的能力,ms细胞可以在适合的环境中分化成特定细胞来修复损伤组织,而旁分泌作用在治疗组织损伤中发挥了更大的作用,即msc分泌细胞因子在组织修复中起了很大的作用。
3.相关技术中,在间充质干细胞分泌因子的提取过程中,选取细胞活力较强的第三代间充质干细胞作为分泌因子来源,于培养瓶中培养第三代间充质干细胞;待细胞融合度达到80%以上时,吸去培养上清液,使用pbs液清洗两次,更换为无血清培养基;培养48小时后收集上清液,用0.22μm的滤膜过滤,将上清液倒入90mm无菌培养皿中,放入冻干箱内预冻;当温度降至-40℃,培养液预冻完毕,抽真空使气压压强下降至100pa以下,升高温度升至-36℃,开始冷冻干燥,持续约24h后收集冻干粉末,于-80℃保存。
4.针对上述中的相关技术,本技术人认为通过添加人血清白蛋白可以使得上清液中的间充质干细胞(msc)分泌因子更加稳定,但间充质干细胞分泌因子在临床上多用于过敏性疾病的治疗,当msc分泌因子应用于使用者患处并用于组织修复时,其在使用过程中已受到过敏原的影响而导致其整体稳定性大大降低,进而导致其组织修复效果不佳,因此,需要提出一种新的方案来解决上述问题。
技术实现要素:
5.为了使间充质干细胞分泌因子不易受到过敏原的影响,并发挥出优异稳定的组织修复作用,本技术提供一种脂肪间充质干细胞分泌因子的制备方法。
6.本技术提供的一种脂肪间充质干细胞分泌因子的制备方法,采用如下的技术方案:一种脂肪间充质干细胞分泌因子的制备方法,包括以下步骤:步骤一,细胞复苏:对脂肪间充质干细胞进行细胞复苏;步骤二,传代培养:使用传代培养基对脂肪间充质干细胞进行传代培养;步骤三,分泌因子收获:移除传代培养基,收集上清液,得到脂肪间充质干细胞分泌因子;上述步骤二中的传代培养基包含以下重量份的原料:干细胞基础培养基400-600ml/l、l-丙氨酰-l-谷氨酰胺1-3mmol/l、4-2-羟乙基-1-哌嗪乙磺酸10-20μmol/l、胰岛素2.0-6.0μg/ml、d-葡萄糖10-20g/l、l-抗坏血酸10-100μmol/l、30-50μg/ml全反式维甲酸、血清蛋白0.3-0.8μg/ml、类胰蛋白酶0.1-0.3μg/ml、人参皂苷10.0-20.0μg/ml。
7.通过采用上述技术方案,在传代培养过程中,不仅对脂肪间充质干细胞具有优异的增殖分化作用,还能够通过血清蛋白、类胰蛋白酶和人参皂苷之间能够起到良好的复配
增效作用,其能够使脂肪间充质干细胞分泌因子在应用过程中能够弱化引起过敏的变应原以及神经肽来抑制过敏原的影响,并能够调节脂肪间充质干细胞分泌因子的活力,进而使得到的脂肪间充质干细胞分泌因子具有良好的稳定性,不易受到过敏原的影响,以便更加长久地发挥其生物活性,并能够发挥出良好稳定的组织修复效果。
8.优选的,所述传代培养基包括干细胞基础培养基460ml/l、l-丙氨酰-l-谷氨酰胺2.2mmol/l、4-2-羟乙基-1-哌嗪乙磺酸15μmol/l、胰岛素3.5μg/ml、d-葡萄糖14g/l、l-抗坏血酸56μmol/l、35μg/ml全反式维甲酸、血清蛋白0.6μg/ml、类胰蛋白酶0.2μg/ml、人参皂苷16μg/ml。
9.通过采用上述技术方案,采用上述组分比例得到的传代培养基,各组分原料之间能够起到良好的配合作用,并发挥出优异的传代培养小样,得到品质优异的脂肪间充质干细胞分泌因子。
10.优选的,所述传代培养基中还加入有1-2g/l的混合助剂,所述混合助剂由诱导增强剂和分泌增强剂按质量比为1:(0.2-0.6)组成。
11.通过采用上述技术方案,混合助剂中的诱导增强剂和分泌增强剂之间相互作用,对脂肪间充质干细胞的传代培养的增殖分化作用起到优异的促进作用,能够快速扩增脂肪间充质干细胞同时又不影响脂肪间充质干细胞的潜能,进而提高脂肪间充质干细胞分泌因子的活性和抗性,得到脂肪间充质干细胞分泌因子的品质大大提高。
12.优选的,所述诱导增强剂选用亚硒酸钠、三磷酸腺苷和二甲基甲酰胺中的任意一种或任意多种按任意比的组合物。
13.通过采用上述技术方案,上述种类的诱导增强剂均能够对脂肪间充质干细胞的传代培养的增殖分化作用起到优异的促进作用。
14.优选的,所述分泌增强剂选用亚麻酸、羟基磷脂和脂肪醇聚氧乙烯醚中的任意一种或任意多种按任意比的组合物。
15.通过采用上述技术方案,上述种类的诱导增强剂均能够对脂肪间充质干细胞的传代培养的增殖分化作用起到优异的促进作用。
16.优选的,所述混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.4组成。
17.通过采用上述技术方案,上述比例的诱导增强剂和分泌增强剂组成的混合助剂,在应用时发挥的效果最为优异。
18.优选的,所述干细胞基础培养基选用bme培养基、dmem培养基和mem培养基中的任意一种。
19.通过采用上述技术方案,上述培养基对细胞生长增殖有显著促进作用,均能够在操作使用过程中,能够快速扩增脂肪间充质干细胞同时又不影响脂肪间充质干细胞的潜能,有利于脂肪间充质干细胞分泌因子的提取收获。
20.优选的,所述步骤一具体包括如下操作:a1:向离心管中倒入基础培养基8-10ml,预热到35-40℃,静置待用;a2:将从液氮罐中提取的带有冻存管的脂肪间充质干细胞放入35-40℃水浴锅中,旋盖朝上直立放置,水面不得没过冻存管管盖,摇动冻存管,使冻存液快速融化;a3:冻存管中的脂肪间充质干细胞融化后,旋开管盖,用移液管吸取脂肪间充质干细胞到操作a1中装有基础培养基的离心管内,并用移液管向转空的冻存管中加入0.8-1ml
基础培养基,轻轻震荡冲洗管壁,将冲洗液倒入对应的离心管中,拧紧管盖,颠倒混匀,放入离心机,300g离心5-10min;a4:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入基础培养基,定容至9-10ml,旋紧管盖,颠倒混匀,放入离心机,300g离心5-10min;a5:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入溶液c,溶液c的加入量为4-5ml/支,旋紧管盖,颠倒混匀,得到细胞悬液;a6:用移液管吸取溶液c,按照28-30ml/瓶量加入到t-175培养瓶中,用移液管吸取操作a5中得到的细胞悬液,接种至t-175培养瓶中,细胞接种量为1.0
×
10
6-1.2
×
106/t-175,拧紧瓶盖,晃动均匀,标记编码,标记操作日期将培养瓶放入培养箱中培养68-72h。
21.通过采用上述技术方案,在细胞复苏过程中,缓慢逐滴加入细胞悬液是使细胞逐步适应高渗,不易对脂肪间充质干细胞造成损伤,能够使脂肪间充质干细胞的形态结构保持稳定正常。
22.优选的,所述步骤二具体包括如下操作:b1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;b2:用移液管吸取生理盐水,加入t-175培养瓶,8-10ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,再用移液管吸取溶液d,按照4-5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;b3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4-5ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;b4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至40-50ml离心管,旋紧管盖,放入离心机,300g离心5-10min;b5:取出离心管,倒弃上清液,震散细胞沉淀,倒入传代培养基,定容至40-50ml,拧紧管盖,颠倒混匀,放入离心机,300g离心5-10min;b6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入18-20ml传代培养基,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个50ml-250ml离心管,然后清洗离心管,并将各清洗液汇集至所并入细胞的离心管中;b7:向离心管中倒入4-5ml溶液c,拧紧管盖,颠倒混匀,向离心管中再次倒入溶液c,调整细胞密度为1.0
×
10
6-1.2
×
106个/ml,得到细胞悬液;b8:用移液管吸取溶液c,按照20-28ml/瓶量加入新t-175培养瓶中,平稳叠放待用,用移液管吸取操作b7中得到细胞悬液,按照1.5-2.0ml/瓶量接种至t-175培养瓶中;b9:拧紧瓶盖,晃动均匀,标记编码,标记操作日期,将培养瓶放入培养箱中培养68-72h;所述溶液c中的组分主要包括基础培养基和血清替代物,然后制成含4-5%血清替代物的培养基,标记为溶液c;所述溶液d中主要由0.25-0.3%胰酶20ml加入30ml生理盐水中混匀得到,标记为溶液d。
23.通过采用上述技术方案,能够使复苏后的脂肪间充质干细胞能够保持良好稳定的
生长速度,且使经传代培养基培养得到的脂肪间充质干细胞具有良好稳定的活性,且增强了脂肪间充质干细胞在体外培养过程中分泌生物活性因子的能力,便于后续脂肪间充质干细胞分泌因子的提取。
24.优选的,所述步骤三具体包括如下操作:s1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;s2:用移液管吸取生理盐水,加入t-175培养瓶,8-10ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,用移液管吸取溶液d,按照4-5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;s3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4-5ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;s4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至40-50ml离心管,旋紧管盖,放入离心机,300g离心5-10min;s5:取出离心管,倒弃上清液,震散细胞沉淀,倒入生理盐水,定容至40-50ml,拧紧管盖,颠倒混匀,放入离心机,300g离心5-10min;s6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入15-20ml生理盐水,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个50-100ml离心管,并清洗各离心管,并将各清洗液汇集所并入细胞的离心管中;s7:向离心管中倒入生理盐水,定容到50-100ml,拧紧管盖,颠倒混匀,将离心管放入﹣80-﹣70℃下冷冻30-40min,完全冷冻后取出室温融化,重复此操作2-3遍;s8:将操作s7中离心管样品放入离心机,300g离心5-10min;将上清液倒入无菌血清瓶,用生理盐水定容到450-550ml,得到脂肪间充质干细胞分泌因子。
25.通过采用上述技术方案,能够更好的提取收获脂肪间充质干细胞分泌因子,并使得到的脂肪间充质干细胞分泌因子具有良好稳定的活性。
26.综上所述,本技术具有以下有益效果:在传代培养过程中,通过血清蛋白、类胰蛋白酶和人参皂苷之间能够起到良好的复配增效作用,能够调节脂肪间充质干细胞分泌因子的活力,进而使得到的脂肪间充质干细胞分泌因子不易受到过敏原的影响,能够发挥出优异稳定的生物活性。
具体实施方式
27.以下结合实施例对本技术作进一步详细说明。实施例
28.实施例1一种脂肪间充质干细胞分泌因子的制备方法,具体包括以下步骤:步骤一,细胞复苏:对脂肪间充质干细胞进行细胞复苏,具体包括如下操作:a1:向离心管中倒入基础培养基10ml,预热到37.5℃,静置待用;a2:将从液氮罐中提取的带有冻存管的脂肪间充质干细胞放入37.5℃水浴锅中,旋盖朝上直立放置,水面不得没过冻存管管盖,摇动冻存管,使冻存液快速融化;a3:冻存管中的脂肪间充质干细胞融化后,旋开管盖,用移液管吸取脂肪间充质干
细胞到操作a1中装有基础培养基的离心管内,并用移液管向转空的冻存管中加入1ml基础培养基,轻轻震荡冲洗管壁,将冲洗液倒入对应的离心管中,拧紧管盖,颠倒混匀,放入离心机,300g离心5min;a4:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入基础培养基,定容至10ml,旋紧管盖,颠倒混匀,放入离心机,300g离心5min;a5:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入溶液c,溶液c的加入量为5ml/支,旋紧管盖,颠倒混匀,得到细胞悬液;a6:用移液管吸取溶液c,按照30ml/瓶量加入到t-175培养瓶中,用移液管吸取操作a5中得到的细胞悬液,接种至t-175培养瓶中,细胞接种量为1.2
×
106/t-175,拧紧瓶盖,晃动均匀,标记编码,标记操作日期将培养瓶放入培养箱中培养72h;步骤二,传代培养:使用传代培养基对脂肪间充质干细胞进行传代培养,具体包括如下操作:b1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;b2:用移液管吸取生理盐水,加入t-175培养瓶,10ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,再用移液管吸取溶液d,按照5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;b3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照5ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;b4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至50ml离心管,旋紧管盖,放入离心机,300g离心5min;b5:取出离心管,倒弃上清液,震散细胞沉淀,倒入传代培养基,定容至50ml,拧紧管盖,颠倒混匀,放入离心机,300g离心5min;b6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入20ml传代培养基,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个250ml离心管,然后清洗离心管,并将各清洗液汇集至所并入细胞的离心管中;b7:向离心管中倒入5ml溶液c,拧紧管盖,颠倒混匀,向离心管中再次倒入溶液c,调整细胞密度为1.2
×
106个/ml,得到细胞悬液;b8:用移液管吸取溶液c,按照28ml/瓶量加入新t-175培养瓶中,平稳叠放待用,用移液管吸取操作b7中得到细胞悬液,按照2.0ml/瓶量接种至t-175培养瓶中;b9:拧紧瓶盖,晃动均匀,标记编码,标记操作日期,将培养瓶放入培养箱中培养72h;步骤三,分泌因子收获:移除传代培养基,收集上清,得到脂肪间充质干细胞分泌因子,具体包括如下操作:s1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;s2:用移液管吸取生理盐水,加入t-175培养瓶,10ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,用移液管吸取溶液d,按照5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;s3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照5ml/瓶量沿t-175培
养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;s4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至50ml离心管,旋紧管盖,放入离心机,300g离心5min;s5:取出离心管,倒弃上清液,震散细胞沉淀,倒入生理盐水,定容至50ml,拧紧管盖,颠倒混匀,放入离心机,300g离心5min;s6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入20ml生理盐水,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个50ml离心管,并清洗各离心管,并将各清洗液汇集所并入细胞的离心管中;s7:向离心管中倒入生理盐水,定容到50ml,拧紧管盖,颠倒混匀,将离心管放入﹣80℃下冷冻40min,完全冷冻后取出室温融化,重复此操作2遍;s8:将操作s7中离心管样品放入离心机,300g离心5min;将上清液倒入无菌血清瓶,用生理盐水定容到550ml,得到脂肪间充质干细胞分泌因子。
29.注:上述步骤操作中的传代培养基包括干细胞基础培养基460ml/l、l-丙氨酰-l-谷氨酰胺2.2mmol/l、4-2-羟乙基-1-哌嗪乙磺酸15μmol/l、胰岛素3.5μg/ml、d-葡萄糖14g/l、l-抗坏血酸56μmol/l、35μg/ml全反式维甲酸、血清蛋白0.6μg/ml、类胰蛋白酶0.2μg/ml、人参皂苷16μg/ml。溶液c中的组分主要包括基础培养基和血清替代物,然后制成含4%血清替代物的培养基,标记为溶液c。溶液d中主要由0.25%胰酶20ml加入30ml生理盐水中混匀得到,标记为溶液d。血清替代物选用为elitegrotm,购自上海贝宝生物科技有限公司;基础培养基选用bme培养基,购自上海哈灵生物科技有限公司。干细胞基础培养基选用dmem培养基,购自大连美仑生物技术有限公司。
30.实施例2一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,具体包括以下步骤:步骤一,细胞复苏:对脂肪间充质干细胞进行细胞复苏,具体包括如下操作:a1:向离心管中倒入基础培养基8ml,预热到35℃,静置待用;a2:将从液氮罐中提取的带有冻存管的脂肪间充质干细胞放入35℃水浴锅中,旋盖朝上直立放置,水面不得没过冻存管管盖,摇动冻存管,使冻存液快速融化;a3:冻存管中的脂肪间充质干细胞融化后,旋开管盖,用移液管吸取脂肪间充质干细胞到操作a1中装有基础培养基的离心管内,并用移液管向转空的冻存管中加入0.8ml基础培养基,轻轻震荡冲洗管壁,将冲洗液倒入对应的离心管中,拧紧管盖,颠倒混匀,放入离心机,300g离心10min;a4:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入基础培养基,定容至9ml,旋紧管盖,颠倒混匀,放入离心机,300g离心10min;a5:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入溶液c,溶液c的加入量为4ml/支,旋紧管盖,颠倒混匀,得到细胞悬液;a6:用移液管吸取溶液c,按照28ml/瓶量加入到t-175培养瓶中,用移液管吸取操作a5中得到的细胞悬液,接种至t-175培养瓶中,细胞接种量为1.0
×
106/t-175,拧紧瓶盖,晃动均匀,标记编码,标记操作日期将培养瓶放入培养箱中培养68h;步骤二,传代培养:使用传代培养基对脂肪间充质干细胞进行传代培养,具体包括
如下操作:b1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;b2:用移液管吸取生理盐水,加入t-175培养瓶,8ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,再用移液管吸取溶液d,按照4ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;b3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;b4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至40ml离心管,旋紧管盖,放入离心机,300g离心10min;b5:取出离心管,倒弃上清液,震散细胞沉淀,倒入传代培养基,定容至40ml,拧紧管盖,颠倒混匀,放入离心机,300g离心10min;b6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入18ml传代培养基,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个50mlml离心管,然后清洗离心管,并将各清洗液汇集至所并入细胞的离心管中;b7:向离心管中倒入4ml溶液c,拧紧管盖,颠倒混匀,向离心管中再次倒入溶液c,调整细胞密度为1.0
×
106个/ml,得到细胞悬液;b8:用移液管吸取溶液c,按照20ml/瓶量加入新t-175培养瓶中,平稳叠放待用,用移液管吸取操作b7中得到细胞悬液,按照1.5ml/瓶量接种至t-175培养瓶中;b9:拧紧瓶盖,晃动均匀,标记编码,标记操作日期,将培养瓶放入培养箱中培养68h;步骤三,分泌因子收获:移除传代培养基,收集上清,得到脂肪间充质干细胞分泌因子,具体包括如下操作:s1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;s2:用移液管吸取生理盐水,加入t-175培养瓶,8ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,用移液管吸取溶液d,按照4ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;s3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;s4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至40ml离心管,旋紧管盖,放入离心机,300g离心10min;s5:取出离心管,倒弃上清液,震散细胞沉淀,倒入生理盐水,定容至40ml,拧紧管盖,颠倒混匀,放入离心机,300g离心10min;s6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入15-20ml生理盐水,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个100ml离心管,并清洗各离心管,并将各清洗液汇集所并入细胞的离心管中;s7:向离心管中倒入生理盐水,定容到100ml,拧紧管盖,颠倒混匀,将离心管放入﹣70℃下冷冻30min,完全冷冻后取出室温融化,重复此操作3遍;s8:将操作s7中离心管样品放入离心机,300g离心10min;将上清液倒入无菌血清
瓶,用生理盐水定容到450ml,得到脂肪间充质干细胞分泌因子。
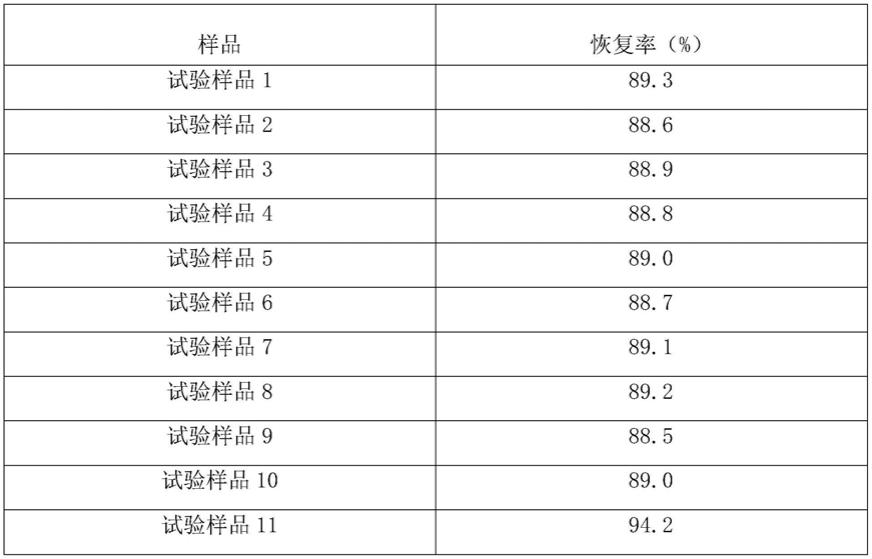
31.实施例3一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,具体包括以下步骤:步骤一,细胞复苏:对脂肪间充质干细胞进行细胞复苏,具体包括如下操作:a1:向离心管中倒入基础培养基9ml,预热到40℃,静置待用;a2:将从液氮罐中提取的带有冻存管的脂肪间充质干细胞放入40℃水浴锅中,旋盖朝上直立放置,水面不得没过冻存管管盖,摇动冻存管,使冻存液快速融化;a3:冻存管中的脂肪间充质干细胞融化后,旋开管盖,用移液管吸取脂肪间充质干细胞到操作a1中装有基础培养基的离心管内,并用移液管向转空的冻存管中加入0.9ml基础培养基,轻轻震荡冲洗管壁,将冲洗液倒入对应的离心管中,拧紧管盖,颠倒混匀,放入离心机,300g离心7.5min;a4:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入基础培养基,定容至9.5ml,旋紧管盖,颠倒混匀,放入离心机,300g离心7.5min;a5:用移液管吸弃上清液,旋紧管盖,震散细胞沉淀,旋开管盖,向离心管中加入溶液c,溶液c的加入量为4.5ml/支,旋紧管盖,颠倒混匀,得到细胞悬液;a6:用移液管吸取溶液c,按照29ml/瓶量加入到t-175培养瓶中,用移液管吸取操作a5中得到的细胞悬液,接种至t-175培养瓶中,细胞接种量为1.1
×
106/t-175,拧紧瓶盖,晃动均匀,标记编码,标记操作日期将培养瓶放入培养箱中培养70h;步骤二,传代培养:使用传代培养基对脂肪间充质干细胞进行传代培养,具体包括如下操作:b1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;b2:用移液管吸取生理盐水,加入t-175培养瓶,9ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,再用移液管吸取溶液d,按照4.5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;b3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4.5ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;b4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至45ml离心管,旋紧管盖,放入离心机,300g离心7.5min;b5:取出离心管,倒弃上清液,震散细胞沉淀,倒入传代培养基,定容至45ml,拧紧管盖,颠倒混匀,放入离心机,300g离心7.5min;b6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入19ml传代培养基,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个150ml离心管,然后清洗离心管,并将各清洗液汇集至所并入细胞的离心管中;b7:向离心管中倒入4.5ml溶液c,拧紧管盖,颠倒混匀,向离心管中再次倒入溶液c,调整细胞密度为1.1
×
106个/ml,得到细胞悬液;b8:用移液管吸取溶液c,按照24ml/瓶量加入新t-175培养瓶中,平稳叠放待用,用移液管吸取操作b7中得到细胞悬液,按照1.75ml/瓶量接种至t-175培养瓶中;
b9:拧紧瓶盖,晃动均匀,标记编码,标记操作日期,将培养瓶放入培养箱中培养70h;步骤三,分泌因子收获:移除传代培养基,收集上清,得到脂肪间充质干细胞分泌因子,具体包括如下操作:s1:打开培养箱,将t-175培养瓶转移至生物安全柜,平稳叠放,旋开瓶盖,用移液管将培养瓶中的上清液移到无菌血清瓶;s2:用移液管吸取生理盐水,加入t-175培养瓶,9ml/瓶,晃动瓶身,润洗瓶底,吸弃洗液,用移液管吸取溶液d,按照4.5ml/瓶量沿t-175培养瓶非细胞面内壁加入,迅速晃动瓶身,充分浸润细胞面后,平放瓶身;s3:镜下观察细胞变圆,竖立瓶身,用移液管吸取溶液c,按照4.5ml/瓶量沿t-175培养瓶细胞面内壁加入,晃动瓶身,均匀浸润细胞面,终止消化;s4:用移液管将t-175培养瓶中的细胞悬液吸出汇集至45ml离心管,旋紧管盖,放入离心机,300g离心7.5min;s5:取出离心管,倒弃上清液,震散细胞沉淀,倒入生理盐水,定容至45ml,拧紧管盖,颠倒混匀,放入离心机,300g离心7.5min;s6:取出离心管,倒弃上清液,震散细胞沉淀,然后取其中一管,用移液管加入17.5ml生理盐水,晃动管身,重悬细胞沉淀后,转移至另一离心管,重复转移,直至将所有细胞并入1个75ml离心管,并清洗各离心管,并将各清洗液汇集所并入细胞的离心管中;s7:向离心管中倒入生理盐水,定容到75ml,拧紧管盖,颠倒混匀,将离心管放入﹣75℃下冷冻35min,完全冷冻后取出室温融化,重复此操作2遍;s8:将操作s7中离心管样品放入离心机,300g离心7.5min;将上清液倒入无菌血清瓶,用生理盐水定容到500ml,得到脂肪间充质干细胞分泌因子。
32.实施例4一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,步骤二中的传代培养基包含以下重量份的原料:干细胞基础培养基600ml/l、l-丙氨酰-l-谷氨酰胺1mmol/l、4-2-羟乙基-1-哌嗪乙磺酸20μmol/l、胰岛素2.0μg/ml、d-葡萄糖20g/l、l-抗坏血酸10μmol/l、50μg/ml全反式维甲酸、血清蛋白0.3μg/ml、类胰蛋白酶0.3μg/ml、人参皂苷10.0μg/ml。
33.实施例5一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,步骤二中的传代培养基包含以下重量份的原料:干细胞基础培养基500ml/l、l-丙氨酰-l-谷氨酰胺2mmol/l、4-2-羟乙基-1-哌嗪乙磺酸15μmol/l、胰岛素4.0μg/ml、d-葡萄糖15g/l、l-抗坏血酸55μmol/l、40μg/ml全反式维甲酸、血清蛋白0.55μg/ml、类胰蛋白酶0.2μg/ml、人参皂苷15μg/ml。
34.实施例6一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,步骤二中的传代培养基包含以下重量份的原料:干细胞基础培养基400ml/l、l-丙氨酰-l-谷氨酰胺3mmol/l、4-2-羟乙基-1-哌嗪乙磺酸10μmol/l、胰岛素6.0μg/ml、d-葡萄糖10g/l、l-抗坏血酸100μmol/l、30μg/ml全反式维甲酸、血清蛋白0.8μg/ml、类胰蛋白酶0.1μg/ml、人参皂苷20.0μg/ml。
35.实施例7一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,上述操作步骤二中的溶液c中的组分主要包括基础培养基和血清替代物,然后制成含5%血清替代物的培养基,标记为溶液c。
36.实施例8一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,上述操作步骤二中的溶液c中的组分主要包括基础培养基和血清替代物,然后制成含4.5%血清替代物的培养基,标记为溶液c。
37.实施例9一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,上述操作步骤二中的溶液d中主要由0.3%胰酶20ml加入30ml生理盐水中混匀得到,标记为溶液d。
38.实施例10一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,上述操作步骤二中的溶液d中主要由0.275%胰酶20ml加入30ml生理盐水中混匀得到,标记为溶液d。
39.实施例11一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,上述步骤二中传代培养基中还加入有1.5g/l的混合助剂,所述混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.4组成。诱导增强剂选用亚硒酸钠。分泌增强剂选用亚麻酸。
40.实施例12一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.2组成。
41.实施例13一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.6组成。
42.实施例14一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,上述步骤二中的混合助剂为1.0g/l。
43.实施例15一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,上述步骤二中的混合助剂为2.0g/l。
44.实施例16一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,诱导增强剂选用三磷酸腺苷。
45.实施例17一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,诱导增强剂由亚硒酸钠、和二甲基甲酰胺按质量比为1:1组成。
46.实施例18一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,分泌
增强剂选用羟基磷脂。
47.实施例19一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,分泌增强剂由亚麻酸和脂肪醇聚氧乙烯醚按质量比为1:1组成。
48.实施例20一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.15组成。
49.实施例21一种脂肪间充质干细胞分泌因子的制备方法,与实施例11的不同之处在于,混合助剂由诱导增强剂和分泌增强剂按质量比为1:0.65组成。
50.对比例对比例1一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的人参皂苷等质量替换为干细胞基础培养基。
51.对比例2一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的类胰蛋白酶等质量替换为干细胞基础培养基。
52.对比例3一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的血清蛋白等质量替换为干细胞基础培养基。
53.对比例4一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的类胰蛋白酶和人参皂苷等质量替换为干细胞基础培养基。
54.对比例5一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的血清蛋白和人参皂苷等质量替换为干细胞基础培养基。
55.对比例6一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的血清蛋白和类胰蛋白酶等质量替换为干细胞基础培养基。
56.对比例7一种脂肪间充质干细胞分泌因子的制备方法,与实施例1的不同之处在于,传代培养基中的血清蛋白、类胰蛋白酶和人参皂苷等质量替换为干细胞基础培养基。
57.性能检测试验ige是介导皮肤过敏反应的重要介质,与组织细胞具有较强的亲和力,当ige抗体进入体内后,ige的fc端与皮肤的肥大细胞表面的特异性受体结合,形成ige复合物,使肥大细胞致敏。当受到抗原攻击时,抗原与肥大细胞表面上ige的另一端fab端结合,导致ige分子构型的改变,引起过敏反应的发生。皮肤过敏反应常表现为荨麻疹、瘙痒、水肿等症状。以ige作为致敏原,可以较容易的造成皮肤过敏反应。
58.试验样品:balb/c小鼠,(6周龄,spf级,雌性),购自中科院上海实验动物中心,动
物合格证号:scxk(沪)2003-0003。抗体:anti-dnp ige单克隆抗体(sigma公司),使用时以ph为7.4磷酸盐缓冲液(pbs)稀释至1∶5000。抗原:0.15%2,4二硝基氟苯溶液,溶剂为丙酮∶橄榄油=3∶1。采用由实施例1-21和对比例1-7中脂肪间充质干细胞分泌因子的制备方法所得到的试验样品1-21和对照样品1-7。
59.试验方法:alb/c小鼠110只,将小鼠随机分为28组,每组5只,激发前24h以测厚仪测定两耳的厚度,每组平均作为基础值,记为m1。在实验过程中按常规饲养,其余各组每只小鼠尾静脉注射0.5μanti-dnp ige单克隆抗体致敏,注射后24h小鼠两耳分别均匀涂以50μl二硝基氟苯溶液进行激发,于激发后24h分别测定小鼠耳厚度后,取每组平均值,记为m2,然后分别在各组小鼠两耳涂抹30μl试验样品1-21和试验样品1-7,24h后再次测定小鼠厚度,取每组平均值,记为m3。计算每组小鼠实验的恢复率,根据如下公式,恢复率(%)=(m2-m3)/(m2-m1)
×
100%,并记录下表。表1试验样品1-21和对照样品1-7的测试结果
60.结合实施例1-3和对比例1-7并结合表1可以看出,本发明中脂肪间充质干细胞分泌因子的制备方法内的各参数控制均能够在实际应用过程中,得到较为稳定和优异的脂肪间充质干细胞分泌因子,且血清蛋白、类胰蛋白酶和人参皂苷之间能够起到良好的复配增效作用,使脂肪间充质干细胞分泌因子能够发挥出良好稳定的组织修复效果,而采用血清蛋白、类胰蛋白酶和人参皂苷中的任意一种或任意两种使用,其效果远不及三者共同使用的效果。
61.结合实施例11并结合表1可以看出,混合助剂中的诱导增强剂和分泌增强剂之间相互作用,对脂肪间充质干细胞的传代培养的增殖分化作用起到优异的促进作用,使脂肪间充质干细胞分泌因子能够发挥出良好稳定的组织修复效果。而控制诱导增强剂和分泌增强剂的质量比为1:(0.2-0.6)能够发挥出优异稳定的作用效果,比例过大或过小均会使得到的脂肪间充质干细胞分泌因子品质大大降低。
62.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1