木犀草素及其药学上可接受的盐作为多巴胺受体激动剂在化妆品中的应用的制作方法
1.本发明涉及药物化妆品领域,具体涉及木犀草素及其药学上可接受的盐作为多巴胺受体激动剂在化妆品中的应用。
背景技术:
2.皮肤炎症是对外源性或内源性有害刺激的防御反应,通常为细胞识别出表面或内部(紫外线辐射、过敏原、化学刺激物)的干扰后,释放促炎细胞因子和趋化因子以招募炎症浸润。紫外线(uv)辐射会增强皮肤细胞中ros(活性氧)的生成,进而引发的细胞内和细胞外氧化应激,不仅能引起细胞损伤,而且易导致多种疾病的发生。
3.多巴胺受体(drd2)是跨膜g蛋白偶联受体,被内源性神经递质多巴胺(dopamine)或激动剂药物激活后,会导致抑制型g蛋白(gi)的刺激和腺苷酸环化酶的抑制,从而引起下游通路的一系列变化。drd2位于外周神经系统(外周神经末梢)和免疫系统细胞表面,包括淋巴细胞、nk细胞、单核细胞、巨噬细胞、成纤维细胞等。drd2激活后在炎症、衰老、细胞增殖、皮肤创面愈合等生物学过程均可得到应用,因此,开发drd2激动剂抗皮肤炎症和衰老等活性具有重要的研究意义。
技术实现要素:
4.本发明的目的在于提供了木犀草素作为一种多巴胺受体激动剂在抵抗皮肤由于紫外造成损伤中的应用。
5.本发明提出木犀草素及其药学上可接受的盐作为多巴胺受体激动剂在化妆品中的应用,所述木犀草素具有如式(i)所示结构:
[0006][0007]
进一步地,所述化妆品具有抗氧化,抗炎或抗衰老功效中至少一种。
[0008]
进一步地,所述木犀草素通过改善紫外诱导的皮肤损伤起到抗氧化,抗炎或抗衰老功效中至少一种。
[0009]
进一步地,所述木犀草素通过激活多巴胺受体,抑制腺苷酸环化酶的活性和促进环磷酸腺苷的下调,抑制氧化、炎症或衰老标志物中至少一种的表达。
[0010]
进一步地,所述化妆品为洗面奶、卸妆水、清洁霜、花露水、爽身粉、沐浴液、洗发液、护肤霜、乳液、精华、化妆水、面膜、唇膏、唇油、护发素、粉饼、胭脂、眼影、眼线笔、眉笔、香水、粉底、隔离霜或粉饼。
[0011]
进一步地,所述木犀草素在化妆品中的浓度为20mg/l-60mg/l。
[0012]
进一步地,所述木犀草素对细胞作用的浓度为4.5mg/l-12mg/l。
[0013]
本发明还提出一种化妆品,包含上述任一项所述的木犀草素及其药学上可接受的盐。
[0014]
本发明具有以下优势:
[0015]
本发明提出的木犀草素能有效激活多巴胺受体,在抗氧化,抗炎或抗衰老等方面具有很好的活性。且木犀草素细胞毒性低。通过对细胞内氧化损伤相关的标志物,如mda(丙二醛)、ros(活性氧)、sod(超氧化物歧化酶)及与炎症相关基因mrna表达量的变化进行分析评价,证明木犀草素可作为多巴胺受体激动剂,在抗氧化,抗炎或抗衰老等方面表现出优异活性。
附图说明
[0016]
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0017]
图1为木犀草素对多巴胺受体下游环磷酸腺苷(camp)的影响;
[0018]
图2为木犀草素的细胞毒性检测;
[0019]
图3为木犀草素对紫外诱导细胞模型脂质氧化水平的影响;
[0020]
图4为木犀草素对紫外诱导细胞模型的超氧化物歧化酶活性的影响;
[0021]
图5a和图5b为木犀草素对紫外诱导细胞模型的活性氧水平的影响;
[0022]
图6为木犀草素对紫外诱导细胞模型的炎症mrna表达的影响;
[0023]
图7为木犀草素在小鼠紫外模型中的应用效果图。
具体实施方式
[0024]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
[0025]
木犀草素(luteolin)属于黄酮类化合物,又名黄色黄素、黄示灵,是一种来源于植物的生物活性成分,主要来源于白毛夏枯草、裸花紫珠、密蒙花、野菊花等植物中,并且在洋葱、芹菜等蔬菜中也存在。木犀草素具有多种药理活性,如抗肿瘤、抗过敏、抗纤维化、抗氧化等作用,故对人类健康具有重要作用。
[0026]
本发明一实施例提出木犀草素及其药学上可接受的盐作为多巴胺受体(drd2)激动剂在化妆品中的应用,所述木犀草素具有如式(i)所示结构:
[0027][0028]
本发明一实施例中,所述木犀草素通过改善紫外诱导的皮肤损伤起到抗氧化,抗炎或抗衰老功效中至少一种。具体而言,所述木犀草素通过提高紫外线(uv)刺激下的小鼠成纤维细胞超氧化物歧化酶活性,防止脂质过氧化降低活性氧水平,达到皮肤抗炎的作用。对预防或改善紫外线造成的皮肤损伤有非常大的用处。
[0029]
本发明一实施例中,所述木犀草素通过激活drd2,抑制腺苷酸环化酶(ac)的活性和促进环磷酸腺苷(camp)的下调,抑制氧化、炎症和衰老标志物的表达。具体而言,木犀草素可有效地激活drd2,降低腺苷酸环化酶(ac)的活性和促进环磷酸腺苷(camp)的下调,在分子方面能够抑制氧化、炎症和衰老标志物mrna表达。
[0030]
本发明一实施例中,所述化妆品具有抗氧化,抗炎或抗衰老功效中至少一种。本发明实施例木犀草素通过靶向drd2,使所得化妆品具有抗氧化,抗炎,抗衰老等活性。木犀草素对皮肤副作用非常小,可添加于化妆品中减缓皮肤炎症。
[0031]
术语“化妆品”指以涂抹、洒、喷或其它类似方式,施于人体表面任何部位,以达到清洁、芳香、改变外观、修正人体气味、保养、保持良好状态目的的产品。
[0032]
化妆品按主要功能不同可以分为清洁类化妆品、护理类化妆品和美容/修饰类化妆品。
[0033]
所述清洁类化妆品包括:洗面奶、卸妆水(乳)、清洁霜(蜜)、花露水、爽身粉、沐浴液、洗发液(水)等。
[0034]
所述护理类化妆品包括:护肤霜(膏)、乳液、精华、化妆水、面膜、唇膏、唇油、护发素等。
[0035]
所述美容/修饰类化妆品包括:粉饼、胭脂、眼影、眼线笔(液)、眉笔、香水、粉底、隔离霜、粉饼等。
[0036]
优选的,本发明一实施例中,所述化妆品为洗面奶、卸妆水、清洁霜、花露水、爽身粉、沐浴液、洗发液、护肤霜、乳液、精华、化妆水、面膜、唇膏、唇油、护发素、粉饼、胭脂、眼影、眼线笔、眉笔、香水、粉底、隔离霜、粉饼等。
[0037]
本发明一实施例中,所述木犀草素在化妆品中的浓度20mg/l-60mg/l。优选的,所述木犀草素在化妆品中的浓度可以为25mg/l、35mg/l、45mg/l、55mg/l等。
[0038]
本发明又一实施例中,所述木犀草素对细胞作用的浓度为4.5mg/l-12mg/l。
[0039]
本发明一实施例中,所述化妆品根据种类的不同,还可以包括甘油、丁二醇、1,2-己二醇、黄原胶、辛酰羟肟酸、纯净水等化妆品制备过程中常用组分。
[0040]
本发明一实施例还提出一种化妆品,包含木犀草素及其药学上可接受的盐。
[0041]
下面将结合实施例详细阐述本发明。
[0042]
本发明使用的试验材料及其来源包括:
[0043]
(1)主要实验药物与试剂
[0044]
木犀草素、多巴胺(dopamine,成都曼思特生物科技有限公司)
[0045]
总sod活性检测试剂盒(wst-8法)(beyotime biotechnnology,上海碧云天生物技术有限公司)
[0046]
脂质氧化(mda)检测试剂盒(beyotime biotechnnology,上海碧云天生物技术有限公司)
[0047]
h-e染液试剂盒(solarbio,北京索莱宝科技有限公司)
[0048]
活性氧检测试剂盒(solarbio,北京索莱宝科技有限公司)
[0049]
改良masson三色染色试剂盒(solarbio,北京索莱宝科技有限公司)
[0050]
il-6、il-1β、tnf-α抗体(affinity)
[0051]
drd2抗体(santa cruz biotechnology,安诺伦(北京)生物科技有限公司)
[0052]
(2)细胞及实验动物
[0053]
小鼠成纤维细胞系(3t3);keygen biotech(中国南京)
[0054]
5周龄的雌性昆明小鼠:由中国人民解放军军事医学科学院试验动物中心和北京维通利华实验动物技术有限公司提供。
[0055]
实施例1木犀草素对下游通路的影响
[0056]
1.木犀草素对下游环磷酸腺苷(camp)信号的影响
[0057]
该实验采用小鼠环磷酸腺苷(camp)酶联免疫吸附测定试剂盒(renjiebio,china)检测3t3细胞内依赖camp的蛋白激酶a(pka)浓度变化。
[0058]
3t3细胞接种于6孔板,设为两组,第一组为正常组,第二组为过表达drd2,每组三个条件,均设三个重复。
[0059]
第一组分别设ctrl组,低浓度木犀草素5.7246mg/l(20μm)组和高浓度木犀草素11.4492mg/l(40μm)组。细胞30%密度时加入对应条件的木犀草素,24小时后收样检测。
[0060]
第二组同第一组的设组和浓度,细胞20%浓度分别加入drd2质粒过表达drd2,48小时之后加入对应条件的木犀草素,24小时后收样检测。
[0061]
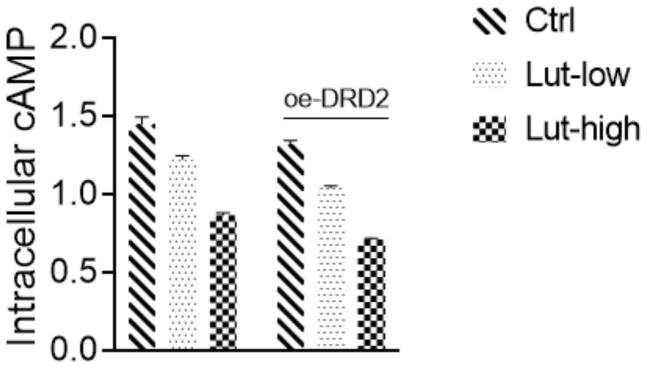
用pbs稀释细胞悬液,置于无菌管,使细胞浓度达到106个细胞/ml,反复冻融以释放细胞内成份,离心收集上清。随后按照试剂盒操作步骤进行,反应终止后在450nm波长处测定各孔od值。通过此实验来探究木犀草素通过激活多巴胺受体(drd2),抑制了腺苷酸环化酶的释放,从而引起下游通路的一系列变化。在excel工作表中,绘制标准品线性回归曲线,按曲线方程计算各样本浓度值。结果见图1。
[0062]
由图1可得,低剂量组和高剂量组的camp信号均比crtl组低;高剂量组的camp信号均比低剂量组低;在高剂量组中,过表达drd2基础上加木犀草素的细胞与单纯加木犀草素的细胞相比,前者camp的信号更低,低剂量组也是如此。这说明木犀草素可以激活细胞内源性的drd2,从而导致camp信号下降;而在过表达drd2组中,camp信号下降更为明显,这说明更多的drd2被木犀草素激活。由此证明,木犀草素可有效地激活drd2,降低腺苷酸环化酶(ac)的活性和促进环磷酸腺苷(camp)的下调。
[0063]
实施例2木犀草素对细胞的毒性检测
[0064]
1.检测木犀草素的细胞增值活性
[0065]
通过cell counting kit-8(apexbio,usa)来检测细胞增殖能力。3t3细胞接种于96孔板(n=3),过夜孵育后用不同浓度2.8623mg/l(10μm)、5.7246mg/l(20μm)、11.4492mg/l(40μm)、22.8984mg/l(80μm)、34.3476mg/l(120μm)、45.7968mg/l(160μm)、57.246mg/l(200μm)的药物处理细胞,24h之后换液,向每孔加入100ul的培养液和10μlcck-8溶液混匀后,37℃孵育2h,测定细胞活力。用酶标仪(multiskan
tm
fc,thermo scientific,usa),测定450nm下的光密度。结果见图2。
[0066]
由图2可得,用3t3测试不同给药浓度下药物对细胞的影响,设置分组为对照组和实验组,实验组药物浓度为2.8623mg/l(10μm)、5.7246mg/l(20μm)、11.4492mg/l(40μm)、22.8984mg/l(80μm)、34.3476mg/l(120μm)、45.7968mg/l(160μm)、57.246mg/l(200μm),通过对比可以发现,药物浓度最佳浓度为20μmol,说明药物浓度的增加没有对细胞产生毒性作用。
[0067]
实施例3木犀草素对于抑制紫外诱导的细胞损伤的研究
[0068]
2.1木犀草素对紫外诱导细胞模型mda水平的影响
[0069]
3t3以50%的密度接种于12孔板内,37℃,5%co2培养箱过夜培养。设置对照组、uv模型组和给药组,给药组分别施以木犀草素5.7246mg/l(20μm低浓度)、11.4492mg/l(40μm高浓度)两个浓度梯度预保护细胞6h。利用紫外线灯作为uv源,对uv模型组和给药组的细胞进行紫外刺激,诱导细胞氧化应激,刺激15分钟后,更换培养基稳定20分钟,使用脂质氧化检测试剂盒检测细胞内丙二醛(mda)水平。根据制造商的方案添加测定试剂,并在532nm处测量吸光度值,对数据做统计分析。结果见图3。
[0070]
由图3可得,uv能诱导3t3细胞产生氧化应激,显著提高细胞内丙二醛(mda)含量。木犀草素表现出很强的抗脂质氧化能力,能够有效降低uv诱导的3t3细胞氧化应激及脂质过氧化作用,且木犀草素浓度越高,表现越明显。
[0071]
2.2木犀草素对紫外诱导细胞模型sod活性的影响
[0072]
3t3以50%的密度接种于12孔板内,37℃,5%co2培养箱过夜培养。设置对照组、uv模型组和给药组,给药组分别施以木犀草素5.7246mg/l(20μm低浓度)、11.4492mg/l(40μm高浓度)两个浓度梯度预保护细胞6h。利用紫外线灯作为uv源,对uv模型组和给药组的细胞进行紫外刺激,诱导细胞氧化应激,刺激15分钟后,更换培养基稳定20分钟,使用总sod检测试剂盒(上海碧云天生物技术有限公司)检测细胞内超氧化物歧化酶水平。根据制造商的方案添加测定试剂,并在450nm处测量吸光度值,对结果做统计分析。结果见图4。
[0073]
由图4可得,木犀草素处理细胞后,对sod的活性表现出极强的保护作用。证明木犀草素能够增强sod酶活,改善uv诱导后细胞sod活性的损伤,且浓度越高,保护作用越明显。
[0074]
2.3木犀草素对紫外诱导细胞模型ros的影响
[0075]
3t3以50%的密度接种于12孔板内,37℃,5%co2培养箱过夜培养。设置对照组、uv模型组和给药组,给药组分别施以木犀草素5.7246mg/l(20μm低浓度)、11.4492mg/l(40μm高浓度)两个浓度梯度预保护细胞6h。利用紫外线灯作为uv源,对uv模型组和给药组的细胞进行紫外刺激,诱导细胞氧化应激,刺激15分钟后,更换培养基稳定20分钟,使用活性氧检测试剂盒检测细胞内ros水平。用流式细胞仪在488nm激发波长,525nm发射波长检测荧光强度,计算细胞内ros水平。结果见图5a和图5b。
[0076]
由图5a和5b可得,uv诱导细胞能显著增强细胞内活性氧水平,经过木犀草素预保护的细胞活性氧水平明显降低,证明木犀草素在降低细胞活性氧水平上具有显著优势,且浓度越高,优势越明显。
[0077]
2.4木犀草素对紫外诱导细胞模型的炎症mrna表达的影响
[0078]
总rna的提取采用molpure cell rna kit(yeasen,china)试剂盒。约1μg rna用quantscript rt kit(tiangen,china)反转录成cdna。用sybr rt pcr kit(tiangen,china)进行特异性引物的转录,得到ct值后用2-ddδct法计算目的基因在rna水平上的表达变化。每个基因的表达量均归一化为gapdh表达量。每个数据点包含三个生物重复,用平均值
±
sd表示。结果见图6。
[0079]
由图6可得,紫外诱导3t3细胞促进炎症因子il-1β、il-6、tnf-α的mrna的表达,木犀草素的浓度与对uv诱导炎症因子表达的抑制活性呈现正相,11.4492mg/l(40μm高浓度)木犀草素作用较5.7246mg/l(20μm低浓度)作用更明显。该结果证明木犀草素能够更有效抑制炎症和衰老因子的表达,发挥抗炎抗衰老的作用。
[0080]
实施例4木犀草素可以抑制紫外诱导的小鼠皮肤损伤
[0081]
1、木犀草素减弱小鼠紫外线辐射造成的皮肤炎症
[0082]
建立紫外损伤小鼠模型,将小鼠随机分为四组(n=6):control、uv(model)、uv+木犀草素(暴露于uv的小鼠背部皮肤每间隔一天给予木犀草素,两组浓度分别为10.01805mg/l(35μm)和17.1738mg/l(60μm),持续4周)。uv辐射的量为500mj/cm2,动物的紫外照射时间以及给药时间实验持续进行4周后对所有小鼠实施安乐死。收集小鼠背部皮肤组织,利用h-e染色评估不同处理组背部皮肤组织病理结构变化。结果见图7。
[0083]
由图7可得,紫外刺激后的小鼠皮肤表皮明显增厚,而木犀草素能够使uv诱导后的表皮变薄,且木犀草素的浓度越高,作用越明显,所以在紫外线的刺激下木犀草素对皮肤有更好的保护效果。
[0084]
试验例1含木犀草素的乳液对于皮肤的抗炎效果研究
[0085]
按如下表1所示配比混合所需物质,即可制备出两种乳液,实验组1中木犀草素在乳液中的浓度为20mg/l,实验组2中木犀草素在乳液中的浓度为60mg/l。
[0086]
表1
[0087]
添加物实验组1(wt%)实验组2(wt%)甘油30%30%丁二醇15%15%1,2-己二醇15%15%黄原胶13%13%辛酰羟肟酸10%10%木犀草素0.02%0.06%纯净水加水至100%加水至100%
[0088]
为测定不同含量木犀草素对人体皮肤的抗炎作用,选取30名20-40岁健康人群作为志愿者,随机均分为两组。第一组志愿者左臂涂抹上述实验组1制备得到的乳液,第二组志愿者左臂涂抹上述实验组2制备得到的乳液,右臂均涂抹不含木犀草素但其余组分含量与左臂相同的乳液,分别形成实验组1和实验组2的试验组与对照组。试验一共进行14天,这
14天中需将手臂暴露于外界,分别在第0、4、7、10、14天使用皮肤检测仪检测皮肤状态,结果表2。其中,对结果的评价来自于使用dermalab仪器检测得到的tewl(经表皮水流失)、ultrasound(超声)、elasticity(弹性)和skin color(肤色)共四项指标的综合评分(各组志愿者的平均分)。
[0089]
表2
[0090] 实验组1对照组1实验组2对照组2第0天66686058第4天68666559第7天71686958第10天72637258第14天73647860
[0091]
通过本次试验结果可得,含木犀草素的乳液对于皮肤的抗炎和抗氧化效果较佳,且木犀草素对皮肤的抗炎抗氧化效果与其含量成正比。
[0092]
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1