利拉鲁肽脂质体制剂及其制备方法和应用
1.本发明涉及医药领域,具体涉及一种全新的利拉鲁肽脂质体制剂及其制备方法和应用。
背景技术:
2.糖尿病是一种病因和发病机制尚未完全明确的内分泌代谢综合征,特点是慢性高血糖,现已成为仅次于心血管疾病和肿瘤之后第三位主要的非传染性疾病。糖尿病引发的并发症有糖尿病肾病、眼部病症、心、脑血管并发症等,这些并发症对人类健康危害很大,甚至导致死亡。因临床常用糖尿病治疗药物可能有增加体重的风险,进而引起血压和血脂失常,进一步加剧胰岛素抵抗,降低外周组织对胰岛素的敏锐度,使血糖更难以调控,因此研发新型糖尿病治疗药物尤为重要。
3.利拉鲁肽是丹麦诺和诺德公司研发的一种长效glp-1受体激动剂,由31个氨基酸组成,分子量为3751.20da,2010年1月25日被美国fda获批上市。利拉鲁肽与glp-1的同源性为97%,在人体天然glp-1结构基础上做了两个部分的修饰,即修饰位点为第34位赖氨酸被精氨酸替代和第26位赖氨酸上增加了谷氨酸介导的16个碳的棕榈酸侧链。利拉鲁肽不仅保留了glp-1生物活性,还避免了被二肽基肽酶-4(dpp-4)降解,半衰期延长至13小时。目前市场上销售的利拉鲁肽仅可供注射用,长期注射给药,患者顺应性差,使用不便,注射部位可能发生过敏、炎症等不良反应。
4.在此应用背景下,发明人预提供一种全新的利拉鲁肽脂质体制剂形式,尤其是提供了一种全新的给药途径,通过改变用药途径,提高患者的使用便利性和顺应性。
技术实现要素:
5.本发明所解决的第一个技术问题是提供一种全新的利拉鲁肽脂质体制剂。为解决上述技术问题,本发明采用以下技术方案:本发明利拉鲁肽脂质体制剂,主要是由利拉鲁肽主药和药用辅料制成,各组分重量配比为:
6.利拉鲁肽1份、磷脂3份~20份、胆固醇0.6份~10份。
7.上述技术方案中,利拉鲁肽脂质体制剂,优选各组分重量配比为:
8.利拉鲁肽1份、磷脂3份~15份、胆固醇2份~10份。
9.上述技术方案中,利拉鲁肽脂质体制剂,优选各组分重量配比为:
10.利拉鲁肽1份、磷脂3份~15份、胆固醇5份~10份。
11.上述技术方案中,利拉鲁肽脂质体制剂,优选各组分重量配比为:
12.利拉鲁肽1份、磷脂3份~10份、胆固醇8份~10份。
13.上述技术方案中,利拉鲁肽脂质体制剂,最优选各组分重量配比为:
14.利拉鲁肽1份、磷脂8份、胆固醇8份。
15.上述技术方案中,所述磷脂采用大豆磷脂或者蛋黄卵磷脂;最优选的,所述磷脂采用大豆磷脂。
16.本发明利拉鲁肽脂质体,减缓了药物的释放和吸收,延长了药物体内滞留时间。本发明所制备的利拉鲁肽脂质体,可以制成用于口服给药、鼻腔给药以及皮下注射给药的制剂形式。尤其是口服给药和鼻腔给药实现了非注射给药方式,提高了药物的生物利用度,从而提高了疗效,具有较大应用价值。需要注意的是制备皮下注射给药的剂型时符合注射用相关辅料及工艺条件的要求,即采用注射用水以及相应的除菌处理方式。
17.本发明所解决的第二个技术问题是提供了本发明利拉鲁肽脂质体的制备方法。
18.本发明中制备方法选择了薄膜分散法、逆向蒸发法、ph梯度法、ph梯度结合逆向蒸发。优选采用ph梯度法。
19.本发明利拉鲁肽脂质体的制备方法,采用ph梯度法的步骤如下:
20.a、按重量配比称取磷脂、胆固醇,用有机溶剂溶解,然后挥干有机溶剂;
21.b、步骤a所得滴加同温度柠檬酸缓冲液,超声洗脱脂质膜,得到水性混悬液;
22.c、步骤b所得水性混悬液;采用细胞破碎仪超声或高压均质机均质得到空白脂质体;
23.d、配制利拉鲁肽溶液:取利拉鲁肽原料药,加入缓冲盐溶液,配制成利拉鲁肽溶液;
24.e、向步骤c所得空白脂质体中加入步骤d所得利拉鲁肽溶液,用缓冲盐体系孵育,定容,即得利拉鲁肽脂质体。
25.上述技术方案中,所述ph梯度法中各组分重量配比为:
26.利拉鲁肽1份、磷脂3份~20份、胆固醇0.6份~10份。
27.上述技术方案中,所述ph梯度法优选各组分重量配比为:
28.利拉鲁肽1份、磷脂3份~15份、胆固醇2份~10份。
29.上述技术方案中,所述ph梯度法优选各组分重量配比为:
30.利拉鲁肽1份、磷脂3份~15份、胆固醇5份~10份。
31.上述技术方案中,所述ph梯度法优选各组分重量配比为:
32.利拉鲁肽1份、磷脂3份~10份、胆固醇8份~10份。
33.上述技术方案中,所述ph梯度法最优选各组分重量配比为:
34.利拉鲁肽1份、磷脂8份、胆固醇8份。
35.上述技术方案中,步骤a所述有机溶剂为乙醚;或者是乙醚与二氯甲烷的任意比例的混合溶剂,或为乙醚与氯仿的任意比例的混合溶剂,或为二氯甲烷、氯仿、乙醚三者任意比例的混合溶剂。最优选的,步骤a所述有机溶剂为乙醚,选择的原因是乙醚制备的磷脂膜易洗脱,便于控制超声洗脱时间,粒径重复性高。
36.上述技术方案中,步骤a磷脂、胆固醇与有机溶剂的用量关系为:按重量配比称取磷脂和胆固醇,有机溶剂添加量按照每添加10ml有机溶剂,溶解磷脂和胆固醇总量30-300mg,该比例有利于有机溶剂溶解磷脂、胆固醇,以便制备成脂质膜。具体的,优选采用按照每添加10ml乙醚,溶解磷脂25.8~172.0mg,胆固醇5.2~86mg制备成脂质膜。
37.上述技术方案中,步骤b制备的水性混悬液,属于内水相,采用的柠檬酸缓冲液的ph值为2.0-5.0;优选的,步骤b所述柠檬酸缓冲液的ph值为3.0-4.0;优选的,步骤b所述柠檬酸缓冲液的ph值为3.0、3.5、4.0;最优选的,步骤b所述柠檬酸缓冲液的ph值为3.0,在该ph条件下,脂质体稳定且所得的包封率较高。
38.上述技术方案中,步骤b所述柠檬酸缓冲液的添加量为:按照柠檬酸缓冲液每添加6ml,适配磷脂和胆固醇总量每30-300mg。优选的,按照柠檬酸缓冲液每添加6ml,适配磷脂25.8~172.0mg,胆固醇5.2~86mg。
39.上述技术方案中,步骤c所述超声条件为:低温条件下,探头超声1~6min,其中超声3~9s,停3~9s,功率为650w
×
(20~80)%。优选采用低温条件下,采用探头超声6min,其中超声3s,停3s,功率为650w
×
40%。
40.上述技术方案中,步骤c均质条件为:低温条件下,高压均质机以30~100mpa的压力循环1~8次。优选地,均质条件为:低温条件下,高压均质机以60~80mpa的压力循环4~6次。
41.上述技术方案中,步骤d中所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得4.30-8.60mg
·
ml-1
利拉鲁肽溶液。
42.上述技术方案中,步骤d中所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得4.30mg
·
ml-1
利拉鲁肽溶液。
43.上述技术方案中,步骤d和步骤e中缓冲盐体系为磷酸氢二钠-naoh溶液。用于调节外水相的ph值。
44.具体的,所述磷酸氢二钠-naoh溶液中的磷酸氢二钠采用0.2mol
·
l-1-1mol
·
l-1
磷酸氢二钠溶液。
45.具体的,所述磷酸氢二钠-naoh溶液中的naoh采用0.5~2mol
·
l-1
naoh溶液。
46.具体的,所述磷酸氢二钠-naoh溶液中的磷酸氢二钠溶液和naoh溶液的体积比为磷酸氢二钠溶液0.5-5份,naoh溶液0.5-5份。
47.优选的,所述磷酸氢二钠-naoh溶液中的磷酸氢二钠溶液和naoh溶液的体积比为磷酸氢二钠溶液1份,naoh溶液1份。
48.步骤d中,所述缓冲盐体系的ph值为3.0-8.0;优选的,采用的缓冲盐体系的ph值为7.4。上述技术方案中,步骤e中所述孵育的孵化温度为35-55℃;优选的,步骤d中所述孵育的孵化温度为35℃、45℃或55℃;最优选的,步骤d中所述孵育的孵化温度为45℃.
49.上述技术方案中,步骤e中所述孵育的孵化时间为15-120min;优选的,步骤e中所述孵育的孵化时间采用15min、30min、45min、60min、90min或120min任意时间;根据包封率优选采用步骤e中所述孵育的孵化时间为15-30min;最优选的,根据包封率以及时间成本的控制,步骤e中所述孵育的孵化时间为15min。
50.上述技术方案中,步骤e向步骤c所得空白脂质体中加入利拉鲁肽溶液,使得利拉鲁肽的终浓度为0.43-0.86mg/ml;优选的,使得利拉鲁肽的终浓度为0.86mg/ml。
51.上述技术方案中,步骤e采用磷酸缓冲盐溶液定容。优选的,采用的磷酸缓冲盐溶液ph值为3-7.4;优选的采用的磷酸缓冲盐溶液ph值为7.4。
52.本发明利拉鲁肽脂质体的制备方法,采用薄膜分散法的步骤如下:
53.a、按重量配比称取磷脂、胆固醇,用有机溶剂溶解,然后旋转蒸发减压除去有机溶剂得脂质膜,真空干燥静置4-12小时;
54.b、配制利拉鲁肽溶液:取利拉鲁肽原料药,加入缓冲盐溶液,配制成利拉鲁肽溶液;
55.c、向步骤a中所得脂质膜加入步骤b所得利拉鲁肽溶液,采用细胞破碎仪超声或高
压均质机均质;
56.d、水浴孵育步骤c所得溶液。
57.上述技术方案中,所述薄膜分散法各组分重量配比为:
58.利拉鲁肽1份、磷脂3份~20份、胆固醇0.6份~10份。
59.上述技术方案中,所述薄膜分散法优选各组分重量配比为:
60.利拉鲁肽1份、磷脂3份~15份、胆固醇2份~10份。
61.上述技术方案中,所述薄膜分散法优选各组分重量配比为:
62.利拉鲁肽1份、磷脂3份~15份、胆固醇5份~10份。
63.上述技术方案中,所述薄膜分散法优选各组分重量配比为:
64.利拉鲁肽1份、磷脂3份~10份、胆固醇8份~10份。
65.上述技术方案中,所述薄膜分散法最优选各组分重量配比为:
66.利拉鲁肽1份、磷脂8份、胆固醇8份。
67.上述技术方案中,步骤a所述有机溶剂为乙醚;或者是乙醚与二氯甲烷的任意比例的混合溶剂,或为乙醚与氯仿的任意比例的混合溶剂,或为二氯甲烷、氯仿、乙醚三者任意比例的混合溶剂。最优选的,步骤a所述有机溶剂为乙醚,选择的原因是乙醚制备的磷脂膜易洗脱,便于控制超声洗脱时间,粒径重复性高。
68.上述技术方案中,步骤a磷脂、胆固醇与有机溶剂的用量关系为:按重量配比称取磷脂和胆固醇,有机溶剂添加量按照每添加10ml有机溶剂,溶解磷脂和胆固醇总量30-300mg,该比例有利于有机溶剂溶解磷脂、胆固醇,以便制备成脂质膜。具体的,优选采用按照每添加10ml乙醚,溶解磷脂25.8~172.0mg,胆固醇5.2~86mg制备成脂质膜。
69.上述技术方案中,步骤a所述旋转蒸发温度条件为35-45℃;优选步骤a所述旋转蒸发温度条件为40℃。
70.上述技术方案中,步骤b所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得4.30-8.60mg
·
ml-1
利拉鲁肽溶液。
71.上述技术方案中,步骤b中所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得8.60mg
·
ml-1
利拉鲁肽溶液。
72.上述技术方案中,步骤c所述超声条件为:低温条件下,探头超声1~6min,其中超声3~9s,停3~9s,功率为650w
×
(20~80)%。优选采用低温条件下,探头超声6min,其中超声3s,停3s,功率为650w
×
40%。
73.上述技术方案中,步骤c所述均质条件为:低温条件下,高压均质机以30~100mpa的压力循环1~8次。优选地,均质条件为:低温条件下,高压均质机以60~80mpa的压力循环4~6次。
74.上述技术方案中,步骤d所述水浴孵育条件为40~50℃水浴孵育20~60min。优选采用水浴孵育条件为45℃水浴孵育30min。
75.本发明利拉鲁肽脂质体的制备方法,采用逆向蒸发法的步骤如下:
76.a、按重量配比称取磷脂、胆固醇,用有机溶剂溶解作为油相;
77.b、配制利拉鲁肽溶液作为水相:取利拉鲁肽原料药,加入缓冲盐溶液,配制成利拉鲁肽溶液;
78.c、将步骤b所得水相加至步骤a所得油相中,乳化形成乳剂,除去有机溶剂;
79.d、向步骤c中加入缓冲盐溶液洗脱脂质膜,采用细胞破碎仪超声或高压均质机均质;
80.e、水浴孵育步骤d所得溶液,加入缓冲盐溶液定容。
81.上述技术方案中,所述逆向蒸发法各组分重量配比为:
82.利拉鲁肽1份、磷脂3份~20份、胆固醇0.6份~10份。
83.上述技术方案中,逆向蒸发法优选各组分重量配比为:
84.利拉鲁肽1份、磷脂3份~15份、胆固醇2份~10份;
85.上述技术方案中,逆向蒸发法优选各组分重量配比为:
86.利拉鲁肽1份、磷脂3份~15份、胆固醇5份~10份;
87.上述技术方案中,逆向蒸发法优选各组分重量配比为:
88.利拉鲁肽1份、磷脂3份~10份、胆固醇8份~10份;
89.上述技术方案中,逆向蒸发法最优选各组分重量配比为:
90.利拉鲁肽1份、磷脂8份、胆固醇8份。
91.上述技术方案中,步骤a所述有机溶剂为乙醚;或者是乙醚与二氯甲烷的任意比例的混合溶剂,或为乙醚与氯仿的任意比例的混合溶剂,或为二氯甲烷、氯仿、乙醚三者任意比例的混合溶剂。最优选的,步骤a所述有机溶剂为乙醚,选择的原因是乙醚制备的磷脂膜易洗脱,便于控制超声洗脱时间,粒径重复性高。
92.上述技术方案中,步骤a磷脂、胆固醇与有机溶剂的用量关系为:按重量配比称取磷脂和胆固醇,有机溶剂添加量按照每10ml有机溶剂,溶解磷脂和胆固醇总量30-300mg,该比例有利于有机溶剂溶解磷脂、胆固醇,以便制备成脂质膜。具体的,优选采用按照每10ml乙醚,溶解磷脂25.8~172.0mg,胆固醇5.2~86mg制备成脂质膜。
93.上述技术方案中,步骤b所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得4.30-8.60mg
·
ml-1
利拉鲁肽溶液。
94.上述技术方案中,步骤b中所述利拉鲁肽溶液为取利拉鲁肽原料药,精密称定,加入pbs7.40溶液超声溶解并定容,即得8.60mg
·
ml-1
利拉鲁肽溶液。
95.上述技术方案中,步骤c所述旋转蒸发温度条件为35-45℃;优选步骤c所述旋转蒸发温度条件为40℃。
96.上述技术方案中,步骤d所述超声洗脱条件为:低温条件下,探头超声1~6min,其中超声3~9s,停3~9s,功率为650w
×
(20~80)%。优选采用低温条件下,探头超声6min,其中超声3s,停3s,功率为650w
×
40%。上述技术方案中,步骤d所述均质条件为:低温条件下,高压均质机以30~100mpa的压力循环1~8次。优选地,均质条件为:低温条件下,高压均质机以60~80mpa的压力循环4~6次。
97.上述技术方案中,步骤e所述水浴孵育条件为40~50℃水浴孵育20~60min。优选采用水浴孵育条件为45℃水浴孵育30min。
98.本发明所解决的第三个技术问题是提供利拉鲁肽脂质体的新用途。即提供利拉鲁肽脂质体在制备鼻腔给药制剂、口服制剂以及皮下注射制剂中的应用。具体的,提供利拉鲁肽脂质体在制备抗糖尿病的药物制剂中的应用。进一步的,所述糖尿病为2型糖尿病。
99.本发明优选采用口服给药和鼻腔给药的用药途径,提高患者的顺应性,脂质体的制剂形式,减缓了药物的释放和吸收,延长了药物体内滞留时间,从而提高了疗效。尤其是
鼻腔给药脂质体制剂可以以脂质体的制剂形式,减缓了药物的释放和吸收,延长了药物体内滞留时间,增加药物在鼻黏膜的吸收。
100.本发明具有以下优点:
101.1、本发明利拉鲁肽脂质体的制备方法优选采用主动载药法-ph梯度法,克服了传统被动载药法包封率低的问题,此法制备的利拉鲁肽脂质体粒径在220~240nm,包封率高于80%,载药量约为5%。
102.2、本发明利拉鲁肽脂质体采用鼻腔给药时,所提供的脂质体减缓了药物的释放和吸收,延长了药物体内滞留时间。故而本发明所制备的利拉鲁肽鼻腔给药脂质体,实现了非注射给药方式,较普通溶液剂型提高了药物的生物利用度,从而提高了疗效,具有较大应用价值。实验表明,本发明所提供的脂质体体内可提供长效的降血糖作用,以皮下注射利拉鲁肽溶液为对照,药理生物利用度可达10-15%。
附图说明
103.图1利拉鲁肽脂质体。
104.图2利拉鲁肽脂质体4℃冰箱放置一个月。
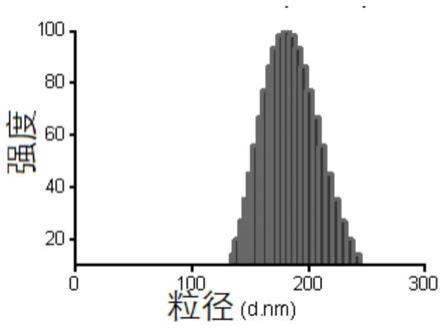
105.图3利拉鲁肽脂质体粒径图。
106.图4利拉鲁肽脂质体透射电镜图。
107.图5体外释放曲线。
108.图6各组糖尿病大鼠给药后降糖百分比-时间曲线图。
具体实施方式
109.为便于理解本发明,本发明列举实施例如下。本领域技术人员应该明了,所述实施例仅用于帮助理解本发明,不应视为对本发明的具体限制。
110.如无具体说明,本发明采用的试剂、药品、仪器皆为普通市售品,皆可于市场购得。
111.本发明的发明人基于已有的利拉鲁肽注射制剂,期望开发一种安全有效、使用方便的非注射给药利拉鲁肽脂质体,特别是鼻腔给药的用药途径,具有非常重要的临床意义,市场前景广阔。
112.发明人利用了鼻腔给药可防止消化道酶的破坏作用和肝脏的首过效应的特点,而且鼻黏膜具备大量的静脉、动脉、淋巴管,这些结构可以通过鼻腔中的纤毛在血管和黏膜之间交换药物,使药物迅速吸收。发明人开创性的利用鼻腔给药,使其成为了利拉鲁肽这类蛋白多肽类药物的最佳用药方式之一。
113.发明人同时还利用脂质体作为蛋白多肽类药物载体,这样可以防止药物结构被酶破坏,保护药物的结构和生物活性,提高稳定性以及延长半衰期;脂质体能连续释放被包封药物以此来增加药物的停留时间;脂质体良好的生物相容性可以减轻药物对鼻黏膜的毒性和刺激性,有效的提高药物的生物利用度。但是如何形成稳定、有效、包封高的脂质体是本发明成败的关键。
114.以下为本发明利拉鲁肽脂质体的筛选试验。
115.本发明利拉鲁肽脂质体制备过程使用的主要试剂和仪器具体如下
116.利拉鲁肽:浙江和泽医药科技股份有限公司(厂家)含量95.2%
117.大豆磷脂:艾伟拓(上海)医药科技有限公司(厂家)含量》95%
118.胆固醇:艾伟拓(上海)医药科技有限公司(厂家)含量》98%
119.高速冷冻离心机:四川蜀科仪器有限公司(厂家)型号tgl-22s
120.本发明利拉鲁肽脂质体质量检测的方法为:
121.游离药物的测定:精密量取利拉鲁肽脂质体溶液1ml稀释10倍后,取1ml置于1.5ml离心管中,22000rpm离心2h,hplc法测定游离药物的浓度c
游离
,计算游离药物量w
游离
。
122.全药量测定:精密量取利拉鲁肽脂质体溶液1ml置于10ml容量瓶,6ml酸化异丙醇(1%,w/v)超声破乳10min,pbs7.4溶液定容到10ml,摇匀,hplc法测定药物浓度c
全药
,计算全药量w
全药
。
123.按下式计算包封率(ee%)和载药量(dl%):
124.ee%=w
全药-w
游离
/w
全药
,dl%=w
全药-w
游离
/w
脂质体
125.式中:w脂质体为脂质总量
126.药理相对生物利用度计算方法:
127.采用梯形法计算降糖百分比-时间曲线上的面积(aac),根据aac计算药理相对生物利用度,计算公式为:
128.aac=sum{(ti+1-ti)[(100-ci(100-ci+1)]/2}
[0129]
f%=aac
nasal
×
(dose)
ih
/aacih
×
(dose)
nasal
[0130]
式中,i表示时间点,ci表示各时间点的降糖百分比值,aac
nasal
和aac
ih
分别为鼻腔给药利拉鲁肽脂质体和皮下注射利拉鲁肽溶液的降血糖百分比-时间曲线上的面积;(dose)
nasal
,(dose)
ih
表示鼻腔给药和皮下注射利拉鲁肽的剂量。
[0131]
利拉鲁肽脂质体含量测定方法:
[0132]
色谱柱:c12 jupiter 4μm proteo (250
×
4.6mm,5μm)流动相a:0.05mol/l磷酸二氢铵(磷酸调ph=3.70)-乙腈=9:1;流动性b:乙腈-水=82:18;流速:1.0ml/min;柱温:35℃;检测波长:215nm;进样量:20μl;梯度洗脱程序:0~25min为50%b,25~32min为50%~90%b,32~35min为90%~50%b,35~45min为50%b。
[0133]
以下结合筛选试验,进一步阐述本发明:
[0134]
一、有机溶剂种类的筛选
[0135]
称取大豆磷脂172mg,胆固醇34.4mg,分别采用10ml不同的有机溶剂(氯仿、二氯甲烷、乙醚、乙醚:氯仿=1:1(v:v)、乙醚:二氯甲烷=1:1(v:v)、氯仿-二氯甲烷-乙醚=1:1:2(v:v))溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声6min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育30min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表1。
[0136]
表1有机溶剂种类筛选结果
0.86mg
·
ml-1
利拉鲁肽溶液作为水相,将水相滴加到油相中超声乳化形成w/o型乳剂,40℃旋转蒸发除去有机溶剂,加入pbs7.40溶液洗脱脂质膜,低温条件下探头超声6min(间歇3s/3s,650w
×
40%),45℃水浴孵育30min,pbs7.40溶液定容到10ml。测定包封率.粒径、粒径分散度、电位,结果见表3。
[0149]
方法3:ph梯度法
[0150]
称取大豆磷脂86mg,胆固醇17.2mg,用10ml乙醚中溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声6min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育30min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表3。
[0151]
表3三种制备方法评价结果
[0152][0153]
由表3可知,三种方法制备的粒径均较小,均符合脂质体要求。将包封率作为脂质体的主要评价指标时,ph梯度法的包封率高于薄膜分散法和逆向蒸发法,故优选采用ph梯度法作为本发明脂质体的制备方法。
[0154]
四、主药与磷脂比例(药脂比)的筛选
[0155]
称取不同重量配比的大豆磷脂和胆固醇:(1)大豆磷脂25.8mg,胆固醇5.16mg、(2)大豆磷脂43mg,胆固醇8.6mg、(3)大豆磷脂86mg,胆固醇17.2mg、(4)大豆磷脂172mg,胆固醇34.4mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育30min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表4。
[0156]
表4药脂比筛选结果
[0157][0158]
备注:以上药脂比是指利拉鲁肽与大豆磷脂的质量配比。
[0159]
由表4可知:药脂比采用1:3-20时,均可以得到包封率、粒径、粒径分散度和电位符合目标指标的情形。随着磷脂用量的增加,包封率呈上升趋势,但一旦超过某个用量,包封率就会降低,药脂比为1:10时包封率最高,故本发明将以利拉鲁肽与磷脂质量比为1︰3-20作为可以制备符合目标指标脂质体的技术方案;在此基础上,可以优选利拉鲁肽与磷脂质
量比为1︰3-15;而将利拉鲁肽与磷脂质量比1︰10作为最优选方案。
[0160]
五、ph梯度法中孵育温度的筛选
[0161]
称取大豆磷脂86mg,胆固醇43mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育不同时间(15、30、45、60、90、120分钟),pbs7.40溶液定容到10ml。分别测定包封率、粒径、粒径分散度、电位,结果见表5。
[0162]
表5孵育时间评价结果
[0163][0164]
结果表明,孵育时间采用15~120min均可以符合包封率、粒径、粒径分散度和电位目标指标的情形。优选采用孵育时间15~30min时,包封率相当,无显著变化,但是随着孵育时间增加,包封率下降,粒径随时间变化不大,利拉鲁肽属于大分子肽类药物,稳定性不高,故选择15min的孵育时间,是包封率主要指标与时间成本双赢的选择。
[0165]
六、改变磷脂与胆固醇比例条件下对两种制备方法的筛选
[0166]
制备方法1:ph梯度法结合逆向蒸发法
[0167]
称取大豆磷脂86mg,胆固醇86mg,用10ml乙醚溶解,加入10ml同温ph=4.0柠檬酸缓冲液继续旋转蒸发孵育20min使其呈半固态,加入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声6min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表6。
[0168]
制备方法2:ph梯度法
[0169]
称取大豆磷脂86mg,胆固醇86mg,用10ml乙醚溶解,,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表6。
[0170]
表6两种方法包封率评价结果
[0171][0172]
由表6可知,提高磷脂与胆固醇比例至10:10后,较磷脂与胆固醇比例10:5时,成品包封率显著提高,但是两种方法分别制备的脂质体包封率、粒径、粒径分散度、电位相差不大,但ph梯度法结合逆向蒸发法相对复杂一些,基于生产的便利性和生产升本考虑,后续实施例采用ph梯度法。
[0173]
七、磷脂与胆固醇质量比的筛选
[0174]
称取不同重量配比的大豆磷脂和胆固醇:(1)大豆磷脂86mg,胆固醇86mg、(2)大豆磷脂86mg,胆固醇68.8mg、(3)大豆磷脂86mg,胆固醇43mg、(4)大豆磷脂86mg,胆固醇17.2mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=4.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表7。
[0175]
表7磷脂与胆固醇质量比筛选结果
[0176][0177]
由表7可知,磷脂与胆固醇质量比为10:2-10时,均可以得到包封率、粒径、粒径分散度和电位符合目标指标的情形。磷脂与胆固醇质量比为10:8-10时,可以达到百分60%以上的包封率,而磷脂与胆固醇的质量比为10:8时,包封率最高。
[0178]
八、内水相ph的筛选
[0179]
称取大豆磷脂86mg,胆固醇68.8mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温不同ph的柠檬酸缓冲液6ml(分别为ph=2.0、ph=3.0、ph=3.5、ph=4.0、ph=5.0),低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表8。
[0180]
表8内水相ph筛选结果
[0181][0182]
由表8可知,内水相ph=2.0-5.0时,均可以得到包封率、粒径、粒径分散度和电位符合目标指标的情形。在内水相ph大于5.0的情况,包封率小于50%。ph低于2会导致磷脂水解。内水相ph=3.0-4.0时,包封率均可达到60%以上,当内水相ph=3.0时包封率最高。
[0183]
九、外水相调节剂的筛选
[0184]
称取大豆磷脂86mg,胆固醇68.8mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=3.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用不同调节剂调ph=7.40(分别为1.0mol
·
l-1
naoh、1.0mol
·
l-1
磷酸氢二钠、以及0.2mol
·
l-1
磷酸氢二钠-1.0mol
·
l-1
naoh(1:1,v/v,ph=13.65)混合溶液),45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表9。
[0185]
表9外水相调节剂筛选结果
[0186][0187]
由表9可见,1.0mol
·
l-1
磷酸氢二钠确可提高利拉鲁肽脂质体的包封率,但1.0mol
·
l-1
磷酸氢二钠碱度太低,需加入的量太多,降低了药物浓度,制备的脂质体放置一天后就会有晶体析出,脂质体不稳定,只能降低磷酸氢二钠的离子强度,采用的柠檬酸缓冲液中加入的是0.2mol
·
l-1
磷酸氢二钠,为保证不析出晶体以及提高碱度,将0.2mol
·
l-1
磷酸氢二钠-1.0mol
·
l-1
naoh(1:1,v/v,ph=13.65)混合后调ph,效果更好。
[0188]
十、ph梯度结合逆向蒸发法中孵育温度的筛选
[0189]
称取大豆磷脂86mg,胆固醇68.8mg,用10ml乙醚溶解,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=3.0柠檬酸缓冲液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用0.2mol
·
l-1
磷酸氢二钠-1.0mol
·
l-1
naoh(1:1,v/v,ph=13.65)混合溶液调ph=7.40,不同水浴温度水浴孵育15min(分别为35℃、45℃、55℃),pbs7.40溶液定容到10ml。测定包封率、粒径、粒径分散度、电位,结果见表10。
[0190]
表10孵育温度筛选结果
[0191][0192]
结果表明,孵育温度采用35-55℃时,均可以得到包封率、粒径、粒径分散度和电位符合目标指标的情形。但是孵育温度的变化对粒径没有太大影响,孵育温度为45℃时的包封率相对最高,故本发明优选采用孵育温度为45℃。
[0193]
十一、处方优化
[0194]
根据单因素筛选结果,由于粒径变化不大,因此选取了两个指标,即包封率(y1)和载药量(y2)进行优化实验。综合考虑选取了三个实验因素,分别是药脂比(a)、磷脂与胆固醇的比例(b)和内水相ph(c),进行了三因素三水平的研究,优化实验处方则利用design expert 8.05b软件中的box-behnken响应面法所设计。表11和表12分别表示了所设计的三因素三水平实验表以及利拉鲁肽脂质体处方优化实验组合及结果。
[0195]
表11 box-behnken设计因素水平实验表
[0196][0197]
表12利拉鲁肽脂质体处方优化实验组合及结果
[0198][0199]
利用design expert 8.05b软件,根据表12中的试验结果对二次回归方程进行拟合,包封率(y1)的回归方程拟合为:
[0200]
y1=68.26+1555.42a-167.02b+49.91c-127.33ab+32.67ac+8.30bc-7411.67a2+30.80b
2-10.81c2(p《0.0001,r=0.9806)
[0201]
载药量(y2)的回归方程拟合为:
[0202]
y2=-5.32+173.25a-4.57b+2.43c-29.00ab+2.50ac+0.69bc-593.33a2+0.94b
2-0.60c2(p=0.0006,r=0.9548)
[0203]
由包封率(y1)和载药量(y2)拟合得到的回归方程的相关系数表明bbd响应面法设计的模型拟合程度较好(p《0.05表示经统计学验证,其差异具备统计学意义),此模型可用于利拉鲁肽脂质体最优处方的分析和预测。
[0204]
优化结果,最佳处方为药脂比(a)为1:8、磷脂与胆固醇的比例(b)为1:1,内水相ph(c)为2.88。
[0205]
根据优化结果和实际验证结果,最终确定本发明的最佳处方为:药脂比(a)为1:8。磷脂与胆固醇的比例(b)为1:1,即本发明的重量配比关系为利拉鲁肽1份,磷脂8份,胆固醇8份。内水相ph(c)为3与上述优化实验结果的趋势一致,因此,按照实际筛选试验确定内水相ph值为3作为最优控制参数。
[0206]
根据上述优化最佳处方制备本发明实施例1
[0207]
精密称取大豆磷脂68.8mg,胆固醇68.8mg,将大豆磷脂和胆固醇溶于10ml乙醚,40℃旋转蒸发减压除去乙醚,在烧瓶壁上形成均匀的脂质膜,投入同温ph=2.88柠檬酸缓冲
液6ml,低温条件下探头超声8min(间歇3s/3s,650w
×
40%),加入2ml 4.3mg
·
ml-1
利拉鲁肽溶液,用0.2mol
·
l-1
磷酸氢二钠-1.0mol
·
l-1
naoh调ph=7.40,45℃水浴孵育15min,pbs7.40溶液定容到10ml。测定载药量、包封率、粒径、粒径分散度、电位,结果见表13。
[0208]
表13最佳优化结果
[0209][0210]
以下形状参数及药理试验采用的脂质体为实施例1制备的利拉鲁肽脂质体。
[0211]
(一)外观检查
[0212]
利拉鲁肽脂质体为乳白色轻微透明带蓝色乳光液体,如图1所示,4℃冰箱放置一个月后,如图2,溶液外观几乎无明显变化。说明本发明脂质体体系稳定,不易分层,便于临床储存应用。
[0213]
(二)粒径测定
[0214]
取利拉鲁肽脂质体经pbs7.4溶液稀释后,于激光粒度仪中测定其粒径和粒度分布,本发明的脂质体的粒径比较均一,在240nm左右。粒径分布图见图3。
[0215]
(三)透射电镜检测
[0216]
取稀释后的最佳配方利拉鲁肽脂质体1滴,2%磷钨酸负染后干燥,置于透射电镜中观察形貌表征,可以看到本发明的脂质体是一个球形或类球形的小单室实心脂质体,透射电镜图见图4。
[0217]
(四)利拉鲁肽脂质体的体外释放实验
[0218]
取新制备的利拉鲁肽脂质体1ml,pbs7.4溶液加至10ml,设定恒温磁力搅拌器的温度为37℃,转速为30r/min,在0.5、1、2、3、4、6、8、10、12、24h时间点取1ml样品,同时补充同体积的1mlpbs7.4溶液,样品于40000rpm下离心1h,hplc法测定药物释放量,以零时刻药物的释放量为0,计算设定取样点药物的释放,绘制累计释放度-时间曲线图,见图5。
[0219]
运用零级、一级、higuchi方程对体外释放曲线进行拟合,根据相关系数判定最佳释药模型。
[0220]
表14利拉鲁肽脂质体的体外释药模型拟合
[0221][0222]
结果显示:利拉鲁肽脂质体的三种方法的相关系数均较高,与零级和higuchi方程相比,一级动力学释药模型的相关系数最高,r2=0.9967,表明利拉鲁肽脂质体具有一定缓释作用。
[0223]
(五)利拉鲁肽脂质体降血糖实验
[0224]
1糖尿病大鼠模型建立
[0225]
取220
±
10g雄性大鼠禁食不禁水12h后称重,按照40mg/kg尾静脉注射5%(w/v)新
配制的四氧嘧啶溶液,30s推注入体内,2.5h后每只灌胃给予2ml 50%葡萄糖溶液,正常饲养3天后尾静脉取血,采用葡萄糖氧化酶法测定血清葡萄糖浓度,一般认为随机血糖》11.1mmol/l者为糖尿病大鼠。
[0226]
2给药方式
[0227]
将建模成功的糖尿病随机分为4组,每组5只,根据大鼠体重计算给药剂量。分别鼻腔给予利拉鲁肽溶液(pbs7.40溶液作为溶剂,浓度为0.86mg/ml)、鼻腔给予生理盐水、鼻腔给予实验室自制利拉鲁肽脂质体以及皮下注射利拉鲁肽溶液(pbs7.40溶液作为溶剂,浓度为8.6μg/ml),编号依次为a、b、c、d。分别于0、0.5、1、2、4、6、8、10、12、24h断尾取血0.3~0.4ml,37℃孵育30min后离心,离心条件均为4000r
·
min-1
,15min取出血清在-20℃冰箱中保存待测。
[0228]
3血清葡萄糖浓度的测定
[0229]
采用葡萄糖检测试剂盒(上海源叶生物科技有限公司),测定血糖时,样品管、标准管和空白管分别加入20μl的血清、葡萄糖标准液和水置于8ml离心管中,分别移取2ml的工作液于涡旋混匀器中混匀1min,置于37℃水浴孵育15min,测定505nm处的吸光度,以空白管调零,读取标准管、样品管的吸光度,记为a
标准
、a
样品
。利用以下公式计算相应时刻每只大鼠的血糖浓度。
[0230]
c=a
样品
/a
标准
×
5.56mmol
·
l-1
[0231]
4实验结果
[0232]
以各时间点降糖百分比(w(%))为纵坐标对横坐标时间(t/h)作图,见图6,绘制降糖百分比-时间的关系曲线。各时间点降糖百分比的计算按w%=c
t
/c0×
100%(c
t
表示th大鼠血清中葡萄糖浓度,c0表示给药前大鼠血清葡萄糖浓度,将大鼠给药前的血清葡萄糖浓度作为100%),表中a组鼻腔给予利拉鲁肽溶液、b组鼻腔给予生理盐水、c组鼻腔给予实验室自制利拉鲁肽脂质体、d组皮下注射利拉鲁肽溶液。
[0233]
表15 0~12h大鼠的药理相对生物利用度和方差分析结果(x
±
s,n=5)
[0234][0235]
p《0.05
[0236]
表16 0~24h大鼠的药理相对生物利用度和方差分析结果(x
±
s,n=5)
[0237][0238]
p《0.05
[0239]
方差分析的结果用p值表示,计算所得的药理生物利用度及p值如表15、16所示,将a组与c组进行统计学差异比较。由表可知,脂质体组0~12h和0~24h的药理相对生物利用度分别为13.96%和12.27%,溶液组0~12h和0~24h的药理相对生物利用度分别为9.83%
和10.11%,方差分析结果均具有显著性差异,可见制备成脂质体后提高了利拉鲁肽在鼻黏膜的吸收。
[0240]
通过上述筛选试验可见,当本发明脂质体配方采用被动载药法如薄膜分散法、逆向蒸发法等制备的脂质体时包封率极低,发明人在制备利拉鲁肽脂质体时遇到了技术障碍,研发脂质体进入了瓶颈期。后来发明人尝试采用了ph梯度法。ph梯度法属于主动载药法,该方法制备脂质体的实现方式是两亲性的弱酸、弱碱以电中性的形式跨过脂质双层,而电离形态不能越过脂质膜,现已被普遍用于蛋白多肽类药物脂质体的制备。ph梯度法以调节内外水相的ph的方式,使内、外水相形成相应的ph梯度差,药物以分子形态顺着产生的梯度跨膜以离子形态被包封。而该方法的难点在于ph梯度范围的选择和调节ph的溶液的筛选。在发明人经过多次筛选后,利用bbd响应面法优化处方工艺结合前述单因素筛选,最终确定了本发明利拉鲁肽脂质体的制备方法中利拉鲁肽1份、磷脂8份、胆固醇8份为最优选重量配比,以内水相ph值为3作为最优内水相ph值。所得脂质体的粒径在160~240nm左右,分布均匀,包封率高于80%,载药量约为5%。该脂质体制剂可以制成口服给药、鼻腔给药或皮下注射给药的制剂形式。尤其是鼻腔给药脂质体制剂能够实现利拉鲁肽的非注射给药,提高患者的顺应性,提高生物利用度。实验表明,本发明所提供的脂质体体内可提供长效的降血糖作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1