一种包含氨氯地平和比索洛尔的药剂及其制备方法与流程
1.本发明涉及医药技术领域,具体涉及一种包含氨氯地平和比索洛尔的药剂及其制备方法。
背景技术:
2.近年来,无论是国际还是国内高血压指南,均一致推荐起始spc(新型单片联合制剂)治疗,因其可简便、高效地解决高血压管理面临的联合治疗和依从性两大关键问题。《2018欧洲心脏病学会(esc)/欧洲高血压学会(esh)指南》推荐:两药联合的spc为所有高血压患者的起始治疗优选方案。2021年系统综述和meta分析结果显示,spc治疗在依从性、持续性和血压达标率等多方面均优于自由联合,已成为高血压药物治疗管理的大势。此外,spc较自由联合还可显著降低高血压患者心血管不良事件,并减少治疗费用。
3.我国高血压患病人数多而控制率低,为实现血压达标,大多数患者需要联合用药,但依从性与用药数量及用药次数成反比。调查发现,我国高血压药物治疗面临联合用药率低(仅30%)且依从性差的严峻问题。尽管spc治疗可带来多重获益,并为众多权威指南一致推荐,但我国高血压患者spc使用率却不足10%。临床应对此给予高度关注,spc使用现状亟需改善。
4.目前市场上有数种优选用于治疗高血压和心绞痛的含有钙通道阻滞剂(“钙拮抗剂”)和β阻滞剂的固定组合,诸如含有非洛地平和美托洛尔或硝苯地平和阿替洛尔的片剂。
5.国际专利申请no.wo2005/099699公开了s-氨氯地平和β阻滞剂的组合物,包括与比索洛尔的组合。但该申请未涉及实际应用的主要问题,即两种活性成分的化学不相容性。
6.中国专利申请cn102164585b,将苯磺酸氨氯地平和富马酸比索洛尔共同制粒、压片,然后将组合物包装在防潮包装中。该生产工艺中,由于投料后,苯磺酸氨氯地平和富马酸比索洛尔即开始接触,开始发生反应,产生降解产物,因此需对整个生产过程中的环境温湿度进行严格的控制,并且尽量缩短生产工序时长,以保证该工艺生产的制剂能够拥有良好的质量,在稳定性期间有良好的稳定性。由于需对其整个生产环境温湿度进行控制、并且需要以极短的工艺时长完成整个生产工艺,以及使用防潮包装,使得生产压力及生产成本大大提高,工艺要求也较高,使得工艺的可操作性大大降低。
7.印度专利申请in845mum2004,苯磺酸氨氯地平和富马酸比索洛尔相互反应产生了新的杂质,n-(2-{[4-(2-氯苯基)-3-(乙氧基羰基)-5-(甲氧基羰基)-6-甲基-1,4-二氢吡啶-2-基]甲氧基}乙基)天冬氨酸,该杂质通过氨氯地平碱和富马酸的化学反应形成,其结构式如下所示,在本发明中代号为aml-2。目前比索洛尔氨氯地平片的中国进口药品注册标准要求组合物中该杂质的限度为≤1.0%。
[0008][0009]
根据in845mum2004,仅当活性成分分隔在不同的颗粒中时才可以制备苯磺酸氨氯地平和富马酸比索洛尔的组合物,颗粒进一步与赋形剂混合并填充入胶囊或药囊中,或压制成所谓的双层片剂。该专利申请的方法有几个缺点,活性成分的单独制粒、制备双层片,但两种活性成分之间仍有较大的接触面,无法完全避免氨氯地平碱和富马酸的化学反应形成杂质产物,稳定性和安全性存在风险。
技术实现要素:
[0010]
(一)要解决的技术问题
[0011]
鉴于现有技术的上述缺点、不足,本发明提供一种包含氨氯地平和比索洛尔的药剂,其将氨氯地平和比索洛尔分别独立制药再组合成spc药剂,有效的减少了两种成分接触的几率,显著的降低了两种成分反应产物生成量,提高贮藏稳定性和安全性。
[0012]
相应地,本发明还提供上述包含氨氯地平和比索洛尔的药剂的制备方法。
[0013]
(二)技术方案
[0014]
为了达到上述目的,本发明采用的主要技术方案包括:
[0015]
第一方面,本发明提供一种包含氨氯地平和比索洛尔的药剂,其包括两个相连接的分药剂,其中一个分药剂包括氨氯地平或/和其药学上可接受的盐,另一个分药剂包括比索洛尔或/和其药学上可接受的盐。
[0016]
本发明将氨氯地平和比索洛尔分别独立制药后再组合制成单一片剂,可以有效减少甚至避免其相互反应所生成的杂质。
[0017]
本发明氨氯地平药学上可接受的盐包括:马来酸氨氯地平、甲磺酸氨氯地平、l-门冬氨酸氨氯地平,优选为苯磺酸氨氯地平;
[0018]
比索洛尔药学上可接受的盐包括但不仅限于富马酸比索洛尔。
[0019]
可选地,其中一个分药剂包裹在另一个分药剂表面,分别形成壳层和片芯层,优选地,壳层将片芯层外侧完全包裹,完全隔绝片芯层与药剂外界环境接触。药剂可以是球体或圆柱体,片芯层为球体或圆柱体的内核,内核的外层为壳层。
[0020]
此方案中,本发明将其中一个药剂包裹在另一个分药剂表面,相对于双层片剂等其它片剂,两个分药剂具有更小的接触面,减少了两个分药剂的反应的几率;又由于包裹在里面的分药剂(片芯层)无法接触到环境,比如水分,阻断了氨氯地平或/和其药学上可接受的盐,与比索洛尔或/和其药学上可接受的盐的反应,可以完全避免杂质的生成。
[0021]
为了进一步隔绝有效成分的相互作用,两个分药剂之间还设有隔层。
[0022]
隔层主要为以下一种或两种以上组分的组合制备而成:羟丙甲纤维素、聚乙烯醇、聚乙二醇、三乙酸甘油酯、钛白粉、滑石粉。
[0023]
可选地,两个分药剂的接触面积与药剂的体积比优选为:100:15~100:25。在此范围内,可以完全避免杂质的生成的同时,提高两个分药剂贮藏结构的稳定性。
[0024]
可选地,本发明的药剂其体积小于500mm3,优选为小于450mm3,更优选为小于420mm3。
[0025]
可选地,分药剂包括填充剂,所述填充剂包括微晶纤维素、无机盐、糊精、甘露醇、山梨醇、淀粉、糖中的一种或两种以上的组合。
[0026]
可选地,分药剂还包括第一辅料、第二辅料、第三辅料中的一种或两种以上的组合;
[0027]
第一辅料包括干淀粉、羧甲基淀粉钠、低取代羟丙基纤维素、交联聚维酮、交联羧甲基纤维素钠、羧甲基纤维素钠、羧甲基纤维素钙其中的一种或两种以上的组合;
[0028]
第二辅料包括胶态二氧化硅或/和滑石粉;
[0029]
第三辅料包括硬脂酸镁、硬脂酸、硬脂酸钙、硬脂富马酸钠、氢化植物油、氢化大豆油、氢化蓖麻油、山嵛酸甘油中的一种或两种以上的组合。
[0030]
可选地,本发明药剂中包含以下重量份比的组分:0.5~10份的氨氯地平或其药用盐,0.5~10份的比索洛尔或其药用盐,进一步含有60~95份的填充剂,1~10份的崩解剂,0.5~3份的助流剂,0.5~3份的润滑剂,0~5份的隔层。
[0031]
可选地,本发明药剂中包含以下重量份的组分:其含有0.5~5份的氨氯地平或其药用盐,0.5~5份的比索洛尔或其药用盐,进一步含有70~95份的填充剂,1~8份的崩解剂,0.5~2份的助流剂,0.5~2份的润滑剂,0~5份的隔层。
[0032]
可选地,本发明药剂中包含以下重量份的组分:其含有0.5~3份的氨氯地平或其药用盐,0.5~3份的比索洛尔或其药用盐,进一步含有80~95份的填充剂,1~5份的崩解剂,0.5~2份的助流剂,0.5~2份的润滑剂,0~5份的隔层。
[0033]
第二方面,本发明还提供上述任一方案中包含氨氯地平和比索洛尔的药剂的制备方法,其包括以下步骤:将氨氯地平或/和其药学可接受的盐,比索洛尔或/和其药学可接受的盐分别制成分药剂,将两个分药剂通过压片机制成所述药剂。如有必要,在所得的药剂的外层还可以形成诸如opadry的膜包衣层。
[0034]
其中,分药剂可以是干颗粒或湿颗粒。可以通过但不仅限于连续压片机压缩制备。
[0035]
(三)有益效果
[0036]
本发明的有益效果是:本发明的包含氨氯地平和比索洛尔的药剂,由于将氨氯地平和比索洛尔分别独立制剂后再组合制成单一片剂,可以有效减少甚至避免其相互反应所生成的杂质,使杂质在储存过程中维持在低水平,提高了药物稳定性和安全性,并且在制备过程中不需要进行环境控湿,也无需防潮包装处理。
[0037]
本发明的制备方法简便,制备成本较低,适合推广使用,利于大规模工业化生产。
[0038]
本发明片剂的体外释放符合标准要求,在ph为3.0的溶出介质中,使用中国药典2020版“0931溶出度与释放度测定法”的第二法溶出装置,经30分钟过程中释放至少80%重量的氨氯地平或其药用盐和85%重量的比索洛尔或其药用盐。两个活性成分能与原研实现等同的释放效果,确保在体内的溶出和吸收,从而保证了药物的疗效发挥。
附图说明
[0039]
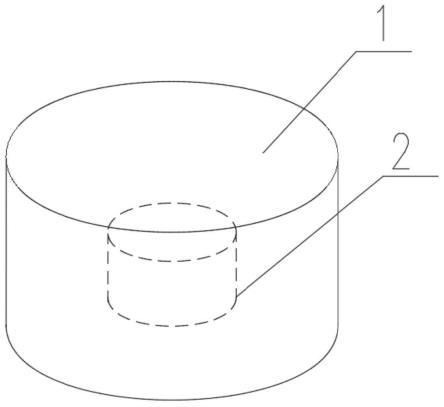
图1为本发明实施例1-20药剂的结构示意图;
[0040]
附图标记:1-片芯层;2-壳层。
具体实施方式
[0041]
为了更好的解释本发明,下面将更详细地描述本发明的示例性实施例。虽然以下显示了本发明的示例性实施例,然而应当理解,可以以各种形式实现本发明而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更清楚、透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
[0042]
实施例1-10:
[0043]
如图1所示:包含氨氯地平和比索洛尔的药剂,其包括氨氯地平片芯层1和比索洛尔壳层2,分别按表1所述的配方进行制备:
[0044]
表1(以下数值均指的是重量份)
[0045][0046]
[0047]
实施例1
[0048]
药剂的制备方法为:
[0049]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0050]
s2使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0051]
实施例2
[0052]
药剂的制备方法为:
[0053]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,经过干混直压的方法压制成氨氯地平片芯层;
[0054]
s2使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、交联聚维酮、胶态二氧化硅、乳糖和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上进行干法制粒的方式压制比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0055]
实施例3
[0056]
药剂的制备方法为:
[0057]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,加入硬脂酸镁混合3分钟,进行干法制粒压制成氨氯地平片芯层;
[0058]
s2使用60目筛,将富马酸比索洛尔、交联聚维酮、胶态二氧化硅和甘露醇采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0059]
实施例4
[0060]
药剂的制备方法为:
[0061]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和无水磷酸氢钙采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0062]
s2使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅、甘露醇和微晶纤维素采用等量递加法过筛3次混合,进行湿法制粒,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0063]
实施例5
[0064]
药剂的制备方法为:
[0065]
s1使用60目筛,将苯磺酸氨氯地平、交联聚维酮、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0066]
s2使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、交联聚维酮、乳糖和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0067]
实施例6
[0068]
药剂的制备方法为:
[0069]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、交联聚维酮、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0070]
s2使用60目筛,将富马酸比索洛尔、交联聚维酮、甘露醇和乳糖采用等量递加法过筛3次混合,进行流化床制粒,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0071]
实施例7
[0072]
药剂的制备方法为:
[0073]
s1使用60目筛,将苯磺酸氨氯地平、交联聚维酮、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0074]
s2使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、交联聚维酮、胶态二氧化硅、乳糖和微晶纤维素采用等量递加法过筛3次混合,流化床制粒,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0075]
实施例8
[0076]
药剂的制备方法为:
[0077]
s1使用60目筛,将苯磺酸氨氯地平、交联聚维酮、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0078]
s2使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅、甘露醇和微晶纤维素采用等量递加法过筛3次混合,干法制粒,加入硬脂酸镁混合3分钟,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0079]
实施例9
[0080]
药剂的制备方法为:
[0081]
s1使用60目筛,将马来酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0082]
s2使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层,并在壳层上包衣得到比索洛尔氨氯地平药剂。
[0083]
实施例10
[0084]
药剂的制备方法为:
[0085]
s1使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成氨氯地平片芯层;
[0086]
s2使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在氨氯地平片芯层上压制得到比索洛尔壳层。
[0087]
实施例11-20:包含氨氯地平和比索洛尔的药剂,其包括富马酸比索洛尔片芯层和
苯磺酸氨氯地平片壳层,在富马酸比索洛尔片芯层和苯磺酸氨氯地平片壳层之间设有隔层,分别按表2所述的配方进行制备:
[0088]
表2(以下数值均指的是重量份)
[0089][0090][0091]
实施例11
[0092]
药剂的制备方法为:
[0093]
s1使用60目筛,将富马酸比索洛尔、交联聚维酮、胶态二氧化硅和甘露醇采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,进行干法制粒,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0094]
s2使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、交联聚维酮、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在隔离
层压制壳层,得到药剂。
[0095]
实施例12
[0096]
药剂的制备方法为:
[0097]
s1使用60目筛,将富马酸比索洛尔、交联聚维酮、胶态二氧化硅、乳糖和甘露醇采用等量递加法过筛3次混合,流化床制粒,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0098]
s2使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,干法制粒,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0099]
实施例13
[0100]
药剂的制备方法为:
[0101]
s1使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0102]
s2使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0103]
实施例14
[0104]
药剂的制备方法为:
[0105]
s1使用60目筛,将富马酸比索洛尔、交联聚维酮、羧甲淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,进行干法制粒,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0106]
s2使用60目筛,将苯磺酸氨氯地平、交联聚维酮、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0107]
实施例15
[0108]
药剂的制备方法为:
[0109]
s1使用60目筛,将富马酸比索洛尔、交联聚维酮、胶态二氧化硅、乳糖、甘露醇和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0110]
s2使用60目筛,将苯磺酸氨氯地平、交联聚维酮、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0111]
实施例16
[0112]
药剂的制备方法为:
[0113]
s1使用60目筛,将富马酸比索洛尔、交联聚维酮、羧甲淀粉钠、甘露醇和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,进行干法制粒,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0114]
s2使用60目筛,将苯磺酸氨氯地平、交联聚维酮、羧甲淀粉钠、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,
加入硬脂酸镁混合3分钟,压制包芯片。得到比索洛尔氨氯地平包芯片。
[0115]
实施例17
[0116]
药剂的制备方法为:
[0117]
s1使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅、乳糖和微晶纤维素采用等量递加法过筛3次混合,湿法制粒,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0118]
s2使用60目筛,将苯磺酸氨氯地平、交联聚维酮和无水磷酸氢钙采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0119]
实施例18
[0120]
药剂的制备方法为:
[0121]
s1使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅、甘露醇和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0122]
s2使用60目筛,将苯磺酸氨氯地平、交联聚维酮、羧甲淀粉钠、胶态二氧化硅、无水磷酸氢钙和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,干法制粒,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0123]
实施例19
[0124]
药剂的制备方法为:
[0125]
s1使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成片芯层,并在片芯层上包衣制得隔离层;
[0126]
s2使用60目筛,将马来酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在隔离层压制壳层,得到药剂。
[0127]
实施例20
[0128]
药剂的制备方法为:
[0129]
s1使用60目筛,将富马酸比索洛尔、羧甲淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制成片芯层;
[0130]
s2使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,在比索洛尔片芯层上压制壳层,得到药剂。
[0131]
如图1所示,实施例1-20药剂为圆柱体的结构示意图,其中,片芯层也为圆柱体,体积为40~50mm3,实施例1-20药剂的底面积设置为相同,底面积为>60mm2,实施例1-20药剂片芯层的底面积设置为相同,底面积为<20mm2。实施例1-20药剂还可以是设置成其它满足片芯层被壳层完全包裹的结构。
[0132]
对比例1:包含氨氯地平和比索洛尔的双层片的制备
[0133]
表3(以下数值均指的是重量份)
[0134][0135]
对比例1制备方法:
[0136]
使用60目筛,将苯磺酸氨氯地平、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟。
[0137]
使用60目筛,将富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟,压制双层片。得到比索洛尔氨氯地平双层片。
[0138]
对比例2:氨氯地平比索洛尔复方普通片的制备
[0139]
表4(以下数值均指的是重量份)
[0140]
成分名称对比例2苯磺酸氨氯地平6.93富马酸比索洛尔5微晶纤维素271.57羧甲基淀粉钠9胶态二氧化硅4.5硬脂酸镁3
[0141]
对比例2的制备方法:
[0142]
使用60目筛,将苯磺酸氨氯地平、富马酸比索洛尔、羧甲基淀粉钠、胶态二氧化硅和微晶纤维素采用等量递加法过筛3次混合,加入硬脂酸镁混合3分钟。压制素片。得到比索洛尔氨氯地平片。
[0143]
试验例1:
[0144]
在不同溶出试验条件下,对本发明实施例制备的制剂进行溶出试验。作为比较溶出度试验中使用的对照药物,使用了merckkft生产的片剂比索洛尔氨氯地平片(康忻安)。对照药物、实施例、对比例1和2的溶出结果如下。
[0145]
表5富马酸比索洛尔溶出结果(ph4.5醋酸盐缓冲液,桨法-50rpm)
[0146]
溶出时间(min)0510152030对照药物097.899.6100.499.899.6实施例1062.698.899.6100100.1实施例3065.5100.5100.6100.7101.1实施例9061.696.799.8100.1100.1实施例10098.299.299.499.999.9实施例11042.898.098.299.4100.3实施例13058.698.599.199.8100.2实施例19057.398.199.799.8100实施例20096.699.099.399.899.9对比例1093.399.499.699.999.9对比例2097.999.9100.2100.4100.2
[0147]
表6富马酸比索洛尔溶出结果(ph6.8磷酸盐缓冲液,桨法-50rpm)
[0148]
溶出时间(min)0510152030对照药物096.398.197.998.298.2实施例1070.299.2101.0101.5100.6实施例3051.2100.9101.2100.7100.7实施例9071.697.9100.2100.5100.5实施例10096.198.699.899.9100.2实施例11059.398.098.2101.4101.1实施例13054.999.9100.7101.8101.8实施例19051.898.699.9100.4100.4实施例20095.698.799.9100.3100.2对比例1092.398.599.499.399.8对比例2094.598.499.599.299.8
[0149]
表7富马酸比索洛尔溶出结果(0.005mol/l盐酸,桨法-50rpm)
[0150]
[0151][0152]
表8富马酸比索洛尔溶出结果(纯水,桨法-50rpm)
[0153]
溶出时间(min)0510152030对照药物092.394.195.596.096.3实施例1060.299.599.9100.1100.6实施例3049.299.399.3100.2100.0实施例9061.599.899.9100.2100.4实施例10094.298.599.499.699.7实施例11053.197.298.898.399.0实施例13045.396.496.996.097.6实施例19043.396.198.999.499.7实施例20094.798.999.899.6100.2对比例1094.298.299.499.799.9对比例2093.296.398.399.8100.2
[0154]
表9氨氯地平溶出结果(ph4.5醋酸盐缓冲液,桨法-50rpm)
[0155][0156]
[0157]
表10氨氯地平溶出结果(0.005mol/l盐酸,桨法-50rpm)
[0158]
溶出时间(min)0510152030对照药物079.487.291.992.595.5实施例1053.985.195.895.397.4实施例3052.284.495.295.595.6实施例9050.982.894.696.497.8实施例10075.286.494.397.898.3实施例11085.391.297.3100.4100.4实施例13084.293.298.2100.299.9实施例19081.491.496.798.299.3实施例20082.693.698.899.699.9对比例1080.488.699.6100.2100.2对比例2082.890.594.695.298.6
[0159]
表101氨氯地平溶出结果(ph6.8磷酸盐缓冲液,桨法-50rpm)
[0160]
溶出时间(min)101520304560对照药物69.174.877.981.785.988.2实施例167.471.477.583.787.689.4实施例359.769.775.482.587.490.5实施例962.469.474.581.784.687.4实施例1068.472.476.581.586.288.3实施例1173.480.284.286.490.293.8实施例1370.273.578.282.485.390.3实施例1966.970.276.280.183.589.2实施例2069.273.977.882.883.890.8对比例169.272.478.180.483.488.0对比例270.975.780.683.686.990.6
[0161]
表11氨氯地平溶出结果(纯水,桨法-50rpm)
[0162][0163]
[0164]
如表5-12所示,实施例制剂与对照药物及对照例相比,在所有溶出条件下,比索洛尔的溶出都满足15分钟累计溶出度大于85%;氨氯地平在ph4.5醋酸盐缓冲液和0.005mol/l盐酸条件下,也满足15分钟累计溶出度大于85%,根据溶出度评价标准,累计溶出度15分钟大于85%,认为制剂溶出相似;在ph6.8磷酸盐缓冲液和纯水条件下的溶出曲线,也均与对照相似。
[0165]
试验例2:杂质研究结果
[0166]
分别检测实施例1-20、对比例1和2的0天杂质结果,并将不带包装的实施例1-20、对比例1和2的样品放置于40℃42℃、相对湿度75%45%条件下进行考察,检测并对比了本复方进口注册标准规定的多个杂质的含量,其aml-2、其他最大单杂、总杂结果如下表所示。
[0167]
表12实施例与对比例的杂质结果
[0168][0169][0170]
结果表明,本发明实施例1-20,氨氯地平比索洛尔加成杂质aml-2可控制在较低水平,其中实施例11-19在0天aml-2杂质未检出。在严苛的考察条件下(不带包装,裸片放置,40℃42℃、相对湿度75%45%)放样考察,实施例的aml-2杂质仍保持在较低水平甚至未检出,而对比例的杂质增长明显。
[0171]
实施例20无隔层且无包衣的设置,其依然具有较好的稳定性,说明本发明制剂的构造在一体式设置的前提下,一方面减少两种药物的接触面,另一方面虽然两种药物依然会接触,但是其中一种药物与外界环境隔绝,隔绝了水分等促进反应的因素,防止两种药物发生反应产生杂质。
[0172]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1