八宝丹在制备用于预防或治疗脓毒症的药物中的用途的制作方法
1.本发明属于中药领域,更具体而言,本发明涉及八宝丹在制备用于预防或治疗脓毒症的药物中的用途。
背景技术:
2.脓毒症(sepsis),包含既往概念中的败血症和脓毒血症,是由细菌等病原微生物侵入机体引起的全身炎症反应综合征。除全身炎症反应综合征和原发感染病灶的表现外,重症患者还常有器官灌注不足的表现。脓毒症病情凶险,病死率高,是目前重症监护病房内非心脏病患者死亡的主要原因。迄今,脓毒症的发病机制仍未完全阐明,亦尚无明确有效的治疗手段
1.。
3.越来越多的证据表明,机体天然免疫功能调控紊乱是过度炎症反应、脓毒症的主要原因之一
2.。在脓毒症病情进展往往伴随心血管、呼吸以及胃肠道消化系统存在nlrp3炎症小体活化及其所致的线粒体能量代谢功能紊乱
3.。为此,nlrp3炎症小体是脓毒症发生的机制以及潜在的治疗靶点之一。
4.八宝丹源自中药古方,具有清利湿热、活血解毒、去黄止痛等功效,适用于湿热蕴结所致发热、黄疸、小便黄赤、恶心呕吐、纳呆、肋痛腹胀、舌苔黄腻或厚腻干白,或湿热下注所致尿道灼热刺痛、小腹胀痛,以及传染性病毒性感染、急性胆囊炎、急性泌尿系统感染等。
5.目前,尚未有研究表明八宝丹是否对脓毒症具有预防或治疗效果。
技术实现要素:
6.一方面,本发明提供了八宝丹在制备用于预防或治疗脓毒症的药物中的用途。
7.在一个实施方式中,八宝丹通过抑制nlrp3炎症小体活化对脓毒症具有预防或治疗效果。
8.另一方面,本发明提供了八宝丹在制备用于抑制nlrp3炎症小体活化的药物中的用途。
9.本发明的药物可以为本领域常规的各种剂型,例如固体、半固体或液体的形式,可以为水溶液、非水溶液、混悬液、锭剂、胶囊剂、片剂、颗粒剂、丸剂和散剂等。所述药物的给药途径可以为注射给药或口服给药。所述注射给药可以包括静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。
10.基于质量百分比,所述药物可以包括0.01~99.99%八宝丹或其提取物,以及99.99~0.01%的辅助成分。
11.所述药物可以包括一种或多种药学上可接受的常规辅料。所述药学上可接受的常规辅料可以为赋形剂、填充剂或稀释剂等。
12.本研究通过1)构建腹腔注射内毒素脂多糖(lps)导致的脓毒症小鼠模型,以八宝丹灌胃给药,分别从小鼠的生存率、血清炎症因子il-1β、tnf-α的产生以及器官(肺、肝、脾)组织病理的改变评价八宝丹的治疗效果;2) 通过lps+atp刺激腹腔巨噬细胞(pms),构建
nlrp3炎症小体活化模型,八宝丹干预给药后,分别从il-1β、tnf-α炎症因子产生、nf-κb信号通路活化、nlrp3复合物形成等指标评价八宝丹对nlrp3炎症小体活化的调控作用;3)以uplc-qtof-ms分析八宝丹提取物的化学成分,分析可能具有抗炎症小体活化效应的化学成分。
13.在上文中已经详细地描述了本发明,但是上述实施方式本质上仅是例示性,且并不欲限制本发明。此外,本文并不受前述现有技术或发明内容或以下实施例中所描述的任何理论的限制。
14.除非另有明确说明,在整个申请文件中的数值范围包括其中的任何子范围和以其中给定值的最小子单位递增的任何数值。除非另有明确说明,在整个申请文件中的数值表示对包括与给定值的微小偏差以及具有大约所提及的值以及具有所提及的精确值的实施方案的范围的近似度量或限制。除了在详细描述最后提供的工作实施例之外,本技术文件(包括所附权利要求)中的参数(例如,数量或条件)的所有数值在所有情况下都应被理解为被术语“大约”修饰,不管“大约”是否实际出现在该数值之前。“大约”表示所述的数值允许稍微不精确(在该值上有一些接近精确;大约或合理地接近该值;近似)。如果“大约”提供的不精确性在本领域中没有以这个普通含义来理解,则本文所用的“大约”至少表示可以通过测量和使用这些参数的普通方法产生的变化。例如,“大约”可以包括小于或等于10%,小于或等于5%,小于或等于4%,小于或等于3%,小于或等于2%,小于或等于1%或者小于或等于0.5%的变化。
附图说明
15.图1显示实施例1中脓毒症小鼠生存曲线。
16.图2为显示实施例1中脓毒症小鼠血清炎症因子含量的图。
17.图3为实施例1中脓毒症小鼠的肺、肝、脾组织病理照片。其中,可看见肝细胞空泡变性,肝脏炎症细胞浸润,脾脏凋亡等情况。标尺:200μm(肺和脾),100μm(肝)。
18.图4为显示实施例2中腹腔巨噬细胞nlrp3炎症小体活化相关炎症因子释放的图。其中:a为不同浓度的八宝丹提取物样品1(6.25-100μg/ml) 对细胞活性的影响;b为不同浓度的八宝丹提取物样品1(25-100μg/ml)对细胞释放il-1β的影响;c为不同浓度的八宝丹提取物样品1(25-100μg/ml) 对细胞释放tnf-α的影响;d为不同浓度的八宝丹提取物样品2 (1.25-20μg/ml)对细胞活性的影响;e为不同浓度的八宝丹提取物样品2 (5-20μg/ml)对细胞释放il-1β的影响;f为不同浓度的八宝丹提取物样品 2(5-20μg/ml)对细胞释放tnf-α的影响。
19.图5显示实施例2中腹腔巨噬细胞nlrp3炎症小体活化步骤1:nf-κb 信号通路活化。其中:a为不同浓度的八宝丹提取物样品1(25-100μg/ml) 干预前后对nlrp3蛋白表达的影响;b为不同浓度的八宝丹提取物样品2 (5-20μg/ml)干预前后对nlrp3蛋白表达的影响;c为八宝丹提取物样品1 和八宝丹提取物样品2干预后的比较。
20.图6显示实施例2中腹腔巨噬细胞nlrp3炎症小体活化步骤2:nlrp3 炎症小体组装。其中:a为八宝丹提取物样品1和样品2分别干预后对asc 影响,标尺:40μm(图像),20μm(放大区域);b为八宝丹提取物样品1和样品2分别干预后对该细胞asc多聚体含量的影响;c为八宝丹提取物样品 1对nlrp3炎症小体组装的影响;d为八宝丹提取物样品2对nlrp3炎症
小体组装的影响。
21.图7显示实施例3中八宝丹提取物uplc-qtof-ms分析阴离子图谱。其中:a为八宝丹提取物样品1的uplc-qtof-ms分析阴离子图谱;b为八宝丹提取物样品2的uplc-qtof-ms分析阴离子图谱。
具体实施方式
22.下述实施例所使用的实验方法如无特殊说明,均为常规方法。
23.下述实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
24.实验药品
25.八宝丹胶囊,产自厦门中药厂有限公司,药品批号:160730030。
26.实验动物:
27.c57bl/6小鼠,雄性,6~8周龄,体重21~23g,购自北京维通利华实验动物技术有限公司。实验动物质量合格证编号:20210113abzz0619040235。小鼠分笼饲养,保持室温20~23℃,光照条件为12h照明,12h黑暗,给予充足饲料及饮用水以供小鼠自由进食。所有动物实验均经浙江大学实验动物伦理委员会批准,批准编号:14580,并严格遵守相关管理条例。
28.主要仪器
29.image xpress pico自动细胞成像及分析系统购自molecular devices公司,酶标仪tecanm1000 microplate reader购自tecan公司,化学发光成像仪购自bio-rad公司。
30.数据处理及统计学分析
31.数据以来自三次独立实验的mean
±
sem(平均值
±
平均值的标准误差) 来表示。生存率数据采用kaplan-meier法分析,采用log-rank检验进行比较。其余数据均根据多因素方差分析(one-way anova)检测组间的差异显著性。当p≤0.05(*)、p≤0.01(**)和p≤0.001(***)时,数据被认为是具有统计学差异的。使用graphpad prism 8.0分析所有数据。
32.实施例1:
33.构建腹腔注射内毒素lps导致的脓毒症小鼠模型,以八宝丹灌胃给药,分别从小鼠的生存率、血清炎症因子il-1β、tnf-α的产生以及器官(肺、肝、脾)组织病理的改变评价八宝丹的治疗效果。
34.灌胃用八宝丹制作方法:
35.称取一定量胶囊内粉末,加入一定量miliq水至指定浓度(低剂量: 110.97mg/ml、高剂量:332.91mg/ml),溶解混匀,冰浴超声30min后,按照10μl/g进行灌胃。
36.败血症小鼠存活率检测
37.将小鼠分为五组:模型组,四组给药组:造模前2h灌胃给予高剂量 3.3291g/kg八宝丹组(高剂量八宝丹造模前给药)、造模前2h灌胃给予低剂量1.1097g/kg八宝丹组(低剂量八宝丹造模前给药)、造模后立即灌胃给予高剂量3.3291g/kg八宝丹组(高剂量八宝丹造模后给药)、造模后立即灌胃给予低剂量1.1097g/kg八宝丹组(低剂量八宝丹造模后给药),每组8只,分笼饲养。五组小鼠均腹腔注射25mg/kg lps,造模组灌胃给予给药组同等体积超纯水。造模及给药完成后,每隔一小时观察一次各组小鼠状态及存活情况,并记录。
38.败血症小鼠血清中炎症因子含量检测
39.将小鼠分为三组:空白组、模型组、八宝丹组,每组7只,分笼饲养。模型组和八宝丹组腹腔注射20mg/kg lps,空白组腹腔注射模型组等体积超纯水,八宝丹组造模后立即灌胃给予1.1097g/kg八宝丹,空白组和模型组灌胃给予给药组等体积超纯水。给药完成4h后,使用异戊巴比妥钠腹腔注射进行麻醉,自下腔静脉取血,置于1.5ml离心管中,静置2h后,4℃,5000rpm 离心10min,分离上层透明血清,进行elisa对各组小鼠血清内炎症因子il-1 β、tnf-α含量检测。
40.器官病理检测
41.将小鼠分为三组:空白组、模型组、八宝丹组,每组3只,分笼饲养。模型组和八宝丹组腹腔注射15mg/kg lps,空白组腹腔注射模型组等体积超纯水,八宝丹组造模后立即灌胃给予1.1097g/kg八宝丹,空白组和模型组灌胃给予给药组等体积超纯水。给药完成24h后,解剖观察并取出各组小鼠肝、肺、脾等器官,置于多于10倍器官体积的4%多聚甲醛中固定,进行石蜡包埋、切片和苏木素-伊红染色(he染色)(武汉赛维尔生物科技有限公司),显微镜(日本尼康)下观察切片(10倍、20倍、40倍物镜),记录各组器官病理情况。
42.结果:
43.以致死量lps(25mg/kg体重)腹腔注射,构建小鼠脓毒症模型,以不同剂量的八宝丹(高剂量3.3291g/kg体重、低剂量1.1097g/kg体重,低剂量等同于3倍临床推荐用量1.8g/天),分别在lps注射2小时前给药,或之后立即给药,给药方式为进行一次性灌胃给药。结果表明,模型组小鼠均在lps 注射后40小时内死亡,八宝丹给药可提高小鼠的生存率,其中高剂量八宝丹造模前给药组、低剂量八宝丹造模前给药组以及造模后给药组小鼠的生存率有显著性差异(分别为p=0.0380,p=0.0268,p=0.0266)。高剂量八宝丹造模后给药组小鼠死亡率未见统计学差异(p=0.0565),可能与部分小鼠发生灌胃后呕吐有关(图1)。
44.以lps(20mg/kg体重)腹腔注射,注射后即刻以低剂量八宝丹(1.1097 g/kg体重)灌胃给药,4小时后收集小鼠血清,以elisa法检测il-1β、tnf-α浓度,结果发现,八宝丹可以显著降低脓毒症小鼠血清炎症因子il-1β、tnf-α的释放(图2)。
45.以lps(15mg/kg体重)腹腔注射,注射后即刻以低剂量八宝丹(1.1097 g/kg体重)灌胃给药,24小时后分别收集小鼠的肺、肝、脾,进行he染色,分析病理变化。结果表明,脓毒症小鼠的肺组织增厚并伴有炎症细胞浸润;肝、脾组织均出现坏死灶,表现为多器官损伤。八宝丹可明显减轻脓毒症小鼠多器官损伤(图3)。
46.实施例2:
47.通过lps+atp刺激腹腔巨噬细胞(pms),构建nlrp3炎症小体活化模型,八宝丹干预给药后,分别从il-1β、tnf-α炎症因子产生、nf-κb信号通路活化、nlrp3复合物形成等指标评价八宝丹对nlrp3炎症小体活化的调控作用。
48.体外细胞实验用八宝丹提取物制作方法:
49.将八宝丹胶囊内粉末(1g)加入到20ml超纯水中超声提取30min,离心后收集上清液1,旋干后用二甲亚砜(dmso)溶解获得提取物样品1,母液浓度为100mg/ml。第一次离心后剩余沉淀加入20ml 70%乙醇再进行 30min超声提取,离心后收集上清液2,旋干后旋干后用二甲亚砜(dmso) 溶解获得提取物样品2,母液浓度为20mg/ml。
50.八宝丹抑制炎症因子分泌检测
51.提取6~8周c57bl/6雄性小鼠腹腔巨噬细胞,8
×
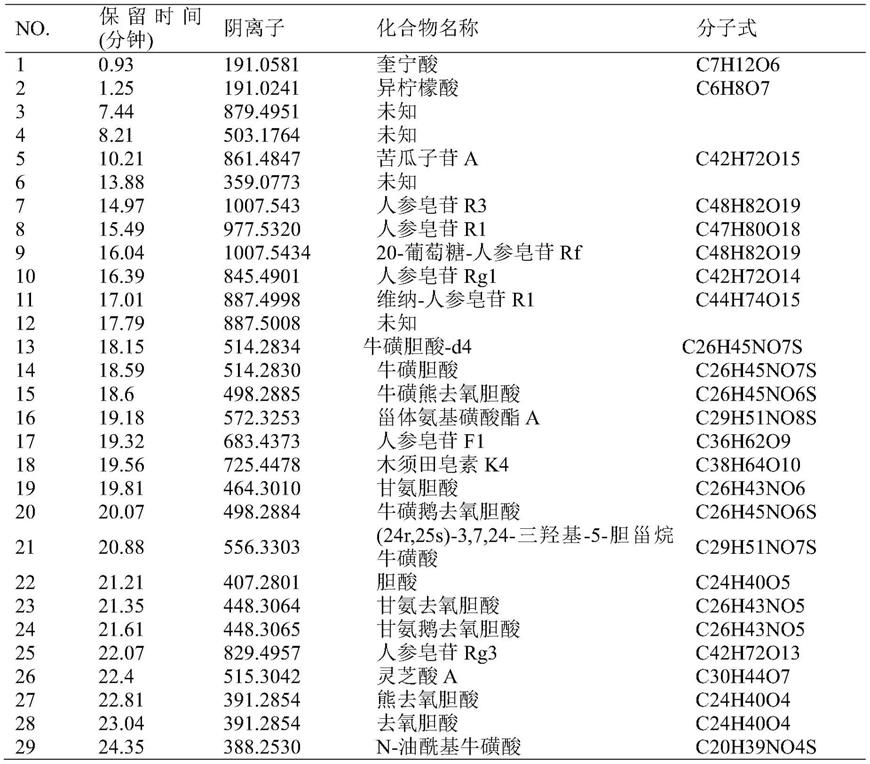
105/孔的密度种于12 孔板中,培养过夜,pbs洗涤一次,更换含有500ng/ml lps培养液,lps 引发5.5h之后,不更换培养液,加入2mm atp刺激30min,期间八宝丹提取物(样品1和样品2)的给药方式为:在lps引发前30min加入或lps引发5h后加入。处理结束后,收集细胞上清液进行elisa检测炎症因子il-1 β和tnf-α含量。
52.八宝丹抑制nf-κb信号通路激活蛋白检测
53.提取6~8周c57bl/6雄性小鼠腹腔巨噬细胞,8
×
105/孔的密度种于12 孔板中,培养过夜,pbs洗涤一次,更换含有500ng/ml lps培养液,lps 引发5.5h之后,不更换培养液,加入2mm atp刺激30min,期间八宝丹提取物(样品1和样品2)的给药方式为:在lps引发前30min加入或lps引发5h后加入。处理结束后,收集细胞裂解物进行western blotting测定p-nf
‑ꢀ
κb p-p65、pro-il-1β、nlrp3和asc蛋白表达水平。
54.八宝丹减少asc斑点形成检测
55.提取6~8周c57bl/6雄性小鼠腹腔巨噬细胞,8
×
104/孔的密度种于96 孔板中,培养过夜,pbs洗涤一次,更换含有500ng/ml lps培养液,lps 引发5.5h之后,不更换培养液,加入2mm atp刺激30min,期间八宝丹提取物(样品1和样品2)的给药方式为:在lps引发5h后加入。处理结束后,除去培养液,pbs洗涤一次,用4%多聚甲醛固定1h,0.3%triton x-100透化30min,5%bsa封闭1h后,将细胞与asc一抗(1:800用5%bsa稀释) 4℃孵育过夜。用fitc标记山羊抗兔igg(h+l)(1:200用5%bsa稀释) 在室温下孵育1h。细胞核用hoechst(2μg/ml用pbs稀释)染色10min。使用imagexpress pico自动细胞成像分析系统观察染色的细胞并进行成像。具体成像参数:40倍物镜;dapi通道进行细胞核荧光图像采集、fitc通道进行asc蛋白荧光图像采集。使用image j软件分析绘制图像。
56.八宝丹抑制asc蛋白寡聚检测
57.提取6~8周c57bl/6雄性小鼠腹腔巨噬细胞,2
×
106/孔的密度种于6孔板中,培养过夜,pbs洗涤一次,更换含有500ng/ml lps培养液,lps引发5.5h之后,不更换培养液,加入2mm atp刺激30min,期间八宝丹提取物(样品1和样品2)的给药方式为:在lps引发5h后加入。处理结束后,收集细胞裂解物,每个样品取出10μl作为蛋白含量参考,剩余样品4℃、 330
×
g离心10min后,收集沉淀物并用预冷pbs洗涤两次。将沉淀物重新悬浮在含有2mm辛二酸双(n-羟基琥珀酰亚胺酯)(sigma)的500μlpbs中,在室温下旋转孵育30分钟。之后将样品在4℃下以5000
×
g离心 10min以获得用于western blotting的沉淀物。
58.结果:
59.以lsp+atp(5.5+0.5小时)刺激腹腔巨噬细胞nlrp3炎症小体活化。分别在lps刺激前后加入八宝丹提取物(样品1、样品2)进行干预。实验终点分别以mtt法检测细胞活率,elisa检测炎症因子il-1β、tnf-α的释放。结果表明,八宝丹提取物可显著抑制il-1β、tnf-α等炎症因子的释放,抑制nlrp3炎症小体活化(图4)。
60.以lsp+atp(5.5+0.5小时)刺激腹腔巨噬细胞nlrp3炎症小体活化。分别在lps刺激前后加入八宝丹提取物(样品1、样品2)进行干预,以蛋白印迹实验(westernblot)检测炎症小体相关蛋白nlrp3、il-1β表达以及 nf-κb信号通路活化,发现八宝丹可以抑制nf-κb信号通路活化(nlrp3 炎症小体活化步骤1)(图5)。
61.以lsp+atp(5.5+0.5小时)刺激腹腔巨噬细胞nlrp3炎症小体活化。在lps刺激后加
入八宝丹提取物(样品1、样品2)进行干预,分别以免疫荧光以蛋白印迹实验(westernblot)检测炎症小体相关蛋白asc蛋白多聚体,发现八宝丹可以抑制nlrp3炎症小体的组装(nlrp3炎症小体活化步骤2) (图6)。
62.实施例3:以uplc-qtof-ms分析八宝丹提取物的化学成分,分析可能具有抗炎症小体活化效应的化学成分。
63.uplc-qtof-ms分析八宝丹提取物
64.uplc-qtof-ms分析八宝丹提取物(实施例2中制备的样品1和样品2) 化学成分。使用acquity uplc系统(waters,milford,ma,usa)与tripletof 5600plus ms(ab sciex,framingham,ma,usa)进行化学成分分析。使用waters acquity uplc hss sb-c18(100mm
×
2.1mm内径,1.8μm) 进行色谱分离,使用0.1%甲酸-水(a)和0.1%甲酸-乙腈(b)作为流动相。线性梯度洗脱程序设置如下:0min,5%b;15分钟,25%b;20分钟, 50%b;25min,95%b。柱温保持在40℃,进样量3μl,流速0.3ml/min 进行分析。q-tof/ms/ms采用负电离(esi)模式,参数设置如下:扫描范围: m/z 60-1200;雾化气体(gs1):55psi;雾化气体(gs2):55psi;帘式空气 (cur):35psi;离子源温度(tem):550℃;离子源电压:-4500v;第一阶段扫描:去簇电压(dp):100v;聚焦电压(ce):10v;二次扫描:质谱数据采用tof ms~子离子~ida模式采集,cid能量为35(15ev),采样前用cds泵进行质轴校正,使质轴误差小于2ppm。使用msconvert软件将获取的ms/ms数据转换为mzxml格式,然后使用mzmine 2v40.1进行分析,将一级质谱噪声水平设置为1.0e5,二级质谱噪声水平设置为1.0e3。
65.结果:
66.以uplc-qtof-ms分析八宝丹提取物(样品1、样品2),分析表明胆酸和皂苷类物质可能是其通过抗nlrp3炎症小体治疗脓毒症的药效物质(图 6、表1、表2)。
67.表1.uplc-qtof-ms鉴定样品1中的化合物保留时间
[0068][0069]
表2.uplc-qtof-ms鉴定样品2中的化合物保留时间
[0070][0071][0072]
综上,八宝丹对内毒素引起的脓毒症具有预防或治疗效果,其作用机制可能为其胆酸和皂苷类物质的抗nlrp3炎症小体效应。
[0073]
参考文献
[0074]
1.singer,m.,deutschman,c.s.,seymour,c.w.,shankar-hari,m.,annane,d.,bauer,m.,bellomo,r.,bernard,g.r.,chiche,j.d.,coopersmith,c.m.,hotchkiss,r.s.,levy,m.m.,marshall,j.c.,martin,g.s.,opal,s.m.,rubenfeld,g.d.,vanderpoll,t.,vincent,j.l.,angus,d.c.,2016.thethirdinternationalconsensusdefinitionsforsepsisandsepticshock(sepsis-3).jama.315(8),801-810.https://doi.org/10.1001/jama.2016.0287.
[0075]
2.delano,m.j.,ward,p.a.,2016.theimmunesystem'sroleinsepsisprogression,resolution,andlong-termoutcome.immunolrev.274(1),330-353.https://doi.org/10.1111/imr.12499.
[0076]
3.danielski,l.g.,giustina,a.d.,bonfante,s.,barichello,t.,petronilho,f.,2020.thenlrp3inflammasomeanditsroleinsepsisdevelopment.inflammation.43(1),24-31.https://doi.org/10.1007/s10753-019-01124-9。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1