一种光增强化疗并实现肿瘤一体化诊疗的纳米材料及其制备方法和应用
1.本发明属于纳米生物医药技术和肿瘤诊疗技术领域,特别涉及一种具有光增强化疗并实现肿瘤一体化诊疗的纳米材料及其制备方法和应用。
背景技术:
2.膀胱癌是世界范围内最常见的肿瘤之一,每年约有573,000新发病例和213,000死亡病例,带来了极大的社会负担。手术联合化疗作为膀胱癌广泛采用的治疗措施仍然面临着极高的复发率和转移率,其原因主要在于残留的微小病灶和浸润性微小转移灶对化疗药物的不敏感。虽然铂类药物为基础的新辅助化疗已经被众多诊疗指南推荐应用于肌层浸润性膀胱癌的综合治疗中,但剂量依赖的副作用显著制约了其广泛应用。有近一半的肌层浸润性膀胱癌患者因化疗前身体状况评估不合格而错失化疗机会。因此,将诊断与治疗有机结合起来,有效整合多模态治疗并采取靶向激活的策略,从而降低化疗药物所导致的全身副作用,是这部分患者临床治疗中的急切需求。
3.近十余年来,光诊疗技术蓬勃发展,不仅实现了可视化生物组织和生命活动的过程,而且还带来了利用荧光、磷光等材料实现疾病诊断和治疗的可能性,并因其无创、高灵敏度、可实时监测和治疗等优点受到广泛关注。对于膀胱癌的诊治,由于内镜可经自然腔道观察和治疗膀胱内的病变,经静脉注射光敏剂并联合膀胱腔内光动力治疗已被临床研究证实对部分反复复发和难治性膀胱癌有效。然而,传统光敏剂溶解性有限,在生理条件下呈现聚集诱导猝灭现象,导致其发光及活性氧的产生都受到抑制。专利《一类级联实施肿瘤一体化诊疗的多功能纳米复合物及其制备方法和应用》公开了肿瘤一体诊疗化的多功能纳米复合物(itmnc)。该多功能纳米复合物集靶向递送、光学/光声双模成像、分子靶向化疗/光治疗联合于一体,可实现体内非侵入性的肿瘤诊断和实时监控治疗,有效抑制肿瘤生长,同时降低对正常组织器官产生的毒副作用。但其不足之处在于:(1)所用的无机纳米粒子尤其是空心硫化铜纳米粒含有的cu金属元素,作为体内的微量元素,过量的铜具有生物毒性,体内代谢和排泄困难;(2)分子靶向前药pdc是指rgd多肽与化疗药物经小分子连接桥臂偶联所得的偶联物。rgd在肿瘤组织中表达不一,已知只有少数几种高表达,才可能具备所描述的亲和力;(3)纳米结构粒径大小约200nm,肿瘤富集困难;(4)所述nir激光照射触发药物释放,触发机制未说明。
4.一类具有聚集诱导发光的有机荧光材料(aiegen)的发现为解决这一问题带来了曙光。这些聚集诱导发光分子可通过对聚集状态的调控,实现荧光增强,ros产率增加或具有出色的光热转化效率。这类光诊疗剂的不断开发为实现荧光诊断,光动力治疗,光热治疗和光声成像提供了新的选择。综合应用这类多功能光敏剂实施的光疗联合化疗,有望降低化疗副作用及解决肿瘤的耐药问题。
5.为了进一步降低顺铂全身副作用,进一步采用了原位激活的前药递送策略。顺铂的前药pt(iv)毒性较低,且可在细胞内被谷胱甘肽还原为pt(ii)发挥细胞毒性作用。并且,
肿瘤组织内还原型谷胱甘肽表达量较正常组织高四倍,可有效激活顺铂前药。因此包载有这类前药的纳米药物可实现肿瘤局部活化并杀伤肿瘤细胞的精准化疗。
6.白蛋白作为人体内最为丰富的血浆蛋白,具有功能丰富的基团,可与多种小分子外源性药物结合,增加长循环时间改善肿瘤部位的药物递送。而且,与人工合成的聚合物相比,白蛋白更容易被肝脏降解和代谢,作为药物载体已经有多种药物被各国药物监管部门批准应用于肿瘤治疗。
技术实现要素:
7.本发明的目的在于解决现有技术存在的不足,提供一类以包载多功能aie光敏剂和化疗药物,实现光增强化疗并实现肿瘤一体化诊疗的纳米材料及其制备方法和应用。该纳米材料将偶联了顺铂前药的白蛋白与具有聚集诱导发光性质的光敏剂自组装,成功构筑载有分子聚集体的蛋白笼状多功能纳米粒子,集肿瘤近红外荧光成像,蛋白笼状纳米粒子光激发释放,化疗药物靶向激活,光动力/光热协同化疗于一体,可实现肿瘤的非侵入性诊断和实时监控治疗过程,能够有效抑制肿瘤增殖,同时降低全身性副作用。
8.本发明提供了一类共载光敏剂和化疗药物的纳米材料,可实现光增强化疗并实现肿瘤一体化诊疗。其由如下四个功能部分组成:1)具有近红外荧光发射的aie光敏剂以聚集态包载于纳米材料中,为肿瘤原位诊断和光疗的靶向实施提供基础;2)该多功能aie光敏剂在光激发下同时具有光动力和光热效应,可实现肿瘤协同治疗;3)以白蛋白作为载体,包载aie分子,进一步使其分子内振动、转动受限,增强荧光发射及ros产生;4)白蛋白载体生物相容性良好,延长药物长循环时间并增加肿瘤内滞留,且易降解;5)白蛋白笼装粒子可光敏器产生的65℃以上变性、解聚,促进偶联于白蛋白的顺铂前药被肿瘤细胞内高表达的还原性物质活化,实现肿瘤局部释放。
9.本发明中所述的多功能aie光敏剂是指具有聚集诱导发光性质,近红外荧光发射,并且具有光动力/光热治疗功能的分子。包括但不限于无机材料如半导体纳米晶体、半导体量子点、单壁碳纳米管、上转换纳米粒子和有机材料如包括半导体聚合物、共轭聚合物和小分子染料等。
10.本发明采用下述技术方案实现:
11.一种光增强化疗并实现肿瘤一体化诊疗的纳米材料bitt@bsa-dsp的制备方法,具体步骤如下:
12.(1)制备顺铂的前药pt(iv)-2cooh(dsp):将顺铂粉末分散在水中并在40~50℃下搅拌,然后加入h2o2并于72~78℃搅拌4~6小时。在此过程中,顺铂逐渐溶解成无色透明溶液。恢复至室温后,反应液在-15~-25℃下重结晶,用冷乙醚洗涤获得pt(iv)-2oh黄色固体并在烘箱中干燥。随后,将pt(iv)-2oh和琥珀酸酐添加到dmf中,在68~73℃下搅拌20~30h,然后将冷乙醚加入混合溶液中,在-20℃重结晶,得到白色固体pt(iv)-2cooh(dsp)。
13.(2)制备bsa与dsp偶联物(bsa-dsp):将dsp、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc
·
hcl)硫代琥珀酰亚胺(sulfo-nhs)于室温下在水(ph=7.0)中混合30~40分钟,其中dsp,edc
·
hcl,sulfo-nhs的摩尔比为dsp:edc
·
hcl:sulfo-nhs=2:(5~10):(20~50)。然后再将牛血清白蛋白(bsa)溶解在pbs缓冲液中,并添加到上述混合溶液中,在25~32℃下搅拌2~3小时。所得混合物用pbs缓冲液洗涤并通过超滤装置超滤以去除未结
合的dsp和未反应的化合物,得到bsa-dsp。
14.(3)制备光增强化疗并实现肿瘤一体化诊疗的纳米材料(bitt@bsa-dsp):将多功能aie光敏剂bitt(bitt为上述多功能aie光敏剂中小分子有机染料的代表)溶于乙醇制成储备液,并将bsa-dsp用pbs缓冲液稀释;然后用乙醇将bitt储备液稀释后快速添加到bsa-dsp溶液中,并使用尖端探头超声仪(qsonica sonicators q125,usa)超声处理,获得bitt@bsa-dsp纳米颗粒悬浮液,将bitt@bsa-dsp纳米颗粒悬浮液在室温下以500~800rpm剧烈搅拌8~12h以蒸发乙醇形成bitt@bsa-dsp纳米粒子。bitt@bsa-dsp纳米粒子通过离心去除沉淀来纯化,然后用pbs缓冲液洗涤,再通过超滤装置超滤以去除游离的bitt,通过冷冻干燥得到bitt@bsa-dsp的固体冻干粉制剂。所述冷冻干燥的温度为-82~-78℃,时间为12~20h。
15.在细胞实验和动物实验之前,需将获得的bitt@bsa-dsp纳米粒子用pbs或超纯水重悬,并用0.22μm pes注射器驱动过滤装置过滤灭菌。
16.本发明还提供了由上述制备方法得到的纳米材料bitt@bsa-dsp在近红外荧光引导下光增强化疗并在膀胱肿瘤及其他以顺铂为化疗方案的肿瘤中实现一体化诊疗的应用。利用纳米材料bitt@bsa-dsp作为生物相容性药物递送系统将光敏剂和化疗药物前药投向恶性肿瘤部位,实现光增强化疗并实现肿瘤一体化诊疗。
17.所述近红外荧光引导一体化诊疗,具体为:
18.在肿瘤细胞培养基中加入bitt@bsa-dsp纳米粒子,在激光共聚焦显微镜(clsm)下观察,可见纳米材料被细胞有效吞噬。在本发明的一些具体实施例中,通过尾静脉注射,可在活体成像仪中观察到皮下荷载膀胱肿瘤的小鼠肿瘤部位近红外荧光发射,对肿瘤进行实时诊断并引导光疗实施。
19.所述光增强化疗,具体为:
20.将bitt@bsa-dsp纳米粒子与肿瘤细胞共培养后,再采用660nm激光进行光照,可在极低铂pt(iv)给药浓度下杀死几乎所有的癌细胞。在本发明的一些具体实施例中,通过静脉注射并富集于肿瘤的纳米粒子进行近红外成像,在荧光显示的肿瘤范围进行精准的光疗可对膀胱癌皮下瘤产生显著的抑制。
21.本发明的原理为:多功能bitt@bsa-dsp纳米粒子由顺铂pt(iv)前药修饰的白蛋白基纳米载体包载多功能aie光敏剂合成,具有强大的nir发射、良好的光动力疗法(pdt)/光热疗法(ptt)性能。通过合成粒径的控制实现纳米材料增强渗透和滞留效应聚集于肿瘤并在光激发下发射明亮的近红外荧光,对肿瘤进行实时诊断并引导光疗实施。光热增强了纳米粒子颤动和解聚,促进低毒性的顺铂前药dsp pt(iv)中pt-o键的裸露,使得细胞内谷胱甘肽(gsh)等还原性物质容易进一步攻击并将其还原为游离的顺铂pt(ii)。由于该纳米粒子在肿瘤内的良好富集及在肿瘤内高表达的gsh,可实现肿瘤局部近红外荧光引导的顺铂靶向释放。同时光敏剂产生的ros可消耗细胞内的gsh,减少gsh与游离的顺铂进一步加合而排出细胞,增加肿瘤细胞内有效顺铂浓度,改善肿瘤细胞对顺铂耐药。
22.所述顺铂的前药pt(iv)-2cooh(dsp)具有下式结构:
[0023][0024]
与现有技术相比,本发明具有如下优点和有益效果:
[0025]
(1)本发明制备的bitt@bsa-dsp纳米粒子,白蛋白载体以自组装形式聚集并形成相对稳定的纳米颗粒,无需额外交联剂,合成粒径稳定在80-100nm,可通过增强渗透和滞留效应很好地实现肿瘤部位聚集从而对肿瘤进行荧光诊断。
[0026]
(2)本发明制备的bitt@bsa-dsp纳米粒子包载的多功能aie光敏剂,可同时实现光动力/光热治疗,并可与化疗协同治疗,实现“1+1+1》3”的效果。
[0027]
(3)本发明制备的bitt@bsa-dsp纳米粒子以白蛋白作为载体,具有长循环时间,生物相容性良好,可与包载的aie分子作用,使其聚集体内分子振动、转动受限,增强荧光发射及ros产生。所用aie光敏剂与白蛋白投料比为15:100(w/w)时,具有相对平衡的ros产率和光热转换效率。
[0028]
(4)化疗药物顺铂以低毒性的药物前体pt(iv)通过酰胺键共价偶联于载体白蛋白,并可被肿瘤细胞内高表达的还原性物质激活,实现肿瘤局部精准释放;并且顺铂前药可在光热效应下快速响应,增强释放。
[0029]
(5)本发明制备的bitt@bsa-dsp纳米粒子可实现肿瘤荧光诊断及光增强化疗的一体化治疗,显著降低了化疗药物全身剂量,可改善以铂类为基础的肿瘤化疗的效果,针对膀胱肿瘤及其他以顺铂为化疗方案的肿瘤具有很好的应用前景。
附图说明
[0030]
图1(a)和图1(b)分别是实施例1合成的顺铂前药dsp的1h nmr和
13
c nmr谱;
[0031]
图2为实施例3中bitt包载于bsa白蛋白前后及不同投料比所合成的bitt@bsa纳米粒子的明场和荧光场成像;
[0032]
图3为实施例3中不同投料比制备的bitt@bsa纳米粒子的粒径分布,bitt包封率,光热转换性能,ros生成以及bitt@bsa nps粒径变化的稳定性分析图;
[0033]
图4为实施例4中bitt@bsa-dsp纳米粒子粒径分布和透射电子显微镜图;
[0034]
图5为实施例4中溶解在pbs中纳米粒子bitt@bsa-dsp纳米粒子归一化的吸收光谱和光致发光光谱;
[0035]
图6为实施例4中溶解在pbs中bitt@bsa-dsp纳米粒子光动力性能测试和光热性能测试图;
[0036]
图7的a为实施例5中通过icp-ms测量不同处理的pbs缓冲液中bitt@bsa-dsp纳米粒子的pt还原和释放过程;图7的b为bitt@bsa-dsp与gsh在光照或在黑暗环境下反应6h后产物中pt
4f
的xps曲线;
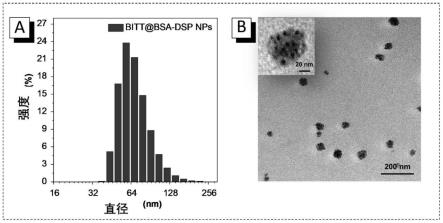
[0037]
图8为实施例6中bitt@bsa-dsp在膀胱癌细胞的摄取及亚细胞分布图,比例尺=5μm;
[0038]
图9为实施例6中bitt@bsa-dsp在光照下细胞内ros生成检测图,比例尺=10μm;
[0039]
图10为实施例6中bitt@bsa-dsp联合光疗处理及相应对照的体外细胞毒性评估结果;
[0040]
图11为实施例6中不同处理后采用calcein-am和pi活/死细胞荧光染色,显示细胞毒性,比例尺=50μm;
[0041]
图12为实施例7中bitt@bsa-dsp静脉注射后小鼠皮下膀胱肿瘤活体近红外荧光成像动态过程图,各脏器分布以及相对荧光强度;
[0042]
图13为实施例7中bitt@bsa-dsp及相应对照,静脉注射后在光激发下体内光热成像动态过程以及肿瘤区域平均温度变化;
[0043]
图14为实施例8中bitt@bsa-dsp体内实时近红外荧光引导的光增强化疗抗肿瘤评估及体重监测。
[0044]
图15为本发明的光增强化疗在多种人类癌症细胞中的抗肿瘤评价结果。
具体实施方式
[0045]
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
[0046]
实施例1顺铂前药pt(iv)-2cooh(dsp)的制备:
[0047][0048]
合成路线如下:
[0049][0050]
a)将黄色粉末顺铂(1g)分散在水(50ml)中并在50℃下搅拌。然后加入h2o2(35ml,30%)并于75℃搅拌5小时。在此过程中,顺铂溶解成无色透明溶液。恢复至室温后,反应液在-20℃下重结晶12小时。用冷乙醚洗涤获得的黄色pt(iv)-2oh固体并在烘箱中干燥,产率为60%。收集产物用于下一步反应。
[0051]
b)将pt(iv)-2oh(0.35g)和琥珀酸酐(1g)添加到dmf(3ml)中,在70℃下搅拌24h。
然后将冷乙醚加入混合溶液中,在-20℃重结晶,得到白色固体pt(iv)-2cooh,收率为45%。
[0052]
本实施例合成的顺铂前药dsp的1h nmr图谱如图1的(a)所示,
13
c nmr图谱如图1的(b)所示,核磁数据如下:
[0053]1h nmr of dsp(figure s2):(500mhz,dmso-d6):δ6.47(s,6h),2.49(d,j=14.0hz,4h),2.36(s,4h).
13
c nmr of dsp(figure s2):(126mhz,dmso-d6)δ179.84(s),173.64(s),30.88(s),30.22(s).esi-ms(m/z):calcd.for c9h
16
cl2n2o8pt 533.0,found:533.2.证明了其结构的正确性。
[0054]
实施例2bsa与顺铂前药dsp偶联物(bsa-dsp)的制备:
[0055]
a)将dsp(60mg,0.11mol),edc
·
hcl(52.72mg,0.28mol),sulfo-nhs(477.69mg,2.2mol)在室温下在水(10ml,ph 7.0)中混合30分钟。
[0056]
b)然后再将bsa(1.86g,0.028mol)溶解在100ml的pbs缓冲液中,并添加到上述溶液中,所得混合物在30℃下搅拌2.5小时。混合物用pbs缓冲液洗涤并通过超滤装置(mwco=10kda)以4000rpm 20分钟超滤3次以去除未结合的dsp和未反应的化合物,得到bsa-dsp。bsa-dsp溶液在pbs缓冲液(dsp 1.11mg
·
ml-1
,pt(iv)503.90μg
·
ml-1
,bsa 183.12mg
·
ml-1
)中超滤至6ml备用。
[0057]
实施例3一种光增强化疗并实现肿瘤一体化诊疗的纳米材料(bitt@bsa-dsp)的制备:
[0058]
a)将1mg bitt溶于乙醇(10mg
·
ml-1
)制成储备液,并将bsa用pbs缓冲液稀释(bsa1mg
·
ml-1
)。然后用乙醇将bitt储备液(0.05ml、0.10ml、0.15ml和0.20ml)稀释至1ml,并将稀释后的bitt储备液快速添加到bsa溶液(1mg
·
ml-1
,10ml)中,并使用尖端探头超声仪(qsonica sonicators q125,usa)在25w输出下于冰上超声处理1分钟,获得bitt与白蛋白的投料比分别为5:100、10:00、15:100和20:100(w/w)的bitt@bsa纳米颗粒悬浮液。bitt@bsa纳米颗粒在明场和荧光成像分别如图2的a和图2的b所示,bsa白蛋白包载后的bitt光敏剂具有更高的荧光强度,但随着bitt光敏剂与bsa白蛋白投料比例升高,荧光逐渐减弱。
[0059]
b)将bitt@bsa悬浮液在室温下以600rpm剧烈搅拌12小时以蒸发乙醇以形成bitt@bsa纳米粒子。样品通过14800rpm离心5分钟去除沉淀来纯化,然后用pbs缓冲液洗涤,然后通过超滤单元(mwco=10kda)以4000rpm 20分钟超滤3次以去除游离的bitt,通过-80℃冷冻干燥15h得到bitt@bsa-dsp的固体冻干粉制剂。
[0060]
c)纳米材料粒径分布结果从图3的a-d可见,bitt与白蛋白的投料比在5:100,10:100,15:100,20:100(w/w)下制备的bitt@bsa纳米粒子平均粒径分别为:44.27nm,52.45nm,63.95nm,69.82nm,即随着bitt投料比的增加粒径呈现逐步升高趋势。从图3的e-h可见,在15:100(w/w)下制备的粒子bitt包封率(ee)最高(35%);光热转化效率最高(26.35%),ros产生效率最高。
[0061]
d)最终选择在bitt与白蛋白为15:100(w/w)的投料比下,将bsa溶液更换为bsa-dsp溶液,按上述a),b)步骤制备bitt@bsa-dsp纳米颗粒。制备的bitt@bsa-dsp纳米粒子用于细胞和动物水平研究。最终连续测定纳米粒子粒径,表示bitt@bsa-dsp在pbs中的稳定性。
[0062]
选择15:100投料比例,在细胞实验和动物实验之前,将获得的bitt@bsa-dsp纳米粒子用pbs或超纯水重悬,并用0.22μm pes注射器驱动过滤装置过滤灭菌。
[0063]
实施例4通过以下测试对实施例3获得的纳米材料bitt@bsa-dsp进行表征:
[0064]
a)利用动态光散射(dynamiclight scattering,dls)测定bitt@bsa-dsp粒度及分布,如图4的a所示,95%粒径分布于在40~100nm,且主要集中分布在80~100nm;利用透射式电子显微镜观察其形态,结果如图4的b所示,白蛋白聚集呈笼状装载bitt分子聚集体,bitt分子聚集体粒径在5~10nm。
[0065]
b)吸收和发射光谱测试。将实施例3获得的bitt@bsa-dsp稀释至10μm,加入比色皿中,测得其紫外-可见吸收光谱和发射光谱。紫外可见-吸收光谱如图5的a所示,在500~800nm有特征吸收,峰值位于584nm;发射光谱如图5的b所示,其聚集态发射峰位于903nm,部分尾部位于近红外ii区域。
[0066]
c)光动力性能测试。将实施例3获得的bitt@bsa-dsp及其他对照试剂(空白bitt,ce6,icg)分别稀释至10μm,dcfh-da用作检测激光照射(660nm,0.3w
·
cm-2
)下溶液中的ros生成的指示剂,该指示剂首先通过一般方法激活成dcfh。每间隔1min测量660nm激光照射下由ros触发的dcfh的荧光。结果如图6的a所示,3分钟后ros浓度达到峰值,且bitt@bsa-dsp荧光高于其他三者,增强320倍,表明该纳米材料bitt@bsa-dsp的ros产率比常用的ce6、icg要高。
[0067]
d)光热性能测试。将实施例3中获得的bitt@bsa-dsp稀释至不同浓度悬浮液200ul,在激光照射(660nm,0.3w
·
cm-2
)下,用热电偶测量其温度变化并记录。结果如图6的b所示,其光热转化效能呈浓度依赖性,光热转化效率pce=26.35%,其光热转化效率及光热稳定性显著优于现有的fda批准可用于临床的icg。
[0068]
实施例5纳米材料bitt@bsa-dsp体外gsh和光触发下的药物释放研究。
[0069]
将bitt@bsa-dsp纳米颗粒悬浮液分别加入含有和不含gsh(10mm)的pbs溶液,在光照(660nm,0.3w
·
cm-2
,10min)或不光照后于37℃下反应,每间隔3h取每组0.5ml悬浮液转移到超滤装置(mwco=10kda)中,并在14800rpm下离心10分钟。通过icp-ms测量超滤液中释放的pt的百分比。结果如图7的a所示,bitt@bsa-dsp呈gsh和光激发双响应,两者均可促进pt(iv)从粒子中释放。将bitt@bsa-dsp纳米颗粒悬浮液在(10mm)的pbs溶液中加上述光照或在黑暗环境37℃反应6h后,xps测试pt元素结合能,如图7的b所示:显示光照可促使pt(ii)在6h时还原率从35.68%提升至75.89%。上述结果表明光疗可显著促进gsh还原pt(iv)为pt(ii)并从纳米粒子释放。
[0070]
实施例6纳米材料bitt@bsa-dsp肿瘤细胞摄取,细胞内ros产生及体外抗肿瘤评价。
[0071]
a)纳米材料bitt@bsa-dsp的细胞摄取及亚细胞分布。将膀胱癌mb49细胞接种于玻璃底共聚焦培养皿中,培养24小时之后,更换为含有bitt@bsa-dsp纳米材料(bitt浓度10μm)的完全培养基。再孵育4小时后,将细胞与lysotracker green(200nm)或mitotracker green(200nm)在培养基中共染色30分钟。细胞核用hoechst 33324(1ug
·
ml-1
)染色。用pbs洗涤两次后,细胞通过激光共聚焦显微镜成像。结果如图8所示,bitt@bsa-dsp纳米粒子2~4h即可被细胞有效内吞,bitt主要定位于线粒体。
[0072]
b)bitt@bsa-dsp细胞内ros生成检测。选择dcfh-da作为ros指示剂。膀胱癌mb49细胞在玻璃底共聚焦培养皿中培养24小时后,在完全培养基中加入bitt@bsa-dsp纳米材料(bitt浓度10μm)。孵育4小时后,将dcfh-da(10μm)添加到培养基中。再孵育30分钟后,用pbs
洗涤细胞两次,并在白光(50mw
·
cm-2
)下照射5分钟。处理过的细胞通过共聚焦显微镜成像,结果如图9所示,所述bitt@bsa-dsp纳米材料联合光疗组细胞dcfh荧光强度最高,显示其在细胞内ros产生。
[0073]
c)体外细胞毒性通过cck-8法测定纳米材料对膀胱癌mb49细胞毒性进行评估。膀胱癌mb49细胞(每孔3
×
103)接种在96孔板中,并在5%co2中37℃培养24小时。然后在完全培养基中用不同浓度的bsa-dsp、bitt@bsa nps和bitt@bsa-dsp nps替换培养基,然后再孵育6小时。之后,将激光照射组的96孔板暴露于660nm激光(0.3w
·
cm-2
,5分钟),以研究化疗、光动力/光热治疗或光增强的化学治疗效果,然后在黑暗中再孵育18小时。同时,将未经激光照射的各组平板在相同实验条件下避光孵育24小时。接下来,进行标准cck-8测定以评估细胞活力。结果如图10所示,相较于单纯化疗(图10的a中的bsa-dsp)和光疗(图10的b中的bitt@bsa nps+l),光增强的化疗(图10的c中的bitt@bsa-dsp nps+l)可产生显著的协同治疗效果,pt ic50值从单纯化疗的1203ng
·
ml-1
下降至光增强化疗后的5.12ng
·
ml-1
,下降了235倍。
[0074]
d)calcein-am和pi活/死细胞荧光染色。膀胱癌mb49细胞接种于玻璃底共聚焦培养皿中,每培养皿8
×
104个细胞,培养24小时。细胞培养皿被分为两组。当mb49细胞达到80%汇合时,将细胞培养基分别更换为含有相同体积的pbs,icg@bsa-dsp(icg 1.2μm,pt(iv)51.2ng
·
ml-1
,bsa 18.6μg
·
ml-1
)或bitt@bsa-dsp nps(bitt 1.2μm,pt(iv)51.2ng
·
ml-1
,bsa 18.6μg
·
ml-1
)的完全培养基。孵育6小时后,将pbs,icg@bsa-dsp和bitt@bsa-dsp nps处理的一组细胞暴露于660nm激光(0.3w
·
cm-2
,5分钟)。同时,平行实验的另一组细胞在相同实验环境下避光孵育。继续孵育18小时后,细胞在无血清培养基中用calcein-am(2μm)和pi(8μm)染色30分钟。最后,用pbs洗涤两次后,通过clsm成像。结果如图11所示,在低浓度pt(51.2ng
·
ml-1
)化疗,低浓度bitt(1.2μm)介导的光热治疗均未显示癌细胞杀伤作用,只有给予光增强化疗组的癌细胞被完全杀灭。
[0075]
实施例7纳米材料bitt@bsa-dsp活体近红外荧光成像和光热成像评价。
[0076]
a)膀胱癌肿瘤模型构建。雄性c57bl/6小鼠(4~5周)由广东省医学实验动物中心提供,饲养于标准spf实验动物房。将悬浮于100μl pbs中的膀胱癌mb49细胞(1
×
106)皮下注射于每只小鼠右侧背部建立小鼠膀胱癌肿瘤皮下模型。大约7天后,当肿瘤体积增长到大约100mm3时,小鼠可被用于体内荧光成像和光热成像实验。
[0077]
b)纳米材料bitt@bsa-dsp体内近红外荧光成像。通过静脉内i.v.注射200μlbitt@bsa-dsp(bitt 1mm,pt(iv)39.40μg
·
ml-1
,bsa 15mg
·
ml-1
)进行肿瘤中的体内荧光积累。体内荧光成像在blt多模式动物活体成像系统aniview100或chemidoc mp成像系统上以预定的时间间隔进行,激发波长647nm,荧光发射波长通滤光片695nm下。静脉注射6h后,按照肿瘤内达到最大荧光强度累积的时间处死小鼠。它们的器官(心脏、肝脏、脾脏、肺、肾脏、肠)和肿瘤被收获并用于离体荧光成像,并计算平均荧光强度。结果如图12所示,从图12的a和b可以看出,纳米材料bitt@bsa-dsp可在6小时内富集于肿瘤局部,点亮肿瘤组织,组织器官分布边界清晰;从图12的c可以看出,除肝脏外,肿瘤组织的荧光强度显著高于其他内脏。
[0078]
c)纳米材料bitt@bsa-dsp体内光热成像。通过静脉注射200μl不同的悬浮液:pbs、bitt@bsa(bitt 1mm,bsa 15mg
·
ml-1
)、bitt@bsa-dsp(bitt 1mm,pt(iv)39.40ug
·
ml-1
,bsa15mg
·
ml-1
)。然后,使用红外热像仪记录静脉注射后6小时后各组动物在660nm激光
(0.3w
·
cm-2
)照射10分钟肿瘤部位的温度变化,并计算肿瘤区域平均温度。结果如图13所示,注射了载有bitt光敏剂的纳米材料组均可实现肿瘤局部光热效应,肿瘤区域温度43℃至45℃,最高温度60℃。表明纳米材料bitt@bsa-dsp可通过肿瘤靶向富集,并在激光光照下产生有效光热治疗。
[0079]
实施例8纳米材料bitt@bsa-dsp体内实时近红外荧光引导的光增强化疗抗肿瘤评估。
[0080]
如实施例7所述,当肿瘤体积达到100mm3后,将小鼠随机分为六组进行不同的治疗:
①
pbs组,i.v.注射200μl pbs;
②
pbs+激光组,静脉注射注入200μl pbs,注射后6小时激光照射;
③
bsa-dsp组,静脉注射注入200μl bsa-dsp溶液(pt(iv)39.40μg
·
ml-1
,bsa15mg
·
ml-1
);
④
bitt@bsa+激光组,静脉注射200μl bitt@bsa悬浮液(bitt 1mm,bsa 15mg
·
ml-1
)6小时后激光照射;
⑤
bitt@bsa-dsp组,静脉注射200μlbitt@bsa-dsp(bitt 1mm,pt(iv)39.40μg
·
ml-1
,bsa 15mg
·
ml-1
);
⑥
bitt@bsa-dsp+激光组,静脉注射200μl bitt@bsa-dsp(bitt 1mm,pt(iv)39.40μg
·
ml-1
,bsa 15mg
·
ml-1
)6小时后激光照射。激光光照部位和范围由近红外荧光成像确定,660nm激光功率为0.3w
·
cm-2
,时间10分钟。每组治疗在初始治疗后一周重复一次。每隔一天监测小鼠的肿瘤体积和体重,治疗后12天处死所有小鼠。记录肿瘤体积及体重变化。结果如图14的a和b所示,**p》0.05,***p《0.01,光增强化疗治疗组的肿瘤平均体积显著低于其余治疗组(p《0.05),而检测小鼠体重增长曲线,各组未见体重差异,显示注射该纳米材料后对小鼠生长未见明显毒性。表明纳米材料bitt@bsa-dsp实现的光增强化疗可显著抑制膀胱癌生长。
[0081]
实施例9光增强化疗策略在多种人类癌症细胞中的抗肿瘤评价。
[0082]
为了进一步检验临床转化价值,我们纳入了接受顺铂作为一线化疗方案且高发病率的人类癌症细胞,以进一步检验上述光增强化疗策略,包括非小细胞肺癌(a549)、乳腺癌(mcf-7)、宫颈癌(hela)和膀胱尿路上皮癌(t24)。通过cck-8法测定细胞毒性。首先,将上述人源癌细胞(每孔3
×
103)接种在96孔板中,并在5%co2中37℃培养24小时。然后在完全培养基中用不同浓度的bitt@bsa-dsp nps替换培养基,然后再孵育6小时。之后,将96孔板暴露于660nm激光(0.3w
·
cm-2
,5分钟),以研究化疗、光动力/光热治疗或光增强的化学治疗效果,然后在黑暗中再孵育18小时。同时,将各浓度顺铂孵育的96孔板在相同实验条件下避光孵育24小时。接下来,进行标准cck-8测定以评估细胞活力。结果进一步证实,纳米材料bitt@bsa-dsp实现的光增强化疗是一种广谱的有效的抗肿瘤协同策略,可显着提高多种癌细胞对顺铂衍生物的敏感性,治疗剂量ic50从μg
·
ml-1
水平降至ng
·
ml-1
水平,如图15的a-h所示。其中,非小细胞肺癌(a549细胞)ic50降低357倍(图a,e),乳腺癌(mcf-7细胞)ic50降低387倍(图b,f),宫颈癌(hela细胞)ic50降低2692倍(图c,g),膀胱尿路上皮癌(t24细胞)ic50降低1638倍(图d,h)。
[0083]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1