包含AZD9291的药用组合物的制作方法
包含azd9291的药用组合物
1.本技术是申请日为2015年1月2日、中国申请号为201580003266.4、发明名称为“包含azd9291的药用组合物”的发明申请的分案申请。
2.本发明涉及适合于口服给药的药用组合物,并且更具体地涉及包含以下称为“azd9291”的化合物的药用组合物(和药用片剂):
[0003][0004]
或其药学上可接受的盐。
[0005]
也已知azd9291的化学名为:
‘
n-(2-{2-二甲基氨基乙基-甲基氨基}-4-甲氧基-5-{[4-(1-甲基吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2-烯酰胺’。azd9291或其药学上可接受的盐在下文称为“药剂”。
[0006]
该药剂披露于国际专利申请号pct/gb 2012/051783(专利号wo 2013/014448)中,其中提供数据以显示该药剂选择性地且强力地抑制表皮生长因子受体(egfr)的某些突变形式。已经发现该药剂是egfrm+感光和egfr的t790m抗性突变体形式两者的有效抑制剂,然而针对野生型egfr具有低得多的效力。在体外,该药剂强有力地抑制在针对野生型egfr系具有低得多的活性的egfrm+和t790m突变细胞系两者中的egfr信号传导途径和细胞生长。在体内,该药剂在低至5mg/kg/天的剂量下对egfr信号传导的抑制引起egfrm+和t790m突变体肿瘤异种移植物和转基因模型两者的充分的和持久的肿瘤消退。在1期临床试验中,许多患有晚期egfrm t790m+肺腺癌的患者在用该药剂治疗之后显示出部分响应(在这种情况下,将该药剂以甲磺酸盐的形式使用)。最初(在1期临床试验中)使用的药用配制品涉及azd9291甲磺酸盐与微晶纤维素的简单共混物,该共混物然后被填充至hpmc胶囊内。这种
‘
胶囊中的共混物’配制品的另外的细节在下文中被描述为
‘
比较实例1’。
[0007]
典型地,药物可以在口服给药之后沿着胃肠道(包括经由胃、十二指肠、空肠、回肠和结肠)在许多不同位点被吸收。随着胃(ph 1-3.5)与小肠(ph 4-8)之间ph显著地变化,该ph可以在各个吸收位点是不同的。从我们的研究,我们已经发现azd9291展现出显著的ph依赖性溶解度和适度的渗透性。例如,已经发现相对于人肠液(hif,ph=7.9),azd9291(处于游离碱形式)在模拟胃液(sgf,ph=1.3)中具有》80x更高的溶解度。在此类情况下,其中药物的溶解度随着ph而变化,并且具体地当溶解度在酸性ph下是最高时,存在一个问题,该问题是当该药物穿过胃肠道时其可以从溶液中沉淀。药物需要在溶液中以便被吸收,所以此类沉淀可以导致该药物吸收的程度和/或速率的可变性。这导致药物到达患者体循环的数量可以在给定患者中的一个计量与下一个剂量之间显著地变化。这还可以导致药物到达患者体循环的数量可以在一个患者与另一个患者之间显著地变化。由于吸收的这种可变性,如果患者有效地接受比他们的内科医师意欲的剂量更低剂量的话,这可以意指针对改善患
者的病症而言该药物比它所能做到的更低效。原则上,可以增加给予至患者的剂量以解决潜在地不良吸收,但这种方法引入这样一种风险,在一些情况下,太多的药剂可以进入患者的系统,即这可能是安全风险和/或增加副作用的风险/严重性。
[0008]
对于azd9291的甲磺酸盐,我们发现在肠的ph下的溶解度显著高于处于游离碱形式的azd9291的溶解度。一旦形成,azd9291甲磺酸盐的溶液似乎是稳定的,经至少24小时的一段时间而不沉淀。基于这些和其他的研究,预期azd9291甲磺酸盐与微晶纤维素的简单
‘
胶囊中的共混物’配制品具有有利的特性,包括在生理ph值范围内的快速和完全溶解,并且因此,希望在含有微晶纤维素的简单
‘
胶囊中的共混物’配制品中使用azd9291的甲磺酸盐可以避免所有上述问题。然而,不幸地,我们发现azd9291甲磺酸盐与微晶纤维素的简单
‘
胶囊中的共混物’配制品(比较实例1)在预期的与胶囊壳的破坏相关联的时滞之后溶解非常缓慢,从而在ph 6.8下在30分钟之后仅实现56.4%释放。因此,对提供一种改进方式将药剂给予至患者仍存在问题,该改进方式应降低/避免吸收的患者间差异性和/或吸收的剂量间差异性的上述问题的风险和/或严重性。
[0009]
本发明提供针对一个或多个上述问题中的解决方案并且涉及包含该药剂的新颖药用组合物。本发明的药用组合物可以形成为片剂,其展现出改进的于生理相关条件下的溶解特性,和/或该药剂在生理相关时标上较高的总释放。达到该药剂的更快的初始溶解速率和/或较高的总释放预期降低药物吸收的剂量间和患者间差异性的风险,该药物具有如通过azd9291展示的ph依赖性溶解度。
[0010]
因此,在本发明的第一方面中,提供一种药用组合物,其在处于ph 6.8下的溶液中在15分钟之后递送显著改进的药剂溶解水平。使用美国药典的通用程序使用装置ii在ph 6.8或1.3下进行溶解测量,如在下文实验部分中进一步详细描述。下表中的每个条目是基于在ph 6.8下三个溶解测量值的平均值,其中比较实例1是
‘
胶囊中的共混物’配制品,并且其中其他的实施例是本发明的第一方面的实施例:
[0011]
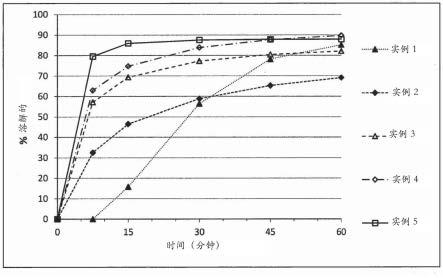
实例号在t=15mins的溶解百分比比较实例115.8246.5369.4474.7586.06a88.36b85.76c92.56d86.97a89.97b42.58a85.08b88.0976.9
[0012]
同时比较实例1涉及使用微晶纤维素作为唯一的药用稀释剂,我们发现本发明(实
例2-9)的改进的药用组合物涉及低得多的wt%的微晶纤维素的使用以及至少一种其他的药学上可接受的稀释剂物质与微晶纤维素组合的使用。
[0013]
因此,本发明第一方面提供一种药用组合物,该药用组合物包括:
[0014]
(a)从2至70份药剂;
[0015]
(b)从5至96份两种或更多种药用稀释剂;
[0016]
(c)从0至15份一种或多种药用崩解剂;
[0017]
(d)从0至1.5份一种或多种药用增溶剂;以及
[0018]
(e)从0至3份一种或多种药用润滑剂;
[0019]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0020]
并且其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0021]
在本说明书中,
‘
wt%’是指
‘
重量百分比’并且旨在具有其如在该技术领域中所习惯的普通含义。因此,
‘
wt%’是指组分x在组分y之内的比例,在每种情况下基于组分x和组分y的重量计算(不同于其他物理参数,例如体积或存在的摩尔数)。通过举例,如果在20g的组分y中有2g的组分x,那么组分x构成10wt%的组分y。
[0022]
如在此所描述,以
‘
份’为单位描述药用组合物的组分,其中
‘
所有份是按重量计’。应理解,此类语言简单地定义了这些组分的相对比率,其中该比率是依据相对重量而定义的(不同于其他物理参数,例如体积或存在的摩尔数)。通过举例,如果在一种混合物中有1g的组分x和4g的组分z,当组分x和组分z的份之和被定义为等于100时,那么在这个实例中,在混合物中有20份组分x和80份组分z。
[0023]
在一个实施例中,该微晶纤维素构成这两种或更多种药用稀释剂(b)的从12至28wt%。
[0024]
在一个另外的实施例中,该微晶纤维素构成这两种或更多种药用稀释剂(b)的从15至25wt%。
[0025]
在一个另外的实施例中,该微晶纤维素构成这两种或更多种药用稀释剂(b)的从17至23wt%。
[0026]
药剂
[0027]
如在上文所定义,
‘
药剂’是指
‘
azd9291或其药学上可接受的盐’。
[0028]
可以使用无机酸或有机酸形成azd9291的药学上可接受的盐。例如,可以使用无机酸,例如选自盐酸、氢溴酸、硫酸和磷酸,形成药学上可接受的盐。还可以使用无机酸,例如选自三氟乙酸、柠檬酸、马来酸、草酸、乙酸、甲酸、苯甲酸、富马酸、琥珀酸、酒石酸、乳酸、丙酮酸、甲磺酸、苯磺酸和对甲苯磺酸,形成药学上可接受的盐。
[0029]
该药剂可以处于
‘
游离碱形式’或作为药学上可接受的盐、或作为其任何混合物而使用。在一个实施例中,该药剂是处于游离碱形式。应理解,
‘
游离碱形式’是指其中药剂不是处于盐的形式的情况。
[0030]
在本发明的其中该药剂在广义上被提及的任何一个权利要求、方面或实施例中,以下实施例也可以被应用以便提供另外的权利要求、方面或实施例:
[0031]
在一个实施例中,该药剂是azd9291(即处于游离碱形式的azd9291)。
[0032]
在一个实施例中,该药剂是azd9291的药学上可接受的盐。
[0033]
在一个实施例中,该药剂是azd9291的药学上可接受的盐,该盐是azd9291的甲磺酸盐。
[0034]
在一个实施例中,azd9291的甲磺酸盐包含1:1摩尔比的azd9291与甲磺酸。
[0035]
在一个实施例中,该药剂是azd9291的药学上可接受的盐,该盐是azd9291的晶态甲磺酸盐。
[0036]
在一个实施例中,该药剂是azd9291的甲磺酸盐的多晶型b(其中azd9291的甲磺酸盐的多晶型b可以按国际专利申请号pct/gb 2012/051783/公开号wo 2013/014448)中所描述的任何方式来定义。
[0037]
因此,在一个实施例中,该药剂是azd9291的甲磺酸盐,其x-射线粉末衍射图在使用cukα辐射所测量的2θ=7.2
°
+/-0.2
°
2θ处具有至少一个特异峰。
[0038]
在一个实施例中,该药剂是azd9291的甲磺酸盐,其x-射线粉末衍射图在使用cukα辐射所测量的2θ=8.6
°
+/-0.2
°
2θ处具有至少一个特异峰。
[0039]
在一个实施例中,该药剂是azd9291的甲磺酸盐,其x-射线粉末衍射图在使用cukα辐射所测量的2θ=7.2
°
和8.6
°
处具有至少两个特异峰,其中所述值可以是+/-0.2
°
2θ。
[0040]
在一个实施例中,该药剂是azd9291的甲磺酸盐,其x-射线粉末衍射图在使用cukα辐射所测量的2θ=7.2
°
、8.6
°
、15.3
°
、10.4
°
、25.7
°
、26.1
°
、16.4
°
、9.5
°
、22.1
°
和18.8
°
2θ处具有特异峰,其中所述值可以是+/-0.2
°
2θ。
[0041]
在本发明的另外的实施例中,如在此所定义的药用组合物(或药用片剂)可以具有限于以下所列范围中任一者的药剂(a)量:
[0042]
·
按重量计从3至70份
[0043]
·
按重量计从4至65份
[0044]
·
按重量计从5至50份
[0045]
·
按重量计从5至40份
[0046]
·
按重量计从6至35份
[0047]
·
按重量计从7至30份
[0048]
·
按重量计从7至25份
[0049]
·
按重量计从3至30份
[0050]
药用稀释剂
[0051]
在本说明书中,术语“稀释剂(diluent)”和“稀释剂(diluents)”旨在药用配制品科学的背景下被解释。因此,除微晶纤维素之外,其他稀释剂还可以是,例如:碳酸钙、磷酸钙、硫酸钙、乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、碳酸镁、氧化镁、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、碳酸氢钠、碳酸钠、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇。
[0052]
因此,在本发明的一个实施例中,除微晶纤维素之外,在这两种或多种药用稀释剂之内的其他一种或多种药用稀释剂还选自碳酸钙、磷酸钙、硫酸钙、乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、碳酸镁、氧化镁、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、碳酸氢钠、碳酸钠、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇。
[0053]
当该药剂以azd9291的药学上可接受的盐形式呈现于药用组合物或(药用片剂)中
时,较少优选某些碱性盐用作药用稀释剂。此类碱性盐包括碳酸钙、碳酸镁、碳酸钠和碳酸氢钠。
[0054]
因此,在本发明的一个实施例中(具体地当该药剂是azd9291的药学上可接受的盐时),除微晶纤维素之外,在这两种或多种药用稀释剂之内的其他一种或多种药用稀释剂还选自磷酸钙、硫酸钙、乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、氧化镁、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇。
[0055]
在本发明的一个实施例中(具体地当该药剂是azd9291的药学上可接受的盐时),除微晶纤维素之外,在这两种或多种药用稀释剂之内的其他一种或多种药用稀释剂还选自乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇。
[0056]
在本发明的某些实施例中,如在此所定义的药用组合物(或药用片剂)可以具有限于以下所列范围中任一者的药用稀释剂(b)量:
[0057]
·
按重量计从10至95份
[0058]
·
按重量计从15至90份
[0059]
·
按重量计从20至90份
[0060]
·
按重量计从25至90份
[0061]
·
按重量计从30至90份
[0062]
·
按重量计从40至90份
[0063]
·
按重量计从50至90份
[0064]
·
按重量计从60至90份
[0065]
·
按重量计从40至80份
[0066]
·
按重量计从50至80份
[0067]
·
按重量计从55至85份
[0068]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括选自甘露醇、山梨糖醇、异麦芽糖醇、聚右旋糖、乳糖醇、乳糖中的一种或多种药用稀释剂。
[0069]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇、山梨糖醇、异麦芽糖醇、聚右旋糖、乳糖醇或乳糖、或其任何混合物,其中甘露醇、山梨糖醇、异麦芽糖醇、聚右旋糖、乳糖醇或乳糖或其任何混合物构成这两种或更多种药用稀释剂(b)部分的从50至100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0070]
在一个实施例中,上述范围是从60至100wt%。
[0071]
在另一个实施例中,上述范围是从70至100wt%。
[0072]
在另一个实施例中,上述范围是从80至100wt%。
[0073]
在另一个实施例中,上述范围是从90至100wt%。
[0074]
在另一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇、山梨糖醇、异麦芽糖醇、聚右旋糖、乳糖醇或乳糖、或其任何混合物,其中甘露醇、山梨糖醇、异麦芽糖醇、聚右旋糖、乳糖醇或乳糖或其任何混合物构成这两种或更多种药用稀释剂(b)部分的100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0075]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇、乳糖或其混合物。
[0076]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇、乳糖或其混合物,其中甘露醇或乳糖或其混合物构成这两种或更多种药用稀释剂(b)部分的从50至100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0077]
在一个实施例中,上述范围是从60至100wt%。
[0078]
在另一个实施例中,上述范围是从70至100wt%。
[0079]
在另一个实施例中,上述范围是从80至100wt%。
[0080]
在另一个实施例中,上述范围是从90至100wt%。
[0081]
在另一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇或乳糖或其混合物,其中甘露醇、或乳糖或其混合物构成这两种或更多种药用稀释剂(b)部分的100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0082]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇。
[0083]
在一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇,其中甘露醇构成这两种或更多种药用稀释剂(b)部分的从50至100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0084]
在一个实施例中,上述范围是从60至100wt%。
[0085]
在另一个实施例中,上述范围是从70至100wt%。
[0086]
在另一个实施例中,上述范围是从80至100wt%。
[0087]
在另一个实施例中,上述范围是从90至100wt%。
[0088]
在另一个实施例中,除微晶纤维素之外,这两种或更多种药用稀释剂(b)还包括甘露醇,其中甘露醇构成这两种或更多种药用稀释剂(b)部分的100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释。
[0089]
以上直接描述的实施例提及
‘
甘露醇构成这两种或更多种药用稀释剂(b)部分的100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释’。因此,例如,在其中微晶纤维素构成这
‘
两种或更多种药用稀释剂(b)’的30wt%的情况下,甘露醇将必须构成这
‘
两种或更多种药用稀释剂(b)’的70wt%,以便符合
‘
甘露醇构成这两种或更多种药用稀释剂(b)部分的100wt%,该部分尚未通过如在此所定义的微晶纤维素的存在而解释’的要求。
[0090]
药用崩解剂
[0091]
在本说明书中,术语“崩解剂(disintegrant)”和“崩解剂(disintegrants)”旨在药用配制品科学的背景下被解释。因此,崩解剂可以是,例如:海藻酸、海藻酸钙、羧甲基纤维素钙、壳聚糖、胶体二氧化硅、交联羧甲基纤维素钠、交聚维酮、甘氨酸、瓜尔胶、羟丙基纤维素、低取代的羟丙基纤维素、硅酸镁铝、甲基纤维素、聚维酮、海藻酸钠、羧甲基纤维素钠、羟基乙酸淀粉钠和淀粉。
[0092]
因此,在一个实施例中,一种或多种药用崩解剂包括选自以下的一种或多种药用崩解剂:海藻酸、海藻酸钙、羧甲基纤维素钙、壳聚糖、胶体二氧化硅、交联羧甲基纤维素钠、交聚维酮、甘氨酸、瓜尔胶、羟丙基纤维素、低取代的羟丙基纤维素、硅酸镁铝、甲基纤维素、
聚维酮、海藻酸钠、羧甲基纤维素钠、羟基乙酸淀粉钠和淀粉。
[0093]
在下文如实例7b所描述的药用组合物不包括任何崩解剂,但是出人意料地,相对比较实例1(
‘
胶囊中的共混物’配制品)仍然实现显著改进的溶解。实例7b组合物在15分钟之内给出42.5%溶解,与来自比较实例1在相同时间点的仅15.8%溶解相比。
[0094]
本发明的一个另外的方面提供一种包含该药剂的药用组合物,其展现出进一步改进的溶解和总释放特性。本发明的这个方面的药用组合物包括药用崩解剂。在下文如实例7a和7b所描述的药用组合物是实质上相同的,除了在实例7b中,实例7a的崩解剂(羟丙纤维素)被另外的稀释剂取代。如在下表中所示,相对实例7b和比较实例1,在ph=6.8下,实例7a的配制品实现了在t=15分钟下大大改进的溶解和在60分钟之后改进的释放:
[0095]
实例号在15分钟下的溶解(%)在60分钟的释放(%)比较实例115.8857b42.5757a89.998
[0096]
根据本发明的这个另外的方面,提供了本发明的另外的权利要求和实施例,其中如在此所定义的药用组合物(药用片剂)具有限于以下所列的范围中任一者的药用崩解剂(c)量:
[0097]
·
按重量计从1至15份。
[0098]
·
按重量计从2至15份
[0099]
·
按重量计从2至10份
[0100]
·
按重量计从2至8份
[0101]
出人意料地发现,低取代的羟丙基纤维素的使用对于实现包含药剂的药用片剂组合物改进的溶解特性曲线是特别有利的。所测试的实验性药用组合物中的一些涉及羧基乙酸淀粉钠作为崩解剂的用途(例如实例3),但是出人意料地发现从羧基乙酸淀粉钠转换成低取代的羟丙基纤维素(实例4)提供溶解曲线的显著性改进,如在下表中所示:
[0102]
实例号在15分钟下的溶解(%)在30分钟之后的释放(%)369.477.3474.783.8
[0103]
根据本发明的这一方面,在一个实施例中,该一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素、羧基乙酸淀粉钠或其混合物。
[0104]
在一个实施例中,该一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素。
[0105]
在一个实施例中,该一种或多种药用崩解剂(c)包括羧基乙酸淀粉钠。
[0106]
低取代的羟丙基纤维素可商购自信越化学工业株式会社(日本)(shin-etsu chemical co.,ltd(japan))并且可以被称为“lh-31”。与羟丙基纤维素相比,低取代的羟丙基纤维素仅具有小比例的三个游离羟基基团/葡萄糖亚基转化成羟丙基醚。当在105℃下干燥1小时,低取代的羟丙基纤维素包含不小于5.0%且不超过16.0%的羟丙氧基基团。
[0107]
在一个实施例中,低取代的羟丙基纤维素和/或羧基乙酸淀粉钠是一种或多种药用崩解剂(c)中的一种或两种,其中该低取代的羟丙基纤维素和/或羧基乙酸淀粉钠构成该一种或多种药用崩解剂(c)的从40至100wt%。
[0108]
在另一个实施例中,上述范围是从50至100wt%。
[0109]
在另一个实施例中,上述范围是从60至100wt%。
[0110]
在另一个实施例中,上述范围是从70至100wt%。
[0111]
在另一个实施例中,上述范围是从80至100wt%。
[0112]
在另一个实施例中,上述范围是从90至100wt%。
[0113]
在一个实施例中,该一种或多种药用崩解剂(c)由低取代的羟丙基纤维素、羧基乙酸淀粉钠或其混合物组成。
[0114]
在一个实施例中,低取代的羟丙基纤维素是该一种或多种药用崩解剂(c)之一,其中该低取代的羟丙基纤维素构成从该一种或多种药用崩解剂(c)的40至100wt%。
[0115]
在另一个实施例中,上述范围是从50至100wt%。
[0116]
在另一个实施例中,上述范围是从60至100wt%。
[0117]
在另一个实施例中,上述范围是从70至100wt%。
[0118]
在另一个实施例中,上述范围是从80至100wt%。
[0119]
在另一个实施例中,上述范围是从90至100wt%。
[0120]
在一个实施例中,该一种或多种药用崩解剂(c)由低取代的羟丙基纤维素组成。
[0121]
在一个实施例中,羧基乙酸淀粉钠是该一种或多种药用崩解剂(c)之一,其中该羧基乙酸淀粉钠构成该一种或多种药用崩解剂(c)的从40至100wt%。
[0122]
在另一个实施例中,上述范围是从50至100wt%。
[0123]
在另一个实施例中,上述范围是从60至100wt%。
[0124]
在另一个实施例中,上述范围是从70至100wt%。
[0125]
在另一个实施例中,上述范围是从80至100wt%。
[0126]
在另一个实施例中,上述范围是从90至100wt%。
[0127]
在一个实施例中,该一种或多种药用崩解剂(c)由羧基乙酸淀粉钠组成。
[0128]
药用增溶剂
[0129]
在本说明书中,术语“增溶剂(solubilising agent)”和“增溶剂(solubilising agents)”旨在药用配制品科学的背景下被解释。因此,增溶剂可以是,例如:氯化苄烷铵、苯甲酸苄酯、磺丁基醚倍他环糊精钠、氯化十六烷基吡啶鎓、环糊精、二乙二醇单乙醚、富马酸、羟丙基倍他环糊精、羟丙甲纤维素、羊毛脂醇、卵磷脂、油醇、磷脂、泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨醇脂肪酸酯、聚羟基15硬脂酸酯、聚氧甘油酯、聚维酮、吡咯烷酮、月桂基硫酸钠、脱水山梨糖醇酯(脱水山梨醇脂肪酸酯)、辛酸甘油酯、三油酸甘油酯以及维生素e聚乙二醇琥珀酸酯。
[0130]
因此,在一个实施例中,该一种或多种药用增溶剂(d)包括选自下组的一种或多种药用增溶剂:氯化苄烷铵、苯甲酸苄酯、磺丁基醚倍他环糊精钠、氯化十六烷基吡啶鎓、环糊精、二乙二醇单乙醚、富马酸、羟丙基倍他环糊精、羟丙甲纤维素、羊毛脂醇、卵磷脂、油醇、磷脂、泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨醇脂肪酸酯、聚羟基15硬脂酸酯、聚氧甘油酯、聚维酮、吡咯烷酮、月桂基硫酸钠、脱水山梨糖醇酯(脱水山梨醇脂肪酸酯)、辛酸甘油酯、三油酸甘油酯以及维生素e聚乙二醇琥珀酸酯。
[0131]
在一个实施例中,该增溶剂是月桂基硫酸钠。
[0132]
在下文如实例2所描述的药用片剂组合物包括增溶剂(月桂基硫酸钠),可以预期其促进溶解并潜在地缓解先前提到的问题中的一种或多种。然而,一方面,实例2的初始溶
解速率被改进超过比较实例1(即简单的
‘
胶囊中的共混物’)的溶解速率,该改进是适度的,在15分钟之后提供46.5%溶解。还存在着未解决的问题,即实例2的改进配制品仍然展现出azd9291甲磺酸盐的不完全释放(在ph 6.8溶解测试中,在60分钟之后仅69.1%)。
[0133]
出人意料地,发现上述问题的解决方案是最小化增溶剂的使用。如在下文实验部分所示,实例2和3是实质上相同的,除了在实例3中未使用增溶剂之外。如在下表中所示,相对实例2,实例3的配制品实现了在t=15分钟下大大改进的溶解和在60分钟之后改进的释放:
[0134]
实例号在15分钟下的溶解(%)在60分钟之后的释放(%)246.569.1369.482.1
[0135]
根据本发明的这个方面,提供了本发明的另外的权利要求和实施例,其中如在此所定义的药用组合物(药用片剂)可以具有限于以下所列的范围中任一者的药用增溶剂(d)量:
[0136]
·
按重量计从0至1份。
[0137]
·
按重量计从0至0.75份。
[0138]
·
按重量计从0至0.5份。
[0139]
·
按重量计从0至0.25份。
[0140]
·
按重量计从0至0.15份。
[0141]
·
按重量计从0至0.1份。
[0142]
·
按重量计从0至0.05份。
[0143]
在另外的方面、权利要求和实施例中,药用增溶剂(d)不存在于药用组合物(或药用片剂)之内。
[0144]
药用润滑剂
[0145]
在本说明书中,术语“润滑剂(lubricant)”和“润滑剂(lubricants)”旨在药用配制品科学的背景下被解释。因此,润滑剂可以是,例如硬脂酸钙、山嵛酸甘油酯、二山嵛酸甘油酯、单硬脂酸甘油酯、棕榈酰硬脂酰甘油酯、或甘油的山嵛酸酯混合物(如二山嵛酸甘油酯、三山嵛酸甘油酯和山嵛酸甘油酯的混合物)、亮氨酸、硬脂酸镁、豆蔻酸、棕榈酸、泊洛沙姆、聚乙二醇、苯甲酸钾、苯甲酸钠、月桂基硫酸钠、硬脂酸钠、硬脂酰富马酸钠、硬脂酸、滑石、三山嵛酸甘油酯以及硬脂酸锌。
[0146]
因此,在一个实施例中,该一种或多种药用润滑剂(e)包括选自以下的一种或多种药用润滑剂:硬脂酸钙、山嵛酸甘油酯、二山嵛酸甘油酯、单硬脂酸甘油酯、棕榈酰硬脂酰甘油酯、或甘油的山嵛酸酯混合物(如二山嵛酸甘油酯、三山嵛酸甘油酯和山嵛酸甘油酯的混合物)、亮氨酸、硬脂酸镁、豆蔻酸、棕榈酸、泊洛沙姆、聚乙二醇、苯甲酸钾、苯甲酸钠、月桂基硫酸钠、硬脂酸钠、硬脂酰富马酸钠、硬脂酸、滑石、三山嵛酸甘油酯以及硬脂酸锌。
[0147]
在下文如实例6所描述的药用组合物不包括润滑剂,表明润滑剂在提供该药剂的药用片剂配制品中不是必需要素。然而,在此类片剂配制品可以旨在被大规模生产用于人类消费的背景下,润滑剂的使用然而可以是优选的,以便尝试降低对药用片剂与制造设备(例如,对片剂冲头)两者的物理性损伤的风险。此类物理伤害有可能导致药用片剂产品的污染,具有少量来自受损设备的金属。通常使用的润滑剂是硬脂酸镁并且我们将硬脂酸镁
包括在下文(例如实例2、3和4)所描述的许多药用组合物中。
[0148]
在本发明的一个另外的方面,诸位发明人出乎意料地发现某些润滑剂的使用提供了本发明的药用组合物的显著改进的溶解特性。在本发明的这个方面,一种特别有益的润滑剂是硬脂酰富马酸钠。可替代地,还发现甘油的山嵛酸酯混合物(包含山嵛酸甘油酯、三山嵛酸甘油酯和山嵛酸甘油酯)是特别有益的。相对硬脂酸镁的使用,表明改进的溶解特性的比较数据在以下表中示出:
[0149][0150]
如在下文在实验部分中所示的,实例4和实例5的配制品是相同的,除了润滑剂物质身份的差异之外。类似地,除了润滑剂物质身份的差异之外,实例4和实例6b的配制品在其他方面是实质上非常相似的。
[0151]
根据本发明的这个另外的方面,提供了另外的权利要求和实施例,其中如在此所定义的药用组合物(药用片剂)可以具有限于以下所列的范围中任一者的药用润滑剂(e)量:
[0152]
·
按重量计从0.25至3份。
[0153]
·
按重量计从0.5至3份。
[0154]
·
按重量计从0.5至2.5份
[0155]
·
按重量计从0.75至3份。
[0156]
·
按重量计从1至3份。
[0157]
·
按重量计从1.5至3份
[0158]
·
按重量计从1至2.5份。
[0159]
·
按重量计从1.5至2.5份。
[0160]
根据本发明的这个方面,在一个实施例中,该一种或多种药用润滑剂(e)包括硬脂酰富马酸钠、二山嵛酸甘油酯或其混合物。
[0161]
在一个实施例中,该一种或多种药用崩解剂(e)包括选自以下的一种或多种药用崩解剂:硬脂酰富马酸钠、二山嵛酸甘油酯、山嵛酸甘油酯和三山嵛酸甘油酯。
[0162]
在一个实施例中,硬脂酰富马酸钠和/或二山嵛酸甘油酯是该一种或多种药用润滑剂(e)中的一种或两种,其中该硬脂酰富马酸钠和/或二山嵛酸甘油酯构成该一种或多种药用润滑剂(e)的从30至100wt%。
[0163]
在另一个实施例中,上述范围是从40至100wt%。
[0164]
在另一个实施例中,上述范围是从50至100wt%。
[0165]
在另一个实施例中,上述范围是从60至100wt%。
[0166]
在另一个实施例中,上述范围是从70至100wt%。
[0167]
在另一个实施例中,上述范围是从80至100wt%。
[0168]
在另一个实施例中,上述范围是从90至100wt%。
[0169]
在另一个实施例中,该一种或多种药用润滑剂(e)由硬脂酰富马酸钠、二山嵛酸甘油酯或其混合物组成。
[0170]
在一个实施例中,该一种或多种药用润滑剂(e)包括硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯。
[0171]
在一个实施例中,硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯是该一种或多种药用润滑剂(e)中的一种或多种,其中该硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯构成该一种或多种药用润滑剂(e)的从30至100wt%。
[0172]
在另一个实施例中,上述范围是从40至100wt%。
[0173]
在另一个实施例中,上述范围是从50至100wt%。
[0174]
在另一个实施例中,上述范围是从60至100wt%。
[0175]
在另一个实施例中,上述范围是从70至100wt%。
[0176]
在另一个实施例中,上述范围是从80至100wt%。
[0177]
在另一个实施例中,上述范围是从90至100wt%。
[0178]
在一个实施例中,该一种或多种药用润滑剂(e)由硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯或其混合物组成。
[0179]
在另一个实施例中,该一种或多种药用润滑剂(e)由硬脂酰富马酸钠、二山嵛酸甘油酯、山嵛酸甘油酯、三山嵛酸甘油酯或其人和混合物组成。
[0180]
在一个实施例中,该一种或多种药用润滑剂(e)包括硬脂酰富马酸钠。
[0181]
在一个实施例中,硬脂酰富马酸钠是一种或多种药用润滑剂(e)之一,其中该硬脂酰富马酸钠构成该一种或多种药用润滑剂(e)的从30至100wt%。
[0182]
在另一个实施例中,上述范围是从40至100wt%。
[0183]
在另一个实施例中,上述范围是从50至100wt%。
[0184]
在另一个实施例中,上述范围是从60至100wt%。
[0185]
在另一个实施例中,上述范围是从70至100wt%。
[0186]
在另一个实施例中,上述范围是从80至100wt%。
[0187]
在另一个实施例中,上述范围是从90至100wt%。
[0188]
在另一个实施例中,该一种或多种药用润滑剂(e)由硬脂酰富马酸钠组成。
[0189]
在一个实施例中,该一种或多种药用润滑剂(e)包括甘油的一种或多种山嵛酸酯。(即二山嵛酸甘油酯、三山嵛酸甘油酯和山嵛酸甘油酯中的一种或多种)。
[0190]
在一个实施例中,甘油的一种或多种山嵛酸酯是该一种或多种药用润滑剂(e)中的一种或多种,其中甘油的该一种或多种山嵛酸酯构成该一种或多种药用润滑剂(e)的从30至100wt%。
[0191]
在另一个实施例中,上述范围是从40至100wt%。
[0192]
在另一个实施例中,上述范围是从50至100wt%。
[0193]
在另一个实施例中,上述范围是从60至100wt%。
[0194]
在另一个实施例中,上述范围是从70至100wt%。
[0195]
在另一个实施例中,上述范围是从80至100wt%。
[0196]
在另一个实施例中,上述范围是从90至100wt%。
[0197]
在一个实施例中,该一种或多种药用润滑剂(e)由甘油的一种或多种山嵛酸酯组
成。
[0198]
在一个实施例中,该一种或多种药用润滑剂(e)包括二山嵛酸甘油酯。
[0199]
在一个实施例中,该一种或多种药用润滑剂(e)包括甘油的一种或多种山嵛酸酯。
[0200]
在一个实施例中,甘油的一种或多种山嵛酸酯是该一种或多种药用润滑剂(e)中的一种或多种,其中甘油的该一种或多种山嵛酸酯构成该一种或多种药用润滑剂(e)的从30至100wt%。
[0201]
在另一个实施例中,上述范围是从40至100wt%。
[0202]
在其他实施例中,上述范围是从50至100wt%。
[0203]
在另一个实施例中,上述范围是从60至100wt%。
[0204]
在另一个实施例中,上述范围是从70至100wt%。
[0205]
在另一个实施例中,上述范围是从80至100wt%。
[0206]
在另一个实施例中,上述范围是从90至100wt%。
[0207]
在一个实施例中,该一种或多种药用润滑剂(e)由甘油的一种或多种山嵛酸酯组成。
[0208]
解释
[0209]
在本说明书中,词“包括”描述一定存在的组分,但保留开放以下可能性:其他未指定的组分也可以存在于相关术语的范围之内。
[0210]
在本说明书中,词“组成”描述本发明一定存在的组分,但不对以下可能性具有开放性:其他未指定的另外的组分也可以存在于相关术语的范围之内。
[0211]
因此,例如,在本发明的第一方面,如在上文其中使用“包括”所定义的,(a)+(b)+(c)+(d)+(e)=100的事实不阻止其他未指定的药学上相关的组分存在于药用组合物之内。此类另外的组分可能包括,例如,药学上可接受的着色剂或其他药学上可接受的物质,其可能作为片剂包衣的组分被包括。
[0212]
本领域的技术人员将理解,能以无水物形式或以一种或多种水合形式使用某些药用赋形剂。例如乳糖可以作为无水形式或作为一水合物被使用。类似地,磷酸氢钙可以作为无水物形式或作为二水合物形式被使用。在本说明书中,其中任何药用赋形剂的水合水平未明确地提及,要解释的是通过术语涵盖任何或所有常规的水合水平。因此,“乳糖”(无另外的限制)包括糖一水合物、处于无水物形式的乳糖以及其混合物。按类似的方式,本领域技术人员将理解,能以二元形式或三元形式使用磷酸钙。在本说明书中,“磷酸钙”(无另外的限制)包括二碱价形式、三碱价形式或其混合物。
[0213]
药用组合物和药用片剂
[0214]
本发明的药用组合物旨在形成为适合于口服给药至人的药用片剂。这可以通过如在下文实验部分中更详细描述的干混合/直接压片工艺来实现。
[0215]
因此,在一个方面,提供了一种药用片剂,该药用片剂包括如在此所定义的药用组合物。
[0216]
在一个实施例中,提供了一种药用片剂,该药用片剂包括片芯,其中该片芯包括如在此所定义的药用组合物并且其中该片芯具有包衣。在一个实施例中,该包衣是薄膜包衣。
[0217]
当该片剂具有薄膜包衣时,可以使用常规方法施加该薄膜包衣。可以使用包衣以提供保护免受例如湿度浸入或光降解、使配制品变色、或者修饰或控制药剂从配制品的释
放。
[0218]
可以根据本发明施加至组合物的适合的包衣(例如薄膜包衣)包括成膜剂,例如糖或更特别地成膜聚合物。适合的糖衣是众所周知的并且包括例如蔗糖或乳糖。适合的成膜剂包括,例如成膜聚合物,例如纤维素醚、酯和混合的醚与酯,包括水溶性纤维素醚的酯,例如羟丙基甲基纤维素、羟丙基乙基纤维素、羟丙基纤维素、甲基纤维素、羟丙基甲基纤维素乙酸丁二酸酯或羟丙基甲基纤维素邻苯二甲酸酯;成膜丙烯酸聚合物,例如甲基丙烯酸-甲基丙烯酸甲酯共聚物;以及成膜乙烯基聚合物,例如聚乙烯醇或聚乙酸乙烯邻苯二甲酸酯。适合地,成膜聚合物是一种水溶性成膜聚合物,特别是水溶性纤维素醚,例如羟丙基甲基纤维素(特别是具有动力粘度为从2至18cp(在20℃下的2%w/v溶液)的羟丙基甲基纤维素,并且选自例如等级1828、2208、2906,并且尤其是2910,如在上文所定义的)。使用的成膜剂的量将取决于所希望的薄膜包衣的特性。通常,该成膜剂将以按重量计薄膜包衣的从40%至90%,例如包衣的从50%至80%的量存在。该成膜剂典型地以按重量计根据本发明的配制品的从0.5%至5%、适合地从2.5%至5%存在。
[0219]
任选地,该薄膜包衣包含另外的组分,例如增塑剂、着色剂、助分散剂和遮光剂。可以使用增塑剂来改进薄膜包衣的薄膜柔性和耐久性以及粘附特性。适合的增塑剂包括,例如甘油、乙酰化的甘油单酯、柠檬酸酯(例如柠檬酸三乙酯)、丙二醇、聚乙二醇(例如聚乙二醇,其中分子量为从200至500,特别是300)、三醋精(甘油三乙酸酯)、三酸甘油脂(例如篦麻油)、或邻苯二甲酸酯(例如邻苯二甲酸二乙酯)。通常,增塑剂当使用时是基于薄膜包衣的重量以按重量计从1%至20%例如5%至15%的量存在。
[0220]
适合的遮光剂和着色剂是众所周知的并且包括例如二氧化钛、三氧化二铁(例如氧化铁)。
[0221]
适合的助分散剂包括例如滑石。
[0222]
在本发明的实施例中,薄膜包衣包括
[0223]
(i)从50至100(适合地从50至80)份水溶性纤维素醚(适合地是羟丙基甲基纤维素,特别是具有动力粘度为从2至18cp(在2%w/v溶液中在20℃下所测量的)的羟丙基甲基纤维素,例如如在上文所定义的具有动力粘度为从5至7cp的等级2910、1828、2208或2906);
[0224]
(ii)从0至25(特别地从5至20)份增塑剂(适合地是聚乙二醇,特别是具有分子量为从200至500的聚乙二醇);以及
[0225]
(iii)从0至50(特别地从0至30)份遮光剂(适合地二氧化钛)、着色剂(适合地氧化铁)和助分散剂;
[0226]
其中所有份是按重量计并且这些份(i)+(ii)+(iii)之和=100。
[0227]
包衣可以是例如按重量计组合物的0.5%至10%,特别是1%至6%,并且优选2.5%至5%。适合的薄膜包衣可商购为浓缩液,所述浓缩液可以在施加至组合物之前用水稀释并且任选地是纤维素醚(例如hpmc)和增塑剂(例如聚乙二醇)。此类浓缩液包括来自卡乐康公司(colorcon)的opaspray
tm
包衣,例如opaspray
tm
棕色m-1-25092和opaspray黄色m-1-22842。
[0228]
在一个实施例中,薄膜包衣包括水溶性纤维素醚和/或水溶性的纤维素醚的酯。
[0229]
在一个实施例中,薄膜包衣包括水溶性纤维素醚。
[0230]
在一个实施例中,薄膜包衣包括羟丙基甲基纤维素。
[0231]
在一个实施例中,薄膜包衣是基于羟丙基甲基纤维素。
[0232]
适合的基于羟丙基甲基纤维素的薄膜以商标名“欧巴代(opadry)ii”(例如“欧巴代ii米黄色”可商购自卡乐康公司(colorcon))。
[0233]
在一个实施例中,提供了一种药用片剂,该药用片剂由具有薄膜包衣的片芯组成;其中该片芯由如在此所定义的药用组合物组成。
[0234]
在本发明的其中
‘
药用组合物’被提及的任何一个权利要求、方面或实施例中,除非上下文另有要求,以下实施例也可以被应用以便提供另外的权利要求、方面或实施例:
[0235]
在一个实施例中,该药用组合物是药用片剂组合物(用于口服给药)。
[0236]
在一个实施例中,本发明的药用组合物是适合于口服给药至人的药用片剂组合物。
[0237]
在一个实施例中,本发明的药用组合物是适合于口服给药至人的药用片剂组合物,该人具有癌症[特别是肺癌,更特别地是非小细胞肺癌(nsclc),例如egfrm+nsclc]。
[0238]
在一个实施例中,本发明的药用组合物是适合于口服给药至人的药用片剂,该人具有egfrm+和t790m+非小细胞肺癌。
[0239]
在本发明的其中
‘
药用片剂’被提及的任何一个权利要求、方面或实施例中,以下实施例也可以被应用以便提供另外的权利要求、方面或实施例:
[0240]
在一个实施例中,该药用片剂具有重量范围为从25至1500mg。
[0241]
在一个实施例中,该药用片剂具有重量范围为从30至1200mg。
[0242]
在一个实施例中,该药用片剂具有重量范围为从40至1000mg。
[0243]
在一个实施例中,该药用片剂具有重量范围为从75至750mg。
[0244]
在本发明的其中
‘
药用组合物’或
‘
药用片剂’被提及的任何一个权利要求、方面或实施例中,以下实施例也可以被应用以便提供另外的权利要求、方面或实施例:
[0245]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用组合物的总重量的75%。
[0246]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用片剂的总重量的75%。
[0247]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用组合物的总重量的85%。
[0248]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用片剂的总重量的85%。
[0249]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于90%的药用组合物的总重量的。
[0250]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用片剂的总重量的90%。
[0251]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用组合物的总重量的95%。
[0252]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用片剂的总重量的95%。
[0253]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或
等于药用组合物的总重量的97.5%。
[0254]
在一个实施例中,如在此所定义的组分(a)、(b)、(c)、(d)和(e)的组合重量大于或等于药用片剂的总重量的97.5%。
[0255]
在本发明的一个另外的方面,提供了如在此所定义的药用组合物用于制造药物的用途。
[0256]
在一个实施例中,提供了如在此所定义的药用组合物用于制造用于治疗癌症的药物的用途。
[0257]
在本发明的一个方面,提供了如在此所定义的药用组合物,用于用作药物。
[0258]
在一个实施例中,提供了如在此所定义的药用片剂,用于用作药物。
[0259]
在一个实施例中,提供了如在此所定义的药用组合物,用于在治疗癌症中使用。
[0260]
在一个实施例中,提供了如在此所定义的药用片剂,用于在治疗癌症中使用。
[0261]
在本发明的一个方面,提供了治疗对其有需要的患者中的癌症的方法,该方法包括向该患者口服给予有效量的如在此所定义的药用组合物。
[0262]
在一个实施例中,该患者是温血哺乳动物。
[0263]
在另一个实施例中,该患者是人类患者。
[0264]
在另一个实施例中,该患者是成年人类患者。
[0265]
在一个实施例中,提供了治疗对其有需要的患者中的癌症的方法,该方法包括向该患者口服给予有效量的如在此所定义的药用片剂。
[0266]
在本说明中其中“癌症”被提及的任何一个方面、实施例或权利要求中,该癌症可以根据以下所列实施例进一步被定义,除非此类定义在具体背景下是不适当的。
[0267]
在一个实施例中,该癌症是肺癌。
[0268]
在一个实施例中,癌症是非小细胞肺癌。
[0269]
在一个实施例中,该癌症是egfr突变阳性非小细胞肺癌。
[0270]
在一个实施例中,该癌症是t790m+非小细胞肺癌。
[0271]
在一个实施例中,该癌症是egfrm+和t790m+非小细胞肺癌。
[0272]
本发明的另外的实施例
[0273]
在本说明书中,意图是,如在下文或上文所定义的具有范围限制的任何数目、实施例、方面或权利要求可以组合在一起(除非上下文说明给定的组合将是不适当的),以便提供另外的实施例和权利要求。例如,此类组合可以合并以提供如以下所定义的另外的实施例。
[0274]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0275]
(a)从2至70份药剂;
[0276]
(b)从5至96份两种或更多种药用稀释剂;
[0277]
(c)从0至15份一种或多种药用崩解剂;
[0278]
(d)从0至1.5份一种或多种药用增溶剂;以及
[0279]
(e)从0.5至3份一种或多种药用润滑剂;
[0280]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0281]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0282]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0283]
(a)从2至70份药剂;
[0284]
(b)从5至96份两种或更多种药用稀释剂;
[0285]
(c)从0至15份一种或多种药用崩解剂;
[0286]
(d)从0至1.5份一种或多种药用增溶剂;以及
[0287]
(e)从0.5至3份一种或多种药用润滑剂;
[0288]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0289]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;并且其中这一种或多种药用润滑剂(e)包括硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯。
[0290]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0291]
(a)从2至70份药剂;
[0292]
(b)从5至96份两种或更多种药用稀释剂;
[0293]
(c)从2至15份一种或多种药用崩解剂;
[0294]
(d)从0至1.5份一种或多种药用增溶剂;以及
[0295]
(e)从0.5至3份一种或多种药用润滑剂;
[0296]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0297]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0298]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0299]
(a)从2至70份药剂;
[0300]
(b)从5至96份两种或更多种药用稀释剂;
[0301]
(c)从2至15份一种或多种药用崩解剂;
[0302]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0303]
(e)从0.5至3份一种或多种药用润滑剂;
[0304]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0305]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0306]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0307]
(a)从5至50份药剂;
[0308]
(b)从5至96份两种或更多种药用稀释剂;
[0309]
(c)从2至15份一种或多种药用崩解剂;
[0310]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0311]
(e)从0.5至3份一种或多种药用润滑剂;
[0312]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0313]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0314]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0315]
(a)从5至50份药剂;
[0316]
(b)从55至85份两种或更多种药用稀释剂;
[0317]
(c)从2至15份一种或多种药用崩解剂;
[0318]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0319]
(e)从0.5至3份一种或多种药用润滑剂;
[0320]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0321]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%。
[0322]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0323]
(a)从5至50份药剂;
[0324]
(b)从5至96份两种或更多种药用稀释剂;
[0325]
(c)从2至15份一种或多种药用崩解剂;
[0326]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0327]
(e)从0.5至3份一种或多种药用润滑剂;
[0328]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0329]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;并且其中这一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素。
[0330]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0331]
(a)从5至50份药剂;
[0332]
(b)从5至96份两种或更多种药用稀释剂;
[0333]
(c)从2至15份一种或多种药用崩解剂;
[0334]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0335]
(e)从0.5至3份一种或多种药用润滑剂;
[0336]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0337]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;并且其中这一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素;并且其中一种或多种药用润滑剂(e)包括硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯。
[0338]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0339]
(a)从5至50份药剂;
[0340]
(b)从55至85份两种或更多种药用稀释剂;
[0341]
(c)从2至15份一种或多种药用崩解剂;
[0342]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0343]
(e)从0.5至3份一种或多种药用润滑剂;
[0344]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0345]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;并且其中一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素。
[0346]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0347]
(a)从5至50份药剂;
[0348]
(b)从55至85份两种或更多种药用稀释剂;
[0349]
(c)从2至15份一种或多种药用崩解剂;
[0350]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0351]
(e)从0.5至3份一种或多种药用润滑剂;
[0352]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0353]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;并且其中这一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素并且其中这一种或多种药用润滑剂(e)包括硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯。
[0354]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0355]
(a)从5至50份药剂;
[0356]
(b)从5至96份两种或更多种药用稀释剂;
[0357]
(c)从2至15份一种或多种药用崩解剂;
[0358]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0359]
(e)从0.5至3份一种或多种药用润滑剂;
[0360]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0361]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;其中该药剂是azd9291的甲磺酸盐。
[0362]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0363]
(a)从5至50份药剂;
[0364]
(b)从5至96份两种或更多种药用稀释剂;
[0365]
(c)从2至15份一种或多种药用崩解剂;
[0366]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0367]
(e)从0.5至3份一种或多种药用润滑剂;
[0368]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0369]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%并且其中除微晶纤维素之外,在这两种或更多种药用稀释剂之内的其他一种或多种药用稀释剂还选自乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇;并且其中这一种或多种药用崩解剂(c)包括低取代的羟丙基纤维素并且其中这一种或多种药用润滑剂(e)包括硬脂酰富马酸钠和/或甘油的一种或多种山嵛酸酯;并且其中该药剂是azd9291的甲磺酸盐。
[0370]
在一个实施例中,提供了一种药用组合物,该药用组合物包括:
[0371]
(a)从5至50份药剂;
[0372]
(b)从5至96份两种或更多种药用稀释剂;
[0373]
(c)从2至15份一种或多种药用崩解剂;
[0374]
(d)从0至0.75份一种或多种药用增溶剂;以及
[0375]
(e)从0.5至3份一种或多种药用润滑剂;
[0376]
其中所有份是按重量计并且这些份(a)+(b)+(c)+(d)+(e)之和=100;
[0377]
其中这两种或更多种药用稀释剂之一是微晶纤维素,其中该微晶纤维素构成这两种或更多种药用稀释剂(b)的从7至30wt%;其中该药剂是azd9291的甲磺酸盐,并且其中除微晶纤维素之外,在这两种或多种药用稀释剂之内的其他一种或多种药用稀释剂还选自乙酸纤维素、赤藓糖醇、乙基纤维素、果糖、菊粉、异麦芽糖醇、乳糖醇、乳糖、麦芽糖醇、麦芽糊精、麦芽糖、甘露醇、聚右旋糖、聚乙二醇、普鲁兰多糖、西甲硅油、氯化钠、山梨糖醇、淀粉、蔗糖、海藻糖和木糖醇。
[0378]
附图目录
[0379]
图1至6显示溶解数据,所述溶解数据是使用在下文实验部分中所描述的美国药典方法(united states pharmacopoeia methodology)来获得的。
[0380]
图1:实例1至5(ph 6.8)的溶解特性曲线
[0381]
图2:实例6a、6b、6c和6d(ph 6.8)的溶解特性曲线
[0382]
图3:实例6a、6b、6c和6d(ph 6.8)的扩大溶解特性曲线
[0383]
图4:实例7a、7b、8a和8b(ph 6.8)的溶解特性曲线
[0384]
图5:实例9(80mg,ph 6.8)的溶解特性曲线
[0385]
图6:实例9(ph 1.3)的溶解特性曲线
[0386]
实验细节
[0387]
溶解测试
[0388]
在此描述的溶解是根据美国药典的通用程序使用装置ii(桨叶(paddle))、用900ml的ph 6.8磷酸缓冲液(50mm nah2po4)亦或ph 1.3介质(2g/l的nacl,用hcl或naoh调节至ph 1.3)在37℃的温度下进行的。将溶解介质的10ml样品在7.5、15、20、30、45和60分钟回收,通过玻璃棉针筒式滤器(acrodisc玻璃棉gxf零件号4529或等效物)过滤,丢弃前4ml。通过在335nm(ph 6.8)或270nm(ph 1.3)的波长下相对标准溶液的uv分析来量化剩余溶液中的药物物质的浓度。通常,本说明书中所披露的溶解结果是基于三次重复性测试的平均值。
[0389]
实例中所用的材料
[0390]
在下文描述的实施例中所用的材料在下表中示出:
[0391][0392]
#
compitrol 888ato被描述为甘油酯的混合物,包括二山嵛酸甘油酯、三山嵛酸甘油酯和山嵛酸甘油酯。
[0393]
比较实例1
‑“
胶囊中的共混物”配制品
[0394]
将azd9291甲磺酸盐与微晶纤维素以按重量计比率1:2共混,填充入不透明的、白色的、尺寸0hpmc胶囊中,这样使得每个胶囊包含20mg azd9291游离碱的等效物。这种“胶囊中的共混物”配制品的定量组成在下表中示出:
[0395][0396][0397]a相当于20mg的azd9291游离碱
[0398]
实例2
[0399]
使用干混合/直接压片工艺来制造这种片剂配制品。将azd9291甲磺酸盐与下表中所列的赋形剂(不包括硬脂酸镁)使用特波拉(turbula)t2掺合器以28rpm的速度进行干混合30分钟。将硬脂酸镁添加至该混合物中并且以28rpm继续共混5分钟。将该干混合物使用配备有8mm圆形凹冲头的丽娃单站迷你压片机(riva single station mini-press)进行压
缩,以形成200mg片剂。这种片剂配制品的定量组成在下表中示出:
[0400][0401]a相当于20mg的azd9291游离碱
[0402]
实例3
[0403]
使用以上针对实例2所描述的工艺来制造这种片剂配制品。这种片剂配制品的定量组成在下表中示出:
[0404][0405]a相当于20mg的azd9291游离碱
[0406]
实例4
[0407]
使用以上针对实例2所描述的工艺来制造这种片剂配制品。这种片剂配制品的定量组成在下表中示出:
[0408][0409]a相当于20mg的azd9291游离碱
[0410]
实例5
[0411]
使用以上针对实例2所描述的工艺来制造这种片剂配制品。这种片剂配制品的定量组成在下表中示出:
[0412][0413]a相当于20mg的azd9291游离碱
[0414]
实例6a
[0415]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。添加一部分的硬脂酰富马酸钠(批重的0.5%)并且使用相同的参数继续混合另外的5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至特波拉(turbula)t2掺合器,添加剩余的硬脂酰富马酸钠,并且继续以28rpm混合5分钟。将这种干混合物使用配备有14.5x7.25mm冲头的丽娃经典旋转压片机(riva classic rotary press)进行压缩,以形成500mg片剂。
[0416][0417]
实例6b
[0418]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。添加一部分的甘油山嵛酸酯(批重的0.5%)并且使用相同的参数继续混合另外的5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至特波拉(turbula)t2掺合器,添加剩余的甘油山嵛酸酯,并且继续以28rpm混合5分钟。将这种干混合物使用配备有7mm凹冲头的丽娃单站压片机(riva single station mini-press)进行压缩,以形成200mg片剂。
[0419][0420][0421]
实例6c
[0422]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机
速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。将这种干混合物使用配备有7mm凹冲头的丽娃单站压片机(riva single station mini-press)进行压缩,以形成200mg片剂。
[0423][0424]
实例6d
[0425]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。添加一部分的硬脂酰富马酸钠(批重的0.5%)并且使用相同的参数继续混合另外的5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至特波拉(turbula)t2掺合器,添加剩余的硬脂酰富马酸钠,并且继续以28rpm混合5分钟。将这种干混合物使用配备有14.5x7.25mm冲头的丽娃经典旋转压片机(riva classic rotary press)进行压缩,以形成500mg片剂。
[0426][0427]
实例7a
[0428]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。添加一部分的硬脂酰富马酸钠(批重的0.5%)并且使用相同
的参数继续混合另外的5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至特波拉(turbula)t2掺合器,添加剩余的硬脂酰富马酸钠,并且继续以28rpm混合5分钟。将这种干混合物使用配备有14.5x7.25mm冲头的丽娃经典旋转压片机(riva classic rotary press)进行压缩,以形成500mg片剂。
[0429][0430]a相当于80mg的azd9291游离碱
[0431]
实例7b
[0432]
使用干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用特波拉(turbula)t2掺合器以28rpm的速度首先混合30分钟。添加一部分的硬脂酰富马酸钠(批重的0.5%)并且使用相同的参数继续混合另外的5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至特波拉(turbula)t2掺合器,添加剩余的硬脂酰富马酸钠,并且继续以28rpm混合5分钟。将这种干混合物使用配备有14.5x7.25mm冲头的丽娃经典旋转压片机(riva classic rotary press)进行压缩,以形成500mg片剂。
[0433]
[0434]a相当于80mg的azd9291游离碱
[0435]
实例8a和8b
[0436]
使用干混合/碾压工艺、使用下表中所列的材料来制造这些片剂配制品。将azd9291甲磺酸盐、甘露醇、微晶纤维素和羟丙基纤维素使用穆勒掺合器(muller blender)(25升圆筒)以15rpm首先混合58分钟。添加一部分的硬脂酰富马酸钠(批重的0.5%)并且使用相同的参数继续混合另外的9.5分钟。将该混合物使用具有滚筒压为40巴、间隙尺寸为2mm、滚筒转速为10.1-10.2rpm(25mm滚筒)以及螺杆转速为22.4-22.9rpm的亚历山大沃克台式碾压机(alexanderwerk bench top roller compactor)进行碾压。将所得带状物使用具有制粒机速度为100rpm和筛孔尺寸为1.27mm的科麦(comil)u3进行碾磨。使所得颗粒返回至穆勒掺合器(muller blender),添加剩余的硬脂酰富马酸钠,并且继续以15rpm混合5分钟。将片芯使用配备有7mm(20mg强度)或14.5x7.25mm(80mg强度)冲头的丽娃派科拉(riva picolla)旋转压片机用转台速度为20rpm进行压缩。
[0437]
将所得片芯用专利薄膜衣(欧巴代ii米黄色,由英国卡乐康有限公司(colorcon uk ltd)提供)以芯重量的4%的水平进行包衣,以分别针对实例8a和8b给出具有标称重量为130mg(20mg强度)和520mg(80mg强度)的包衣片剂。实例8a的片芯(在包衣之前)的定量组成在下表中示出:
[0438]a相当于20mg的azd9291游离碱
[0439]
实例8b的片芯(在包衣之前)的定量组成在下表中示出:
[0440][0441]a相当于80mg的azd9291游离碱
[0442]
实例9
[0443]
使用如实例8a和8b中所描述的干混合/碾压工艺、使用下表中所列的材料来制造这种片剂配制品。将片芯使用配备有9mm(40mg强度)或14.5x7.25mm(80mg强度)冲头的丽娃(riva)经典旋转压片机用转台速度为20rpm进行压缩。
[0444]
将所得片芯用专利薄膜衣(欧巴代ii米黄色,由英国卡乐康有限公司(colorcon uk ltd)提供)以芯重量的4%的水平进行包衣以给出具有标称重量为520mg(80mg强度)的包衣片剂,并且以芯重量的5%的水平进行包衣以给出具有标称重量为262.5mg(40mg强度)的包衣片剂。实例9的片芯(在包衣之前)的定量组成在下表中示出:
[0445][0446]a相当于40mg的azd9291游离碱
[0447]b相当于80mg的azd9291游离碱。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1