一种环状mRNA聚合物-脂质杂化递送系统及其制备方法和应用与流程
mrna的新材料递送主要为脂质纳米颗粒系统(lipid nanoparticles)。脂质纳米颗粒系统通常包括可电离脂质分子(具有负电性,在酸性缓冲液中通过静电作用与负电性环状 mrna形成复合物纳米颗粒,并促进环状mrna在细胞溶酶体中的逃脱)、胆固醇脂质类分子(通过填充脂质之间的空隙来增强纳米颗粒的稳定性)、辅助磷脂分子(有助于调节纳米颗粒的流动性并增强功效)和聚乙二醇化脂质分子(可减少与巨噬细胞的非特异性相互作用增加纳米颗粒的体内循环和半衰期)。然而,脂质纳米颗粒系统对于环状 mrna的递送存在以下弊端:
7.(1)脂质纳米颗粒系统中的可离子化脂质、辅助磷脂分子等脂质结构的合成、生产放大、原材料规模化生产难度大。
8.(2)除环状mrna外,脂质纳米颗粒系统包含至少4种脂质成分,而每种组分的比例对于环状mrna的最终翻译效果产生直接的影响,而组分的复杂性也为递送系统的优化带来难度。
9.(3)脂质纳米颗粒系统的脂质成分使其流动性更强,而导致整体结构稳定性降低。
技术实现要素:
10.环状mrna具有闭合环状结构,不易被核酸外切酶降解,结构更加稳定,在细胞内的表达时间长,表达量高。因此,环状mrna其具有巨大的产业化潜力。然而,环状 mrna是带负电的大分子结构,而细胞膜也带负电,静电排斥作用使环状mrna难以进入细胞内。此外,环状mrna易被先天免疫系统的细胞吞噬,并被核酸酶降解。因此,必须解决递送难题,才能实现环状mrna的广泛应用。
11.目前,环状mrna的药物研发仍处于起步发展状态,针对环状mrna的材料递送解决方案较为匮乏。脂质纳米颗粒系统是环状mrna常用的递送策略,其通常包括可电离脂质分子、胆固醇脂质类分子、辅助磷脂和聚乙二醇化脂质分子等至少4中组分。然而,脂质纳米颗粒系统对环状mrna的递送存在组分复杂、组分原料的生产放大难度大、流动性强导致的结构稳定性差等关键问题。
12.因此,目前急需一种新型环状mrna递送系统,其相较于脂质纳米颗粒系统,应具有更少的组分、组分生产成本低以及更稳定的结构等优势,进而推动环状mrna的应用和发展。
13.本发明提供一种聚合物-脂质杂化递送系统(lipid-polymer hybrid nanoparticles)实现环状mrna的递送,以克服现有技术的不足。
14.本发明的目的在于公开了一种环状mrna聚合物-脂质杂化递送系统。
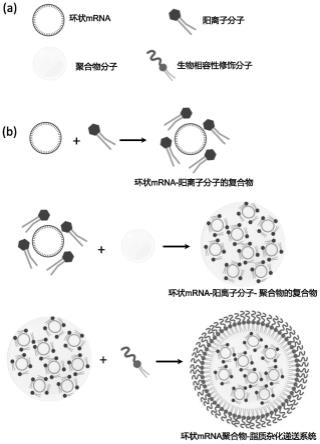
15.本发明的环状mrna聚合物-脂质杂化递送系统成分包括阳离子分子、聚合物以及生物相容性修饰分子3种组分。其中,阳离子分子可与负电性环状mrna通过静电作用形成复合物纳米颗粒,并促进环状mrna在细胞溶酶体中的逃脱;聚合物可稳定阳离子分子-环状mrna复合纳米颗粒,三者形成内核结构;生物相容性修饰分子用于提高内核的亲水性,增加纳米颗粒的体内循环和半衰期。
16.与脂质纳米颗粒系统相比,本发明的聚合物-脂质杂化递送系统有益效果在于:
17.(1)本发明提供的聚合物-脂质杂化递送系统由3部分组分组成,其中的聚合物的引入减少了递送系统的组分。
18.(2)本发明制备的聚合物-脂质杂化递送系统中,聚合物的原材料规模化生产难度
低以及合成成本低。
19.(3)本发明制备的聚合物-脂质杂化递送系统中,聚合物的引入降低了结构的流动性,增加了结构的稳定性。
20.上述特征使聚合物-脂质杂化递送系统由为高效递送环状mrna提供了新的平台。
21.本发明的第二个目的在于公开了上述环状mrna聚合物-脂质杂化递送系统的制备方法。
22.本发明的第三个目的在于公开了上述环状mrna聚合物-脂质杂化递送系统的应用。
23.本发明的第四个目的在于公开了含有上述环状mrna聚合物-脂质杂化递送系统的制品。
24.本发明的目的是通过以下技术方案实现的:
25.一种环状mrna聚合物-脂质杂化递送系统,其中,所述环状mrna聚合物-脂质杂化递送系统包括环状mrna、阳离子分子、聚合物和生物相容性修饰分子;阳离子分子与环状mrna通过静电作用形成阳离子分子-环状mrna复合纳米颗粒;聚合物与稳定阳离子分子-环状mrna复合纳米颗粒,三者形成内核结构;生物相容性修饰分子包裹于内核结构外层形成类球形结构。
26.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统,其中,所述环状mrna 选自至少一种以下环状mrna:自报告基因环状mrna、基因组编辑环状mrna、抗原环状mrna、抑癌基因环状mrna、白细胞介素环状mrna或、细胞嵌合抗原受体环状 mrna或功能性环状mrna。
27.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统,其中:
28.所述自报告基因环状mrna选自egfp、fluc、mcherry、beta gal或renilla luc中的一种;
29.所述基因组编辑环状mrna选自cas9、cas9 nickase或cre重组酶中的一种;
30.所述抗原环状mrna选自ova;
31.所述抑癌基因环状mrna选自p53或pten中的一种;
32.所述白细胞介素环状mrna选自il-10、il-12或il-6中的一种。
33.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统,其中:所述生物相容性修饰分子选自聚乙二醇及其衍生物、甘露醇、改性的壳聚糖、葡聚糖、羧基葡聚糖、脂质体、白蛋白、正硅酸乙酯、聚丙烯酸、kh560、kh550、f127、co-520、二乙烯三胺五乙酸、葡甲胺、精氨酸、聚谷氨酸、多肽中的至少一种。
34.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统,其中:所述阳离子分子选自氨分子衍生物、带正电荷两亲性类脂化合物、铵盐及其衍生物、聚酰胺及其衍生物中的至少一种。
35.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统,其中:所述聚合物选聚乳酸及其共聚物、碳磷脂及其衍生物、自多糖及其衍生物、氨基酸及其衍生物、多元醇及其衍生物、聚合物多元醇、聚丙烯酸及其衍生物中的至少一种。
36.一种环状mrna聚合物-脂质杂化递送系统制备方法,所述方法包括以下步骤:
37.(a)制备得到含有阳离子分子的溶液;
38.(b)阳离子分子溶液与酸性缓冲溶液混合均匀,得到含有阳离子分子的酸性溶液;
39.(c)获得环状mrna和阳离子分子酸性溶液组成的复合物粒子;
40.(d)对所述环状mrna-阳离子分子复合物进行聚合物包覆,得到稳定的环状mrna
‑ꢀ
阳离子分子-聚合物复合纳米颗粒;
41.(e)对所述环状mrna-阳离子分子-聚合物复合纳米颗粒进行生物相容性分子修饰,得到稳定封装环状mrna的纳米粒子。
42.上述技术方案所述的环状mrna聚合物-脂质杂化递送系统制备方法,其中,具体步骤为:
43.(a1)将阳离子分子溶于溶剂中,制备浓度为2.5mg/ml的含有阳离子分子的溶液;所述阳离子分子选自氨分子衍生物、带正电荷两亲性类脂化合物、铵盐及其衍生物、聚酰胺、聚酰胺衍生物中的至少一种;
44.所述溶剂选自甲醇、甲醛、乙醇、乙醛、乙二醇、二乙二醇、dmf、苯甲醇、水合肼、硼氢化钠、氢碘酸、丙酮、二氯甲烷、三氯甲烷至少一种;
45.(b1)将含有阳离子分子的溶液与酸性缓冲溶液混合均匀,得到含有阳离子分子的酸性溶液即阳离子分子缓冲液;含有阳离子分子的酸性溶液的ph范围为1-6;反应时间为30秒~24小时、反应的温度为0度~37度;
46.所述酸性缓冲溶液选自柠檬酸、柠檬酸盐、醋酸、醋酸盐、盐酸、盐酸盐、硫酸、硫酸盐、硝酸、硝酸盐至少一种,酸性缓冲溶液ph范围为1-6;
47.(c1)将含有环状mrna的溶液与含有阳离子分子的酸性溶液混合均匀,反应一段时间后,得到环状mrna和阳离子分子组成的复合物粒子;反应时间为30秒~24小时、反应的温度为0度~37度;
48.所述环状mrna和阳离子分子组成的复合物粒子中,环状mrna与阳离子分子的质量比为1:100~10:1;
49.所述环状mrna选自至少一种以下环状mrna:自报告基因环状mrna、基因组编辑环状mrna、抗原环状mrna、抑癌基因环状mrna、白细胞介素环状mrna、细胞嵌合抗原受体环状mrna或功能性环状mrna;
50.所述自报告基因环状mrna选自egfp、fluc、mcherry、beta gal或renilla luc中的一种;
51.所述基因组编辑环状mrna选自cas9、cas9 nickase或cre重组酶中的一种;
52.所述抗原环状mrna选自ova;
53.所述抑癌基因环状mrna选自p53或pten中的一种;
54.所述白细胞介素环状mrna选自il-10、il-12或il-6中的一种;
55.所述含有环状mrna的溶液中环状mrna的浓度为1000~0.1g/l;
56.所述含有阳离子分子的酸性溶液中阳离子分子的浓度为1000~0.1g/l;
57.(d1)将所述环状mrna-阳离子分子复合物与含有聚合物分子的溶液混合均匀,反应一段时间后,得到含有的环状mrna-阳离子分子-聚合物复合纳米颗粒的溶液;反应时间为30秒~24小时、反应的温度为0度~37度;
58.所述含有聚合物分子的溶液中聚合物分子的浓度为1000~0.1g/l;所述聚合物选自聚乳酸、聚乳酸共聚物、碳磷脂、碳磷脂衍生物、多糖、多糖衍生物、氨基酸、氨基酸衍生
聚合物-脂质杂化递送系统中环状mrna的细胞转染效率≥50%,较佳地≥60%,更佳地≥70%,更佳地≥80%,更佳地≥90%,最佳地≥95%(如99%)。
72.上述技术方案所述的一种环状mrna聚合物-脂质杂化递送系统,其中:环状mrna 聚合物-脂质杂化递送系统按所述递送系统的总个数计,80%(较佳地85%,更佳地90%,更佳地95%,最佳地≥99%)的所述递送系统材料的粒径位于
±
15%(较佳地
±
10%,更佳地
±
1%)的所述纳米复合材料的d50范围内。
73.上述技术方案所述的一种环状mrna聚合物-脂质杂化递送系统的应用,其中:所述应用为在制备肿瘤治疗药物的应用、在制备肿瘤疫苗的应用、在制备肿瘤靶向药物中的应用、在制备肿瘤诊断材料中的应用、在制备体内外诊断肿瘤材料中的应用、在制备炎症相关疾病的治疗的应用、在制备传染疾病的治疗的应用、在制备传染疾病的预防的应用、在制备伤口愈合治疗的应用、在制备心脑血管慢行疾病治疗的应用、在制备器官维化的治疗的应用、在制备病毒感染治疗的应用、在制备病毒感染预防的应用、在制备体内外细胞编辑的应用、在制备非酒精性脂肪肝的应用、在制备肠道疾病的应用、在制备新抗原疫苗的应用、在制备细胞诱导的应用、在制备蛋白美容的应用、在制备蛋白缺陷类疾病的应用、在制备衰老修复的应用、在制备抗衰老的应用或在制备药物载体中的应用。本技术方案中根据所递送的环状mrna的功能不同,最终递送系统的应用也有变化。
74.一种含有上述技术方案中任一技术方案所述的一种环状mrna聚合物-脂质杂化递送系统的制品。
75.本发明具有以下有益效果:
76.(1)本发明所提供的用于递送环状mrna的聚合物-脂质杂化递送系统成分包括阳离子分子、聚合物和生物相容性修饰分子,因聚合物分子可稳定环状mrna-阳离子分子复合物,从而在减少递送环状mrna所需组分的同时,达到较高的环状mrna转染效率。
77.(2)本发明提供的用于递送环状mrna的聚合物-脂质杂化递送系统的制备方法,通过组装法得到一系列环状mrna转染性能优异的纳米材料。具体地,本发明人通过组装法对环状mrna进行包封,得到一种具有粒径合适、稳定性好、水分散性好、生物相容性优异、环状mrna转染效率高、结构稳定、材料组分少、材料原料生产简便且廉价的环状mrna递送系统纳米材料。
78.(3)本发明提供的用于递送环状mrna的聚合物-脂质杂化递送系统的制备方法,具有环境友好、安全可靠、工艺简单、成本低廉且产率高、质量易于控制、易于大规模生产的优势。
79.(4)本发明提供的用于递送环状mrna的聚合物-脂质杂化递送系统的制备方法,具有高环状mrna包封率,可以保护环状mrna结构,降低对酶促降解的敏感,减少酶降解。
80.(5)本发明提供的用于递送环状mrna的聚合物-脂质杂化递送系统的制备方法,可以提高环状mrna对温度储存的适应性,纳米化后的环状mrna递送系统纳米材料相较于单纯环状mrna可在4度、室温、37度、-20度、-80度保存更久。
81.(6)本发明提供的用于递送环状mrna的聚合物-脂质杂化递送系统相较于传统脂质纳米颗粒系统,聚合物的引入减少了递送系统的组分、增加整体结构的稳定性、降低原材料规模化生产难度和成本,为高效递送环状mrna提供了新的平台。
附图说明:
82.1、图1是实施例1的主要制备过程示意图。
83.2、图2是实施例1所得的环状mrna递送系统纳米材料的tem结果。
84.3、图3是实施例1所得的环状mrna递送系统纳米材料的细胞毒性测试结果。
85.4、图4是实施例1所得的egfp环状mrna递送系统纳米材料的细胞转染结果;空载递送系统纳米材料和egfp环状mrna递送系统纳米材料与细胞孵育后,对egfp蛋白进行激光共聚焦拍摄。
86.5、图5是实施例1所得的fluc环状mrna递送系统纳米材料的细胞转染结果。
87.6、图6是实施例1所得的fluc环状mrna递送系统纳米材料的体内表达结果。
具体实施方式:
88.鉴于现有脂质纳米颗粒系统用于递送环状mrna技术的缺陷,本案发明人经研究和实践,得以提出本发明的技术方案,下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
89.如本文所用,术语“递送系统纳米材料”、“纳米粒子”、“聚合物-脂质杂化递送系统”或者“mrna递送系统纳米材料”与“环状mrna聚合物-脂质杂化递送系统”可互换使用,均指具有下组特征的纳米粒子:
90.(1)所述纳米材料包封环状mrna的聚合物-脂质杂化纳米材料;
91.(2)所述纳米材料的粒径为≥0.1nm;
92.(3)所述纳米材料的环状mrna包封率≥10%;
93.如本文所用,术语“mrna递送系统纳米材料”、“聚合物-脂质杂化递送系统”、“纳米复合材料”或者“复合纳米粒子”与“环状mrna聚合物-脂质杂化递送系统”可互换使用,均指在所述包封环状mrna的聚合物-脂质杂化纳米材料或所形成的复合材料。
94.如本文所用,术语“egfp”为增强型绿色荧光蛋白的简称。
95.如本文所用,术语“fluc”为萤火虫荧光素酶蛋白的简称。
96.如本文所用,术语“dspe-peg”为二硬脂酰磷脂酰乙醇胺-聚乙二醇的简称。
97.如本文所用,术语“plga”为聚乳酸-羟基乙酸共聚物的简称。
98.如本文所用,术语“室温”指0-30℃,较佳地为4-25℃。
99.本发明中的通用测试设备和方法包括:
100.(1)透射电镜tem:
101.测试仪器:jeol-2100型透射电子显微镜;测试条件:200kv,101μa;且待测纳米粒子分散于水中进行测试。
102.(2)小动物生物自发光成像系统:
103.详细的实施方式和具体的操作过程如下:
104.1.将fluc线性或环状mrna递送系统纳米材料肌肉注射在c57小鼠(14-15g,4-5 周龄)的下肢。
105.2.24小时后,小鼠腹腔注射d-荧光素钾盐发光底物溶液(3mg每只小鼠)。
106.3.15分钟后,通过小型动物荧光成像系统(lumina iii perkinelmer)显示环状mrna在小鼠的体内的翻译情况。
107.(3)egfp激光共聚焦实验:
108.详细的实施方式和具体的操作过程如下:
109.1.将细胞接种在共聚焦皿上,并在37℃的5%co2培养箱中培养24小时。
110.2.将培养基替换为经dmem培养基稀释的含有空载递送系统纳米材料或egfp环状 mrna递送系统纳米材料的100μl培养基,再孵育24小时。
111.3.pbs洗涤两次后,将细胞用4%多聚甲醛固定30分钟并通过激光共聚焦成像(egfp 在488nm激发)。
112.(4)fluc细胞表达实验:
113.详细的实施方式和具体的操作过程如下:
114.1.将100μl的细胞(1
×
105个细胞/毫升)接种在全黑透明底96孔板中,并培养24 小时。
115.2.将培养基替换为包含空载递送系统纳米材料或egfp环状mrna递送系统纳米材料的100μl的dmem培养基,再孵育24小时。
116.3.去除培养基,加入荧光素底物,5-10分钟后,用酶标仪进行自发光强度测量。
117.(5)细胞毒性试验:
118.详细的实施方式和具体的操作过程如下:
119.1.将100μl的细胞(1
×
105个细胞/毫升)接种在96孔板中,并培养24小时。
120.2.将培养基替换为经dmem培养基稀释的不同浓度纳米粒子的100μl培养基,再孵育24小时。
121.3.将10μl的mtt pbs溶液(5mg/ml)添加到每个孔中,再孵育4小时。
122.4.小心地除去培养基,并向每个孔中加入100μl的二甲基亚砜。
123.5.用酶标仪在490nm波长下测量吸光值,并计算细胞存活率。
124.(6)fluc环状mrna递送系统纳米材料与细胞转染后的fluc荧光素酶表达测试:
125.详细的实施方式和具体的操作过程如下:
126.1.将100μl的细胞(1
×
105个细胞/毫升)接种在96孔板中,并培养24小时。
127.2.将培养基替换为100μl的dmem培养基或含有fluc环状mrna递送系统纳米材料的100μl的dmem培养基,再孵育24小时。
128.3.小心地除去培养基,并向每个孔中加入100μl的荧光素酶底物,孵育5-10分钟。
129.5.用酶标仪测量生物自发光强度,以步骤(3)中接受dmem孵育的细胞所得到的生物自发光强度为参照,计算fluc荧光素酶表达变化。
130.本发明实施例的一个方面提供了一种用于递送环状mrna的聚合物-脂质杂化递送系统的制备方法,下面结合若干优选实施例及附图对本发明的技术方案做进一步详细说明,本实施例在以发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
131.下面所用的实施例中所采用的实验材料,如无特殊说明,均可由常规的生化试剂公司购买得到。
132.实施例1:
133.(1)阳离子分子的制备:将1mmol的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的1,2-环氧辛烷(cas号:2984-50-1)加入20ml 玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
134.反应结束后,玻璃样品瓶中加入甲醇,稀释反应产物,将反应产物转移至截留分子量为1000da的透析袋中。透析溶液为n,n-二甲基甲酰胺和乙醇的混合溶液(n,n-二甲基甲酰胺:乙醇为8:2,%v/v)。上述溶液透析2天,第1天用n,n-二甲基甲酰胺和乙醇的混合溶液,以移除未反应的1,2-环氧辛烷,第2天用水透析以移除有机溶剂。
135.上述透析液通过冷冻干燥得到阳离子分子。
136.(2)阳离子分子缓冲液的制备:将2.5mg的步骤(1)中的阳离子分子溶于1ml的 n,n-二甲基甲酰胺溶剂中,制备浓度为2.5mg/ml的阳离子分子溶液,得到a液。将6.5μl 的阳离子分子溶液与6.5μl的柠檬酸盐缓冲液(ph=3.0)混合,形成阳离子分子缓冲液,得到b液。
137.(3)阳离子分子-环状mrna复合物的制备:将上述13μl的阳离子分子缓冲液与2.5μl 的浓度为1μg/μl的环状mrna(如egfp环状mrna或fluc环状mrna等)混合,静置15 分钟,形成阳离子分子-环状mrna聚合物,得到c液。
138.(4)阳离子分子-环状mrna-聚合物复合物的制备:将上述15.5μl的阳离子分子
‑ꢀ
环状mrna复合物与15μl的聚乳酸-羟基乙酸共聚物(5mg/ml)混合,形成阳离子分子
‑ꢀ
环状mrna-聚合物复合物,得到d液。
139.(5)阳离子分子-环状mrna-聚合物-生物相容性修饰分子复合物(环状mrna的聚合物-脂质杂化递送系统)的制备:将0.125mg的二硬脂酰基磷脂酰乙醇胺-聚乙二醇溶于 1.25ml水中,制备浓度为0.1mg/ml的生物相容性修饰分子溶液,得到e液。
140.将d液加入e液中,800rpm的搅拌速度下反应30分钟,获得递送环状mrna的聚合物-脂质杂化递送系统的水分散液。
141.结果及性能表征:
142.图1是实施例1的主要制备过程示意图。从图1可以确认本发明的核心技术,主要包括利用聚合物分子稳定环状mrna-阳离子分子复合物,使用生物相容性修饰分子将环状 mrna-阳离子分子-聚合物复合物进行修饰,得到所述的含有环状mrna的聚合物-脂质杂化递送系统。
143.图2是实施例1所得的环状mrna递送系统纳米材料的tem结果。从图2中可以确认制备的mrna的聚合物-脂质杂化递送系统的平均粒径在120nm左右,形貌为类球形结构。
144.图3是实施例1所得的环状mrna递送系统纳米材料的细胞毒性测试结果。从图3中可以确认所制备的递送环状mrna的聚合物-脂质杂化递送系统对细胞活性影响小,具有良好的生物相容性。
145.图4是实施例1所得的细胞与egfp环状mrna的聚合物-脂质杂化递送系统孵育后的激光共聚焦结果;其中,图4为空载聚合物-脂质杂化递送系统和包封egfp环状mrna递送系统纳米材料与细胞孵育后,对egfp蛋白进行激光共聚焦拍摄;
146.从图4可以看出,空载递送系统纳米材料与细胞孵育后,激光共聚焦显微镜下无egfp 蛋白的绿色荧光表达。包封egfp环状mrna递送系统纳米材料与细胞孵育后,可以观察
到显著的egfp蛋白绿色荧光信号。因此,本实施例制备的聚合物-脂质杂化递送系统可以高效递送egfp环状mrna,促进egfp环状mrna在细胞内的转染和有效表达。
147.图5是实施例1所得的fluc环状mrna递送系统纳米材料的细胞转染结果。从图5 可以看出,空载递送系统纳米材料与细胞孵育后,酶标仪测量下无fluc蛋白的自发荧光的表达。而包封fluc环状mrna递送系统纳米材料与细胞孵育后,可以观察到显著的fluc 蛋白的自发荧光信号。因此,本实施例制备的聚合物-脂质杂化递送系统可以高效递送 fluc环状mrna,促进fluc环状mrna在细胞内的转染和有效表达。
148.图6是实施例1所得的fluc环状mrna递送系统纳米材料的体内表达结果。图中统计了环状fluc与线性fluc的体内表达结果,小鼠左下肢与右下肢皮下组织注射聚合物
‑ꢀ
脂质杂化递送系统包封fluc线性或环状mrna,(小鼠左右下肢所注射的聚合物-脂质杂化递送系统中,所包封的fluc线性mrna和fluc环状mrna为同等质量)。
149.从图6可以看出,本实施例制备的聚合物-脂质杂化递送系统可以高效并显著延长体内递送fluc环状mrna,促进fluc环状mrna在体内转染和有效表达。此外,也证实在聚合物-脂质杂化递送系统的递送前提下,fluc环状mrna相较于fluc线性mrna所表达的时间更持久,显著延长了体内的表达持续时间。
150.实施例2
151.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和18mmol 的1,2-环氧辛烷(cas号:2984-50-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
152.实施例2所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
153.实施例3
154.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,2.0代甲醇溶液(cas号:93376-66-0)和32mmol的 1,2-环氧辛烷(cas号:2984-50-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴 90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
155.实施例3所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
156.实施例4
157.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,3.0代甲醇溶液(cas号:153891-46-4)和64mmol 的1,2-环氧辛烷(cas号:2984-50-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
158.实施例4所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
159.实施例5
160.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,4.0代甲醇溶液(cas号:163442-67-9)和128mmol 的1,2-环氧辛烷(cas号:2984-50-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
161.实施例5所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
162.实施例6
163.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.5代甲醇溶液(cas号:202009-64-1)和25mmol 的1,2-环氧辛烷(cas号:2984-50-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
164.实施例6所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
165.实施例7
166.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的 1,2-环氧己烷(cas号:1436-34-6)加入20ml玻璃样品瓶中,形成混合反应液,在油浴 90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
167.实施例7所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
168.实施例8
169.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的 1,2-环氧十二烷(cas号:2855-19-8)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
170.实施例8所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
171.实施例9
172.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的 1,2-环氧戊烷(cas号:1003-14-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴 90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
173.实施例9所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达
相应的蛋白。
174.实施例10
175.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的 1,2-环氧丁烷(cas号:106-88-7)加入20ml玻璃样品瓶中,形成混合反应液,在油浴 90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
176.实施例10所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
177.实施例11
178.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的1,2-环氧十六烷(cas号:7320-37-8)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
179.实施例11所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
180.实施例12
181.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,0.0代甲醇溶液(cas号:155773-72-1)和9mmol的 1,2-环氧十四烷(cas号:3234-28-4)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
182.实施例12所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
183.实施例13
184.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧己烷(cas号:1436-34-6)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
185.实施例13所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
186.实施例14
187.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧十二烷(cas号:2855-19-8)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
188.实施例14所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
189.实施例15
190.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧戊烷(cas号:1003-14-1)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
191.实施例15所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
192.实施例16
193.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧丁烷(cas号:106-88-7)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
194.实施例16所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
195.实施例17
196.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧十六烷(cas号:7320-37-8)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
197.实施例17所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
198.实施例18
199.与实施例1相比,区别仅在于实施例1中的步骤(1)阳离子分子的制备:将1mmol 的pamam树枝状聚合物,乙二胺核,1.0代甲醇溶液(cas号:142986-44-5)和9mmol 的1,2-环氧十四烷(cas号:3234-28-4)加入20ml玻璃样品瓶中,形成混合反应液,在油浴90℃和800rpm的搅拌速度下敞开玻璃样品瓶口反应3小时,让甲醇挥发。之后拧紧玻璃样品瓶瓶塞,继续在油浴90℃和800rpm的搅拌速度下反应48小时。
200.实施例18所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
201.实施例19
202.与实施例1相比,区别仅在于实施例1中的步骤(2)阳离子分子缓冲液的制备:将 2.5mg的步骤(1)中的阳离子分子溶于1ml的n,n-二甲基甲酰胺溶剂中,制备浓度为 2.5mg/ml的阳离子分子溶液,得到a液。将6.5μl的阳离子分子溶液与6.5μl的柠檬酸盐缓冲液(ph=4.0)混合,形成阳离子分子缓冲液,得到b液。
203.实施例19所制备的环状mrna聚合物-脂质杂化递送系统可高效转染环状mrna,表达相应的蛋白。
204.此外,本案发明人还参照前述实施例,以本说明书述及的其它原料、工艺操作、工艺条件进行了试验,并均获得了较为理想的结果。
205.本发明的各方面、实施例、特征及实例应视为在所有方面为说明性的且不打算限制本发明,本发明的范围仅由权利要求书界定。在不背离所主张的本发明的精神及范围的情况下,所属领域的技术人员将明了其它实施例、修改及使用。
206.在本发明案中标题及章节的使用不意味着限制本发明;每一章节可应用于本发明的任何方面、实施例或特征。
207.在本发明案通篇中,在将组合物描述为具有、包含或包括特定组份之处或者在将过程描述为具有、包含或包括特定过程步骤之处,预期本发明教示的组合物也基本上由所叙述组份组成或由所叙述组份组成,且本发明教示的过程也基本上由所叙述过程步骤组成或由所叙述过程步骤组组成。
208.应理解,各步骤的次序或执行特定动作的次序并非十分重要,只要本发明教示保持可操作即可。此外,可同时进行两个或两个以上步骤或动作。
209.以上所述,仅为本发明的较佳实施例,并非对本发明作任何形式上和实质上的限制,凡熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用以上所揭示的技术内容,而作出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对以上实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1