酒精性肝损伤用化合物、制法、组合物、饮食品及用途的制作方法
1.本发明涉及医药领域,特别涉及酒精性肝损伤的药物和饮食品。
背景技术:
2.肝脏是人体最大的消化腺,也是人体最大的解毒器官。中国是饮酒大国,也是肝病大国。
3.酒精被广泛认为具有肝脏毒害作用。酒精性肝损伤是指长期大量饮酒或含有乙醇饮料造成的肝脏疾患,包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、轻症酒精性肝病、酒精性肝硬化等。酒精性肝损伤通常开始于酒精性脂肪肝(afl),其特征是肝脏脂肪变性(甘油三酯在肝细胞中积聚)。一些人会进展并发展成肝脏炎症、肝细胞损伤和气球,这在组织学上被定义为酒精性脂肪性肝炎(ash)。ash进展缓慢,持续的慢性肝损伤和炎症最终导致进行性纤维化和肝硬化,最终可能导致肝细胞癌(hcc)的发展。
4.近20几年来,相对于乙肝疫苗普及、抗病毒药物应用带来新发病毒性肝炎病例的递减,我国国民生活质量的提高直接造成了酒精滥用,最终导致酒精性肝病(alcoholic liver disease,ald)在我国发病率的迅速增加。据gao b等2011年的调查研究发现,在重度饮酒者中,约90%(酒精摄入多于60克/天)呈现脂肪肝,10%~35%会发展成酒精性肝炎,5%~15%会发展为肝硬化。美国niaaa/nih调查显示仅2007年死于肝硬化患者中就已有48%和酒精相关。我国近二十多年来饮酒死亡人数上升达到每年死亡总人数的30.2%。2013年全年饮酒致死者高达59万人,一半以上为男性。
5.已有大量的保肝护肝的保健品/食品,用于在饮酒期间或之后缓解酒精对肝脏的毒性。这类产品通常包括抗氧化剂、微量矿物质、传统的护肝药物/食物等等。
6.对于已经形成的酒精性肝损伤仍缺乏新颖且方便施用(如口服)的用于预防、缓解或治疗的有效药物。对于可能造成酒精性肝损伤的饮食品还需要更有效预防或缓解酒精引起的肝损伤的相关产品。
技术实现要素:
7.有鉴于此,本发明的主要目的在于提供一种能够有效预防、缓解或治疗酒精性肝损伤的化合物。所述化合物易于制备,且具有口服活性,对于酒精性肝损伤有显著的效果。本发明进一步的目的在于提供该化合物的制备方法和包含该化合物的药物组合物或饮食品,以及所述化合物、药物组合及饮食品的用途。
8.为此,本技术的第一方面提供一种具有以下通式i的化合物:
9.[m(a)2]
·
nb
ꢀꢀꢀ(i)[0010]
其中,m为选自cu、fe和zn的二价金属阳离子;
[0011]
a选自谷胱甘肽和谷胱甘肽衍生物,其中所述谷胱甘肽衍生物选自谷胱甘肽中的氨基或羧基中的至少一个被氨基保护基和/或羧基保护基取代;
[0012]
b为一价或二价平衡阴离子;以及
[0013]
n为1或2。
[0014]
根据一种实施方式,b可为硫酸根或卤离子。所述卤离子可为氯离子或溴离子。
[0015]
根据一种实施方式,所述谷胱甘肽和谷胱甘肽衍生物由l型氨基酸形成。
[0016]
具体地,所述的化合物可选自:[zn
2+
(l-gsh)2]
·
so
42-、[zn
2+
(l-gsh)2]
·
2cl-、[cu
2+
(l-gsh)2]
·
so
42-、[cu
2+
(l-gsh)2]
·
2cl-、[fe
2+
(l-gsh)2]
·
so
42-和[fe
2+
(l-gsh)2]
·
2cl-。
[0017]
根据本授权的第二方面,提供上述化合物的制备方法。所述方法包括将a与m的无机盐mbn以a与mbn的摩尔比为2:(1~1.2)的比例在水性溶剂中混合并进行反应的步骤,其中,a、m、b及n如上定义。
[0018]
根据具体实施方式,反应结束后,可通过减压蒸馏获得浓缩液;并进一步纯化获得所述化合物。
[0019]
根据一种具体实施方式,所述二价金属离子m的无机盐mbn可为该金属离子m的氢卤酸盐(如盐酸盐)或硫酸盐。
[0020]
根据一种具体实施方式,所述纯化可包括将所得浓缩液用良溶剂(诸如水)溶解,然后加入不良溶剂(诸如醇)使所述化合物结晶、沉淀。然后将溶液过滤,洗涤沉淀并干燥,可获得所述式(i)的化合物。
[0021]
根据本技术的第三方面,提供一种药物组合物,所述药物组合物包括酒精性肝损伤治疗有效量的上述化合物。
[0022]
根据本发明的第四方面,提供一种饮食品,所述饮食品包括上述化合物中的至少一种。
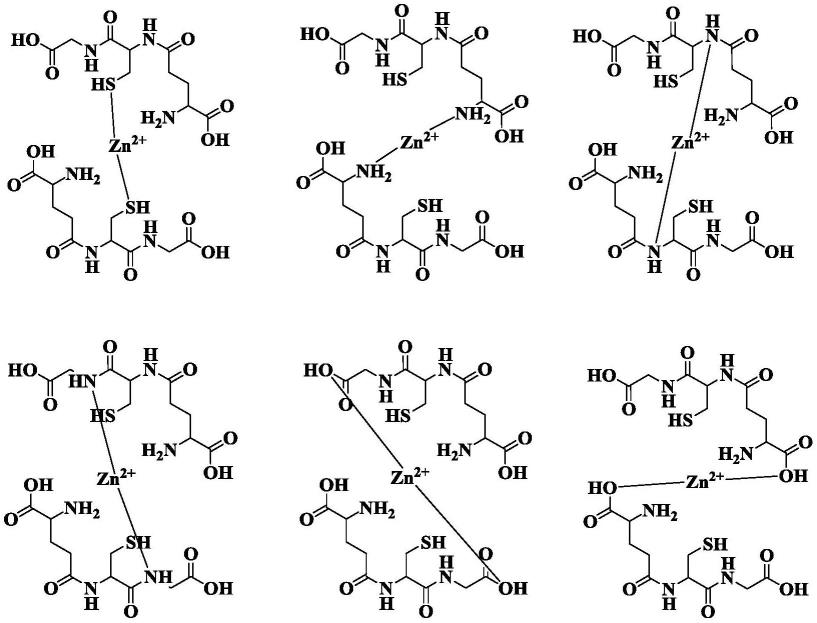
[0023]
所述饮食品为酒。
[0024]
根据一种具体实施方式,所述酒含有0.6~0.8g/l,优选0.7~0.8g/l的上述化合物。
[0025]
根据本发明的第五方面,提供上述化合物、或上述药物组合物在制备预防、缓解或治疗酒精性肝损伤的药物中的用途。
[0026]
通过以下将详述的实施例可知,本发明的基于谷胱甘肽的金属螯合物能够有效减轻酒精性肝损伤。
附图说明
[0027]
图1示出了通过hplc监测实施例1制备l-谷胱甘肽锌螯合物的反应过程中反应体系中反应物和产物的变化;
[0028]
图2示出了l-gsh(a)和实施例1产物(b)的红外谱图示出了l-gsh(a)和实施例1产物(b)的质谱;
[0029]
图3示出了l-gsh(a)和实施例1产物(b)的质谱;
[0030]
图4示出了实施例4中动物分组及处理流程图;
[0031]
图5为实施例3中正常饲养三个月、酒精饲喂三个月和六个月的小鼠经油红o染色的肝脏组织切片的显微镜照片;
[0032]
图6为实施例3中根据正常饲养三个月、酒精饲喂三个月和六个月的小鼠经油红o染色的肝脏组织切片计算的脂质沉积占肝脏总面积的百分比进行统计分析;
[0033]
图7为实施例3中正常饲养三个月、酒精饲喂三个月和六个月的小鼠经he染色的肝
脏组织切片的显微镜照片;
[0034]
图8为实施例4中正常饲养六个月、酒精饲养六个月未干预组和酒精饲喂六个月且后三个月干预组的小鼠的生存情况;
[0035]
图9为实施例4中正常饲养六个月、酒精饲养六个月未干预组和酒精饲喂六个月且后三个月干预组小鼠经油红o染色的肝脏组织切片的显微镜照片;
[0036]
图10为实施例4中根据正常饲养六个月、酒精饲养六个月未干预组和酒精饲喂六个月且后三个月干预组小鼠经油红o染色的肝脏组织切片计算的脂质沉积占肝脏总面积的百分比进行统计分析;
[0037]
图11为实施例4中各组小鼠经he染色的肝脏组织切片的显微镜照片;
[0038]
图12为根据实施例4中正常饲养六个月、酒精饲养六个月未干预组和酒精饲喂六个月且后三个月干预组小鼠肝脏中锌含量的测定结果;
[0039]
图13示出了实施例6中动物分组及处理流程图;
[0040]
图14为实施例6中正常饲料饲喂七个月(正常饮食组)、酒精饲养六个月后正常饲料饲喂一个月(未干预组)、酒精饲养六个月后锌谷胱甘肽饲料饲喂一个月(锌谷胱甘肽干预组)、酒精饲养六个月后锌饲料饲喂一个月(锌干预组)和酒精饲喂六个月且后谷胱甘肽饲料饲喂一个月(谷胱甘肽干预组),小鼠血清中谷丙转氨酶(alt)的检测结果;
[0041]
图15为实施例6中正常饲料饲喂七个月(正常饮食组)、酒精饲养六个月后正常饲料饲喂一个月(未干预组)、酒精饲养六个月后锌谷胱甘肽饲料饲喂一个月(锌谷胱甘肽干预组)、酒精饲养六个月后锌饲料饲喂一个月(锌干预组)和酒精饲喂六个月且后谷胱甘肽饲料饲喂一个月(谷胱甘肽干预组),小鼠经油红o染色的肝脏组织切片的显微镜照片;
[0042]
图16为实施例6中根据正常饲料饲喂七个月(正常饮食组)、酒精饲养六个月后正常饲料饲喂一个月(未干预组)、酒精饲养六个月后锌谷胱甘肽饲料饲喂一个月(锌谷胱甘肽干预组)、酒精饲养六个月后锌饲料饲喂一个月(锌干预组)和酒精饲喂六个月且后谷胱甘肽饲料饲喂一个月(谷胱甘肽干预组),小鼠经油红o染色的肝脏组织切片计算的脂质沉积占肝脏总面积的百分比进行统计分析。
具体实施方式
[0043]
下面将结合本发明实施方式及附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式仅仅是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
[0044]
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
[0045]
需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的方法或者装置不仅包括所明确记载的要素,而且还包括没有明确列出的其他要素,或者是还包括为实施方法或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的方法或者装置中还存在另外的相关要素。
[0046]
为此,本技术的第一方面提供一种具有以下式(i)的化合物:
[0047]
[m(a)2]
·
nb(i)
[0048]
其中,m为选自cu、fe和zn的二价金属阳离子;
[0049]
a选自谷胱甘肽和谷胱甘肽衍生物,其中所述谷胱甘肽衍生物选自谷胱甘肽中的氨基或羧基中的至少一个被氨基保护基和/或羧基保护基取代;
[0050]
b为一价或二价平衡阴离子;以及
[0051]
n为1或2。
[0052]
根据具体实例,m是zn
2+
。
[0053]
本文所述谷胱甘肽(gsh)为l构型(l-gsh),即:n-(n-l-γ-谷氨酰基-l-半胱胺酰基)-甘氨酸,结构式如下:
[0054][0055]
根据一种具体实施方式,所述氨基保护基选自c
1-20
烃基氧羰基、c
1-6
烷酰基、c
1-6
烷基苯磺酰基、c
1-10
烃基酰胺基和c
1-20
烃基,上述基团可选地被至少一种选自卤素、甲氧基、乙氧基、甲基和乙基的取代基所取代。
[0056]
其中烃基可为烷基、芳烷基、烯基等。
[0057]
根据一种更具体实施方式,所述氨基保护基可以是例如选自以下基团中的一种:叔丁基氧羰基(t-boc)、乙氧羰基、甲氧羰基、苄氧羰基(cbz)、2-联苯基-2-丙氧羰基(bpoc)、三苯基甲氧羰基(trt)、9-芴甲氧基羰基(fmoc)、烯丙基氧羰基(alloc)、甲酰基、乙酰基、三氟乙酰基(tfa)、2,2-二甲基丙酰基、对甲苯磺酰基(tosyl)、邻苯二甲酰亚胺基(pht)、甲基、乙基、丙基、叔丁基、异戊基、苄基、三苯甲基(trityl)和对甲氧基苄基(pmb)。
[0058]
优选地,所述氨基保护基可选自叔丁基氧羰基(t-boc)、苄氧羰基(cbz)。
[0059]
根据一种具体实施方式,所述羧基保护基选自c
1-20
烃氧基。
[0060]
其中烃基可为烷基、芳烷基、烯基等。
[0061]
根据一种更具体实施方式,所述羧基保护基可以是例如选自以下基团中的一种:甲氧基、乙氧基、丙氧基、叔丁氧基、苄氧基、9-芴甲氧基。
[0062]
优选地,所述羧基保护基可为甲氧基、乙氧基、叔丁氧基。
[0063]
平衡阴离子示例性地可为硫酸根离子或卤离子。卤离子例如为氯离子、溴离子。平衡阴离子也可以是其他阴离子,只要利于获得所述化合物,且对其应用没有不良作用即可。
[0064]
示例性地,所述的化合物可选自以下具体化合物中:[zn
2+
(l-gsh)2]
·
so
42-、[zn
2+
(l-gsh)2]
·
2cl-、[cu
2+
(l-gsh)2]
·
so
42-、[cu
2+
(l-gsh)2]
·
2cl-、[fe
2+
(l-gsh)2]
·
so
42-和[fe
2+
(l-gsh)2]
·
2cl-。
[0065]
所述化合物在水性溶液中溶解并形成具有式(ii)的螯合物:[m(a)2](ii),其中m和a如上所定义。
[0066]
式(ii)中,二价金属阳离子m与两分子作为螯合剂的谷胱甘肽或谷胱甘肽衍生物a之间形成2~6个配位键,优选地,形成2、4或6个配位键,更优选形成2或4个配位键。所述配位键在金属离子m与巯基、氨基、亚胺基和/或羧基之间形成。
[0067]
以下以锌离子和谷胱甘肽(l-gsh)的螯合物[zn
2+
(l-gsh)2]作为示例,示出所述化合物在水性溶液中的配位结构。
[0068]
二配位结构:
[0069][0070]
三配位结构:
[0071]
[0072][0073]
四配位结构:
[0074]
[0075][0076]
五配位结构:
[0077]
[0078][0079]
六配位结构:
[0080][0081]
应知,铜离子和亚铁离子的谷胱甘肽螯合物可具有上述相同的结构。即,以上所示[zn
2+
(l-gsh)2]结构中的zn
2+
可被cu
2+
或fe
2+
替换。而且以上所示[zn
2+
(l-gsh)2]结构中,谷胱甘肽中的羧基和氨基中未形成配键的一个或多个(如果存在的话)可被以上定义的氨基或羧基保护基所取代。
[0082]
根据本技术的第二方面,提供式(i)化合物的制备方法。所述方法包括将作为螯合
剂的a与二价金属阳离子m的无机盐mbn以a:mbn的摩尔比为2:(1~1.2)的比例在水性溶剂中混合并进行反应的步骤,直至反应液澄明说明反应完全。
[0083]
其中,a、m、b和n如上定义。
[0084]
根据一种具体实施方式,所述二价金属阳离子m的无机盐mbn可为金属离子m的盐酸盐或硫酸盐。
[0085]
根据一种实施方式,所述水性溶剂为水和醇的混合溶剂。更具体地,所述醇为甲醇或乙醇。水和醇的混合比例没有特别限定,可根据谷胱甘肽或其衍生物a和二价金属阳离子的无机盐mbn的溶解度来确定。通常所述醇可以10~90vol%的比例存在于所述混合溶剂中。较优地,所述醇可以20~80vol%、30~70vol%、甚至40~60vol%的比例存在于所述混合溶剂中。
[0086]
所述水性溶剂的用量也没有特别限制,使反应物的总浓度在合适的范围即可。
[0087]
根据一种实施方式,所述反应在温和条件下进行。例如在10℃~60℃的温度下进行。其中当在升高的温度下,如40℃~60℃,进行反应时可加快反应进程,但仍优选在室温下进行。
[0088]
反应时间没有特别限制,观察到溶液变澄明,说明以上定义的螯合物已形成。例如可在室温下持续搅拌5~20小时,如8~12小时。
[0089]
接着,将反应液减压蒸馏,获得浓缩液。进一步将所述浓缩液进行纯化获得所述化合物。
[0090]
根据一种具体实施方式,所述纯化可包括将所得浓缩液用良溶剂(诸如水)溶解,然后加入不良溶剂(诸如醇)使所述化合物结晶、沉淀,然后将沉淀物过滤、洗涤并干燥。
[0091]
其他适宜的纯化方法也可用于所述化合物的制备,本技术对此并无特别限制。
[0092]
根据本技术的第三方面,提供一种药物组合物,所述药物组合物包括治疗有效量的上述化合物。
[0093]
其中,本文所述“治疗有效量”是指对酒精性肝损伤有预防、缓解或治疗作用的所述化合物的量。
[0094]
本技术的药物组合物还可包括诸如赋形剂、溶剂、载体等可药用的添加剂。
[0095]
所述药物组合物可通过诸如口服、胃肠外给药等方式施用于受试者。较优的是通过口服的方式给药。
[0096]
根据本技术的其他方面,还提供一种用于预防、缓解或治疗酒精性肝损伤的上述化合物或上述药物组合物。
[0097]
此外,本技术还提供一种预防、缓解或治疗经受酒精性肝损伤的患者的方法,所述方法包括对所述患者给予治疗有效量的上述化合物或上述药物组合物。
[0098]
根据本技术的第四方面,提供上述化合物或其药学上可接受的盐、或上述药物组合物在制备预防、缓解或治疗酒精性肝损伤的药物中的用途。
[0099]
所述酒精性肝损伤可选自轻症酒精性肝病、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化中的一种。
[0100]
酒精性肝损伤在病理方面区别于非酒精性肝损伤,通常是由于一定的饮酒年限和/或一定的饮酒量所导致,同时还受性别、种族、个体状况、遗传等多种因素影响。受中国传统的酒文化的影响,随物质生活水平的提高,饮酒人群在一般人群中的比例显著增加,患
有酒精性肝损伤的人群数量在我国成逐年上升趋势。
[0101]
酒精性肝损伤根据临床分型可诊断为:轻症酒精性肝病(ma1)、酒精性脂肪肝(afl)、酒精性肝炎(ah)、酒精性肝纤维化(ahf)和酒精性肝硬化(ac)。其中,轻症酒精性肝病(ma1)和酒精性脂肪肝(afl)是程度较轻的酒精性肝。肝纤维化(liver fibrosis或hepatic fibrosis)为细胞外基质蛋白(包括胶原)的过度累积以及后续瘢痕形成过程。酒精性脂肪肝很可能发展为酒精性肝纤维化。随着时间推移,晚期肝纤维化会发展为肝硬化。肝硬化为慢性肝病的最终阶段并且一般长期预后不良且不可逆。一旦发展到肝硬化的阶段,对肝脏的损伤则是不可逆转的。
[0102]
遗憾的是,对于肝纤维化可用治疗选择很少,且通常的治疗仅针对肝硬化的病因和/或缓解肝硬化的症状。例如硫普罗宁(英文名:tipronin,化学名:巯基丙酰甘氨酸)是一种代谢改善解毒剂,主要用于急/慢性肝病的肝功能改善,能全面、明显改善病毒性肝炎、酒精性肝损伤的肝功能指标及有关症状,但毒副作用较大。cn105693577a公开了一种硫普罗宁锌,并声称硫普罗宁和锌具有协同的效果,然而其实施例却证实在相同剂量下,硫普罗宁锌的药效与硫普罗宁基本相同,说明硫普罗宁锌并未取得其声称的协同效果。
[0103]
因此,对于早期和中期肝损伤的预防、缓解和治疗,甚至是治愈就尤为关键和重要。
[0104]
以下详述的实施例证实了本技术的化合物对于酒精诱发的肝损伤小鼠能够有效改善肝脏脂肪沉积,可有效预防、缓解和/或治疗酒精性肝损伤。
[0105]
根据本技术的再一方面,提供一种饮食品,所述饮食品包括式(i)化合物中的至少一种。
[0106]
所述饮食品可为固体或液体形式。尤其地,所述饮食品可为酒。根据一种具体实施方式,所述酒的酒精度小于等于53度。更具体地,所述酒的酒精度为4~53度,如39~53度。酒的类型没有特别限制,可以是任何种类的酒品,尤其优选为白酒。
[0107]
在本技术的化合物中,较优地所述饮食品包含m为锌离子的化合物。
[0108]
根据另一种具体的实施方式,所述饮食品包含选自[zn
2+
(l-gsh)2]
·
so
42-、[zn
2+
(l-gsh)2]
·
2cl-、[cu
2+
(l-gsh)2]
·
so
42-、[cu
2+
(l-gsh)2]
·
2cl-、[fe
2+
(l-gsh)2]
·
so
42-和[fe
2+
(l-gsh)2]
·
2cl-中的至少一种化合物,特别优选地包含[zn
2+
(l-gsh)2]
·
so
42-或[zn
2+
(l-gsh)2]
·
2cl-。
[0109]
根据一种具体实施方式,所述酒中含有06~0.9g/l,优选0.6~0.8g/l,更优选0.7~0.8g/l,特别优选0.75~0.80g/l的式(i)化合物。
[0110]
具体地,所述酒(例如酒精度为53度的白酒)中可含有0.784g/l的式(i)化合物(尤其是[zn
2+
(l-gsh)2]
·
so
42-或[zn
2+
(l-gsh)2]
·
2cl-)。
[0111]
举例来说,含式(i)化合物的酒的制备可将适量的所述化合物加入酒精度小于等于53度的酒中,放置7-14天,使化合物充分与酒融合。
[0112]
根据本技术的又一方面,提供上述式(i)化合物或上述饮食品用于预防和或缓解酒精性肝损伤的用途。
[0113]
以下通过具体实施例来具体说明本技术各方面的优点。
[0114]
实施例1l-谷胱甘肽-锌螯合物[zn
2+
(l-gsh)2]的制备
[0115]
将10g(2eq)的l-谷胱甘肽(l-gsh)溶于100ml的50%乙醇水溶液中,直至完全溶解
再缓慢加入5.6g(1.2eq)znso4·
7h2o,室温下搅拌过夜,直至反应液澄明。从反应开始至反应结束分若干次取少量反应液,通过hplc(安捷伦1260)检测反应物和产物的变化。
[0116]
hplc条件:(乙腈水洗脱,乙腈含量变化(0-5min,5%-100%;5-10min,100%);色谱柱:赛默飞,c18,100
×
46mm,5μm;进样量:20μl)
[0117]
结果如图1所示。从图1可以看出,反应开始时仅可见l-gsh的尖锐单峰(t=7.647)。随时间推移,可以看到单峰变宽,并逐渐看到更大的保留时间处(t=8.190)出现了另外一个峰,说明产物逐步生成。当l-gsh的峰消失,仅剩t=8.190处的峰时,说明反应完全。
[0118]
反应结束后,减压浓缩反应液,得到无色油状物。向浓缩物中加入适量水完全溶解,再加入大量无水乙醇使产物沉淀,然后抽滤,用无水乙醇洗涤沉淀,并真空干燥,获得白色固体粉末状的产物(a),产率70%。采用液质联用方法测定产物(a)纯度为80.0%。
[0119]
按上述相同的方法,区别为用氯化锌替换硫酸锌,同样获得白色固体粉末状的产物(b),产率70%。采用液质联用方法测定产物(b)纯度为84.9%。
[0120]
实施例2实施例1获得的产物的鉴定
[0121]
将实施例1获得的产物(a)、(b)和l-谷胱甘肽纯品(购自:阿达玛斯)进行红外光谱(nicolet 6700,美国热电公司)检测,并将实施例1获得的产物(a)和l-谷胱甘肽纯品进行质谱(lcms 1260-6110,安捷伦)检测,以进一步确定产物结构。结果分别如图2和图3所示。
[0122]
参见图2,其中示出了l-gsh、实施例1产物(a)和(b)的红外谱图。可以看到l-gsh(曲线gsh)和实施例1的两种产物的吸收峰明显不同,而产物(a)(曲线gsh-so
4)
和(b)(曲线gsh-cl)的红外吸收峰的位置和强度均类似。说明以不同的锌盐作为反应物,均获得了结构相同的l-gsh-zn螯合物。
[0123]
进一步参见图3,其中示出了l-gsh(图3中的a)和实施例1产物(a)(图3中的b)的质谱。l-gsh的质谱图显示出m/z为308.2(理论值为:307.33),b是实施例1产物的质谱图,其中显示出最大m/z为679.2([zn
2+
(gsh)2]分子量的理论值为:680.05)。说明实施例1的制备方法生成了[zn
2+
(gsh)2]螯合物,根据反应物可确定产物(a)为硫酸盐zn(gsh)2·
so4。
[0124]
实施例3小鼠酒精性肝损伤模型的建立
[0125]
本实验采用lieber-decarli酒精性脂肪肝造模方法。lieber-decarli饲料购自南通特洛菲饲料科技有限公司。具体方法如下:c57小鼠(购自南通特洛菲饲料科技有限公司trophic animal feed high-tech co.ltd,china,下同)食用正常固体维持饲料在饲养环境适应至少一周后,改为麦芽糖糊精饮食过渡一周,然后饲喂lieber-decarli饲料,饲喂lieber-decarli饲料首周酒精浓度为3%,每周递增0.5%直至达到酒精浓度为5%,持续以含5%酒精的饲料喂养。对c57小鼠用lieber-decarli饲料共饲喂12周建立酒精性肝损伤的模型。
[0126]
按照以下实施例4中的取材及测定方法在建模结束后对正常饲喂的动物和饲喂lieber-decarli酒精饲料的动物的肝脏酒精性脂肪肝形成,对肝脏的脂肪沉积,转氨酶改变,组织形态结构变化,纤维化程度进行检测。
[0127]
其中,对肝脏进行油红o染色可明显看出,lieber-decarli酒精饮食的小鼠肝脏出现明显的脂肪沉积,而正常饮食组的肝脏未见脂肪沉积(参见图5、6)。he染色同样可以看到小泡脂肪变性增加(参见图7)。
初始体重(g)
‑‑
22.78
±
0.5222.93
±
3.73最终体重(g)25.24
±
1.2027.51
±
1.9924.94
±
1.7322.53
±
1.67肝重(g)1.30
±
0.201.35
±
0.381.20
±
0.131.26
±
0.25肝重/最终体重(%)5.16
±
1.024.88
±
1.004.81
±
0.245.62
±
0.80
[0150]
4.2脂肪沉积
[0151]
按照前述造模方法,根据油红o染色结果计算,结果如下图6所示。相对于作为对照的正常饮食组(normal(3m)),采用酒精饲料喂养3个月(etoh(3m))和6个月(未干预组etoh(6m)),小鼠出现明显的脂肪沉积且随着喂养时间增加,脂肪沉积增多。
[0152]
进一步参见图9,在按照前述干预方法,在建模后进行干预的锌/谷胱甘肽组(etoh(6m)/zn(gsh)2(3m)的脂肪沉积相对于未干预组明显改善。
[0153]
根据油红o染色结果计算脂质沉积占肝脏总面积的百分比,结果如下图10所示。由图10可见,在锌复合物的作用下,脂肪沉积的面积显著减少,与未干预组相比具有差异。
[0154]
4.3肝损伤
[0155]
he染色结果如图11所示:在zn(gsh)2·
so4的作用下,与未干预组相比,小泡性脂肪变性显著减少。
[0156]
4.4肝脏中锌含量
[0157]
按上述方法测定了各组小鼠肝脏中锌的量,如果图12所示。由图12可见,未干预组小鼠肝脏的锌含量显著降低,而干预组明显提升肝脏中的锌含量。
[0158]
实施例5制备含谷胱甘肽锌的保健酒
[0159]
将0.392g实施例1制备的谷胱甘肽-锌硫酸盐加入53度500ml白酒中,放置10天充分融合即得成品。
[0160]
以上所述仅为本发明的优选实施方式,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
[0161]
实施例6实施例1产物(a)对酒精性肝损伤的作用
[0162]
分组及处理方法:
[0163]
对30只c57小鼠,适应性饲喂1周后,将动物按照体重随机分入正常饮食组(n=6)和酒精饮食组(n=24)。酒精饮食组按照实施例3的方法以lieber-decarli饲料饲喂24周建立小鼠酒精性肝损伤模型。造模结束后,随机分为4组,分别为未干预组(etoh(6m)+normal(1m),n=6)、锌谷胱甘肽干预组(etoh(6m)+zn(gsh)2(1m),n=6)、锌干预组(etoh(6m)+zn(1m),n=6)、谷胱甘肽干预组(etoh(6m)+gsh(1m),n=6)。将剩余正常饮食组命名为正常组(normal(7m)组,n=5)。详细流程及分组见图13。
[0164]
干预方法:
[0165]
在正常液体饲料中加入不同干预物饲喂1个月,其中锌谷胱甘肽干预组的饲料按1mg zn每10ml饲料的量加入zn(gsh)2·
so4(gsh为9.35mg/10ml),干预一个月;锌干预组的饲料按1mg zn每10ml饲料的量加入znso4;谷胱甘肽干预组的饲料按9.35mggsh每10ml饲料的量加入谷胱甘肽。
[0166]
取材及测定方法:
[0167]
在各组的实验终点对动物进行称重、采血后,取材。
[0168]
采血:眼眶采血。
[0169]
肝脏:动物通过脱颈致死。沿小鼠腹部中线剖开,使腹部暴露后剥离出肝脏。完整剥离肝脏,分离不同叶。
[0170]
肝脏各叶的组织分配:用刀片左叶分成三段,右叶分成两段,其中左叶和右叶第一段用于制作制作病理切片,进行组织学检测;左叶和右叶第二段用于进行锌检测,剩余的左叶第三段存于液氮用于分子检测等分析。
[0171]
血清生化分析:采用比色法对血液样本中的谷丙转氨酶(alt)进行分析。
[0172]
冰冻切片油红o染色:冰冻病理切片用oro染液染色,用苏木素复染核。封片后立即用显微镜观察采图,采用image pro-plus 6.0软件测量oro阳性区域面积,并计算出阳性面积与总面积的比值。
[0173]
数据处理与统计分析:本文中所有实验数据使用graphpad prime6统计分析软件进行分析。两组单因素分析采用student t检验,p《0.05即具有统计学差异。
[0174]
检测结果:
[0175]
4.1谷丙转氨酶(alt)
[0176]
测定方法:收集血液后,采集的全血25℃放置30min,待血液凝固后,3500rpm离心15min,分离血清,及时检测各参数。血清中alt检测均采用试剂盒(南京建成生物工程研究所),按产品说明书进行操作。
[0177]
测定结果如图14所示。
[0178]
酒精处理六个月后的酒精饮食组中,未干预组喂养正常饮食一个月相比于一直喂养正常饲料的正常饮食组小鼠,血清中alt含量由12.03升高至44.84,升高超过2.6倍,提示小鼠肝脏损伤持续存在。而锌谷胱甘肽干预组(8.96)的alt水平相较于未干预组(44.84)有显著的降低,且已经恢复到了正常水平。虽然锌干预组(22.03)与谷胱甘肽干预组(22.86)组的alt水平相较于未干预组组(44.84)的alt水平都有所降低,但是并alt水平未回复到正常水平,且为锌谷胱甘肽干预组约2倍以上。
[0179]
4.2脂肪沉积
[0180]
油红o染色结果如图15所示。相对于作为对照的正常饮食组,未干预组小鼠出现明显的脂肪沉积。
[0181]
根据油红o染色结果计算脂质沉积占肝脏总面积的百分比,结果如下图16所示。锌谷胱甘肽干预组(0.21)的脂肪沉积占比相对于未干预组(0.68)明显改善。锌干预组(0.36)的脂肪沉积占比相较于未干预组(0.68)有改善,但是效果不如锌谷胱甘肽干预组,而谷胱甘肽干预组(0.62)的脂肪沉积占比与未干预组(0.68)相比则没有显著差异。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1