一种ETEC疫苗及其应用
一种etec疫苗及其应用
技术领域
1.本发明涉及疫苗技术领域,尤其涉及一种etec疫苗及其应用。
背景技术:
2.产肠毒素大肠杆菌(enterotoxigenic escherichia coli,etec)是引起幼龄动物,如仔猪、犊牛和羔羊腹泻的病原体之一,给养殖业带来巨大的经济损失。由于大肠杆菌血清型众多,抗原成分极其复杂,各地区流行血清型差异较大,各血清型之间免疫交叉保护效果不理想。目前国内商用的疫苗主要以含k88、k99、987p的全菌为主要成分,疫苗中不仅含有可以提高动物机体免疫原性的成分,还存在与免疫保护无关的成分及内毒素,也导致疫苗的保护效果不佳。因此,提高etec灭活疫苗的保护效果是当下亟需解决的问题。
3.近年来,许多研究发现通过灌胃或注射疫苗佐剂,可以提高机体的免疫应答,提高机体免疫水平。但是目前常用的疫苗佐剂存在一定的毒性,免疫原性弱,安全性较差,所以需要研究一种安全、高效的免疫佐剂对提升细胞免疫应答的水平,能够增强对疫苗组分抗原特异性的免疫应答具有重要意义。
技术实现要素:
4.针对现有etec疫苗保护效果不佳,疫苗佐剂存在一定毒性、疫原性弱,安全性较差等问题,本发明提供一种etec疫苗,能显著提高动物体内的特异性抗体,促进肠道肠道紧密连接蛋白和黏蛋白的表达量,增强肠道的屏障功能,提高机体对etec疫苗的免疫应答。
5.进一步,本发明还提供上述的etec疫苗在促进动物产生特异性抗体中的应用。
6.进一步,本发明还提供上述的etec疫苗在提高紧密连接蛋白和黏蛋白表达量中的应用。
7.为达到上述发明目的,本发明实施例采用了如下的技术方案:
8.一种etec疫苗,包括毕赤酵母。
9.相对于现有技术,本技术提供的etec疫苗具有以下优势:
10.幼龄动物注射etec疫苗后容易导致其腹泻,申请人偶然发现,在注射etec疫苗时,添加毕赤酵母菌液,能显著提升动物体内的特异性抗体,提高机体的免疫应答;还能改善机体的肠道黏膜状态,促进组织结构发育完善,保护机体肠道,进而提升etec疫苗的免疫保护效果。
11.本技术将毕赤酵母添加至etec疫苗中,毕赤酵母可作为灭活疫苗etec的疫苗佐剂,解决了疫苗佐剂存在一定毒性、疫原性弱,安全性较差等问题,并在提高etec疫苗保护效果方面,显示出了极大的应用价值和发展潜力。
12.毕赤酵母(pichia pastoris,p.pastoris)是一种甲基营养型酵母,具有外源基因表达量高、遗传稳定性高、胞外分泌能力强等优点,其含有的葡聚糖和甘露聚糖在增强机体免疫力,改善血脂代谢水平和提高机体抗氧化能力方面均具有良好的效果,这可能是毕赤酵母作为疫苗佐剂具有提高疫苗的应答水平和保护机体肠道的能力的原因。
13.可选的,所述毕赤酵母为活菌株。
14.可选的,所述毕赤酵母为灭活菌株。
15.毕赤酵母活菌与毕赤酵母灭活菌均能高etec灭活疫苗的免疫保护效果和肠道保护功能,其中毕赤酵母活菌的效果更佳。
16.可选的,所述毕赤酵母的菌株含量为0.8
×
109cfu/ml~1.2
×
109cfu/ml。
17.可选的,所述毕赤酵母的菌种编号为gs115。
18.进一步地,本技术还提供上述的etec疫苗在促进动物产生特异性抗体中的应用。
19.包括毕赤酵母的etec疫苗,能显著提高动物体内特异性抗体的水平,有效提高机体对etec疫苗的免疫应答,同时丰富了佐剂的种类,为防治大肠杆菌腹泻提供了新的潜在佐剂。
20.进一步地,本技术还提供上述的etec疫苗在提高紧密连接蛋白和黏蛋白表达量中的应用。
21.包括毕赤酵母的etec疫苗,能有效改善动物机体肠道黏膜形态,促进组织结构发育完善;还可促进肠道紧密连接蛋白mrna表达量,增强肠道的屏障功能。
22.可选的,所述特异性抗体包括iga或igg中的至少一种。
23.可选的,所述紧密连接蛋白包括occludin或zo-1中的至少一种。
24.可选的,所述黏蛋白为muc2。
附图说明
25.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1是本发明实施例提供的小鼠k88ac特异性抗体iga的抗体水平;
27.图2是本发明实施例提供的小鼠k88ac特异性抗体igg的抗体水平;
28.图3是本发明实施例提供的紧密连接蛋白occludin的mrna表达量;
29.图4是本发明实施例提供的紧密连接蛋白zo-1的mrna表达量;
30.图5是本发明实施例提供的黏蛋白muc2的mrna表达量;
31.图6是本发明实施例提供的小鼠肠液中k88ac特异性抗体iga的抗体水平;
32.图7是本发明实施例提供的小鼠小肠组织切片;
33.图8是本发明实施例提供的小鼠脾脏指数;
34.图9是本发明实施例提供的小鼠感染后体重维持百分比;
35.其中,live pichia+v:毕赤酵母活菌+疫苗组;inactivated pichia+v:毕赤酵母灭活菌+疫苗组;pichia rna+v:毕赤酵母核酸+疫苗组;live sc+v:酿酒酵母活菌+疫苗组;v:单独疫苗组;normal saline:生理盐水组。
具体实施方式
36.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于
限定本发明。
37.实施例1
38.1材料与方法
39.1.1菌种与实验动物
40.etec k88ac购自中国兽医微生物菌种保藏中心,菌种编号为c1518。
41.毕赤酵母菌种,菌种编号为gs115;
42.6-8周龄spf级balb/c雌鼠购自北京斯贝福生物科技有限公司
43.1.2主要试剂
44.无水乙醇、异丙醇、甲醛溶液、二甲苯均为分析纯试剂,购自天津市进丰化工有限公司。trizol购自美国invitrogen公司。小鼠大肠杆菌k88ac抗体igg(k88ac igg)elisa试剂盒(货号:mm-45009m1),小鼠大肠杆菌k88ac抗体iga(k88ac iga)elisa试剂盒(货号:mm-45003m1)购自江苏宝莱(酶免)生物科技有限公司;反转录试剂盒hiscript ii 1st strand cdna synthesis kit购自南京诺唯赞生物科技有限公司;iqtm sybr green supermix试剂盒购自美国bio-rad公司;仔猪大肠埃希氏菌病k88、k99、987p三价灭活疫苗购自山东华宏生物工程有限公司;酵母浸出物、胰蛋白胨购自英国oxoid公司;氯化钠购自福晨(天津)化学试剂有限公司;所有引物由上海生工生物工程技术服务有限公司合成。
45.1.3酵母菌液的制备
46.将存于-80℃的冻存毕赤酵母菌液接种在ypd固体培养基上,在培养箱中30℃培养4d。采用灭菌后的接种环挑取单菌落于液体ypd培养基中,摇床225℃过夜。然后取10ml菌液于锥形瓶中,倒入液体ypd培养基250m;,摇床摇菌,当采用nanodrop one测得菌液在600nm处的测得吸光度为2时即可,此菌液为活菌液。取将一部分活菌液分装到另一锥形瓶中,121℃高压灭菌20min,得灭活菌液,当温度降至45℃时,在超净台中酒精灯火焰旁倒入平板,凝固后使用。将活菌液与灭活菌液离心收集菌体,去除上清,在沉淀加入生理盐水进行清洗,离心后再用无菌生理盐水重悬混匀,制成混悬液,分别得到毕赤酵母含菌量为1
×
109cfu/ml的活菌液和灭活菌液。
47.上述固体ypd培养基的制备过程为:在100ml的ypd液体培养基中加入2g琼脂,配成液体后,经过121℃/20min高压灭菌,降温至45℃,倒入平板中倒置凝固,即为固体ypd培养基。
48.酿酒酵母活菌液也通过上述方法得到,且其含菌量也为1
×
109cfu/ml。
49.1.4毕赤酵母rna的提取
50.采用1.3的操作步骤制备毕赤酵母活菌液,离心收集菌体,弃去上清,用液氮预冷研钵及钵棒,用液氮研磨酵母菌体至细腻的粉末得菌粉。取80mg菌粉加入无rnase的离心管中,立即加入1ml trizol,剧烈震荡混匀,室温静置离心取上清。将上清液加入到新的离心管中,加入0.2ml氯仿,漩涡振荡后放置于冰上,离心取上清于离心管中,并加入与上清等体积的异丙醇,颠倒混匀,-20℃放置,离心去除上清。采用体积浓度为75%depc水-乙醇溶液1ml洗涤沉淀,然后离心弃上清;超净台开盖静置数分钟,待乙醇挥发干净;向管中加入适量depc水充分溶解rna至浓度在1000ng/μ~2000ng/μl即可。
51.1.5小鼠免疫及攻菌
52.将72只spf级balb/c雌鼠分为6组,每组12只,分别为毕赤酵母活菌+疫苗组、毕赤
酵母灭活菌+疫苗组,毕赤酵母核酸+疫苗组、酿酒酵母活菌+疫苗组、单独疫苗组以及生理盐水组。小鼠适应7天后进行免疫,每只小鼠肌肉注射0.1ml菌液和etec疫苗的混合液,其中etec灭活疫苗的量为10μl,活菌液或灭活菌液均为90μl;毕赤酵母核酸疫苗组,疫苗剂量为10ul,rna的注射剂量为100μg,其余体积用生理盐水补齐。免疫后15天各组分别取6只进行样品的收集以及各指标的检测。同时将各组剩余小鼠进行攻毒,腹腔注射半数致死量的0.3ml etec k88ac,连续5天观察各组小鼠存活的数量以及体重变化。
53.1.6样品的采集
54.在免疫后第15天,各组取6只小鼠,记录体重,采集血液,离心分离血清,并分装冻于-80℃备用。然后收集小肠组织在液氮中进行速冻,之后转移到-80℃进行保存,后续做rna的提取处理;取一段小肠组织于10%甲醛溶液中浸泡,后续做he染色,此外,记录小鼠脾脏的重量。
55.1.7血清免疫球蛋白的测定
56.收集的血清样品按照酶联免疫elisa试剂盒操作步骤进行操作,测定血清中iga、igg的浓度。检测结果使用spss进行差异显著性分析,运用两个独立样本检验,检测结果p>0.05表示组间差异不显著,p《0.05表示组间差异显著,p《0.01表示组间差异极显著。
57.1.8小肠组织rna的提取
58.称取小鼠小肠组织100mg,加入1ml trizol于玻璃匀浆器中进行研磨,收集匀浆至离心管中,剧烈震荡,离心取上清。向上清液中加入200μl氯仿,涡旋振荡静置,离心取上清置另一无rnase离心管中,并加入与上清液等体积的异丙醇,上下颠倒混匀,在-20℃中静置。然后离心弃上清,加入depc水配制的75%的乙醇,轻弹管壁使沉淀悬浮,静置后离心弃去上清,室温风干至沉淀呈透明,加入适量depc水,使沉淀溶解,使用nanodrop one测rna浓度并将其稀释至1000ng/μl-2000ng/μl,-80℃保存备用。
59.1.9荧光定量pcr(rt-qpcr)
60.rt-qpcr引物根据ncbi上的mrna序列进行设计,将小肠组织的rna进行反转录,步骤按照hiscript ii 1st strand cdna synthesis kit试剂盒。采用sybr green进行扩增,扩增程序为preincubation 95℃/600s;3step amplification 95℃/10s、60℃/10s、72℃/10s,40个循环;melting 95℃/10s、65℃/60s、97℃/1s;cooling 37℃/30s。以β-肌动蛋白基因(β-actin)为内参基因。采用2-δδct法计算各基因的相对转录水平。目的基因和引物的简要描述见表1。
61.表1 rt-qpcr所用引物序列
[0062][0063]
1.10小肠组织石蜡切片及he染色
[0064]
用10%甲醛溶液浸泡小肠组织2周以上,直至组织变白,修整组织块为2mm3~3mm3,先在70%的酒精中过夜,再采用不同梯度的酒精溶液(体积浓度)中进行脱水:80%,2h;85%,1h;90%,1h;95%,1h;100%i,1h;100%ii,30min;酒精/二甲苯(体积比1:1),5min。二甲苯中透明2min,之后于蜡i,65℃,浸蜡1h;蜡ii,70℃,浸蜡30min;将浸蜡好的小肠组织垂直放入蜡盒底部正中进行包埋,放置于冷冻台上过夜,切片机切片5mm,45℃温水展片,捞至载玻片上,做好标记,50℃~60℃烘箱进行烘干,烘干后进行he染色,最后用树胶进行封片,晾干后显微镜观察小肠组织的结构完整性。
[0065]
2结果
[0066]
2.1小鼠k88ac特异性抗体水平
[0067]
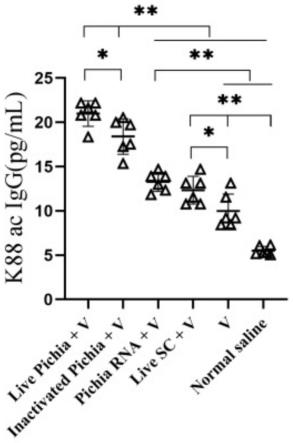
小鼠体内疫苗etec k88ac的特异性抗体iga与igg的抗体水平结果如图1和图2所示。图1和图2中,横坐标:live pichia+v:毕赤酵母活菌+疫苗组;inactivated pichia+v:毕赤酵母灭活菌+疫苗组;pichia rna+v:毕赤酵母核酸+疫苗组;live sc+v:酿酒酵母活菌+疫苗组;v:单独疫苗组;normal saline:生理盐水组。图1和图2的纵坐标分别代表各组小鼠血清中k88ac特异性抗体iga与igg的抗体水平。
[0068]
从图1中可以看出,毕赤酵母活菌疫苗组k88ac iga水平极显著高于其他组;毕赤酵母灭活菌疫苗组与酿酒酵母活菌疫苗组极显著高于单独疫苗组和生理盐水组;毕赤酵母灭活疫苗组显著高于毕赤酵母核酸疫苗组。
[0069]
从图2中可以看出,毕赤酵母活菌疫苗组与毕赤酵母灭活菌疫苗组k88ac igg的水平极显著高于其他四组,且毕赤酵母活菌疫苗组与毕赤酵母灭活菌疫苗组之间差异显著;与生理盐水组相比,添加毕赤酵母核酸与酿酒酵母活菌体均可极显著提高k88ac igg的水平,酿酒酵母活菌疫苗组k88ac igg的水平显著高于疫苗组。
[0070]
从图1和图2可以看出,毕赤酵母活菌体和毕赤酵母灭活菌体均能产生更多特异性抗体,能更有效地提高灭活疫苗的免疫保护效果。
[0071]
2.2小鼠小肠屏障功能
[0072]
小鼠体内的紧密连接蛋白及黏蛋白的表达量的结果如图3~5所示。图3~图5中,横坐标:live pichia+v:毕赤酵母活菌+疫苗组;inactivated pichia+v:毕赤酵母灭活菌+疫苗组;pichia rna+v:毕赤酵母核酸+疫苗组;live sc+v:酿酒酵母活菌+疫苗组;v:单独疫苗组;normal saline:生理盐水组。图3~5的纵坐标分别代表各组小鼠小肠的紧密连接
蛋白occludin、zo-1以及黏蛋白muc2的mrna表达量。
[0073]
从图3~5中可以看出,毕赤酵母活菌与毕赤酵母灭活菌均可极显著提高紧密连接蛋白与黏蛋白的表达量;毕赤酵母活菌疫苗组中紧密连接蛋白occludin与zo-1的表达量显著高于灭活毕赤酵母疫苗组、毕赤酵母核酸疫苗组、酿酒酵母活菌疫苗组、单独疫苗组。毕赤酵母核酸疫苗组的occludin表达组量显著高于生理盐水组;酿酒酵母活菌组、单独疫苗组以及生理盐水组之间差异不显著。由此可知,毕赤酵母活菌与灭活酵母菌均可加增加小鼠紧密连接蛋白及黏蛋白的表达量,都对肠道有保护作用,其中毕赤酵母活菌能更好的提高灭活疫苗的保护效果。
[0074]
小鼠肠液中k88ac特异性抗体iga的抗体水平结果如图6所示,从图6中可以看出,毕赤酵母活菌疫苗中k88ac iga的抗体含量极显著高于其他五组;与生理盐水组相比,添加毕赤酵母活菌、毕赤酵母灭活菌、毕赤酵母核酸以及酿酒酵母活菌后,k88ac iga的抗体含量均有极显著的升高;酿酒酵母活菌的肠液k88ac iga的含量要显著高于单独疫苗组。由此可知,毕赤酵母活菌与毕赤酵母灭活菌均可加提高肠液k88ac iga抗体的水平,都对肠道有保护作用,其中毕赤酵母活菌作用更为明显,能更好的提高灭活疫苗的保护效果,并优于酿酒酵母活菌。
[0075]
2.3毕赤酵母对小肠组织肠道结构及完整性的影响
[0076]
小肠组织的绒毛高度(villus height,vh)、隐窝深度(villus height,cd)以及绒隐比(v/c)的结果如表2所示。从表2中可以看出,毕赤酵母活菌的绒毛高度以及绒隐比极显著高于其他组,隐窝深度较其他组低,由此说明毕赤酵母活菌与毕赤酵母灭活菌均可提高小肠绒毛的高度,对肠道黏膜均起到一定的保护作用,且毕赤酵母活菌保护性更强。
[0077]
表2中:live pichia+v:毕赤酵母活菌+疫苗组;inactivated pichia+v:毕赤酵母灭活菌+疫苗组;pichia rna+v:毕赤酵母核酸+疫苗组;live sc+v:酿酒酵母活菌+疫苗组;v:单独疫苗组;normal saline:生理盐水组。
[0078]
表2小肠绒毛高度、隐窝深度及绒隐比
[0079] vhcdv/clive pichia+v716.25
±
43.47a121.30
±
13.57
cc
5.96
±
0.63ainactivated pichia+v561.77
±
19.96
ba
132.85
±
15.49
bc
4.30
±
0.66bpichia rna+v553.87
±
58.90b147.83
±
25.15
ab
3.82
±
0.64
bacd
live sc+v588.33
±
25.15b174.60
±
21.52a3.12
±
0.45
cbd
v531.12
±
39.17
bb
137.92
±
17.84
bbc
3.91
±
0.56
bcc
normal saline455.08
±
25.14c139.07
±
13.01b3.30
±
0.36
dd
[0080]
注:同列数据肩标不同小写字母表示差异显著(p《0.05),不同大写字母表示差异极显著(p《0.01),相同字母或无字母表示差异不显著(p》0.05)。
[0081]
小鼠小肠组织切片的结果如图7所示,从图7中可以看出,以毕赤酵母为疫苗佐剂,可以增加小肠绒毛的高度,从而保护肠道的完整性。
[0082]
2.4小鼠的脾脏指数
[0083]
各组的小鼠的脾脏指数的结果如图8所示。图8中,横坐标:live pichia+v:毕赤酵母活菌+疫苗组;inactivated pichia+v:毕赤酵母灭活菌+疫苗组;pichia rna+v:毕赤酵母核酸+疫苗组;live sc+v:酿酒酵母活菌+疫苗组;v:单独疫苗组;normal saline:生理盐
水组;纵坐标分别代表各组小鼠的脾脏指数,其中脾脏指数,即小鼠脾脏重量与其自身体重的比值,其反映了机体的免疫水平。脾脏是重要的外周免疫器官,是免疫细胞定居的场所,脾脏指数同样也可以反应免疫力的高低。
[0084]
从图8中可以看出,与单独疫苗和生理盐水组相比,添加毕赤酵母活菌与毕赤酵母灭活菌疫苗可极显著或显著提高脾脏指数;添加毕赤酵母活菌的脾脏指数极显著高于酿酒酵母活菌。由此可知,毕赤酵母活菌和毕赤酵母灭活菌均可以提高小鼠的免疫力,提高小鼠的脾脏指数,两者之中,活酵母菌比灭活酵母菌在提高小鼠机体免疫力上效果更加明显。
[0085]
2.5etec k88ac感染小鼠的体重变化
[0086]
各组小鼠之后连续五天记录体重变化结果如图9所示,从图9中可以看出,各组在感染后第1天体重均有所下降,生理盐水组下降的最为显著,毕赤酵母活菌疫苗组、毕赤酵母灭活菌疫苗组以及毕赤酵母核酸疫苗组在感染后第2天体重均有所上升,且毕赤酵母活菌疫苗组比其他两组体重更高,酿酒酵母活菌疫苗组、单独疫苗组以及生理盐水组第2天体重均呈下降状态;各组从感染第3天体重缓慢上升;在第5天,毕赤酵母活菌疫苗组、毕赤酵母灭活菌疫苗组以及毕赤酵母核酸疫苗组小鼠体重无显著差异。由此可知,赤酵母活菌和赤酵母灭活菌能维持etec k88ac感染后小鼠的体重。
[0087]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1