一种叶酸受体靶向的大分子钆肿瘤磁共振造影剂及其制备方法与应用
gd,(b)dtpa和(c)cs-dtpa-gd。
27.图3为实施例1的fa-cs/cs-dtpa-gd纳米粒的粒径分布(左)和zeta电位(右)图。
28.图4为实施例1制得的fa-cs/cs-dtpa-gd纳米粒的透射电子显微镜照片图。
29.图5为不同浓度的实施例1的dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的mri显影效果图。
30.图6为不同浓度的实施例1的dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的弛豫速率关系图。
31.图7为不同浓度的实施例1的dtpa-gd复合物、cs-dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的细胞毒性结果分析图。其中(a)a549细胞,(b)hela细胞。
32.图8为cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的a549细胞、hela细胞荧光成像结果分析图。其中,(a)和(c)未经游离叶酸阻断叶酸受体;(b)和(d)预先使用1mm游离叶酸阻断叶酸受体。
33.图9为cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的细胞荧光强度值结果分析图。
具体实施方式
34.下面结合实施例及附图对本发明作进一步详细地描述。
35.实施例1:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的制备
36.(1)fa-cs复合物的制备
37.取适量的叶酸,用无水dmso溶解,配制成浓度为20mg/ml的溶液,加入5倍量的碳化二亚胺盐酸盐和n-羟基琥珀酰亚胺,室温下避光搅拌约1h,得到活化后的叶酸溶液。取适量壳聚糖溶解于1%醋酸溶液中,制备5mg/ml壳聚糖溶液,用6m的氢氧化钠溶液调节ph=4.7。边搅拌边缓慢滴加活化后的叶酸溶液,室温避光反应24h后,用naoh调节溶液ph=9.0。使用截留分子量为1000的透析袋,经ph7.4的pbs透析三天,再经二次蒸水透析三天(每天换三次溶液)后,经离心、冷冻干燥后即得淡黄色fa-cs复合物。
38.(2)dtpa-gd复合物的制备
39.分别取2.5mmol的dtpa和六水氯化钆置于圆底烧瓶中,加入20ml纯化水,回流搅拌过夜,过滤,滤液加入三倍体积的丙酮,析出白色沉淀,抽滤,干燥,得到白色的dtpa-gd复合物粉末。
40.(3)cs-dtpa-gd复合物的制备
41.取适量dtpa加入ph4.7的temed/hcl缓冲溶液中,室温下避光搅拌使溶解,之后加入过量的碳化二亚胺盐酸盐和n-羟基琥珀酰亚胺,继续搅拌2h,将dtpa活化,反应过程中控制溶液ph值在3.5-4.5范围内。将活化后的dtpa缓慢滴加到ph4.7的壳聚糖溶液中,室温搅拌72h后,加入过量的六水氯化钆,继续搅拌30min。然后将溶液用截留分子量为1000的透析袋透析3天,每五个小时更换一次双蒸水,经冷冻干燥,得到cs-dtpa-gd复合物。
42.(4)fitc荧光素的标记
43.将适量的步骤(3)制得的cs-dtpa-gd复合物溶于0.5%的醋酸溶液中,然后加入10ml甲醇,再缓慢加入2mg/ml的fitc甲醇溶液,室温暗处反应3h后,用0.2m的naoh沉淀产物,离心,用体积比为7:3的甲醇水溶液洗涤,直至上清液无荧光检出,干燥。
44.(5)fa-cs/cs-dtpa-gd纳米粒的制备
45.取适量的步骤(1)制得的fa-cs复合物和适量的步骤(4)制得的标记有荧光素的cs-dtpa-gd复合物混合,溶解于10ml的1%醋酸溶液中,并用1m的naoh溶液调节ph值为5.0,边搅拌边缓慢滴加tpp溶液,继续搅拌10min,反应完成后,经低温离心、冷冻干燥,得到fa-cs/cs-dtpa-gd纳米粒,即为所述的叶酸受体靶向的大分子钆肿瘤磁共振造影剂。
46.实施例2:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的傅里叶红外光谱表征
47.取实施例1制得的fa-cs复合物、dtpa-gd复合物和cs-dtpa-gd复合物适量,以及cs、fa和dtpa,通过溴化钾压片法,在4000~500cm-1
范围内用ft-ir谱仪测定。
48.cs、fa、fa-cs复合物的ft-ir结果如图1所示。
49.cs(c)1020cm-1
处的峰是c-o-c的典型振动,fa(b)在1694、1606和1484cm-1
处的强吸收峰,分别归因于fa的c=o、蝶啶环氨基和苯环特征吸收峰。fa-cs复合物(a)中原有的叶酸的1694cm-1
消失,由于形成新的酰胺键在1649cm-1
处吸收峰增强。此外,在1603cm-1
处出现一个新峰,这是叶酸盐的典型振动,1504cm-1
处为苯环的特征峰,证实fa-cs复合物成功制备。
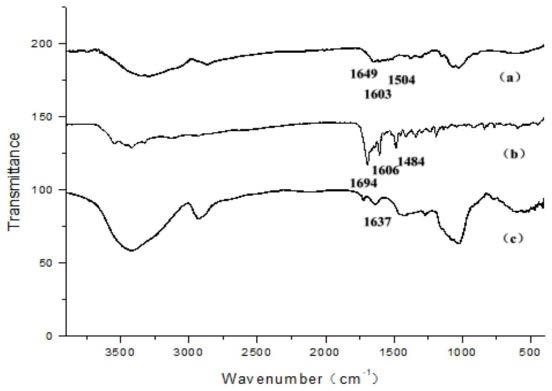
50.dtpa、dtpa-gd复合物、cs-dtpa-gd复合物的ft-ir结果如图2所示。
51.dtpa(b),1733,1697,1633cm-1
处分别为以单体、二聚体和羧酸盐形式下羧基的c=o伸缩振动吸收峰;dtpa-gd复合物(a)在1733,1697,1633cm-1
处峰消失,由于羧基形成配位键出现了1589cm-1
新峰,表明dtpa螯合gd形成新的配位化合物,证明dtpa-gd复合物成功制备;cs-dtpa-gd复合物(c)在1020cm-1
附近由壳聚糖c-o-c的典型振动吸收峰的同时,1576cm-1
dtpa-gd络合物中羧基的吸收峰,证明cs-dtpa-gd复合物成功制备。
52.实施例3:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的粒径和zeta电位表征
53.取实施例1制得的fa-cs/cs-dtpa-gd纳米粒,配制成适宜浓度的溶液,用动态激光散射仪与电位分析仪测定粒径、粒径分布及zeta电位。
54.结果如图3所示,fa-cs/cs-dtpa-gd纳米粒粒径大小分布均匀,分散性良好,平均粒径为120.12
±
1.29nm,pdi为0.154
±
0.02;平均电位为6.61
±
0.24mv,体系较稳定。
55.实施例4:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的透射电镜(tem)表征
56.取实施例1制得的fa-cs/cs-dtpa-gd纳米粒,配制成适宜浓度的溶液,用透射电镜观察纳米粒外观形态。
57.结果如图4所示,fa-cs/cs-dtpa-gd纳米粒外观呈球形或类球形。
58.实施例5:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的gd
3+
浓度测定
59.取实施例1制得的cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒,配制成适宜浓度的溶液,通过电感耦合等离子体发射光谱仪测定纳米粒中gd
3+
的浓度。
60.结果显示实施例1制得的cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒中gd
3+
的浓度分别为178.23mg/l和102.93mg/l。
61.实施例6:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的体外磁性能测试
62.使用磁共振成像仪在t1扫描序列下进行扫描,即固定回波时间(te)为15.5ms,改变重复时间(tr)对不同浓度的实施例1制得的dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒进行扫描,记录弛豫时间(t1)。
63.结果显示实施例1制得的dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd
纳米粒的弛豫速率(r1)分别为为3.0mm-1
·
s-1
、7.8mm-1
·
s-1
和7.5mm-1
·
s-1
,cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒的r1值均比dtpa-gd复合物的高,证明实施例1制得的cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒具有更好的显影效果。显影效果图及弛豫速率关系图如图5,图6所示。
64.实施例7:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的细胞毒性测试
65.对实施例1制得的dtpa-gd复合物、cs-dtpa-gd复合物、cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒进行细胞毒性进行测试,所用细胞为hela细胞和a549细胞,结果如图7所示,所制备的复合物及纳米粒对两种细胞均无明显的细胞毒性。
66.实施例8:叶酸受体靶向的大分子钆肿瘤磁共振造影剂的体外细胞靶向性测试
67.用荧光显微镜观察实施例1制得的cs-dtpa-gd纳米粒和fa-cs/cs-dtpa-gd纳米粒在经或不经叶酸受体饱和的hela细胞和a549细胞的荧光成像情况并通过0.10%的曲拉通x-100将细胞摄取的荧光素溶出,用荧光分光光度计测定荧光强度。
68.结果如图8所示,两种纳米粒对经或不经叶酸受体饱和的a549细胞均呈现较弱的荧光成像。没有叶酸靶向性的cs-dtpa-gd纳米粒对hela细胞所呈现的荧光成像不受叶酸受体是否饱和的影响,呈现几乎相同荧光强度;而fa-cs/cs-dtpa-gd纳米粒对经和未经叶酸受体饱和的hela细胞,分别表现出较不同的荧光强度,未经叶酸受体饱和的样品组荧光强度更强。荧光强度的大小如图9所示,所制备的fa-cs/cs-dtpa-gd纳米粒具有较优异的肿瘤细胞靶向性,能特异性结合过度表达叶酸受体的肿瘤细胞。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1