一种响应型核酸递送系统及其制备方法、交联聚合物载体与流程
1.本发明属于基因治疗技术领域,尤其涉及一种响应型核酸递送系统及其制备方法、交联聚合物载体。
背景技术:
2.基因疗法是通过基因转移技术将外源基因导入受体细胞以治疗由基因缺陷引起的疾病。1968年美国科学家迈克尔
·
布莱泽发表《改变基因缺损:医疗美好前景》,首次提出基因治疗的概念。从此,基因治疗飞速发展,截止2021 年1月,已有约3400项基因治疗临床试验正在开展或者已经完成,并已经在重症联合免疫缺陷症、β-地中海贫血症、先天性黑蒙症等多种遗传病的治疗上取得了令人兴奋的临床试验进展。可以预见,基因治疗在未来将拥有更广阔的应用前景。
3.虽然对基因治疗的研究已经取得了一定成果,但是仍有许多问题制约着基因治疗的发展,其中缺乏有效的基因载体是一个主要的因素。病毒由于具有将遗传物质转移到靶细胞中的能力,因此常被改造用作基因递送载体。但是,有限的核酸携带能力、特异性的缺乏以及不可避免的安全性等问题是病毒载体难以解决的缺陷,因此非病毒载体的构建成为基因递送载体的一大热点。
4.非病毒载体如阳离子聚合物、脂质体、蛋白质和肽等,与阴离子核酸基于静电自组装形成纳米复合物并将其递送到细胞中。虽然非病毒载体规避了病毒载体的毒性与免疫原性等安全问题,但是目前许多报道的非病毒载体的合成过程复杂,且由于它们基于自组装作用包载核酸,组装的复合物易受生物环境中多聚离子影响,因此在体内递送过程中容易在到达靶点前发生结构解离,造成核酸提前泄漏。
5.近年来,交联聚合物纳米载体引起了人们的极大兴趣。交联聚合物是由共价键连接而成的网状聚合物壳。相比传统非病毒载体通过静电作用或疏水作用与核酸进行自组装的方式,在核酸表面共价连接的交联聚合物具有更高的稳定性。制备交联聚合物常用的方法是模板合成,通过纳米模板指导合成大小、形状和结构可控的纳米材料。交联聚合物最常用的模板类型是空化壳交联纳米结构(scns),具有较高的稳定性。生物大分子的原位聚合技术是指在生物分子表面化学修饰或物理吸附功能单体与交联剂后引发聚合反应,合成聚合物-生物分子复合物的过程,省略了传统scns复杂的去核及装载步骤,开创了scns在生物医学应用的新思路,现已发展用于递送小分子rnamir-21以及crispr-cas9复合物,被证明在基因治疗领域具有巨大潜力。但纳米载体通过内吞作用进入肿瘤细胞后,通常会进入溶酶体中降解,因此转染效率较低。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供一种较高稳定性及转染效率的响应型核酸递送系统及其制备方法、交联聚合物载体。
7.本发明提供了一种响应型核酸递送系统,包括核酸与包裹在核酸表面的交联聚合
物;所述交联聚合物由功能单体交联聚合形成;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;
8.所述阳离子聚合单体包括咪唑类单体。
9.优选的,所述阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体的摩尔比为(0.5~5):100:(0.5~5)。
10.优选的,所述阳离子聚合单体中的阳离子与核酸表面的阴离子的比例大于等于40。
11.优选的,所述核酸为寡聚核苷酸和/或dna;所述阳离子聚合单体还包括式(i)所示的丙烯酰胺盐类单体;所述式(i)所示的丙烯酰胺盐类单体与咪唑类单体的摩尔比为1:(0.5~2);
[0012][0013]
其中,r1为取代或未取代的c1~c10的烷基、取代或未取代的c6~c20 的芳基;n为1~10的整数;
[0014]
所述取代的c1~c10的烷基与取代的c6~c20的芳基中的取代基各自独立地选自c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种。
[0015]
优选的,所述咪唑类单体如式(ii)所示:
[0016][0017]
其中,r2为取代或未取代的c2~c10的烯基;
[0018]
所述取代的c1~c10的烯基中的取代基选自c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种。
[0019]
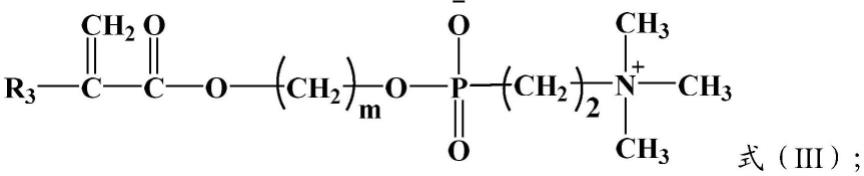
优选的,所述含磷酸胆碱基的单体如式(iii)所示:
[0020][0021]
r3为取代或未取代的c1~c10的烷基、取代或未取代的c6~c20的芳基; m为1~10的整数;
[0022]
所述取代的c1~c10的烷基与取代的c6~c20的芳基中的取代基各自独立地选自c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种。
[0023]
优选的,所述含二硫键的交联单体如式(iv)所示:
[0024][0025]
其中,x与y各自独立地选自1~5的整数。
[0026]
优选的,所述响应型核酸递送系统的水和半径为100~200nm;zeta电位为-6~-7mv。
[0027]
本发明还提供了一种响应型核酸递送系统的制备方法,包括:
[0028]
将核酸、功能单体与水混合,在保护气氛及低温的条件下静置,然后加入引发剂,进行交联聚合,得到响应型核酸递送系统;
[0029]
所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;
[0030]
所述阳离子聚合单体包括咪唑类单体。
[0031]
本发明还提供了一种交联聚合物纳米载体,所述交联聚合物纳米载体由功能单体交联聚合形成;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;
[0032]
所述阳离子聚合单体包括咪唑类单体。
[0033]
本发明提供了一种响应型核酸递送系统,包括核酸与包裹在核酸表面的交联聚合物;所述交联聚合物由功能单体交联聚合形成;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;所述阳离子聚合单体包括咪唑类单体。与现有技术相比,本发明在核酸表面包覆交联聚合物作为载体,不仅具有较高的稳定性,在被细胞摄取后,可在溶酶体酸性环境内通过咪唑基团质子海绵效应破坏溶酶体,实现溶酶体逃逸,在转移至细胞质后,载体还可以响应肿瘤细胞内高gsh环境,裂解网状聚合物壳,实现核酸的释放,不仅提高了核酸递送系统对gsh的响应及释放核酸的能力,还提高了其细胞摄取与转染效率。
[0034]
实验结果表明,本发明提供的响应型核酸递送系统的平均水合半径约135 nm,ζ电位约-6.5mv,显微形貌近似球形。该响应型核酸递送系统可在10 mg/ml肝素环境中保持结构稳定性,具有响应细胞内gsh,触发释放包载核酸分子的功能。细胞实验证明该响应型核酸递送系统细胞毒性低,细胞摄取、转染能力强。综上所述,基于原位聚合技术制备响应型核酸递送系统在基因递送领域具有重要应用前景,为新型基因递送载体的开发提供了新的思路。
[0035]
附图说明
[0036]
图1为本发明提供的响应型核酸递送系统的合成及在细胞内环境响应释放核酸的示意图;
[0037]
图2为本发明实施例及比较例中不同n/p合成nc的凝胶电泳分析图;
[0038]
图3为本发明实施例及比较例中nc(ss)
40
粒径分析结果:nc(ss)
40
的dls 流体动力学直径(a)及nc(ss)
40
的tem微观形貌图(b);
[0039]
图4为本发明实施例及比较例中肝素处理后non-nc
40
(a)与nc(ss)
40
(b) 的凝胶电泳分析图;
[0040]
图5a为本发明实施例及比较例中n,n
’‑
双(丙稀酰)胱胺的化学结构式;
[0041]
图5b为本发明实施例及比较例中n,n
’‑
亚甲基双丙烯酰的化学结构式;
[0042]
图5c为两种负载pdna的复合物经过各种dtt和肝素处理后的凝胶电泳分析图;
[0043]
图6为本发明实施例及比较例中不同浓度nc(ss)
40
处理下mcf-7细胞的细胞存活率柱形图;
[0044]
图7为本发明实施例及比较例中alexa-nc(ss)
40
在mcf-7细胞中的共聚焦荧光成像照片;
[0045]
图8为本发明实施例及比较例中nc(cag-luc)
40
在mcf-7细胞中表达荧光素酶分析结果图。
具体实施方式
[0046]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0047]
本发明提供了一种交联聚合物纳米载体,所述交联聚合物纳米载体由功能单体交联聚合形成;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;
[0048]
所述阳离子聚合单体包括咪唑类单体。
[0049]
在本发明,优选的,所述阳离子聚合单体还包括式(i)所示的丙烯酰胺盐类单体;
[0050][0051]
其中,r1为取代或未取代的c1~c10的烷基、取代或未取代的c6~c20 的芳基,优选为取代或未取代的c1~c8的烷基、取代或未取代的c6~c15的芳基,更优选为取代或未取代的c1~c6的烷基、取代或未取代的c6~c10的芳基,再优选为取代或未取代的c1~c4的烷基、取代或未取代的c6~c10的芳基,最优选为取代或未取代的c1~c2的烷基、取代或未取代的苯基;n为 1~10的整数,优选为2~8的整数,更优选为2~6的整数,再优选为3~5的整数,最优选为3或4。
[0052]
所述取代的c1~c10的烷基与取代的c6~c20的芳基中的取代基各自独立地为c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种,优选为c1~c3 的烷基、c6~c10的芳基与卤素中的一种或多种,更优选为c1~c2的烷基、 c6~c8的芳基与卤素中的一种或多种;所述卤素优选为f、cl或br。
[0053]
所述式(i)所示的丙烯酰胺盐类单体与咪唑类单体的摩尔比优选为1: (0.5~2),更优选为1:(0.8~1.5),再优选为1:(0.8~1.2),最优选为1: 1。
[0054]
所述咪唑类单体优选为如式(ii)所示;咪唑类单体具备响应胞内溶酶体酸性微环境,可触发质子海绵效应便于复合物的溶酶体逃逸。
[0055][0056]
其中,r2为取代或未取代的c2~c10的烯基,优选为取代或未取代的 c2~c8的烯基,再优选为取代或未取代的c2~c6的烯基,再优选为c2~c4 的烯基,最优选为c2~c3的烯基。
[0057]
所述取代的c1~c10的烯基中的取代基为c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种,优选为c1~c3的烷基、c6~c10的芳基与卤素中的一种或多种,更优选为c1~c2的烷基、c6~c8的芳基与卤素中的一种或多种;所述卤素优选为f、cl或br。
[0058]
在本发明中,所述含磷酸胆碱基的单体优选如式(iii)所示:
[0059][0060]
r3为取代或未取代的c1~c10的烷基、取代或未取代的c6~c20的芳基,优选为取代或未取代的c1~c8的烷基、取代或未取代的c6~c15的芳基,更优选为取代或未取代的c1~c6的烷基、取代或未取代的c6~c10的芳基,再优选为取代或未取代的c1~c4的烷基、取代或未取代的c6~c10的芳基,最优选为取代或未取代的c1~c2的烷基、取代或未取代的苯基;m为1~10的整数,优选为1~8的整数,更优选为1~6的整数,再优选为1~5的整数,最优选为2或3。
[0061]
所述取代的c1~c10的烷基与取代的c6~c20的芳基中的取代基各自独立地为c1~c5的烷基、c6~c15的芳基与卤素中的一种或多种,优选为c1~c3 的烷基、c6~c10的芳基与卤素中的一种或多种,更优选为c1~c2的烷基、 c6~c8的芳基与卤素中的一种或多种;所述卤素优选为f、cl或br。
[0062]
在本发明中,所述含二硫键的交联单体如式(iv)所示;含二硫键的交联单体的二硫键可以响应胞内高水平的谷胱甘肽(gsh),实现复合物在细胞内部选择性解聚,释放内含pdna。
[0063][0064]
其中,x与y各自独立地为1~5的整数,更优选各自独立地为1~4的整数,再优选各自独立地为2或3。
[0065]
所述交联聚合物纳米载体由上述的功能单体交联聚合形成;上述阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体的摩尔比优选为 (0.5~5):100:(0.5~5),更优选为(1~4):100:(1~4),再优选为(1~3): 100:(1~3),再优选为(1.5~2.5):100:(1.5~2.5),最优选为(2~2.5): 100:(2~2.5);在本发明提供的实施例中,所述阳离
子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体的摩尔比具体为2:100:2.2。
[0066]
本发明还提供了一种响应型核酸递送系统,包括核酸与包裹在核酸表面的交联聚合物;所述交联聚合物由功能单体交联聚合形成;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;所述阳离子聚合单体包括咪唑类单体。
[0067]
其中,所述核酸优选为寡聚核苷酸和/或dna;所述寡聚核苷酸优选包括适配体、sirna;所述dna优选为质粒dna。
[0068]
所述核酸表面包裹有交联聚合物;所述交联聚合物由功能单体交联聚合形成;所述功能单体中的阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体的种类及比例均同上所述,在此不再赘述。所述阳离子聚合单体中的阳离子与核酸表面的阴离子的比例优选大于等于40。
[0069]
本发明提供的响应型核酸递送系统的水和半径优选为100~200nm,更优选为110~160nm,再优选为120~150nm,再优选为130~140nm,最优选为 135nm;zeta电位优(ζ电位)选为-6~-7mv,更优选为-6.5mv。
[0070]
本发明在核酸表面包覆交联聚合物作为载体,不仅具有较高的稳定性,在被细胞摄取后,可在溶酶体酸性环境内通过咪唑基团质子海绵效应破坏溶酶体,实现溶酶体逃逸,在转移至细胞质后,载体还可以响应肿瘤细胞内高 gsh环境,裂解网状聚合物壳,实现核酸的释放,不仅提高了核酸递送系统对gsh的响应及释放核酸的能力,还提高了其细胞摄取与转染效率。
[0071]
本发明还提供了一种响应型核酸递送系统的制备方法,包括:将核酸、功能单体与水混合,在保护气氛及低温的条件下静置,然后加入引发剂,进行交联聚合,得到响应型核酸递送系统;所述功能单体包括阳离子聚合单体、含磷酸胆碱基的单体与含二硫键的交联单体;所述阳离子聚合单体包括咪唑类单体。
[0072]
其中,本发明对所有原料的来源并没有特殊的限制,为市售即可。
[0073]
将核酸、功能单体与水混合;所述核酸与功能单体均同上所述,在此不再赘述;所述水优选为去离子水;混合后体系中核酸的浓度优选为10~100 ng/μl,更优选为20~80ng/μl,再优选为40~60ng/μl,最优选为50ng/μl.
[0074]
然后在保护气氛及低温的条件下静置;所述保护气氛为本领域技术人员熟知的保护气氛即可,并无特殊的限制,本发明中优选为氮气;在本发明中优选用保护气氛除去体系中的氧气以使体系处于保护气氛中;所述除去氧气的时间优选为10~60min,更优选为20~50min,再优选为30~40min;所述低温的温度优选为2℃~8℃,更优选为4℃~6℃;所述静置的时间优选为1~5h,更优选为2~4h,再优选为3h;通过静置可实现单体在核酸周围的原位结合。
[0075]
再加入引发剂,进行交联聚合;所述引发剂为本领域技术人员熟知的引发剂即可,并无特殊的限制,本发明中优选为过硫酸盐与脂肪胺类体系;所述过硫酸盐优选为过硫酸铵;所述脂肪胺优选为四甲基乙二胺;所述引发剂的摩尔量优选为功能单体总质量的0.5%~5%,更优选为1%~3%,再优选为 1%~2%;所述交联聚合的温度优选为2℃~8℃,更优选为4℃~6℃;所述交联聚合的时间优选为6~20h,更优选为8~15h,再优选为8~12h。
[0076]
交联反应后,优选通过透析除去多余单体与游离聚合物链,得到响应型核酸递送系统;在本发明中,透析所用的透析袋优选为800~1200kda的透析袋,更优选为1000kda的
透析袋;所述透析优选在pbs缓冲液中进行;所述 pbs缓冲液的ph值优选为7~8,更优选为7.2~7.6,再优选为7.4。在本发明提供的实施例中,所述pbs缓冲液具体包括:nacl 8g/l,kcl 0.2g/l,kh2po
4 0.27g/l,na2hpo41.42 g/l。
[0077]
本发明基于原位聚合技术,采用特定的功能单体构建了一种响应型核酸递送系统,共价键为载体提供了优异的结构稳定性,从而使核酸递送系统具有较高的稳定性,被细胞摄取后,在溶酶体酸性环境内通过咪唑基团质子海绵效应破坏溶酶体,实现溶酶体逃逸。转移至细胞质后,载体还可以响应肿瘤细胞内高gsh环境,裂解网状聚合物壳,实现核酸的释放。如图1所示,图1为本发明提供的响应型核酸递送系统的合成及在细胞内环境响应释放核酸的示意图。
[0078]
为了进一步说明本发明,以下结合实施例对本发明提供的一种响应型核酸递送系统及其制备方法、交联聚合物载体进行详细描述。
[0079]
以下实施例中所用的试剂均为市售。
[0080]
仪器和试剂
[0081]
试剂
[0082]
n-(3-氨丙基)甲基丙烯酰胺盐酸盐(阿拉丁试剂有限公司,apma);1-乙烯基咪唑(上海易恩化学技术有限公司,vi);2-甲基丙烯酰氧乙基磷酸胆碱 (mpc)(阿拉丁试剂有限公司);n,n
’‑
双(丙稀酰)胱胺(alfa aesar公司,baca);n,n
’‑
亚甲基双丙烯酰胺(阿拉丁试剂有限公司)四甲基乙二胺 (tmeda)(安徽泽升科技有限公司);alexa fluor 647nhs ester(赛默飞世尔科技有限公司);胰蛋白酶、胎牛血清(fbs)、dmem培养基(gibro公司);琼脂糖(bioweste);gel stain核酸染料(全式生物技术有限公司);肝素钠和无内毒素大量质粒提取试剂盒(omega);生物规格pbs缓冲液(zl 1-9062, origene);pdsred2-n1红色荧光蛋白质粒(clontech公司);荧光素酶质粒(武汉淼灵生物科技有限公司);醋酸双氧铀染色液[ua,2%(w/v);榕柏生物技术有限公司];d-虫荧光素钾盐(索莱宝科技有限公司);无水乙醇,二甲基亚砜等实验用有机溶剂均为市售分析纯;实验用水为去离子水;细胞株:mcf-7(中科院上海细胞所细胞库)。
[0083]
仪器
[0084]
纯水仪(milli-q,millipore公司);电子天平(ml204/02,梅特勒-托利多仪器有限公司);磁力搅拌器(ika,ika rct公司);扫描电子显微镜(quanta 450,fei公司);全自动高压灭菌锅(gi54dwz,tomy kogyo公司);多功能读板机mithras lb 940(berthold technologies公司);超净工作台(sw-cj-2fd,苏净安泰airtech公司);co2孵育箱(heracell 150i,赛默飞世尔科技公司);高速冷冻离心机(tgl-16m,卢湘仪离心机仪器有限公司);纳米粒度仪 (zetasizernano zs90,malvern公司);激光共聚焦显微镜(fv-1000,olympus 公司);凝胶成像分析仪(g:box,gene公司);透射电子显微镜[tecnaispirit(120kv),fel公司]。
[0085]
实施例及对比例
[0086]
1)载体设计与合成
[0087]
根据拟合成复合物的n/p在反应瓶中加入相应含量的pdna(红色荧光蛋白质粒或荧光素酶质粒),apma、vi、mpc与baca,单体间摩尔比为: apma:vi:baca:mpc=1:1:2.2:100。补充去离子水使反应体系中 pdna终浓度为50ng/μl。氮气除氧30min,4℃静置3h实现
单体在pdna 周围的原位结合。再加入总单体含量的1%摩尔量的引发剂过硫酸铵(aps) 与四甲基乙二胺(tmeda),4℃反应过夜。选择1000kda的透析袋在ph= 7.4的pbs缓冲液中充分透析除去多余单体与游离聚合物链,得到液体状载体-pdna复合物即为核酸递送系统(pbs缓冲液配制:nacl 8g/l,kcl 0.2g/l, kh2po40.27 g/l,na2hpo41.42 g/l)。
[0088]
2)载体-pdna复合物合成探索
[0089]
分别合成n/p=10、20、30、40的载体-pdna复合物。将这些复合物在 37℃,10mg/ml肝素环境中孵育30min。使用dyy-8c凝胶电泳仪对复合物进行凝胶电泳分析,pdna作为对照。电泳缓冲液为1
×
tae,电泳凝胶为1.0%琼脂糖凝胶(含0.1μg/ml gel stain),在上样前每孔加入适量loading buffer。电泳条件:电压110v,电泳时间40min。电泳结束后用凝胶成像仪系统观察并拍照。
[0090]
复合物粒径测试及tem表征
[0091]
水合粒径:使用zetasizernano zs90纳米粒度仪测量合成复合物的粒径和电位及多分散性指数。
[0092]
tem图像:用去离子水对复合物溶液再次透析,目的是将除去pbs溶剂中能与醋酸双氧铀结合的钠盐。以体积比1:1制备复合物溶液-醋酸双氧铀混合溶液,将铜网浸入溶液中孵育10min,取出铜网放置在滤纸上静置至其表面完全干燥。使用tecnai spirit(120kv)透射电子显微镜观察铜网上的复合物。
[0093]
复合物稳定性研究
[0094]
通过肝素竞争实验验证交联剂对纳米复合物稳定性的增强。在合成复合物的过程中不添加baca,以制备无交联的复合物。将完整复合物与无交联复合物在1、5mg/ml浓度的肝素环境中孵育30min。使用dyy-8c凝胶电泳仪对肝素孵育后的两种纳米复合物进行凝胶电泳分析。加入裸pdna以及未经处理的纳米复合物做对照。
[0095]
复合物gsh响应能力研究
[0096]
用dtt+肝素竞争实验验证交联剂响应gsh断裂的能力。用n,n
’‑
亚甲基双丙烯酰胺制作对照用无gsh响应能力的复合物。将二者在10mm dtt环境中孵育1h,再在10mg/ml肝素37℃环境中孵育30min。使用dyy-8c凝胶电泳仪对dtt与肝素处理过后的纳米复合物进行凝胶电泳分析。加入 pdna、未经处理的纳米复合物以及只有dtt或肝素处理的纳米复合物做对照。
[0097]
复合物细胞毒性研究
[0098]
使用mtt法对载体-pdna复合物的细胞毒性进行分析。以1
×
105个/ml 的密度将mcf-7细胞接种于96孔板(100μl)。在37℃、5%co2的细胞培养箱中孵育24h。弃去旧培养基,然后每孔加入含有不同pdna含量纳米复合物的培养基中,不加药物组为正常对照,不含细胞的对照孔为空白对照,培养24h后,弃掉孔中培养液,每孔加入100μl mtt溶液(0.5mg/ml)继续培养4h,小心吸去培养液并加入二甲基亚砜(100μl/孔)溶解蓝紫色结晶物,稍微振荡,使用酶标仪测定在570nm处的吸光度值(参比波长630nm)。细胞存活率的计算公式:细胞存活率(%)=[(od
样品孔
-od
空白组
)/(od
对照孔
-od
空白组
)]
×
100%。
[0099]
复合物细胞摄取研究
[0100]
使用激光共聚焦显微镜可视化地观察mcf-7细胞对载体-pdna复合物的摄取情况。用alexa 647荧光染料以10μg/ml的浓度与复合物溶液孵育1h,以标记复合物壳上的氨基,
得到荧光标记的复合物。将mcf-7细胞以1
×
105个/ml的密度接种于35mm激光共聚焦专用皿中,放入37℃、5%co2的细胞培养箱中孵育24h。每皿加入100μl荧光标记过的复合物溶液(pdna浓度2.5μg/ml),放入细胞培养箱,继续孵育12h,用pbs清洗2次后,使用 fv-1000激光共聚焦显微镜观察其摄取情况(alexa 647的激发波长为635 nm)。
[0101]
复合物转染能力测试
[0102]
用cag-luc合成载体-pdna复合物。以1
×
105个/ml的密度将mcf-7 细胞接种于24孔培养板上,并在400μl含有10%fbs的dmem中在37℃和5%co2的环境中孵育24h。用400μl新鲜培养基替换培养基,然后添加 20μl复合物溶液(pdna浓度2.5μg/ml)。孵育24h后,将培养基更换为 400μl新鲜dmem,然后再孵育24小时。用400μl pbs洗涤细胞,并在150 μl细胞培养裂解缓冲液中裂解。使用酶标仪评估裂解物的荧光素酶活性。
[0103]
统计学分析
[0104]
统计分析采用originpro(9.5)软件进行单因素方差分析(anova),数据以mean
±
s.d.表示,p<0.05采用“*”表示;p<0.01采用“**”表示。
[0105]
结果与讨论
[0106]
载体-pdna复合物的合成
[0107]
如图1所示,首先选用功能单体n-(3-氨丙基)甲基丙烯酰胺盐酸盐 (apma)、1-乙烯基咪唑(vi)、2-甲基丙烯酰氧乙基磷酸胆碱(mpc)、n,n
’‑
双 (丙稀酰)胱胺(baca)与红色荧光蛋白质粒(rfp)共孵育。其中携带阳离子的apma和vi通过静电作用与pdna结合,mpc、baca通过氢键和范德华力吸引在pdna周围。随后加入引发剂过硫酸铵(aps)与四甲基乙二胺(tmeda)引发各功能单体在pdna表面的原位聚合反应,形成以共价键连接的纳米递送载体(nanocarriers,nc)。其中,vi的质子海绵效应赋予nc 溶酶体逃逸能力,mpc为nc提供良好的生物相容性
[22]
,交联剂baca将各聚合物链连接成网状结构,同时结构中的二硫键能被胞内较高的gsh浓度 (2-10mm)还原断裂,使pdna表面网状交联结构降解,从而有利于包载 pdna的胞内的选择性释放。
[0108]
本发明首先探索了能够成功包载pdna的单体化学计量比,优化单体间摩尔比apma:vi:baca:mpc=1:1:2.2:100。合成过程中,与pdna静电结合的apma与vi的含量影响载体对pdna的结合能力,本发明以两种单体提供的阳离子与核酸表面阴离子的比例(n/p)为变量,合成n/p为10、 20、30、40的nc,并通过琼脂糖凝胶电泳分析不同n/p的nc对pdna的包载情况。结果如图2所示,当n/p为10~30时,pdna条带迁移情况与裸质粒迁移情况相同,证明此时载体并未与pdna紧密结合,以游离pdna的状态迁移出孔;而当n/p达到40时,pdna完全被阻滞在上样孔内,证明此时载体已经完全包载了pdna。基于以上结果,后续研究选取40:1的n/p合成nc进行实验,下文称为nc(ss)
40
。在后续实验过程中通过改变各单体投料合成的不同nc名称与成分如表1所示。
[0109]
表1不同nc的单体组成
[0110][0111]
注:mba是n,n
’‑
亚甲基双丙烯酰胺的缩写,是无法被gsh分解的交联剂。
[0112]
复合物理化性状的表征
[0113]
通过纳米粒度测量仪与透射电子显微镜(tem)分析了nc(ss)
40
的粒径,结果如图3所示。其中动态光散射(dls)测量nc(ss)
40
平均水合半径约135 nm,多分散性指数(pdi)为0.24。而tem图显示nc(ss)
40
呈现出规则的具有纳米尺寸的球状结构,此粒径范围的纳米载体在细胞摄取,防止肾脏代谢以及肝脏积累等方面表现出色。此外,经纳米粒度测量仪检测,pdna的ζ电位约为-36.0mv,nc(ss)
40
的电位则由于交联聚合物对pdna表面阴离子的屏蔽作用而升高为-6.5mv,接近中性的表面电荷使得nc(ss)
40
在具有较低的细胞毒性的同时还拥有较高的细胞摄取能力。
[0114]
复合物结构稳定性试验
[0115]
基因递送系统在体内运输过程中,容易与体内多聚阴离子发生静电结合,这会减弱载体与核酸的静电结合,造成核酸的提前泄漏。在本发明中,baca 作为各聚合物链的交联剂,使各功能单体共价连接形成网状聚合物载体,包覆pdna,极大增强了复合物的稳定性。
[0116]
为了验证交联剂增强复合物稳定性的功能,本发明合成了不含交联剂的 nc,称为non-nc
40
。将non-nc
40
与nc(ss)
40
分别在10mg/ml肝素环境下孵育,肝素携带大量负电荷,会与pdna竞争正电荷载体,影响载体与pdna 的静电结合,对nc的稳定性是一个挑战。通过琼脂糖凝胶电泳分析两者在肝素环境下的稳定性,结果如图4所示。在图4a中,non-nc
40
泳道并未观察到 pdna条带迁移,证明载体完全包载了pdna。而在肝素孵育后的non-nc
40
泳道里观察到与裸pdna完全一致的条带迁移,表明non-nc
40
在肝素环境下载体与pdna完全分离,证明无交联剂的non-nc
40
极易受到环境中阴离子的影响,释放pdna。在图4b中,在肝素环境中的nc(ss)
40
泳道大部分pdna 均未发生明显迁移,只有少许pdna弥散在孔道外,说明nc(ss)
40
在肝素环境中并未仍能保持原结构,交联剂的加入显著增强了纳米复合物的稳定性。
[0117]
复合物响应gsh能力试验
[0118]
交联剂对聚合物链的连接使交联聚合物呈现出共价连接的网状结构,这赋予交联聚合物在复杂环境中保持稳定结构的能力,然而这同时给核酸的胞内释放造成麻烦。在本发明中,baca不仅能作为交联剂增强复合物稳定性,其结构中含有的二硫键还可以被细胞内高浓度的gsh还原,这可以帮助实现载体解聚,促进pdna在细胞内的选择性释放。为了验证baca的二硫键对 gsh的响应能力,本发明用无二硫键的交联剂n,n
’‑
亚甲基双丙烯酰胺(mba,图5b)代替baca(图5a)制备无gsh响应能力的nc,称为nc(cc)
40
。实验中选用10mg/ml的二硫苏糖醇(dtt)模拟细胞水平的gsh,将nc(ss)
40
及nc(cc)
40
纳米复合物与dtt孵育1h后加入10mg/ml肝素继续孵育30min,随后进行琼脂糖凝胶电泳分析,结果如图5c所示,其中泳道分别为:(1) pdna,(2)nc(ss)
40
,(3)nc(cc)
40
,(4)肝素+nc(ss)
40
,(5)肝素+nc(cc)
40
, (6)
dtt+nc(ss)
40
,(7)dtt+nc(cc)
40
,(8)dtt+肝素+nc(ss)
40
,(9)dtt+肝素+nc(cc)
40
。nc(ss)
40
及nc(cc)
40
纳米复合物(2、3泳道)条带被完全阻滞在孔内,说明复合物对pdna包载完好。只用肝素或gsh处理过的nc(ss)
40
及nc(cc)
40
纳米复合物(4~7泳道)有少部分迁移。而nc(ss)
40
在经过dtt 与肝素共同处理后则显示出与裸pdna条带同样的迁移情况(8泳道),不可响应gsh的nc(cc)
40
在同样处理后条带迁移距离相比nc(ss)
40
显著变短(9 泳道)。这表明nc(ss)
40
能够响应gsh断裂二硫键,解聚聚合物壳从而释放出pdna,而不含二硫键的nc(cc)
40
在gsh处理后仍然保持着载体-pdna的稳定结构,从而无法有效释放pdna。这个结果成功验证了baca响应gsh 的能力,说明nc(ss)
40
拥有响应细胞内gsh释放pdna的能力。。
[0119]
复合物的生物相容性
[0120]
良好的生物相容性是基因递送载体的关键性质之一。为了研究nc(ss)
40
的细胞毒性,用红色荧光蛋白重组质粒作为dna模板制备nc(ss)
40
,通过 mtt法测定不同浓度的nc(ss)
40
对mcf-7细胞的细胞毒性(通过dna的含量衡量nc(ss)
40
的浓度)。结果如图6所示,图6为不同浓度nc(ss)
40
处理下 mcf-7细胞的细胞存活率柱形图。由图6可知,在pdna剂量范围0~100μg/ml 内的nc(ss)
40
对细胞均没有明显毒性,即便pdna浓度高达100μg/ml时,细胞仍具有80%以上的存活率。这个结果证明nc(ss)
40
具有良好的生物相容性。
[0121]
复合物的细胞摄取
[0122]
利用激光共聚焦显微镜(clsm)考察nc(ss)
40
在mcf-7细胞中的细胞摄取活性。首先,使用alexa fluor 647nhs ester(alexa 647)标记复合物 nc(ss)
40
,随后再与mcf-7细胞孵育12h。clsm结果如图7所示,图7为 alexa-nc(ss)
40
在mcf-7细胞中的共聚焦荧光成像图。由图7可知,mcf-7 细胞中观察到了alexa-nc(ss)
40
携带的alexa 647荧光,说明nc(ss)
40
成功被细胞摄取。
[0123]
体外基因转染
[0124]
为了考察nc(ss)
40
的转染能力,选择荧光素酶质粒(cag-luc质粒)合成纳米复合物nc(cag-luc)
40
,在mcf-7细胞中评估体外基因转染效率,pbs 与裸cag-luc质粒作为对照。结果如图8所示,图8为nc(cag-luc)
40
在 mcf-7细胞中表达荧光素酶分析结果图。由图8可知,nc(cag-luc)
40
显示出极高的荧光素酶转染效率,证明以原位聚合手段合成的交联聚合物nc(ss)
40
具有优秀的转染能力。
[0125]
结论
[0126]
本发明选用n-(3-氨丙基)甲基丙烯酰胺盐酸盐、1-乙烯基咪唑、2-甲基丙烯酰氧乙基磷酸胆碱(mpc)与n,n
’‑
双(丙稀酰)胱胺作为聚合功能单体,通过原位聚合技术成功制备能够响应多级生物微环境的交联聚合-pdna纳米复合物nc(ss)
40
。该纳米复合物半径平均在135nm左右,ζ电位在-6.5mv左右,并且该复合物拥有高结构稳定性,低细胞毒性,以及细胞内gsh响应能力。经体外实验验证,该复合物具有良好的细胞摄取以及转染能力。本工作为开发安全、高稳定性、多功能的基因递送系统提供了思路。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1