一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药及其制备方法和应用
1.本发明属于生物医药技术领域,具体涉及一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药及其制备方法和应用。
背景技术:
2.传统的纳米药物输送体系大多是将抗癌药物包封在纳米载体内部,利用epr效应将药物输送到肿瘤部位。该方法虽然在一定程度上改善了抗肿瘤的效果,但存在载药率低、药物过早泄露、稳定性差等问题。为此,将两种小分子药物通过刺激响应性化学键链接在一起,制备出两亲性药-药缀合物,构建一种无需任何载体,同时又具有小分子抗癌药物活性和纳米特性的前药纳米给药体系,不仅提高了载药效率,增强了药物的溶解性和稳定性,降低了药物的系统毒性,而且链接的化学键在内部或外部刺激源的作用下,可以响应性地释放出药物,实现对药物的控制释放,提高治疗效果。但是,这种两亲性药-药物缀合物要求两种药物分别是亲水性和疏水性,而大多数抗癌药物都是疏水性药物,这大大限制了两亲性药-药缀合物在癌症治疗领域的应用。因此,使用水溶性大环化合物通过主客体识别作用络合药-药缀合物构建两亲性的主客体络合物,再自组装形成超分子纳米前药,这里的药-药缀合物可以使用两种疏水性抗癌药物,这大大提高了抗癌药物的可选择性,构建不同种类的超分子纳米前药。目前,常用的大环化合物包括环糊精、杯芳烃、葫芦脲、柱芳烃等,但是其制备过程很难精准控制,而且传统的大环化合物难以功能化。此外,为了满足构建超分子纳米前药的要求,主体大环化合物需要有足够大的内腔去络合不同的客体药-药缀合物,这也限制了传统大环化合物在超分子纳米前药中的而应用。
3.文献检索发现,我国南京大学王乐勇课题组在题目《construction of drug-drug conjugate supramolecular nanocarriers based on water-soluble pillar[6]arene for combination chemotherapy》(基于水溶性柱[6]芳烃构建超分子纳米载体用于联合治疗)论文中(wei shao et al.chem.commun.2018,54,9462-9465)基于水溶性柱[6]芳烃构建了一种超分子纳米载体,通过主客体识别作用制备了一种纳米药物,并对其性能以及抗肿瘤联合治疗效果进行研究。但是,上述体系中使用的水溶性柱[6]芳烃制备过程复杂且产率低,大环内腔也较小,可络合的抗癌药物有限。文中,仅使用了化疗药物,通过一种化疗手段,其抗肿瘤效果差,难以达到预期的效果。
技术实现要素:
[0004]
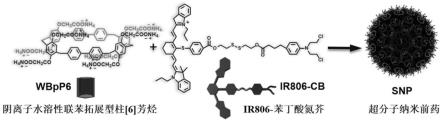
针对现有技术的不足,本发明提供一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药及其制备方法和应用,阴离子水溶性联苯拓展型柱[6]芳烃比传统的水溶性柱[6]芳烃拥有更大的内腔,能通过主客体之别作用络合更多种类的抗癌药物,并且其制备过程更容易控制,产率更高。同时,本发明通过还原响应性的二硫键链接近红外光敏剂ir806和化疗药物苯丁酸氮芥(db),制备了药-药缀合物ir806-苯丁酸氮芥(ir806-db)。通过阴离子
水溶性联苯拓展型柱[6]芳烃与苯丁酸氮芥的主客体识别作用,主体阴离子水溶性联苯拓展型柱[6]芳烃与客体药-药缀合物ir806-苯丁酸氮芥自组装形成超分子纳米前药(snp),用于光动力治疗-光热疗-化疗的三重联合治疗。
[0005]
本发明是通过以下技术方案实现的:
[0006]
一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药,所述超分子纳米前药由阴离子水溶性联苯拓展型柱[6]芳烃和ir806-苯丁酸氮芥制备而成;所述阴离子水溶性联苯拓展型柱[6]芳烃的结构式如下式ⅰ所示:
[0007][0008]
优选地,所述超分子纳米前药的粒径为157.6
±
6.2nm。
[0009]
一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药的制备方法,制备阴离子水溶性联苯拓展型柱[6]芳烃;将ir806-苯丁酸氮芥溶于n,n-二甲基甲酰胺溶剂中,再滴加阴离子水溶性联苯拓展型柱[6]芳烃的去离子水溶液,搅拌后,经透析得到所述超分子纳米前药。
[0010]
优选地,所述阴离子水溶性联苯拓展型柱[6]芳烃的制备过程如下式ⅱ所示:
[0011]
具体为:
[0012]
(1)将3g修饰了8个羟基的联苯拓展型柱[6]芳烃、21g的碳酸钾和50mg的碘化钾于氮气保护下加入300ml乙腈和10ml的2-溴丙酸甲酯,于65℃反应48h;反应结束后抽滤,并将滤液旋干,通过柱层析法提纯得到产物;
[0013]
(2)将1.4g步骤(1)得到的产物和1.5g的氢氧化钠溶于200ml体积比为1:1的去离子水/乙醇的混合溶剂中,于60℃搅拌反应过夜,结束后,反应液冷却沉降,然后进行抽滤得到固体,将固体溶于氨水中,旋干得到产物阴离子水溶性联苯拓展型柱[6]芳烃。
[0014]
优选地,所述ir806-苯丁酸氮芥的浓度为4.2mg/ml,所述阴离子水溶性联苯拓展型柱[6]芳烃的浓度为0.58mg/ml。
[0015]
优选地,所述n,n-二甲基甲酰胺溶剂与去离子水的体积比为1:10。
[0016]
优选地,所述搅拌的方式为:室温搅拌12h。
[0017]
优选地,所述透析的方式为:用分子量300的透析袋,去离子水500ml
×
1次/8h,透
析24h。
[0018]
一种基于阴离子水溶性联苯拓展型柱的超分子纳米前药在制备抗肿瘤药物中的应用。
[0019]
优选地,所述抗肿瘤药物为抗宫颈癌药物。
[0020]
本发明的有益效果如下:
[0021]
(1)本发明高效地合成了一种新型阴离子水溶性大环化合物,阴离子水溶性联苯拓展型柱[6]芳烃比传统的水溶性柱[6]芳烃具有更大的内腔,能络合更多种类的抗癌药物。
[0022]
(2)本发明通过主客体识别作用构建超分子纳米前药,该方法简洁高效。
[0023]
(3)本发明的超分子纳米前药在肿瘤细胞内的酸性环境中,能够快速的解组装,并且在细胞内谷胱甘肽的作用下,响应性释放出化疗药物苯丁酸氮芥。
[0024]
(4)本发明的超分子纳米前药负载的ir806能够在808nm近红外光的照射下使肿瘤部位温度升高,使得肿瘤温度升高死亡,实现光热治疗,同时其能够释放出活性氧(单线态氧),杀死肿瘤细胞,实现光动力学治疗。
[0025]
(5)该光动力治疗-光热疗-化疗三重联合治疗技术操作简单,通过静脉注射,便可实现肿瘤的有效治疗,具有重要的临床应用前景。
[0026]
(6)本发明为制备超分子纳米前药提供了一种简单而有效的途径,为获得具有还原/近红外光双重响应性的光动力治疗-光热疗-化疗三重联合治疗的超分子纳米前药提供了很好的实验平台。
附图说明
[0027]
图1为实施例1中阴离子水溶性联苯拓展型柱[6]芳烃的核磁谱图;
[0028]
图2为实施例2中ir806-苯丁酸氮芥的核磁谱图;
[0029]
图3为实施例3中超分子纳米前药的构建示意图;
[0030]
图4为实施例3中电荷反转型超分子纳米前药的动态光散射图谱和透射电镜图。
[0031]
图5为实施例4中超分子纳米前药对宫颈癌细胞的细胞活性测试结果。
具体实施方式
[0032]
以下结合附图与具体实施例对本发明的技术方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。实施例中采用的实施条件可以根据具体厂家的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
[0033]
实施例1阴离子水溶性联苯拓展型柱[6]芳烃的制备
[0034]
阴离子水溶性联苯拓展型柱[6]芳烃的结构式如下式ⅰ所示:
[0035][0036]
其制备反应式如下式ⅱ所示:
[0037][0038]
具体步骤如下:
[0039]
(1)将3g修饰了8个羟基的联苯拓展型柱[6]芳烃、21g的碳酸钾和50mg的碘化钾于氮气保护下加入300ml乙腈和10ml的2-溴丙酸甲酯,于65℃反应48h。反应结束后抽滤,并将滤液旋干,通过柱层析法提纯得到5.12g产物,产率为83.7%。
[0040]
(2)将1.4g步骤(1)得到的产物和1.5g的氢氧化钠溶于200ml去离子水/乙醇(体积比为1:1)的混合溶剂中,于60℃搅拌反应过夜,结束后,反应液冷却沉降,然后进行抽滤得到固体,将固体溶于氨水中,旋干得到产物阴离子水溶性联苯拓展型柱[6]芳烃0.72g,产率为50.5%。
[0041]
本实施例制得的阴离子水溶性联苯拓展型柱[6]芳烃如图1所示,详细峰位置归属:1h-nmr(400mhz,cdcl3):δ7.44(d,j=8hz,8h),7.17(d,j=8hz,8h),6.83(s,4h),6.66(s,4h),4.24(s,8h),4.15(s,8h),3.92(d,j=8hz,12h).
[0042]
实施例2ir806-苯丁酸氮芥的制备
[0043]
ir806-苯丁酸氮芥的结构式如下式ⅲ所示:
[0044][0045]
其制备反应式如下式ⅳ所示:
[0046][0047]
具体步骤如下:
[0048]
(1)参考已有文献(adv.funct.mater.2021,31,2104473)得到ir806。将18mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、15mg 4-二甲氨基吡啶和100mg ir806加入到10ml二氯甲烷反应4h,得到反应液a。然后将55mg的2-羟乙基二硫化物溶于1ml的二氯甲烷中,并加入到反应液a中,室温反应48h。反应结束后,加入5ml去离子水,分离出有机层并旋干,再用柱层析法进行提纯得到产物97.4mg,产率82.8%。
[0049]
(2)将38mg的苯丁酸氮芥、20mg的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和15mg的4-二甲氨基吡啶加入10ml dcm溶剂搅拌4h,得到反应液b。然后将70mg的步骤(1)得到的产物溶于1ml的二氯甲烷中,并加入到反应液b中,室温反应48h。反应结束后,加入5ml去离子水,分离出有机层并旋干,再用柱层析法进行提纯得到产物ir806-苯丁酸氮芥(ir806-2-羟乙基二硫化物-苯丁酸氮芥)53.4mg,产率76.3%。
[0050]
本实施例制得的ir806-苯丁酸氮芥如图2所示,详细峰位置归属:1h-nmr(400mhz,cdcl3):δ8.60(d,j=12hz,2h,cooph),7.95(d,j=12hz,2h,sph),7.36(t,j=16hz,2h,ch),7.28(t,j=8hz,3h,ch),7.20(t,j=16hz,2h,ch),7.12(d,j=8hz,2h,ch),6.62(d,j=12hz,2h,ch),6.30(d,j=12hz,2h,ch),4.50(t,j=12hz,2h,och2),4.30(t,j=12hz,2h,nch2),4.17(t,j=16hz,4h,ch2),3.70(t,j=12hz,4h,ch2oh),3.61(t,j=12hz,4h,ch2),3.00(t,j=12hz,2h,sch2),2.90(t,j=16hz,2h,och2),2.85(t,j=16hz,4h,ch2),2.54(t,j=16hz,2h,sch2),2.31(t,j=12hz,2h,ch2),2.08(s,2h,ch2),1.90(q,j=20hz,6h,ch2),1.55(s,12h,cch3),1.06(t,j=16hz,6h,ch3).
[0051]
实施例3超分子纳米前药的制备
[0052]
超分子纳米前药的制备方法如图3所示,具体步骤如下:
[0053]
取4.6mg实施例2制得的ir806-2-羟乙基二硫化物-苯丁酸氮芥溶解于1ml的n,n-二甲基甲酰胺中,搅拌12h后,得到反应液c;将5.4mg实施例1制得的阴离子水溶性联苯拓展型柱[6]芳烃溶解在10ml的去离子水中向反应液c中滴加,再搅拌24h。结束后,将溶液置于分子量300的透析袋中,用500ml去离子水透析2天,中间每8小时换一次去离子水,透析结束后,得到超分子纳米前药(snp),收率为86.1%~89.8%。
[0054]
本实施例制得的超分子纳米前药的动态光散射图谱和透射电镜图如图4所示,其流体动力学粒径为157.6
±
6.2nm,pdi为0.26
±
0.03,形貌为均匀的球形囊泡结构。
[0055]
实施例4超分子纳米前药对宫颈癌细胞的影响
[0056]
取实施例3中制备得到的超分子纳米前药(snp)、苯丁酸氮芥和ir806,分别用细胞培养液配制成:苯丁酸氮芥浓度分别为0.05、0.1、0.2、0.5、1、2μg/ml,对应的ir806的浓度分别为0.23、0.46、0.92、2.3、4.6、9.2μg/ml。然后分别跟hela细胞(宫颈癌腺癌)培养48h。
对于超分子纳米前药需要另设一组,加上ir806实验组,需要在加入药物后和细胞共培养4h,再用近红外激光对其进行光照5min(808nm,1.0w/cm2),继续培养48h。最后,采用mtt方法进行细胞活性测试,结果如图5所示。
[0057]
图5中,下横坐标是指苯丁酸氮芥的浓度,上横坐标指ir806的浓度,cb是指单使用苯丁酸氮芥的实验组,ir806+nir是指单用ir806并用近红外光照射的实验组,snp是指单使用超分子纳米前药的实验组,snp+nir是指单用超分子纳米前药并用近红外光照射的实验组。
[0058]
由图5可知,对于其他三个对照组,snp+nir实验组能够产生光动力治疗-光热疗-化疗三重联合治疗效果,因此表现出最高的细胞毒性,这是由于,在近红外光照作用下,组分ir806能够使温度升高,杀死宫颈癌细胞,产生光热疗效果,同时还能产生活性氧,使宫颈癌细胞凋亡,产生光动力治疗效果,并且超分子纳米前药在肿瘤细胞内的酸性环境和谷胱甘肽作用下,能够快速释放出化疗药物苯丁酸氮芥,产生化疗效果,三种抗癌疗法产生协同抗肿瘤效果。
[0059]
上述实例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人是能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1