一种人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒的构建与应用
1.本发明涉及铁复合物纳米粒,具体是人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒的构建与应用。
背景技术:
2.研究表明,金属化合物能够在细胞内建立氧化还原模型使癌细胞产生大量的活性氧(ros),进而引起细胞器损伤和自噬的发生,最终导致癌细胞死亡。然而,如何使金属化合物在肿瘤组织中的癌细胞内产生大量的ros仍然是个难题。这里首先需要解决两个问题:1)如何实现金属化合物在体内对肿瘤细胞的靶向运输;2)如何提高肿瘤细胞内的氧(o2)含量,因为o2在细胞产生ros的过程中起着至关重要的作用,而实体瘤组织致密生长,导致血管远端的肿瘤组织处于乏o2状态。临床上常常使用高压氧(hbo)结合注射阿霉素治疗肿瘤,过高的o2含量有利于肿瘤细胞产生更多的ros,然而这种方法会引起严重的全身性副作用,因为高压氧使肿瘤细胞o2含量升高的同时也会导致全身其他正常细胞o2含量升高。因此,o2在肿瘤细胞内的定点释放策略将有效解决hbo带来的副作用,即如果能够实现癌细胞内的o2定点释放,将会为基于ros机制发展抗肿瘤金属药物提供有力支撑。
3.铁是人体内的必需元素之一,肿瘤细胞比正常细胞代谢更快,需要摄取更多的铁元素。一些铁螯合剂所形成的金属络合物因为其较高的氧化还原活性以及毒理学特性受到许多药物化学家的关注,而这些潜在性质在癌症治疗领域具有重要意义。特别是三价铁(iii)配合物具有较好的氧化还原活性,且其氧化还原电位处于细胞氧化剂与还原剂均可达到的范围内,在细胞内能够构建氧化还原模型,并有效促进细胞内ros的产生。
技术实现要素:
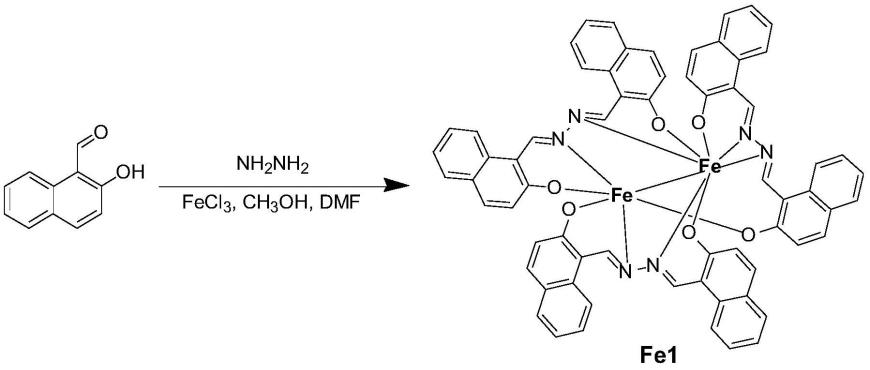
4.为促进癌细胞内大量ros的生成,本发明提出了一种有效的解决方案,既构建一个能够制o2的人血清白蛋白(hsa)纳米粒,并将铁化合物一起包封到纳米粒中。hsa纳米粒通过epr效应聚集在肿瘤组织内,并靶向癌细胞内释放o2和铁化合物,产生大量ros最终导致癌细胞死亡。
5.本发明第一方面,提供一种人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒的构建方法,包括如下步骤:
6.(1)合成铁化合物fe1,其合成路线为:
[0007][0008]
铁化合物fe1的合成方法是:
[0009]
将2-羟基-1-萘甲醛溶于dmf,加入nh2nh2,回流,再加入fecl3,继续回流;回流后过滤,取滤液于一端密闭的玻璃管中,再添加与滤液等量的ch3oh,真空密封后置于烘箱内静置,得到黑色晶体fe1;
[0010]
(2)构建人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒,简称hsa-fe1-o
2 nps,具体步骤为:
[0011]
(2.1)先将含有7.5mg/ml cao2和20,000u/ml过氧化氢酶的6%海藻酸钠溶液在搅拌状态下滴加到cacl2溶液中,形成ca
2+
交联的海藻酸钠颗粒;
[0012]
(2.2)使用0.1n氢氧化钠将溶解于2ml超纯水中40mg的hsa滴定至ph=8.2,然后向混合物中加入海藻酸钠颗粒和20mm/l的fe1,然后在搅拌条件下,逐滴添加乙醇,在去溶剂化过程后,形成纳米颗粒;
[0013]
(2.3)在纳米颗粒中,加入23.5μl 8%的戊二醛,搅拌,使粒子交联,再通过两次离心纯化制备得到hsa-fe1-o
2 nps。
[0014]
进一步地,步骤(1)铁化合物fe1的合成方法中,
[0015]
2-羟基-1-萘甲醛与dmf的摩尔比为1:129.6;
[0016]
2-羟基-1-萘甲醛与nh2nh2和fecl3的摩尔比为1:1:1;
[0017]
加入nh2nh2后,在80℃回流12h,再加入fecl3,继续回流4h;
[0018]
最后,真空密封后置于80℃烘箱内静置24h,得到黑色晶体fe1。
[0019]
进一步地,步骤(2.2)所述搅拌,搅拌机转速为800rpm,逐滴添加乙醇,速率为1ml/min;
[0020]
步骤(2.3)所述离心,离心机转速为12000rpm,离心时间为20min。
[0021]
采用本发明构建方法构建的人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒为球形,平均粒径为116.6nm。
[0022]
本发明第二方面,提供人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒的应用,公开了人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒在制备抗肿瘤药物中的应用,以及在制备肿瘤检测剂中的应用;所述人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒是经过标记的,所述的标记为cy5.5标记。
[0023]
与现有技术相比,本发明的技术方案具有以下优点:
[0024]
(1)临床上常常使用高压氧(hbo)结合注射阿霉素治疗肿瘤,过高的o2含量有利于
肿瘤细胞产生更多的ros,然而这种方法会引起严重的全身性副作用,因为高压氧使肿瘤细胞o2含量升高的同时也会导致全身其他正常细胞o2含量升高。本发明通过hsa包裹ca
2+
交联的海藻酸钠颗粒和铁化合物(fe1),所构建的hsa-fe1-o
2 nps具有在细胞内产生o2的功能,相比于高压氧(hbo)的治疗方式,避免了全身性高o2含量的缺点。hsa-fe1-o
2 nps通过epr效应聚集在肿瘤组织内,将包裹在其中的金属化合物fe1和制o2海藻酸钠颗粒靶向运输至肿瘤细胞,仅仅在癌细胞中产生o2,有效提高了基于ros机制金属化合物的抗肿瘤效果。由于hsa-fe1-o
2 nps能够在肿瘤部位靶向富集,从而特异性地对肿瘤细胞产生杀伤作用而不影响其他正常组织;
[0025]
(2)本发明的hsa、fe1化合物、ca
2+
交联的海藻酸钠颗粒、标记物(如cy5.5)的复合物纳米粒除了更有效杀伤癌细胞以外,还能够实现肿瘤细胞的靶向成像,具体验证了对癌细胞的靶向成像。
附图说明
[0026]
图1为实施例铁化合物fe1的单晶结构图;
[0027]
图2为实施例铁化合物fe1的核磁共振氢谱图;
[0028]
图3为实施例铁化合物fe1的核磁共振碳谱图;
[0029]
图4为实施例构建的hsa-fe1-o
2 nps在癌细胞内制氧及抗肿瘤机制示意图;
[0030]
图5为实施例构建的hsa-fe1-o
2 nps的形貌、粒径、释放情况,以及被癌细胞(sk-n-mc)和人正常细胞(wi38)摄取的情况示意图;
[0031]
其中,图5a为hsa-fe1-o
2 nps的扫描电镜图像;
[0032]
图5b为hsa-fe1-o
2 nps的粒径分布分析图;
[0033]
图5c为hsa-fe1-o
2 nps在模拟癌细胞内环境下的释放情况示意图;
[0034]
图5d为用cy5.5标记的hsa-fe1-o
2 nps被癌细胞(sk-n-mc)摄取的情况示意图;
[0035]
图5e为用cy5.5标记的hsa-fe1-o
2 nps被人正常细胞(wi38)摄取的情况示意图;
[0036]
图6为实施例构建的hsa-fe1-o
2 nps缓解癌细胞内缺氧实验结果对照图;
[0037]
其中,图6a为在常氧或缺氧条件下hsa-fe1-o
2 nps对癌细胞缺氧诱导因子-1α(hif-1α)的影响情况示意图;
[0038]
图6b为图6a的荧光定量分析图;
[0039]
图6c为在常氧或缺氧条件下fe1、hsa-fe1-o
2 nps促使癌细胞产生ros以及诱导癌细胞凋亡的情况示意图;
[0040]
图6d为在常氧或缺氧条件下fe1、hsa-fe1-o
2 nps对癌细胞活力的影响情况示意图。
具体实施方式
[0041]
下面结合实施例和附图对本发明内容作进一步的说明,但不是对本发明的限定。
[0042]
实施例
[0043]
构建人血清白蛋白-2-羟基-1-萘甲醛-铁复合物纳米粒,简称hsa-fe1-o
2 nps,首先合成化合物fe1,其合成路线为:
[0044][0045]
铁化合物fe1的合成方法为:将2-羟基-1-萘甲醛(172mg,1mmol)溶于dmf(10ml,129.6mmol),加入nh2nh2(32mg,1mmol),80℃回流12h,再加入fecl3(162mg,1mmol),继续回流4h;过滤,取2ml滤液于一端密闭的玻璃管中,再添加2ml ch3oh(49.3mmol),真空密封后置于80℃烘箱内静置24h,其单晶结构如图1所示,晶体数据已上传至剑桥晶体数据库,ccdc:2156036。
[0046]
铁化合物fe1的核磁共振氢谱如图2所示,核磁共振碳谱如图3所示,表征为:1h nmr(400mhz,dmso-d6)δ10.53(s,6h),8.46
–
8.44(m,6h),8.11
–
8.08(m,12h),7.86
–
7.80(m,18h).
13
c nmr(101mhz,dmso-d6)δ193.03,137.18,131.78,131.52,130.56,130.28,129.40,129.25,129.11,127.85,124.26。
[0047]
合成的铁化合物fe1的晶体数据,如表1所示:
[0048]
表1铁化合物fe1的晶体数据
[0049][0050]
其次构建hsa-fe1-o
2 nps,具体构建方法如下:先将含有7.5mg/ml cao2和20,000u/ml过氧化氢酶的6%海藻酸钠溶液在搅拌状态下滴加到cacl2(0.18mm)溶液中,形成ca
2+
交联的海藻酸钠颗粒;
[0051]
使用0.1n氢氧化钠(naoh)将溶解于2ml超纯水中的40mg hsa滴定至ph=8.2,然后向混合物中加入海藻酸钠颗粒和fe1(20mm/l),然后在搅拌(800rpm)下以1ml/min的速率逐滴添加8ml乙醇,在去溶剂化过程后,形成纳米颗粒。然后,缓慢加入23.5μl 8%的戊二醛,搅拌24小时,使粒子交联。通过两次离心(12000rpm,20min)纯化制备的纳米颗粒。通过扫描电子显微镜进行形貌分析,使用dls系统测定纳米粒的流体动力学直径。
[0052]
申请人对构建的hsa-fe1-o
2 nps在癌细胞内制氧及抗肿瘤机制进行了实验:
[0053]
申请人假设植入式的制o2纳米粒仅在恶性肿瘤组织供o2并释放药物进而以高度特异性的方式提高fe1对抗恶性肿瘤的细胞毒性,而不增加全身o2含量和金属药物毒性,降低全身性不良反应。这个制o2纳米粒是先将含有氧化钙(cao2)和过氧化氢酶(catalase)的海藻酸钠(alginate)溶液滴加到氯化钙(cacl2)溶液中,形成钙交联的海藻酸钠颗粒(alginate pellets);再将海藻酸钠颗粒滴加到hsa-fe1的混合溶液中,最后交联得到hsa-fe1-o
2 nps。肿瘤组织的间隙比正常组织大,由于增强渗透性和滞留效果(epr效应),hsa-fe1-o
2 nps进入体内后会高度聚集在肿瘤组织中。随后hsa与癌细胞上高表达的sparc蛋白
结合,介导内吞机制将hsa-fe1-o
2 nps摄入癌细胞。在溶酶体酸性环境下,纳米粒内的fe1、cao2和catalase被释放出来,如图4所示。cao2与细胞内水生成氢氧化钙[ca(oh)2]和过氧化氢(h2o2),然后在过氧化氢酶催化下分解形成o2。升高的o2含量有助于fe1促进癌细胞产生过量ros,最终导致更强的细胞毒性。
[0054]
实施例构建的hsa-fe1-o
2 nps的形貌、粒径、释放情况,以及被癌细胞(sk-n-mc)和人正常细胞(wi38)摄取的情况,如图5所示。
[0055]
实施例构建的hsa-fe1-o2nps,其sem图像显示hsa-fe1-o
2 nps为球形,平均粒径为116.6nm,如图5a所示。
[0056]
通过动态光散射(dls)分析hsa-fe1-o
2 nps的完整性和尺寸,发现其平均直径与sem分析结果大致相同,如图5b所示。
[0057]
hsa-fe1-o
2 nps的释放是发挥抗癌作用的关键因素。通过模拟血液循环和癌细胞内的环境来研究hsa-fe1-o
2 nps的释放。用icp-ms测量fe1从hsa-fe1-o
2 nps中的释放量。icp-ms数据显示,在ph值为4.7的缓冲溶液中,大约81%的fe1从hsa-fe1-o
2 nps中释放出来,表明fe1在癌细胞溶酶体酸性环境下是能够有效释放的,如图5c所示。
[0058]
为了研究癌细胞对hsa-fe1-o
2 nps的摄取能力,我们利用cy5.5标记了hsa-fe1-o
2 nps,并与sk-n-mc细胞一起培养1小时、6小时和12小时。在sk-n-mc细胞中观察到大量的cy5.5荧光,如图5d所示,这表明sk-n-mc癌细胞可以有效摄取hsa-fe1-o
2 nps。另外,实验发现,相对于sk-n-mc癌细胞,人正常细胞(wi38)对hsa-fe1-o
2 nps的摄取相对较少,如图5e所示。
[0059]
在常氧条件下,缺氧诱导因子-1α(hif-1α)通过pvhl介导的泛素蛋白体途径降解。在缺氧条件下,hif-1α蛋白逃避蛋白水解并迅速在细胞内积累。如图6a-d所示,在常氧条件下(21%o2),sk-n-mc细胞中没有出现hif-1α的显著积累。然而,暴露于缺氧条件(1%o2)后,sk-n-mc细胞表现出很强的hif-1α染色。当使用hsa-fe1-o
2 nps治疗后,可以清楚地观察到hif-1α的荧光强度呈现剂量依赖性降低,如图6a-b所示。所以,hsa-fe1-o
2 nps对缺氧条件下sk-n-mc细胞中的缺氧标志物hif-1α有显著的下调作用。这一结果表明,当hsa-fe1-o
2 nps被癌细胞摄取后,会导致hif-1α被降解。
[0060]
接下来,我们研究了fe1/hsa-fe1-o
2 nps促使sk-n-mc细胞缺氧或常氧条件下产生ros的能力。未经处理的细胞和用fe1处理的细胞作为对照组。在常氧条件下,经fe1处理的sk-n-mc细胞表现出显著的ros水平升高。然而,在缺氧条件下,fe1诱导细胞产生ros的能力显著降低。有趣的是,用hsa-fe1-o
2 nps治疗后,显著促进缺氧sk-n-mc细胞中ros的积累,增强了fe1的细胞毒性作用。另外,通过tunel染色检测细胞凋亡,结果显示hsa-fe1-o
2 nps增加了fe1对癌细胞的毒性,如图6c-d所示。
[0061]
体外活性测试(mtt),测试结果如表2所示:
[0062]
表2fe1/hsa-fe1-o
2 nps在常氧/缺氧条件下对各癌细胞株的抑制活性(ic
50
μm)
[0063][0064]
利用mtt法对fe1和hsa-fe1-o
2 nps进行了体外癌细胞增殖抑制活性实验。实验结果显示,不论是在常氧还是缺氧条件下,hsa-fe1-o
2 nps都能够有效的抑制癌细胞的生长,以上实验结果表明hsa-fe1-o
2 nps能够有效缓解癌细胞内的缺氧情况。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1