一种药物组合物及其应用、双硫仑和/或双硫仑的盐的应用
1.本发明涉及骨关节炎的预防和治疗技术领域,具体涉及一种药物组合物及其在制备药物中的应用、双硫仑和/或双硫仑的盐在制备药物中的应用。
背景技术:
2.骨关节炎是一种以关节软骨退变、软骨下骨硬化和骨赘形成为主要特点的关节退行性疾病,并以活动后关节疼痛、活动受限和关节变形为其主要临床表现,常累及负重关节。
3.我国流行病学调查研究显示,65岁以上人群中骨关节炎的患病率超过50%,约80%的骨关节炎患者存在一定程度的运动受限,25%的骨关节炎患者日常生活受到明显影响,而每年用于治疗骨关节炎的费用或高达1500亿元。随着全球老龄化人口以及肥胖人口的增加,骨关节炎的患病率还将进一步升高。
4.目前,国内外尚无明确有效且安全的可延缓骨关节炎病情进展的药物。最新的国际骨关节炎权威指南明确提出,许多一直以来被广泛用于治疗骨关节炎的药物,如透明质酸、氨基葡萄糖、硫酸软骨素和双醋瑞因等,由于最新的高质量的循证医学证据的出现,其有效性在世界范围内引起了广泛的争议,甚至被认定为疗效不确定或不推荐使用,针对早中期骨关节炎的治疗往往只能起到缓解疼痛和改善功能的作用。
5.此外,由于骨关节炎患者多为中老年人,常伴有其它系统疾病,如消化系统以及心血管系统疾病,而骨关节炎的一线治疗药物(症状缓解)如非甾体类抗炎药(non-steroidal antiinflammatory drugs,nsaids)的使用易引起胃肠道副作用和心血管事件风险的增加,因此,亟待探索出针对早中期骨关节炎患者的安全有效的治疗药物。
6.双硫仑是一种美国食品药品管理局(food and drug administration,fda)批准的药物,临床应用历史已超过60年,具有良好的安全性和耐受性,药代动力学明确,药理作用较强。双硫仑通过作用于胞质内和线粒体内的乙醛脱氢酶(aldehyde dehydrogenase,aldh),使得乙醛无法被氧化,因而饮酒者血中乙醛浓度升高5-10倍,从而产生强烈不适感,达到戒酒目的。
7.除了治疗酒精成瘾外,近年来有大量的观察性研究表明,双硫仑具有抗肿瘤活性,对多种恶性肿瘤均有效,如前列腺癌、乳腺癌和结肠癌等,且已有临床试验证明,双硫仑可用于治疗高度恶性的乳腺癌。即双硫仑可能具有超说明书用途,但双硫仑能否预防和治疗骨关节炎暂无文献报道。
技术实现要素:
8.本发明的目的是为了解决现有的骨关节炎预防和/或治疗技术存在的尚无明确有效且安全的可延缓骨关节炎病情进展的药物的问题。
9.为了实现上述目的,本发明第一方面提供双硫仑和/或双硫仑的盐在制备药物中的应用,该药物为具有选自保护软骨细胞的功能、保护软骨的功能、缓解由骨关节炎引起的
软骨退变的功能、减轻由骨关节炎引起的疼痛症状的功能、降低关节置换的风险的功能、预防骨关节炎的功能和治疗骨关节炎的功能中的至少一种功能的药物。
10.本发明第二方面提供一种药物组合物,该药物组合物中含有两者以上混合保存或者各自独立保存的以下组分:
11.组分a和组分b,所述组分a为双硫仑和/或双硫仑的盐,所述组分b为透明质酸和/或非甾体抗炎药;在所述药物组合物中,所述组分a与所述组分b的含量重量比为1:0.2-1。
12.本发明第三方面提供上述第二方面所述的药物组合物在制备药物中的应用,该药物为具有选自保护软骨细胞的功能、保护软骨的功能、缓解由骨关节炎引起的软骨退变的功能、减轻由骨关节炎引起的疼痛症状的功能、降低关节置换的风险的功能、预防骨关节炎的功能和治疗骨关节炎的功能中的至少一种功能的药物。
13.与现存骨关节炎预防和/或治疗技术相比,本发明提供的含有双硫仑和/或双硫仑的盐的药物组合物至少具有如下优势:
14.本发明提供的药物组合物中的双硫仑和/或双硫仑的盐能够改善代谢功能障碍,保护软骨细胞和软骨,缓解由骨关节炎引起的软骨退变,减轻由骨关节炎引起的疼痛症状,降低关节置换的风险,能够用于骨关节炎的预防和治疗。
15.本发明的其它特征和优点将通过随后的具体实施方式部分予以详细说明。
附图说明
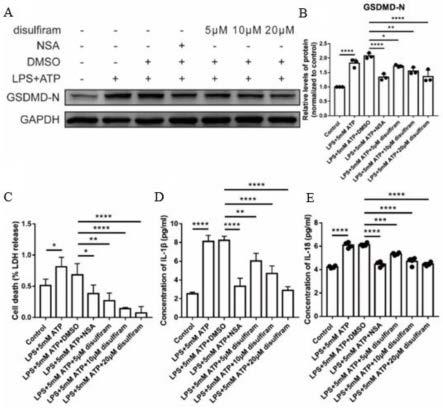
16.图1为不同干预处理后小鼠软骨细胞的焦亡结果图。其中,图1a为不同干预处理后小鼠软骨细胞中消皮素-n端(gsdmd-n)蛋白印记图,图1b为不同干预处理后小鼠软骨细胞中gsdmd-n蛋白含量结果图,图1c为不同干预处理后小鼠软骨细胞中ldh分泌量结果图,图1d为不同干预处理后小鼠软骨细胞中il-1β分泌量结果图,图1e为不同干预处理后小鼠软骨细胞中il-18分泌量结果图;
17.图2为不同干预处理后小鼠软骨细胞rna逆转录后的qrt-pcr检测结果图。其中,图2a为不同干预处理后小鼠软骨细胞rna逆转录后acan mrna表达量结果图,图2b为不同干预处理后小鼠软骨细胞rna逆转录后timp-3 mrna表达量结果图,图2c为不同干预处理后小鼠软骨细胞rna逆转录后timp-1 mrna表达量含量结果图,图2d为不同干预处理后小鼠软骨细胞rna逆转录后adamts-4 mrna表达量结果图,图2e为不同干预处理后小鼠软骨细胞rna逆转录后adamts-5 mrna表达量结果图;图2f为不同干预处理后小鼠软骨细胞rna逆转录后mmp-3 mrna表达量结果图;图2g为不同干预处理后小鼠软骨细胞rna逆转录后mmp-13 mrna表达量结果图;
18.图3为不同干预处理后小鼠软骨细胞中不同蛋白含量结果图。其中,图3a为不同干预处理后小鼠软骨细胞中不同蛋白的蛋白印记图,图3b为不同干预处理后小鼠软骨细胞中inos蛋白含量结果图,图1c为不同干预处理后小鼠软骨细胞中timp-3蛋白含量结果图,图1d为不同干预处理后小鼠软骨细胞中mmp-3蛋白含量结果图;
19.图4为不同干预处理后小鼠软骨细胞中不同蛋白含量结果图。其中,图4a为不同干预处理后小鼠软骨细胞中不同蛋白的蛋白印记图,图4b为不同干预处理后小鼠软骨细胞中col-2蛋白含量结果图,图4c为不同干预处理后小鼠软骨细胞中aggrecan蛋白含量结果图,图4d为不同干预处理后小鼠软骨细胞中mmp-13蛋白含量结果图;
20.图5为不同干预处理后小鼠软骨细胞中不同蛋白分泌量结果图。其中,图5a为不同干预处理后小鼠软骨细胞中adamts-4蛋白分泌量结果图,图5b为不同干预处理后小鼠软骨细胞中mmp-13蛋白分泌量结果图;
21.图6为不同干预处理后番红固绿染色检测小鼠膝关节软骨退变情况图;
22.图7为不同干预处理后小鼠膝关节软骨中股骨(femur)和胫骨(tibia)的oarsi评分结果图;
23.图8为不同干预处理后小鼠膝关节软骨中不同蛋白的表达情况图;
24.图9为不同干预处理后小鼠膝关节软骨中不同蛋白表达的定量结果图。
25.其中,其中,图9a为不同干预处理后小鼠膝关节软骨中gsdmd蛋白表达的定量结果图,图9b为不同干预处理后小鼠膝关节软骨中mmp-3蛋白表达的定量结果图,图9c为不同干预处理后小鼠膝关节软骨中adamts-5蛋白表达的定量结果图,图9d为不同干预处理后小鼠膝关节软骨中mmp-13蛋白表达的定量结果图;
26.图10为不同干预处理后he染色检测小鼠膝关节滑膜增生情况图;
27.图11为不同干预处理后小鼠膝关节滑膜炎评分(synovitis score)结果图;
28.图12为不同干预处理后小鼠膝关节滑膜焦亡和炎性细胞浸润情况图;
29.图13为不同干预处理后小鼠膝关节滑膜纤维化情况图。
具体实施方式
30.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
31.如前所述,本发明的第一方面提供了双硫仑和/或双硫仑的盐在制备药物中的应用,该药物为具有选自保护软骨细胞的功能、保护软骨的功能、缓解由骨关节炎引起的软骨退变的功能、减轻由骨关节炎引起的疼痛症状的功能、降低关节置换的风险的功能、预防骨关节炎的功能和治疗骨关节炎的功能中的至少一种功能的药物。
32.优选地,所述骨关节炎选自膝关节骨关节炎、髋关节骨关节炎、踝关节骨关节炎、肩关节骨关节炎、肘关节骨关节炎、手关节骨关节炎中的至少一种。
33.如前所述,本发明的第二方面提供了一种药物组合物,该药物组合物中含有两者以上混合保存或者各自独立保存的以下组分:
34.组分a和组分b,所述组分a为双硫仑和/或双硫仑的盐,所述组分b为透明质酸和/或非甾体抗炎药;在所述药物组合物中,所述组分a与所述组分b的含量重量比为1:0.2-1。
35.优选地,所述双硫仑的盐为双硫仑盐酸盐。
36.优选地,该药物组合物中还含有赋形剂,所述组分a和赋形剂的含量重量比为1:10-100。
37.优选地,所述赋形剂选自无水乳糖、硬脂酸镁、微晶纤维素、淀粉乙醇酸钠、硬脂酸中的至少一种。
38.优选地,该药物组合物的剂型为口服剂型或注射剂型。
39.优选地,该药物组合物的剂型选自针剂、片剂、胶囊剂、冲剂、颗粒剂中的至少一
种。
40.如前所述,本发明的第三方面提供了由前述第二方面所述的药物组合物在制备药物中的应用,该药物为具有选自保护软骨细胞的功能、保护软骨的功能、缓解由骨关节炎引起的软骨退变的功能、减轻由骨关节炎引起的疼痛症状的功能、降低关节置换的风险的功能、预防骨关节炎的功能和治疗骨关节炎的功能中的至少一种功能的药物。
41.优选地,所述骨关节炎选自膝关节骨关节炎、髋关节骨关节炎、踝关节骨关节炎、肩关节骨关节炎、肘关节骨关节炎、手关节骨关节炎中的至少一种。
42.以下将通过实例对本发明进行详细描述。
43.本发明中所有动物实验方案已经中南大学湘雅医院动物实验伦理委员会审核通过,且所有的实验都严格按照动物伦理准则和已被批准的动物实验制度设计进行。
44.本发明中实验所需的雄性12周龄c57bl/6j小鼠购自湖南斯莱克景达公司,并饲养于中南大学实验动物学部,spf级,室温22
±
3℃,12小时光照/黑暗循环。
45.本发明中实验所用的双硫仑(disulfiram),所用溶剂二甲基亚砜(dmso)和橄榄油均购自sigma公司。
46.以下实例中的研究方法如下:
47.(1)研究对象
48.本研究纳入了40岁以上的研究对象25,505名,排除既往患有癌症以及发生了髋或膝关节置换手术的患者。
49.(2)双硫仑服药情况的确定
50.通过药物代码来识别首次服用双硫仑或其他戒酒药物(阿坎酸、纳曲酮、巴氯芬和托吡酯)的患者。
51.双硫仑组为治疗组,其他戒酒药物组为对照组,“首次服药”的定义为进入队列之后的戒酒药物的首次处方,即排除了进入研究队列之前具有戒酒药物处方史的研究对象。
52.(3)结局的确定
53.本研究的结局是在随访期间因骨关节炎而新发的髋或膝关节置换手术,通过疾病代码进行识别和定义。
54.(4)统计学分析
55.本研究是基于前瞻性队列研究比较双硫仑组与其他戒酒药物组因骨关节炎而新发的髋或膝关节置换手术的风险。
56.比较了两组基线的特征,定量资料采用均数和标准差进行统计描述,定性资料采用百分比进行统计描述。为了模拟临床试验,我们采用了逆概率加权法(inverse probability weighting,ipw)来平衡两组之间潜在的混杂因素,在逆概率加权分析中,我们使用倾向评分模型的预测概率来计算稳定的逆概率加权权重,并采用了不对称截断法排除了那些几乎总是接受双硫仑或其他戒酒药物治疗的研究对象(倾向评分接近0或1)。
57.倾向评分模型中包括的混杂因素为:一般人口学资料(年龄、性别与汤森剥夺指数),生活习惯信息(吸烟情况和饮酒情况),体重指数,治疗日期之前合并症和药物使用情况,以及治疗日期前一年内的医疗保健利用率。
58.本研究采用cox比例风险回归模型来评估双硫仑组与其他戒酒药物组相比发生骨关节炎导致的髋或膝关节置换手术的风险,并计算出风险比(hazard ratio,hr)及其95%
可信区间(95%confidence interval,95%ci)。
59.所有统计分析均采用sas 9.4软件进行,p《0.05时可认为差异具有统计学意义,检验均为双侧检验。
60.实施例1:结果记录
61.本研究共纳入25,505名研究对象(双硫仑组1,724名,其他戒酒药物组23,781名),包括11,197名男性和14,308名女性,平均年龄为53.3
±
9.6岁。总体而言,两组人群通过ipw后的人群基本特征的均衡性较好,所有混杂因素的标准均数差均《0.1,详见表1。
62.cox比例风险回归分析结果显示,在整个随访过程中,双硫仑组中骨关节炎导致的髋或膝关节置换手术的发生率相比其他戒酒药物组的发生率显著降低,结果为0.53(95%ci:0.31-0.89)。
63.实施例2:软骨细胞提取与培养、焦亡模型的建立及药物干预
64.(1)对实验所用器械、容器进行消毒,且实验操作均在无菌条件下进行。
65.(2)将4日龄新生小鼠(购自湖南斯莱克景达公司)采用颈椎脱臼法处死,然后置于75%乙醇中消毒2小时;将消毒过的小鼠置于无菌纱布上,用镊子从髋关节部位将小鼠的双后肢取出,去除表面的皮肤,然后置于盛有磷酸盐缓冲液(phosphate buffered saline-pbs,购自普诺赛公司)的培养皿中,再用10号手术刀片刮除关节软骨周围的软组织,将透明的软骨组织置于新的盛有pbs缓冲液的培养皿中;
66.(3)吸去pbs缓冲液,加入4ml二型胶原酶(购自bioforxx公司,用dmem(dulbecco's modified eagle's medium)/f-12培养基溶解,dmem/f-12培养基购自gibco公司),然后用手术刀切碎软骨组织块。将培养皿置于37℃、5%的co2培养箱内过夜消化;
67.(4)次日取出培养皿,加入4ml完全培养基(由dmem/f-12培养基和胎牛血清(fbs)配制而成,胎牛血清的比例为10%,购自thermo公司)终止消化,然后用巴氏管吸至0.45μm一次性滤器中过滤,得到含小鼠软骨细胞的滤液;
68.(5)1000转/分钟(rpm)离心5分钟,弃上清液,完全培养基洗涤小鼠软骨细胞后1000rpm离心5分钟,再加入完全培养基重悬细胞,得到小鼠软骨细胞悬液;
69.(6)小鼠软骨细胞以1
×
105/ml接种于细胞培养皿中,然后将培养皿置于37℃、5%的co2恒温培养箱进行细胞培养;
70.(7)1天后更换新的完全培养基,以后每2天换液1次,同时在显微镜下观察小鼠软骨细胞的形态和生长状况;
71.(8)当培养皿细胞贴壁达80%左右时进行传代,吸净培养皿中的培养液,用pbs缓冲液清洗细胞2次,然后吸去pbs缓冲液;接着加入4ml二型胶原酶,将培养皿置于37℃、5%的co2恒温培养箱消化30分钟。将培养皿倒置于显微镜下观察,发现圆形细胞漂浮流动时加入2ml完全培养基,反复吹打培养皿,直至细胞形成的薄膜完全脱离培养皿底部。然后吸至15ml离心管中1000rpm离心5分钟,弃上清液,完全培养基洗涤细胞后1000rpm离心5分钟,再加入完全培养基重悬细胞,得到小鼠软骨细胞悬液。最后以1
×
105/ml接种于6孔细胞培养板上,放入37℃、5%的co2恒温培养箱进行培养;
72.(9)1天后更换新的完全培养基,以后每2天换液1次,同时在显微镜下观察小鼠软骨细胞的形态和生长状况;
73.(10)待细胞生长到合适状况后,对小鼠软骨细胞予以饥饿24小时,使细胞同步化
出现在非增殖期和非活动期;
74.(11)将第1代小鼠软骨细胞予以完全培养基进行培养,然后随机地给予不同的干预进行造模,具体地,如下:
75.先加入1μl的1μg/ml的脂多糖(lipopolysaccharide-lps,无菌水配置)或等体积的无菌水刺激24小时,接着再用60μl的5mm腺嘌呤核苷三磷酸(adenosine triphosphate-atp,无菌水配置)或等体积的无菌水刺激0.5小时;并对前述造模组给予0.8μl的20μm的坏死磺酰胺(necrosulfonamide-nsa)或等体积的dmso或不同浓度的双硫仑干预。
76.实施例3:小鼠软骨细胞上清液乳酸脱氢酶(lactate dehydrogenase-ldh)检测
77.(1)根据小鼠软骨细胞的大小和生长速度将适量细胞接种到96孔细胞培养板中,使待检测时细胞密度不超过80%;
78.(2)吸去培养液,用pbs液洗涤一次后换新鲜培养基,将各培养孔分成如下几组:
79.包括无细胞的培养液孔(背景空白对照孔),用于后续裂解的细胞孔(最大酶活性对照孔),以及不同干预处理的细胞孔(药物处理样品孔),并做好标记,其中药物处理样品孔按照实施例2中的实验步骤给予不同的干预。
80.预定的检测时间点前1.25小时,从细胞培养箱里取出细胞培养板,在“最大酶活性对照孔”中加入试剂盒(购自thermo公司)提供的10μl的10x裂解缓冲液,在“药物处理样品孔”中加入10μl无菌水,然后轻轻敲打混匀,然后继续在细胞培养箱中孵育45分钟;
81.(3)到达预定检测时间点后,转移50μl细胞培养板中的细胞培养基至酶标板中,将试剂盒提供的50μl反应混合物加入每个待测孔中,轻轻敲打混,然后室温下避光孵育30分钟,再向每个待测孔中加入试剂盒提供的50μl终止液,轻轻敲打混匀后置于酶标仪(型号epoch,厂家biotek)中进行检测。
82.实施例4:小鼠软骨细胞上清液酶联免疫吸附测定(enzyme linked immunosorbent assay-elisa)检测
83.(1)确定检测所需的微孔板数量,然后用洗涤缓冲液(购自biosharp公司)洗涤微孔板2次;
84.(2)在微孔板上进行标准稀释:向所有待测微孔中添加试剂盒(购自r&d systems公司)提供的100μl样品稀释液,将100μl制备好的标准液(原液试剂盒提供)添加到微孔板横向第一个微孔中,并依次吸取100μl前一微孔中的液体至后一微孔中以创建标准稀释液,从最后一个微孔中弃去100μl液体;
85.(3)向空白孔中一式两份添加100μl样品稀释液,然后将50μl样品稀释液以及50μl样品一式两份添加至样品孔中;随后加入向空白孔和样品孔中添加50μl试剂盒提供的生物素偶联物后盖上微孔板盖,在室温下孵育2小时;
86.(4)吸走空白孔和样品孔中的生物素偶联物并用洗涤缓冲液将微孔板洗涤4次,然后向空白孔和样品孔中加入100μl试剂盒提供的链霉亲和素-hrp后盖上微孔板盖,并在室温下孵育1小时;
87.(5)吸走空白孔和样品孔中的链霉亲和素-hrp,并用洗涤缓冲液洗涤4次;然后向空白孔和样品孔中添加100μl试剂盒提供的tmb底物溶液后,将微孔板在室温下避光孵育10分钟;
88.(6)向空白孔和样品孔中添加100μl试剂盒提供的终止液后,采用酶标仪在450nm
下测量空白孔和样品孔的吸光值。
89.实施例5:小鼠软骨细胞rna逆转录及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction-qrt-pcr)检测
90.(1)取2μl的rna样本,采用酶标仪对rna的浓度进行定量检测;
91.(2)去除rna样本中的基因组dna:将1μg的rna样本、2μl的5
×
gdna eraser buffer、1μl的gdna eraser加入离心管中,并用rnase free dh2o定容至10μl,充分混匀后于42℃反应2分钟;
92.(3)配置反转录反应混合物:将1μl的primescript rt enzyme mix i、1μl的rt primer mix
*4
、4μl的5
×
primescript buffer 2(for real time)以及4μl的rnase free dh2o充分混匀;
93.(4)向步骤(2)中的离心管加入步骤(3)中的反转录反应混合物后,于37℃反应15分钟后,再于85℃反应5秒;
94.(5)将步骤(4)中获得的混合物(cdna)根据需要进行稀释后充分混匀;
95.(6)qrt-pcr反应体系:将1μl的cdna、2μl上游引物、2μl下游引物、0.8μl的rox、2.4μl的mix以及1.8μl的rnase free dh2o充分混匀;
96.(7)设置qrt-pcr反应程序,用thermo fisher quantstudio 3荧光定量pcr仪扩增cdna,内参为β-actin。
97.实施例6:小鼠软骨细胞总蛋白提取及western blot
98.(1)取实施例2中步骤(11)中的小鼠软骨细胞,吸去培养基后加入pbs缓冲液洗2次,然后加入120μl细胞裂解液进行裂解15分钟;
99.(2)将含有细胞裂解产物的液体吸至1.5ml离心管中,于95℃加热10分钟后,采用超声细胞破碎仪进行超声处理,每管3次,每次5秒;然后于25℃以10000rpm的转速离心10分钟,取上清液置于新的1.5ml离心管中,并置于-80℃冻存;
100.(3)采用蛋白定量(bicinchoninic acid assay-bca)法测定蛋白浓度:
101.(4)sds-page胶电泳:蛋白定量后,根据浓度取合适体积的蛋白液于新的离心管中,加入loading buffer,95℃加热5分钟使蛋白变性;
102.接着设计好点样顺序,并作记录,点样,80v恒压电泳40分钟后,改为130v恒压电泳,直至loading buffer迁移至分离胶底部1.0cm处,关闭电源;
103.(5)转膜:将胶条切割至合适大小,放入转膜液中平衡,预先裁切好略大于胶条的聚偏二氟乙烯膜,转膜前先将聚偏二氟乙烯膜浸泡在甲醇中10秒激活,接着放入转膜液中平衡,转膜装置以阳极碳极-海绵-滤纸-凝胶-滤纸-海绵-阴极碳极的顺序放置好,夹紧,每一步注意避免气泡的形成,接通电源后,290ma恒流80分钟转膜;
104.(6)封闭:转膜完成后,膜用含吐温20的tris-hcl缓冲盐溶液(tris buffered saline+tween-20-tbst)缓冲液冲洗3次,注意聚偏二氟乙烯膜有蛋白的一面朝上,再用5%脱脂牛奶(用tbst缓冲液溶解)封闭1小时;
105.(7)抗体孵育:加入按比例稀释好的一抗,分别为:
106.cleaved gasdermin d(asp276)抗体(牌号10137,购自cell signaling technology公司,浓度为1:1000)、aggrecan抗体(牌号13880-1-ap,购自proteintech公司,浓度为1:1000)、col-2抗体(牌号ab85266,购自abcam公司,浓度为1:1500)、mmp-3抗体(牌
号ab53015,购自abcam公司,浓度为1:750)、mmp-13抗体(牌号18165-1-ap,购自proteintech公司,浓度为1:2000)、inos抗体(牌号ab15323,购自abcam公司,浓度为1:750)、timp-3抗体(牌号ab39184,购自abcam公司,浓度为1:1000)和gapdh抗体(牌号sc-32233,购自santa cruz biotechnology公司,浓度为1:2000),4℃孵育过夜,用tbst缓冲液洗膜3次,每次10分钟;之后加入按比例稀释好的二抗,分别为:
107.anti-mouse igg,hrp-linked抗体(牌号7076,购自cell signaling technology公司,浓度为1:5000)和anti-rabbit igg,hrp-linked抗体(牌号7074,购自cell signaling technology公司,浓度为1:5000),室温孵育1小时,用tbst缓冲液洗膜3次,每次10分钟;
108.(8)显影:按1:1的比例配制显影液,将聚偏二氟乙烯膜有蛋白的一面朝上,显影液充分反应后,进入暗室显影。
109.实施例7:
110.1、骨关节炎模型的建立
111.采用内侧半月板失稳术(destabilisation of the medial meniscu,dmm)方法切断57bl/6j小鼠右后肢的内侧半月板板胫韧带作为实验组,以及仅切开57bl/6j小鼠右后肢的关节囊作为假手术组。
112.2、实验分组
113.2.1、将35只57bl/6j小鼠随机分成5组,每组7只,具体分组情况如下:
114.1)假手术组:仅进行假手术处理;
115.2)溶剂灌胃组:对行dmm术构建膝关节骨关节炎模型后3天的小鼠予以溶剂(dmso:橄榄油(v/v)=0.05:0.95)灌胃处理,每天1次;
116.3)双硫仑(50mg/kg)灌胃组:对行dmm术构建膝关节骨关节炎模型后3天的小鼠予以双硫仑(50mg/kg)灌胃处理,每天1次;
117.4)双硫仑(100mg/kg)灌胃组:对行dmm术构建膝关节骨关节炎模型后3天的小鼠予以双硫仑(100mg/kg)灌胃处理,每天1次;
118.5)双硫仑(200mg/kg)灌胃组:对行dmm术构建膝关节骨关节炎模型后3天的小鼠予以双硫仑(200mg/kg)灌胃处理,每天1次。
119.术后12周处死小鼠,切取小鼠的膝关节标本进行后续检测。
120.实施例8:膝关节取材及包埋
121.(1)将小鼠采用颈椎脱臼法处死,取下膝关节,用眼科剪剔除多余的软组织,同时注意避免损伤膝关节关节腔,然后用铁丝固定膝关节于135
°
,放入装有4%多聚甲醛水溶液的15ml离心管中于4℃摇床上固定过夜;
122.(2)将固定后的组织放入包埋盒中,用自来水冲洗1小时,然后用0.5mol/l的15%乙二胺四乙酸(脱钙液)进行脱钙处理7天;
123.(3)对脱钙处理后的组织进行梯度乙醇脱水,具体程序依次为:50%乙醇水溶液,2小时;70%乙醇水溶液,2小时;80%乙醇水溶液,2小时;95%乙醇水溶液,2小时;100%乙醇i,过夜;100%乙醇ii,2小时;
124.(4)对乙醇脱水后的组织进行透明,即采用二甲苯置换乙醇,具体程序依次为:二甲苯i,20分钟;二甲苯ii,20分钟;
125.(5)对透明后的组织进行浸蜡,即采用石蜡置换二甲苯,具体程序依次为:石蜡i,65℃处理1.5小时;石蜡ii,65℃处理2小时;石蜡iii,65℃处理2小时;
126.(6)对浸蜡后的组织用石蜡包埋机采取矢状位进行包埋,包埋时需保证蜡块完整无裂痕,无气泡;然后采用石蜡切片机对包埋后的组织进行切片,切片厚度为3μm。
127.实施例9:病理学检测
128.从开始出现软骨面至软骨面消失中每隔40μm选择一张切片进行染色评分,每个膝关节选择5个连续切片进行以下操作:
129.(1)将膝关节组织的石蜡切片置于65℃恒温箱中烘烤2小时后,将石蜡切片置于脱蜡液(牌号ya0031,购自solaribo公司)中进行脱蜡处理,共2次,每次浸泡20分钟;
130.(2)对脱蜡处理后的组织切片进行梯度乙醇水合并清洗,具体程序依次为:100%乙醇水溶液,3分钟;90%乙醇水溶液,3分钟;80%乙醇水溶液,3分钟;70%乙醇水溶液,3分钟;50%乙醇水溶液,3分钟;然后采用pbs水溶液冲洗3分钟;
131.(3)将冲洗后的组织切片分别进行苏木精-伊红(he,购自sigma aldrich公司)染色、番红固绿(购自sigma aldrich公司)染色、天狼猩红(型号ab150681,购自abcam公司)染色,具体地为:
132.i)he染色以评估滑膜炎:将冲洗后的组织切片置于苏木素染料中浸泡3分钟后用自来水冲洗15分钟;接着置于分化液中分化30秒后用自来水冲洗15分钟;然后置于伊红染料中浸泡30秒后用自来水冲洗15分钟;再依次置于95%乙醇、100%乙醇、二甲苯中浸泡,各1分钟,最后将切片边缘多余的二甲苯拭去,快速滴加2滴中性树胶,再用盖玻片封片;
133.ii)番红固绿(safranin o-fast green)染色以评估软骨退变:将冲洗后的组织切片置于固绿染料中浸泡3分钟后用1%冰醋酸快速漂洗;接着置于番红染料中浸泡1分钟后用自来水冲洗15分钟,再依次置于95%乙醇、100%乙醇、二甲苯中浸泡,各1分钟,最后将切片边缘多余的二甲苯拭去,快速滴加2滴中性树胶,再用盖玻片封片;
134.iii)天狼猩红(sirius)染色以评估滑膜纤维化:将冲洗后的组织切片置于天狼猩红染料中浸泡5分钟后用自来水冲洗15分钟;然后依次置于95%乙醇、100%乙醇、二甲苯中浸泡,各1分钟,最后将切片边缘多余的二甲苯拭去,快速滴加2滴中性树胶,再用盖玻片封片;
135.(4)对染色后的组织切片进行软骨破坏评分,具体地为:由两名评分人员在盲法条件下使用国际骨关节炎研究协会评分系统(oarsi,0-6级)对番红固绿染色切片进行软骨(股骨和胫骨)破坏评分,如有任何分歧,则加入第三名评分人员,并通过讨论后以少数服从多数原则解决分歧。
136.用同样的方法使用滑膜衬里层及细胞密度评分系统(0-6级)对he染色切片进行滑膜炎评分。
137.实施例10:免疫组化分析
138.(1)将膝关节组织的石蜡切片置于65℃恒温箱中烘烤2小时后,将石蜡切片置于脱蜡液进行脱蜡处理,共2次,每次浸泡20分钟;
139.(2)对脱蜡处理后的组织切片进行梯度乙醇水合并清洗,具体程序依次为:100%乙醇水溶液,3分钟;90%乙醇水溶液,3分钟;80%乙醇水溶液,3分钟;70%乙醇水溶液,3分钟;50%乙醇水溶液,3分钟;然后采用pbs水溶液冲洗3分钟;
140.(3)采用免疫组化笔围绕冲洗后的组织切片中的组织画圈,然后加入150μl的胃蛋白酶消化液,室温修复15分钟,pbs缓冲液冲洗2次,每次3分钟;然后加入150μl的内源性过氧化物酶阻断剂,室温孵育10分钟,pbs缓冲液冲洗2次,每次3分钟;再加入150μl的封闭用正常山羊血清工作液室温孵育15分钟以进行封闭,弃去血清;
141.(4)将封闭后的组织切片分别与以下抗体(一抗)于4℃条件下孵育过夜之后用pbs缓冲液冲洗2次,每次3分钟:
142.gsdmd抗体(牌号ab219800,购自abcam公司,浓度为1:500)、mmp-13抗体(牌号18165-1-ap,购自proteintech公司,浓度为1:800)、adamts-5抗体(牌号ab41037,购自abcam公司,浓度为1:300)和mmp-3抗体(牌号ab53015,购自abcam公司,浓度为1:200);
143.(5)在一抗孵育后的组织切片中加入150μl的生物素标记山羊抗兔igg聚合物(二抗),室温孵育15分钟,用pbs缓冲液冲洗2次,每次3分钟;
144.(6)在二抗孵育后的组织切片中加入150μl的辣根酶标记链霉卵白素工作液,室温孵育15分钟,用pbs缓冲液冲洗2次,每次3分钟;
145.(7)在标记后的组织切片中加入现配现用的显色液(dab浓缩液:dab释液(v/v)=1:20),显微镜下用pbs冲洗以控制显色程度;
146.(8)将显色后的组织切片置于苏木素染料中浸泡30秒;1%盐酸乙醇溶液分化30秒后用自来水冲洗至返蓝;然后依次置于95%乙醇、100%乙醇、二甲苯中浸泡,各1分钟,最后将切片边缘多余的二甲苯拭去,快速滴加2滴中性树胶,再用盖玻片封片。
147.实施例11:免疫荧光分析
148.(1)将膝关节组织的石蜡切片置于65℃恒温箱中烘烤2小时后,将石蜡切片置于脱蜡液进行脱蜡处理,共2次,每次浸泡20分钟;
149.(2)对脱蜡处理后的组织切片进行梯度乙醇水合并清洗,具体程序依次为:100%乙醇水溶液,3分钟;90%乙醇水溶液,3分钟;80%乙醇水溶液,3分钟;70%乙醇水溶液,3分钟;50%乙醇水溶液,3分钟;然后采用pbs水溶液冲洗3分钟;
150.(3)采用免疫组化笔围绕冲洗后的组织切片中的组织画圈,然后加入150μl的胃蛋白酶消化液,室温修复15分钟,pbs缓冲液冲洗2次,每次3分钟;再加入150μl的4%牛血清白蛋白(bsa)室温孵育1小时以进行封闭,弃去血清;
151.(4)将封闭后的组织切片分别与以下抗体(一抗)于4℃条件下孵育过夜之后用pbs缓冲液冲洗5次,每次3分钟:
152.gsdmd抗体(牌号ab219800,购自abcam公司,浓度为1:500)、f4/80抗体(牌号ab6640,购自abcam公司,浓度为1:300)和vitmentin抗体(牌号ab8978,购自abcam公司,浓度为1:300);
153.(5)在一抗孵育后的组织切片中加入150μl的alexa 488(牌号ab150077,购自abcam公司,浓度为1:500)染色抗体(二抗)或alexa 594(牌号ab150116,购自abcam公司,浓度为1:400)染色抗体(二抗),室温孵育15分钟,用pbs缓冲液冲洗5次,每次3分钟;
154.(6)在二抗孵育后的组织切片中加入100μl的抗荧光淬灭剂,盖上盖玻片,指甲油封片。
155.实验结果
156.本发明中所有数据均以均值
±
标准差表示。数据分析采用软件sas9.4进行分析,
使用单向方差分析或tukey’s事后检验分析的统计学方法进行分析,其中,时间和组间的相互效应采用双向重复方差分析来评估,所有p值均为双侧p值,统计学差异的阈值是p《0.05,*p《0.05、**p《0.01、***p《0.001、****p《0.0001。
157.表1:基线时的基本信息(n=25,505)
[0158][0159]
n:样本数量;ipw:逆概率加权法
[0160]
图1为不同干预处理后小鼠软骨细胞的焦亡结果图。从图1中可以看出,双硫仑显著抑制了lps和5mm的atp诱导的软骨细胞gsdmd-n蛋白的表达(图1b);同时双硫仑以剂量依赖性方式减少lps和5mm的atp诱导的软骨细胞培养基中ldh的释放(图1c)。此外,双硫仑同样以剂量依赖性方式抑制lps和5mm的atp诱导的软骨细胞培养基中il-1β和il-18的产生(图1d和图1e),这些结果表明双硫仑能够通过降低gsdmd-n的表达和抑制膜穿孔,从而抑制软骨细胞焦亡的发生,减少炎症因子的释放。
[0161]
图2为不同干预处理后小鼠软骨细胞rna逆转录后的qrt-pcr检测结果图。从图2中可以看出,双硫仑能够显著逆转lps和5mm的atp诱导的软骨细胞acan和timp-3的减少(图2a和图2b),以及timp-1、adamts-4、adamts-5、mmp-3和mmp-13和的增加(图2c-图2g)。
[0162]
图3、图4和图5均为不同干预处理后小鼠软骨细胞中不同蛋白含量结果图。从图中可以看出,双硫仑能够显著抑制lps和5mm的atp诱导的软骨细胞中mmp-3、mmp-13和inos蛋白表达增加(图3a-图3d),并促进lps和5mm的atp诱导的软骨细胞中aggrecan、col-2和timp-3蛋白表达减少(图4a-图4d)。另外,lps和5mm的atp诱导的软骨细胞培养基中adamts-4和mmp-13的释放显著增加,而双硫仑以剂量依赖性方式抑制lps和5mm的atp诱导的软骨细胞培养基中adamts-4和mmp-13的产生(图5a和图5b)。这些结果表明双硫仑能够减轻软骨细胞焦亡诱导的细胞分解代谢和炎症,加强合成代谢。
[0163]
图6为不同干预处理后番红固绿染色检测小鼠膝关节软骨退变情况图。从图中可以看出,dmm+vehicle组的小鼠在术后12周表现出明显的软骨退变,oarsi评分高于sham+vehicle组,同时双硫仑以剂量依赖性方式减轻dmm手术造成的膝关节软骨退变。
[0164]
图7为不同干预处理后小鼠膝关节软骨中股骨(femur)和胫骨(tibia)的oarsi评分结果图。从图中可以看出,双硫仑以剂量依赖性方式降低oarsi评分。
[0165]
图8为不同干预处理后小鼠膝关节软骨中不同蛋白的表达情况图,图9为不同干预处理后小鼠膝关节软骨中不同蛋白表达的定量结果图。dmm+vehicle组的小鼠术后12周的膝关节软骨细胞中gsdmd、mmp-3、adamts-5和mmp-13的表达显著增加,而双硫仑能够显著降低gsdmd、mmp-3、adamts-5和mmp-13的表达(图9a-图9d)。这些结果表明,双硫仑能够抑制dmm诱导的小鼠oa模型中的软骨细胞焦亡并延缓软骨退变进展。
[0166]
图10为不同干预处理后he染色检测小鼠膝关节滑膜增生情况图。从图中可以看
出,与sham+vehicle组相比,dmm+vehicle组的胶原蛋白沉积明显增加,而双硫仑干预组的胶原蛋白沉积增加的情况得到缓解。
[0167]
图11为不同干预处理后小鼠膝关节滑膜炎评分(synovitis score)结果图。从图中可以看出,双硫仑以剂量依赖性方式减轻dmm术后膝关节滑膜增生和炎性细胞浸润,降低滑膜炎评分(图11)。
[0168]
图12为不同干预处理后小鼠膝关节滑膜焦亡和炎性细胞浸润情况图。从图中可以看出,双硫仑降低了滑膜组织中gsdmd和f4/80(巨噬细胞标志物)的表达。
[0169]
图13为不同干预处理后小鼠膝关节滑膜纤维化情况图。从图中可以看出,双硫仑降低了滑膜组织中gsdmd和vimeintin(成纤维细胞标志物)的表达。
[0170]
以上结果表明双硫仑能够抑制dmm诱导的小鼠oa模型中的滑膜细胞焦亡,减轻滑膜炎及滑膜纤维化,延缓oa发生发展。
[0171]
通过表1的结果可以看出,服用双硫仑的人群发生由骨关节炎导致的髋或膝关节置换手术的风险低于服用其他戒酒药物的人群。表明双硫仑和/或双硫仑的盐能够降低关节置换的风险,对骨关节炎的发生和进展具有延缓作用,能够用于骨关节炎的预防和治疗。
[0172]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1