一种藏药组合物在制备治疗2型糖尿病药物中的用途
1.本发明涉及了藏药组合物的用途,具体涉及了一种藏药组合物在制备治疗2型糖尿病药物中的用途。
背景技术:
2.2型糖尿病(t2dm)是一类胰岛素分泌相对不足或胰岛素抵抗致血糖升高的慢性代谢性疾病。现代研究表明,t2dm患者除胰岛素抵抗外,往往还会出现炎症、血脂异常、肠道菌群紊乱等情况。从传统天然药物中寻找良好的治疗2型糖尿病的药物具有重要的意义。
3.藏医药理论认为,t2dm属于“京尼萨库”病的范畴,在饮食、起居不当、邪气等外源因素作用下,诱发体内三因“隆”、“赤巴”、“培根”的紊乱,饮食精华不能正常的吸收、输布、排泄,导致机体代谢失调,从而发病。八味小檗皮胶囊(杰星杰巴)由小檗皮、荜茇、红花、余甘子、甘草、熊胆、麝香、京墨共8味藏药组成,具有消炎止痛、固精止血的功效,临床常用于治疗尿路感染、白浊、滑精等泌尿系统疾病。迄今为止,尚未发现八味小檗皮胶囊对t2dm及其并发症具有治疗作用的相关报道。
技术实现要素:
4.本发明的目的在于:提供一种藏药组合物的新用途,即一种藏药组合物在制备治疗2型糖尿病药物中的用途。
5.通过大量的实验研究发现,由八种天然藏药组成的藏药组合物能显著改善胰岛素抵抗、减少炎症、降低血脂水平,并改善肠道菌群失调,可用于治疗t2dm。
6.为了实现上述目的,本发明采用的技术方案为:
7.一种藏药组合物在制备治疗2型糖尿病药物中的用途,所述藏药组合物由以下原料制备而成的:小檗皮、荜茇、红花、余甘子、甘草、熊胆粉、人工麝香和京墨。
8.本发明以高脂饲料配合小剂量stz(35mg/kg)诱导的t2dm大鼠为研究对象,测定lps、tnf-α、tg、ldl-c等指标。结果发现,与正常组大鼠比较,t2dm大鼠胰岛素抵抗严重,lps、il-6、tg、tc等指标显著升高;八种藏药组合物给药42d后,t2dm大鼠体内胰岛素抵抗明显有所改善,lps、tnf-α、il-6、il-1β、tg、tc、ldl-c含量显著降低。结果表明,八种藏药组合物能显著改善胰岛素抵抗、减少炎症反应及降低血脂水平。基于16s rrna高通量测序技术对大鼠粪便进行检测,结果发现,t2dm大鼠体内肠道菌群发生了失调,而八种藏药组合物给药后可调节t2dm大鼠菌群的丰富度和多样性,t2dm大鼠的微生物组成结构逐渐趋于正常。结果表明,t2dm大鼠体内肠道菌群发生了失调,八种藏药组合物可恢复肠道菌群的稳态。八种藏药组合物能显著改善胰岛素抵抗、减少炎症、降低血脂水平,并改善肠道菌群失调,可用于治疗t2dm;八种藏药的天然产物的特性也能够在治疗过程中发挥高效低毒的显著优势,为2型糖尿病的治疗提供了全新的选择。
9.进一步的,所述藏药组合物是由以下原料混合制备而成的:小檗皮、荜茇、红花、余甘子、甘草、熊胆粉、人工麝香和京墨。
10.进一步的,所述藏药组合物按重量份计由以下原料制备而成的:小檗皮101份~102份、荜茇13份~14份、红花50份~51份、余甘子84份~85份、甘草33份~34份、熊胆粉4份~5份、人工麝香4份~5份和京墨8份~9份。优选地,所述藏药组合物按重量份计由以下原料制备而成的:小檗皮101份~101.5份、荜茇13份~13.5份、红花50.5份~51份、余甘子84份~84.5份、甘草33.5份~34份、熊胆粉4份~4.5份、人工麝香4份~4.5份和京墨8份~8.5份。更优选地,所述藏药组合物按重量份计由以下原料制备而成的:小檗皮101.3份、荜茇13.5份、红花50.6份、余甘子84.4份、甘草33.8份、熊胆粉4.1份、人工麝香4.1份和京墨8.2份。
11.进一步的,所述藏药组合物取自八味小檗皮胶囊。
12.进一步的,所述药物能够改善2型糖尿病引起的胰岛素抵抗;所述药物能够减少2型糖尿病引起的炎症;所述药物能够降低2型糖尿病引起的血脂水平。
13.进一步的,所述药物能够改善2型糖尿病引起的肠道菌群失调,恢复肠道菌群的稳态。
14.本发明的另一目的是为了提供一种包含上述藏药组合物的药物组合物。
15.一种治疗2型糖尿病的药物组合物,所述药物组合物由有效量的上述藏药组合物为活性成分,加上药物学上可接受的辅料或辅助性成分制备而成的药物学上常用的制剂。
16.进一步的,所述制剂是口服制剂、注射制剂、外用制剂、缓释制剂或控释制剂。
17.进一步的,所述口服制剂包括胶囊剂、颗粒剂、片剂、合剂或糖浆剂。
18.综上所述,由于采用了上述技术方案,本发明的有益效果是:
19.本发明提供了一种藏药组合物在制备治疗2型糖尿病药物中的用途,该藏药组合物由八种藏药组成,分别是小檗皮、荜茇、红花、余甘子、甘草、熊胆粉、人工麝香和京墨。研究发现藏药组合物能够显著改善胰岛素抵抗、减少炎症、降低血脂水平,并改善肠道菌群失调,可用于治疗t2dm;八种藏药的天然产物的特性也能够在治疗过程中发挥高效低毒的显著优势,为2型糖尿病的治疗提供了全新的选择。
附图说明
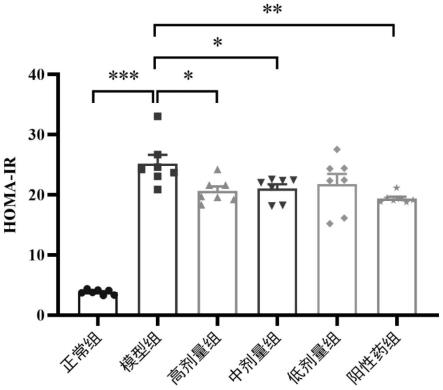
20.图1为各组大鼠homa-ir的差异情况图。
21.图2为各组大鼠lps的差异情况图。
22.图3为各组大鼠炎症因子的差异情况图;(a)肿瘤坏死因子-α(b)白细胞介素-6(c)白细胞介素-1β。
23.图4为各组大鼠血脂指标的差异情况图;(a)甘油三酯(b)总胆固醇(c)低密度脂蛋白胆固醇。
24.图5为三组大鼠的稀释曲线和等级聚类曲线图(a)稀释曲线(b)等级聚类曲线。
25.图6为三组大鼠的otu venn图。
26.图7为门水平物种分布柱状图。
27.图8为属水平物种分布柱状图。
28.图9为三组大鼠的α多样性指数图;(ⅰ)shannon(ⅱ)simpson(ⅲ)chao1(ⅳ)ace。
29.图10为三组大鼠的pcoa分析图。
30.图11为三组大鼠的lda值分布柱状图。
31.图12为三组大鼠的进化分支图。
32.图13为三组大鼠属水平下菌群的差异情况图;a:正常组;b:模型组;c:八味小檗皮胶囊高剂量组;*p<0.05,**p<0.01,***p<0.001。
33.图14为三组大鼠种水平下菌群的差异情况图;a:正常组;b:模型组;c:八味小檗皮胶囊高剂量组;*p<0.05,**p<0.01。
具体实施方式
34.下面结合附图,对本发明作详细的说明。
35.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
36.实施例1
37.1实验材料
38.1.1实验动物
39.spf级雄性sd大鼠,160-180g,由成都达硕实验动物有限公司购入,许可证号:scxk(川)2020-030。
40.1.2实验药物及仪器
41.八味小檗皮胶囊,国药准字:z20025870,产品批号:20190502,购自青海久美藏药药业有限公司。盐酸二甲双胍片,国药准字:h20023370,产品批号:abe0107,购自中美上海施贵宝制药有限公司。链脲佐菌素(stz,sigma-s0130)购自北京博爱港生物技术有限公司。高脂饲料(普通饲料70%,蔗糖16%,猪油12%,胆固醇1%,胆酸钠1%),购自成都达硕实验动物有限公司。
42.血糖仪与试纸购自三诺生物传感股份有限公司,tgl-16c台式高速冷冻离心机购自长沙湘仪离心机仪器有限公司,bk-200全自动生化分析仪购自山东博科科学仪器有限公司。胰岛素(ins)、脂多糖(lps)、肿瘤坏死因子-α(tnf-α)、白细胞介素-6(il-6)、白细胞介素-1β(il-1β)elisa试剂盒购自江苏酶免实业有限公司;甘油三酯(tg)、总胆固醇(tc)、低密度脂蛋白胆固醇(ldl-c)测定试剂盒购自长春汇力生物技术有限公司。超保真pcr master mix购自美国new england biolabs公司;胶回收试剂盒购自德国qiagen公司;dna pcr-free建库试剂盒、novaseq 6000测序平台购自美国illumina公司;qubit@2.0荧光计购自美国thermo scientific公司。
43.2实验方法
44.2.1 t2dm模型的建立
45.正常组大鼠给予普通饲料喂养,模型筛选组大鼠给予高脂饲料喂养。模型筛选组大鼠喂养4周后,禁食12h,次日按35mg/kg腹腔注射新鲜配制浓度为1%的stz缓冲溶液,正常组大鼠腹腔注射等量的0.1mol/l柠檬酸-柠檬酸钠缓冲溶液(ph=4.1)。72h后,尾尖取血,测定大鼠空腹血糖(fbg),fbg≥11.0mmol/l,且3次测定均稳定,则认为造模成功。
46.2.2分组及指标检测
47.选取正常组和造模成功的糖尿病大鼠,按体重及血糖随机分为6组,分为正常组、模型组、阳性药组(盐酸二甲双胍,0.25g/kg/d)、八味小檗皮胶囊高剂量组(0.4g/kg/d)、八
味小檗皮胶囊中剂量组(0.2g/kg/d)和八味小檗皮胶囊低剂量组(0.1g/kg/d),每组7只。连续给药42d,每天1次。实验过程中,除正常组外,其余5组均给予高脂饲料。
48.观察大鼠造模前后的饮水量、进食量及尿量等一般状况变化;末次给药后,分别对各组老鼠禁食不禁水12h,尾尖取血,用血糖仪测定大鼠空腹血糖(fbg);腹主动脉取血,分离血清,按试剂盒说明书,取分离后的上清液分别测定血清中胰岛素(ins)、脂多糖(lps)、炎症因子(il-6、il-1β、tnf-α)、血脂指标(tg、tc、ldl-c)水平;按homa-ir=fbg
×
ins/22.5公式计算胰岛素抵抗指数(homa-ir);收集粪便,采用16s rrna测序检测肠道菌群(肠道菌群测序分析中各代码:a表示正常组,b表示模型组,c表示八味小檗皮胶囊高剂量组)。
49.2.3肠道菌群测序流程及方法
50.2.3.1基因组dna的提取
51.采用十六烷基三甲基溴化铵法(ctab)或十二烷基磺酸钠法(sds)对大鼠粪便样本的基因组dna进行提取,利用琼脂糖凝胶电泳检测dna的纯度和浓度,取适量的样本dna于离心管中,使用无菌水稀释样本至1ng/μl。
52.2.3.2聚合酶链式反应扩增
53.以浓度为1ng/μl的基因组dna为模板,使用带barcode的特异引物进行聚合酶链式反应(pcr)扩增。pcr扩增使用high-fidelity pcr master mix,15μl反应体系(0.2μm正向和反向引物,10ng dna模板)。反应流程:98℃预变性1min;98℃变性10s,50℃退火30s,72℃延伸30s,共进行30个循环;72℃扩增5min。
54.2.3.3 pcr产物的混样和纯化
55.pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测;对检测合格的pcr产物进行磁珠纯化,采用酶标定量,根据pcr产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测pcr产物,对目的条带使用qiagen凝胶回收试剂盒回收产物。
56.2.3.4文库的构建和测序
57.使用dna pcr-free建库试剂盒进行文库构建,构建好的文库经过qubit和q-pcr定量,文库合格后,使用novaseq 6000进行上机测序。
58.2.4数据分析
59.采用graphpad prism(version 9.3.1)对所有数据进行单因素方差分析,当p《0.05时认为具有统计学意义。数据均采用均值
±
标准误(mean
±
sem)表示。
60.3实验结果
61.3.1各组大鼠状态
62.糖尿病大鼠造模成功后,饮水量、进食量及尿量均显著高于正常组。实验期间,每7d记录一次大鼠体重,结果发现随着饲养时间的增加,部分糖尿病大鼠体重降低、精神萎靡、皮毛黯淡无光、大便稀溏。
63.3.2八味小檗皮胶囊对t2dm大鼠胰岛素抵抗指数的影响
64.由图1、表1可知,与正常组相比,模型组大鼠homa-ir显著升高(p<0.001)。给药42d后,八味小檗皮胶囊高、中剂量组大鼠homa-ir较模型组显著降低(p<0.05)。图1中,
*
p<0.05,
**
p<0.01,
***
p<0.001。
65.表1八味小檗皮胶囊对t2dm大鼠homa-ir的影响(mean
±
sem,n=7)
66.组别homa-ir
正常组3.83
±
0.16
***
模型组25.17
±
1.47高剂量组20.62
±
0.76
*
中剂量组21.01
±
0.75
*
低剂量组21.79
±
1.71阳性药组19.38
±
0.31
**
67.注:与模型组比较,
*
p<0.05,
**
p<0.01,
***
p<0.001。
68.3.3八味小檗皮胶囊对t2dm大鼠脂多糖的影响
69.由图2、表2可知,与正常组相比,模型组大鼠lps显著升高(p<0.001)。给药42d后,八味小檗皮胶囊高、中剂量组大鼠lps含量较模型组均显著降低(p<0.05)。
70.表2八味小檗皮胶囊对t2dm大鼠lps的影响(mean
±
sem,n=7)
[0071][0072][0073]
注:与模型组比较,
*
p<0.05,
***
p<0.001。
[0074]
3.4八味小檗皮胶囊对t2dm大鼠炎症因子的影响
[0075]
由图3、表3可知,与正常组炎症因子(tnf-α、il-6、il-1β)含量相比,模型组显著升高(p<0.001)。给药42d后,高、中剂量组的tnf-α含量较模型组显著降低;高剂量组的il-6含量显著降低;高、中、低剂量组的il-1β含量均显著降低(p<0.05)。
[0076]
表3八味小檗皮胶囊对各组大鼠炎症因子的影响(mean
±
sem,n=7)
[0077]
组别tnf-α(ng
·
l-1
)il-6(ng
·
l-1
)il-1β(ng
·
l-1
)正常组365.43
±
7.60
***
318.61
±
9.90
***
338.56
±
8.38
***
模型组433.74
±
9.91402.00
±
11.87424.16
±
8.35高剂量组394.60
±
7.46
**
363.98
±
5.77
*
387.15
±
6.86
**
中剂量组397.77
±
8.94
*
394.32
±
10.99384.61
±
7.38
**
低剂量组411.13
±
9.42393.21
±
9.07394.29
±
7.50
*
阳性药组396.13
±
5.79
*
366.48
±
6.88
*
399.15
±
7.87
[0078]
注:与模型组比较,
*
p<0.05,
**
p<0.01,
***
p<0.001。
[0079]
3.5八味小檗皮胶囊对t2dm大鼠血脂指标的影响
[0080]
由图4、表4可知,与正常组相比,模型组tg、tc、ldl-c含量显著升高(p<0.001)。给药42d后,灌胃八味小檗皮胶囊高、中剂量组的tg、tc含量较模型组显著降低;与模型组ldl-c含量比较,高剂量组显著降低(p<0.05)。
[0081]
表4八味小檗皮胶囊对t2dm大鼠血脂指标的影响(mean
±
sem,n=7)
[0082]
组别tg(mmol
·
l-1
)tc(mmol
·
l-1
)ldl-c(mmol
·
l-1
)正常组0.46
±
0.05
***
1.34
±
0.07
***
0.43
±
0.03
***
模型组3.42
±
0.373.46
±
0.353.09
±
0.40高剂量组2.26
±
0.24
*
2.22
±
0.19
**
1.82
±
0.18
*
中剂量组2.10
±
0.23
*
2.38
±
0.20
*
2.36
±
0.24低剂量组2.69
±
0.432.85
±
0.262.51
±
0.34阳性药组2.09
±
0.24
*
2.23
±
0.23
**
1.79
±
0.22
**
[0083]
注:与模型组比较,
*
p<0.05,
**
p<0.01,
***
p<0.001。
[0084]
3.6八味小檗皮胶囊对t2dm大鼠肠道菌群的影响
[0085]
3.6.1测序数据质量分析
[0086]
通过样品序列数以评估其质量好坏。由表5可知,在正常组、模型组和八味小檗皮胶囊高剂量组的粪便中,序列长度均在94-390bp之间。经拼接、过滤等处理后,共获到1375793个effective tags。q30(质量值大于30的碱基所占比例)均大于97.0%,说明测序数据质量较好。
[0087]
表5样本信息统计表
[0088][0089]
注:a:正常组;b:模型组;c:八味小檗皮胶囊高剂量组
[0090]
3.6.2测序深度分析
[0091]
稀释曲线和等级聚类曲线可表征样本多样性。由图5-a可知,稀释曲线逐渐趋于平缓,说明本研究的测序量合理,覆盖了绝大多数的物种信息;由图5-b可知,等级聚类曲线在水平方向的跨度越来越大、垂直方向越来越平缓,说明本研究物种丰富度与均匀度能满足后续研究。
[0092]
3.6.3 otu分析
[0093]
以97%的相似性对effective tags进行otu聚类,对均一化的otu数据绘制venn图。由图6可知,三组共同含有的otu为1088个,正常组中特有otu为708个,模型组中特有otu为134个,八味小檗皮胶囊高剂量组中特有otu为217个。这说明在八味小檗皮胶囊治疗t2dm的过程中,otu的数目和种类会发生变化。
[0094]
3.6.4物种注释分析
[0095]
选择门和属水平下相对丰度前10的物种,生成柱状图。由图7可知,在门水平下,物种主要有拟杆菌门(bacteroidota)、厚壁菌门(firmicutes)、梭杆菌门(fusobacteriota)、变形菌门(proteobacteria)和广古菌门(euryarchaeota)。与正常组比较,模型组大鼠体内拟杆菌门和梭杆菌门丰度增加而厚壁菌门、变形菌门和广古菌门丰度降低;给药高剂量的八味小檗皮胶囊后,与模型组相比,拟杆菌门丰度有所降低而厚壁菌门、梭杆菌门和变形菌门丰度有所增加。
[0096]
属水平下的结果如图8所示,正常组的细菌主要有普雷沃氏菌属nk3b31(prevotellaceae nk3b31 group)、anaerobiospirillum、romboutsia、普雷沃氏菌属ucg-003(prevotellaceae ucg-003)、弧菌属(vibrio)、假单胞菌属(pseudomonas)、拟普雷沃氏菌属(alloprevotella)和乳杆菌属(lactobacillus)。而糖尿病大鼠中prevotellaceae nk3b31group、梭杆菌属(fusobacterium)、anaerobiospirillum、blautia和alloprevotella较正常组增加,而romboutsia、prevotellaceae ucg-003、vibrio和pseudomonas丰度有所减少;给药八味小檗皮胶囊后,与模型组相比,prevotellaceae nk3b31 group、blautia和lactobacillus丰度降低,而romboutsia、vibrio和pseudomonas丰度增加。
[0097]
3.6.5α多样性分析
[0098]
对样本的α多样性指数进行分析,结果如图9所示。与正常组相比,模型组的shannon、simpson、ace、chao1指数显著降低(p<0.05);而八味小檗皮胶囊给药后,与模型组相比,菌群的丰富度和多样性虽有所变化。
[0099]
3.6.6β多样性分析
[0100]
pcoa分析可反映样本间的差异性。如图10所示,pc1对差异性的贡献度为25.77%,pc2对差异性的贡献度为13.26%。图中正常组和模型组相隔较远,说明正常组与模型组之间菌群组成结构存在较大的差异,而给药组位于正常组和模型组之间且较接近于正常组,说明八味小檗皮胶囊给药后,t2dm大鼠的菌群逐渐趋于正常。
[0101]
3.6.7物种差异分析
[0102]
常用lefse分析来进行组间差异物种分析。如图11、图12所示,三组间共有28个物种具有差异性。在门水平下,变形菌门丰度在正常组中较高,梭杆菌门在八味小檗皮胶囊高剂量组中丰度较高。在属水平下,vibrio、pseudomonas和prevotellaceae ucg-003在正常组中丰度较高,blautia和prevotellaceae nk3b31 group在模型组中丰度较高,
candidatus arthromitus、romboutsia和fusobacterium在八味小檗皮胶囊高剂量组中丰度较高。
[0103]
3.6.8方差分析
[0104]
方差分析可判断样本间的差异显著程度。本研究对特征性属和种水平的菌群做单因素方差分析,以寻求各组间的差异性。如图13所示,在属水平下,模型组中blautia、prevotellaceae nk3b31 group和clostridium sensu stricto 1的相对丰度较正常组显著上升(p<0.05);给药后,与模型组相比,prevotellaceae nk3b31 group、clostridium sensu stricto 1的相对丰度显著降低(p<0.05),romboutsia的丰度显著上升(p<0.05)。
[0105]
种水平下的结果如图14所示,与正常组相比,模型组中bacteroides barnesiae、脆弱拟杆菌(b.fragilis)、粪拟杆菌(b.caccae)、粪便拟杆菌(b.stercoris)和埃氏拟杆菌(b.eggerth2)的相对丰度显著上升(p<0.05);给药后,b.barnesiae和b.fragilis的相对丰度较模型组显著降低(p<0.05)。结果表明,八味小檗皮胶囊给药能显著降低b.barnesiae和b.fragilis的相对丰度。
[0106]
4.总结与讨论
[0107]
炎症反应、糖脂代谢、肠道微生物等与t2dm的发生发展密切相关,肠道微生物可通过脂多糖、炎症因子等途径影响t2dm的糖脂代谢。lps、炎症因子(如tnf-α、il-6)分泌过多会造成胰岛素抵抗和β细胞功能障碍,从而影响t2dm的发展过程。t2dm患者胰岛功能损害,导致脂代谢异常,降低氨基酸合成脂蛋白酶的作用,增加血液中脂肪含量,进而诱发血脂异常。另有研究表明,t2dm患者体内肠道菌群组成结构与健康个体具有明显差异。因此,脂多糖、炎症因子、血脂指标、肠道菌群与t2dm息息相关。
[0108]
本发明以高脂饲料配合小剂量stz(35mg/kg)诱导的t2dm大鼠为研究对象,测定lps、tnf-α、tg、ldl-c等指标。结果发现,与正常组大鼠比较,t2dm大鼠胰岛素抵抗严重,lps、il-6、tg、tc等指标显著升高;八味小檗皮胶囊给药42d后,t2dm大鼠体内胰岛素抵抗明显有所改善,lps、tnf-α、il-6、il-1β、tg、tc、ldl-c含量显著降低。结果表明,八味小檗皮胶囊能显著改善胰岛素抵抗、减少炎症反应及降低血脂水平。基于16s rrna高通量测序技术对大鼠粪便进行检测,结果发现,t2dm大鼠体内肠道菌群发生了失调,而八味小檗皮胶囊给药后可调节t2dm大鼠菌群的丰富度和多样性,t2dm大鼠的微生物组成结构逐渐趋于正常。结果表明,t2dm大鼠体内肠道菌群发生了失调,八味小檗皮胶囊可恢复肠道菌群的稳态。
[0109]
综上所述,藏药八味小檗皮胶囊能显著改善胰岛素抵抗、减少炎症、降低血脂水平,并改善肠道菌群失调,可用于治疗t2dm。
[0110]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1