一种利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法及其应用
1.本发明涉及肿瘤生物学领域,特别涉及一种利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法及其应用。
背景技术:
2.因三阴乳腺癌、非小细胞肺癌和胰腺导管腺癌患者肿瘤具有高转移性,发展迅速,化疗耐药和临床隐匿等特点,至今仍缺乏有效的个体化治疗方法。虽然阿霉素(doxorubicin,dox)和吉西他滨(gemcitabine,gem)等化疗药物可以在一定程度上提高以上癌症患者存活率,但肿瘤区域血管少、药物靶向性差等原因导致单药化疗有效率低下。所以急需构建一种药物递送体系提高化疗药物肿瘤递送效率,从而提高其疗效。
3.细胞在受到化疗药物、紫外、饥饿等刺激时会产生粒径在100~1000nm微泡(mv),该微泡会携带母细胞相关蛋白及抗原等信息,可与母细胞产生同源性靶向作用。目前,肿瘤细胞、成纤维细胞、脂肪细胞、树突状细胞和中性粒细胞等来源的细胞膜已被广泛应用于抗肿瘤药物的靶向递送。但大部分研究都基于已有的细胞系展开,导致难以实现有效的临床转化;而直接制备患者来源肿瘤细胞的微泡又面临着癌细胞在体外培养过程中表型改变等问题,导致微泡在体内的药物输送效率及疗效降低。
4.类器官(organoid)是一种利用人体组织来源的成体干细胞或肿瘤细胞在基质胶中培养得到的与人体组织表型高度一致的可用于药物筛选的体外3d模型,该模型可部分重现人体器官结构,基本保持了原器官或肿瘤的遗传表型,是一种重要的人体组织体外模型。三阴乳腺癌,非小细胞肺癌和胰腺导管腺癌等实体瘤患者肿瘤组织均可用于衍生类器官。但到目前为止,尚未发现有患者肿瘤来源类器官衍生微泡包载化疗药物以实现个体化靶向治疗的相关报道。
技术实现要素:
5.本发明的首要目的在于克服现有技术的缺点与不足,提供一种利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法。
6.本发明的另一目的在于提供所述利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法的应用。
7.本发明的目的通过下述技术方案实现:
8.一种利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法,包括如下步骤:
9.(1)类器官培养
10.将肿瘤患者自体来源的肿瘤组织剪切后进行酶消化,然后将消化后的肿瘤细胞用滤网过滤,离心收集后与基质胶混合均匀,再加入类器官培养基进行培养,待类器官生长到直径为200~400μm,收集得到类器官;
11.(2)制备载药类器官微泡
12.将步骤(1)中得到的类器官经紫外刺激后加入化疗药物,孵育,然后收集培养液,并离心去除细胞及碎片,再离心收集得到载药类器官微泡;其中,紫外刺激的条件为:利用功率为8w、波长为254nm的紫外灯照射30~90min。
13.步骤(1)中所述的肿瘤为人胰腺癌、人三阴乳腺癌或人非小细胞肺癌;优选为人胰腺癌。
14.步骤(1)中所述的酶消化所用的消化液为含有5mg/ml胶原酶ⅲ,10.5μm y27632(y0503),10μg/ml dnaseⅰ的advanced dmem/f12培养基。
15.步骤(1)中所述的酶消化的条件为:37℃消化45~55min;优选为:37℃消化50min。
16.步骤(1)中所述的滤网优选为70μm滤网。
17.步骤(1)中所述的基质胶为matrigel基质胶。
18.步骤(1)中所述的基质胶的用量为按每微升肿瘤细胞(离心收集的沉淀)配比30~35μl基质胶计算;优选为按每微升肿瘤细胞配比32μl基质胶计算。
19.步骤(1)中所述的类器官培养基为含有前列腺素e2(peg2)和胃泌素gastrin i的类器官培养基;优选为含有20ng/ml wnt-3a(wnt3a-conditioned medium),500ng/ml r-spondin1(r-spondin1-condition medium),1
×
b27supplement(b27添加剂);10mm烟酰胺(nicotinamide),1.25mm n-乙酰-l-半胱氨酸(n-acetylcsteine),100μg/ml primocin(primocin
tm
抗生素),100ng/ml hnoggin(human noggin),50ng/ml hegf(人表皮生长因子),100ng/ml hfgf(酸性成纤维生长因子),10nm hgastrin i(胃泌素,gastrin i human),500nm a 83-01,10.5μm y-27632,1μm前列腺素e2(peg2)的human wash medium。
20.所述的human wash medium为含有ph 7.2~7.5、10mm 4-羟乙基哌嗪乙磺酸(hepes),1
×
glutamax supplement(glutamax
tm
添加剂),100μg/ml primocin(primocin
tm
抗生素)和0.1%(w/v)牛血清白蛋白(bsa)的advanced dmem/f12。
21.步骤(1)中所述的类器官的培养条件为:在37℃、5%(v/v)co2条件下培养7~10天。
22.步骤(1)中所述的类器官的收集方法为:吸出培养基,然后加入细胞回收液cell recovery solution吹打分散基质胶,冰上孵育30min,离心后再用类器官培养基分散,即为类器官悬液。
23.步骤(1)中所述的类器官的尺寸大小优选为直径200μm左右。
24.步骤(2)中所述的紫外刺激优选为在hl-2000 hybridization oven组合型分子杂交箱进行。
25.步骤(2)中所述的紫外灯的个数可根据实际需要进行选择,优选为5个。
26.步骤(2)中所述的紫外刺激的时间优选为60min。
27.步骤(2)中所述的化疗药物为阿霉素(dox)和吉西他滨(gem)的至少一种。
28.步骤(2)中所述的化疗药物的用量为按其在体系的终浓度为10~300μg/ml添加计算;优选为按其在体系的终浓度为50~300μg/ml添加计算;更优选为按其在体系的终浓度为100μg/ml添加计算。
29.步骤(2)中所述的孵育的时间为16~30h,以产生足够量的微泡;优选为24h。
30.步骤(2)中所述的离心去除细胞及碎片的条件为:2000~3500rpm离心5min,能有
效除去细胞碎片,又能充分保留微泡成分;优选为3000rpm离心5min。
31.步骤(2)中所述的离心收集得到载药类器官微泡的条件为:10000~15000rpm离心30min,收集到尽量多的微泡,同时不影响离心后微泡的分散;优选为13000rpm离心30min。
32.所述的利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法,在步骤(2)之后还包括进一步检测载药类器官微泡的载药量的步骤,后续可以根据载药量,按治疗剂量将其通过静脉会输给肿瘤患者,用于癌症的治疗。
33.所述的利用肿瘤患者自体来源的类器官衍生微泡包载化疗药物的方法在制备抗肿瘤药物方面的应用。
34.所述的肿瘤为人胰腺癌、人三阴乳腺癌或人非小细胞肺癌;优选为人胰腺癌。
35.本发明相对于现有技术具有如下的优点及效果:
36.1、为了解决目前临床上实体瘤(如:三阴乳腺癌,非小细胞肺癌和胰腺导管腺癌)治疗药物靶向性差,广泛耐药的问题,先利用人体肿瘤组织如人体胰腺肿瘤组织特异性培养生成胰腺癌类器官,并通过温和紫外刺激的方式成功制备了类器官衍生微泡(mv
org
),由于类器官保留了胰腺肿瘤组织里的复杂表型,因此该方法制备的mv
org
可靶向肿瘤微环境;本发明进一步利用该类器官和各种化疗药物共孵育还能制备获得包载不同化疗药物(dox、gem)的微泡mv
org-drug
(mv
org-dox
和mv
org-gem
),与对照组相比,mv
org-drug
使药物在肿瘤区域滞留并缓慢释放药物,延长了药物的半衰期,因此,该方法适用于以具有3d结构的肿瘤患者来源的类器官为供体的载药微泡的开发。
37.2、由于体内外环境的差异会影响肿瘤细胞一些特殊抗原及分子标志表达水平的改变,本发明致力于开发一种和患者体内肿瘤细胞高度同源的微泡载药系统,而研究表明,细胞在紫外射线刺激下会释放大量的细胞外囊泡,且体外培养的类器官和患者体内的肿瘤细胞表型基本一致,因此,本发明构建的微泡mv
org-drug
是一种有效的肿瘤药物递送系统,能够包载多种化疗药物,与普通药物相比具有更广泛的人体肿瘤靶向作用和更强的肿瘤细胞杀伤作用,同时该载体使药物在肿瘤区域滞留缓慢释放药物,增强单次给药药物治疗时长,更有效。
38.3、本发明通过构建患者来源胰腺肿瘤类器官异位移植小鼠模型(pdx)并静脉注射mv
org-drug
,将该微泡静脉注射到体内,双光子活体显微成像结果表明mv
org-drug
能够有效穿透肿瘤血管,到达肿瘤深部,实现肿瘤深部药物输送。
39.4、相比于其他细胞膜衍生给药系统,本发明开发的mv
org
药物递送体系具有以下优势:(1)载体材料来自于人体自身肿瘤组织,具有较高的生物安全性和生物相容性;(2)所开发mv
org
衍生于人肿瘤组织来源的类器官,与患者癌组织表型高度一致,具有更强的同源靶向效应,可实现更有效的个体化靶向治疗,实现癌症个体化给药;(3)mv
org
可包载不同化疗药物,且能够明显提高化疗药物在肿瘤的富集,提高化疗疗效;(4)患者肿瘤来源类器官(如:三阴乳腺癌,非小细胞肺癌和胰腺导管腺癌)易在体外大规模培养,有利于mv
org
后续的放大生产,并具有应于用治疗多种类型癌症患者的潜在广谱性;(5)由于其粒径优势,可以通过血液循环到达胰腺癌原位,穿过肿瘤血管进入肿瘤深部;(6)本发明中制备的包载的化疗药物dox和gem可有效杀伤肿瘤细胞;(7)由于其携带胰腺癌细胞膜成分,可特异性靶向胰腺癌组织,提高dox或gem在肿瘤组织的分布,增强疗效并降低全身毒副作用。
40.5、本发明先通过人体肿瘤组织制备类器官衍生微泡,再利用其包载不同化疗药物
获得微泡mv
org-drug
,最后通过检测mv
org-drug
的载药量(载药量=包载入载体dox(或gem)质量/载体质量
×
100%),按照治疗剂量将mv
org-drug
静脉还输给患者,用于癌症的治疗。
附图说明
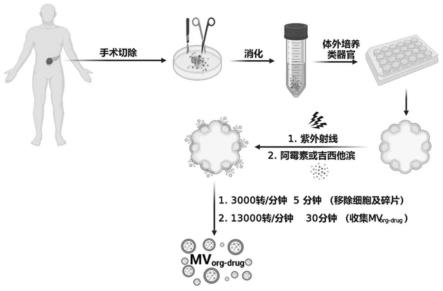
41.图1是从类器官的提取到微泡的制备的主要流程图。
42.图2是类器官培养7天左右的显微照片图(从图中可以明显看出该胰腺癌类器官呈现出中空球状结构)。
43.图3是利用该类器官制备的mv
org-dox
所拍摄的共聚焦显微照片图(照片显示微泡为均匀的球状结构)。
44.图4是将dox、mv
mia-dox
和mv
org-dox
分别与类器官共孵育24h后检测细胞存活率图。
45.图5是给荷瘤小鼠静脉注射dox和mv
org-dox
后双光子拍摄小鼠肿瘤内药物分布情况图(图中荧光显示药物在小鼠肿瘤内分布情况)。
46.图6是实施例2中构建载药类器官微泡mv
org-gem
的药物包载结果图。
47.图7是mv
org-gem
与类器官共孵育24h后检测细胞存活率图。
48.图8是不同照射时间获得载药类器官微泡中的蛋白含量图。
具体实施方式
49.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
50.1.相关试剂
51.a.培养基
52.类器官培养基为含有wnt3a-conditioned medium(wnt-3a),r-spondin1-condition medium(r-spondin1),b27添加剂(b27supplement),烟酰胺(nicotinamide),n-乙酰-l-半胱氨酸(n-acetylcsteine),primocin(primocin
tm
抗生素),hnoggin,人表皮生长因子(hegf),酸性成纤维生长因子(hfgf),胃泌素gastrin i(gastrin i human),a 83-01,y-27632,前列腺素e2(peg2)的human wash medium;其中human wash medium为含有4-羟乙基哌嗪乙磺酸(hepes),glutamax supplement(glutamax
tm
添加剂),primocin和牛血清白蛋白(bsa)的advanced dmem/f12。培养基中相关细胞因子添加的浓度和总量见表1。
53.b.试剂
54.表1相关试剂
[0055][0056][0057]
实施例1
[0058]
构建载药类器官微泡mv
org-dox
,所有实验操作均在生物安全柜中进行(图1)。
[0059]
(1)将胰腺癌患者来源的胰腺癌组织(组织大小约为1mm3)剪碎,用5ml预先配制好的消化液(消化液的配方为含有胶原酶ⅲ(ls004182,终浓度5mg/ml)、y27632(y0503,终浓度10.5μm)、dnaseⅰ(10μg/ml)的advanced dmem/f12)消化组织(37℃消化50min),消化好的组织溶液用70μm滤网过滤,200g离心收集肿瘤细胞,再将肿瘤细胞分散到matrigel基质胶
(25μl沉淀使用800μl基质胶重悬)并固定于24孔板,用于肿瘤类器官3d培养,待基质胶凝固后加入提前配制好的类器官培养基。
[0060]
(2)在37℃、5%(v/v)co2条件下培养7~10天,待类器官生长到合适大小(直径200~400μm均可,本实验选择直径200μm的类器官),吸出培养基加入细胞回收液cell recovery solution(每孔加入1ml)吹打分散基质胶,冰上孵育30min,离心收集后用预先配制好的类器官培养基分散为类器官悬液(每孔消化的类器官用500ml类器官培养基分散)。然后将该类器官悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯照射30min,加入阿霉素(dox)(终浓度为10mm)继续培养24h(紫外照射刺激后继续孵育目的为等待细胞摄取dox,分泌载药类器官微泡mv
org-dox
)后收集培养基;其中,类器官培养7天左右的显微照片如图2所示,从图中可以明显看出该胰腺癌类器官呈现出中空球状结构。
[0061]
(3)先将步骤(2)中收集的培养基3000rpm
×
5min离心去除大的细胞以及碎片,然后13000rpm
×
30min离心收集沉淀,沉淀用pbs缓冲液分散(离心后的微泡初步以100μl/孔浓度用pbs分散,后续可根据所需药物浓度调整)后即为载药类器官微泡mv
org-dox
;其中利用该类器官制备的mv
org-dox
所拍摄的共聚焦显微照片如图3所示:结果显示微泡为均匀的球状结构。
[0062]
实施例2
[0063]
构建载药类器官微泡mv
org-gem
,所有实验操作均在生物安全柜中进行。
[0064]
(1)将胰腺癌患者来源的胰腺癌组织(组织大小约为1mm3)剪碎,用5ml预先配制好的消化液(消化液的配方为含有胶原酶ⅲ(ls004182,终浓度5mg/ml)、y27632(y0503,终浓度10.5μm)、dnaseⅰ(10μg/ml)的advanced dmem/f12)消化组织(37℃消化50min),消化好的组织溶液用70μm滤网过滤,200g离心收集肿瘤细胞,肿瘤细胞分散到matrigel基质胶(25μl沉淀使用800μl基质胶重悬)并固定于24孔板,用于肿瘤类器官3d培养,待基质胶凝固后加入提前配制好的类器官培养基。
[0065]
(2)在37℃、5%(v/v)co2条件下培养7~10天,待类器官生长到合适大小(直径200~400μm均可,本实验选择直径200μm的类器官),吸出培养基加入细胞回收液cellrecovery solution(每孔加入1ml)吹打分散基质胶,冰上孵育30min,离心收集后用类器官培养基分散为类器官悬液(每孔消化的类器官用500ml类器官培养基分散)。然后将该类器官悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯照射30min,加入吉西他滨(gem)(终浓度为10mm),继续培养24h后收集培养基(这里紫外照射刺激后继续孵育目的为等待细胞摄取gem,分泌载药类器官微泡mv
org-gem
);
[0066]
(3)先将步骤(2)中收集的培养基3000rpm
×
5min离心去除大的细胞以及碎片,然后13000rpm
×
30min离心收集沉淀,沉淀用pbs缓冲液分散(离心后的微泡以100μl/孔浓度用pbs分散)后即为载药类器官微泡mv
org-gem
。
[0067]
(4)离心收集微泡(mv),所得微泡平均分为两部分,一部分用ripa裂解液裂解mv后,用bca蛋白定量试剂盒检测mv中的蛋白含量。另一部分用50μl纯甲醇破坏mv结构(用40khz非接触式超声仪超声10min,破坏囊泡膜结构)释放gem后,离心去除mv碎片,用hplc(高效液相色谱法)(流动相为乙腈-0.1%(v/v)三氟乙酸溶液,体积比为3:97),流速1ml/
min,紫外检测波长268nm)检测gem含量。投入不同浓度gem(每1
×
106细胞分别投入54.4、108.7、217.4和434.8μg,计算对应药物包载量,确认217.4μg是最佳投药量),药物包载结果见图6。
[0068]
(5)将所得mv
org-gem
与步骤(2)中获得的类器官共孵育24h,结果显示该药物递送体系能快速进入类器官细胞内并获得较好的肿瘤杀伤效果(图7)。
[0069]
实施例3
[0070]
通过改变紫外照射时间确定最佳实验条件。
[0071]
(a)参考实施例1的方法,将步骤(2)中的类器官悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯下照射30min后取出,加入dox(终浓度为10mm)孵育24h,离心收集mv
org-dox-1。
[0072]
(b)参考实施例1的方法,将步骤(2)中的类器官悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯下照射60min后取出,加入dox(终浓度为10mm)孵育24h,离心收集mv
org-dox-2。
[0073]
(c)参考实施例1的方法,将步骤(2)中的类器官悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯下照射90min后取出,加入dox(终浓度为10mm)孵育24h,离心收集mv
org-dox-3。
[0074]
(d)用bca蛋白定量试剂盒检测步骤(a)~(c)所得mv
org-dox-1、mv
org-dox-2和mv
org-dox-3所含总蛋白量。
[0075]
不同照射时间获得微泡中的蛋白含量见图8:结果显示,步骤(b)收集到的微泡(mv)最多。因此,本发明以60min为紫外照射最优时间。
[0076]
实施例4
[0077]
通过改变加入类器官中dox浓度确定最佳实验条件。
[0078]
(a)参考实施例1的方法,将步骤(2)中的类器官悬液经紫外照射后,分别与终浓度为300、200、100、50和10μg/ml的dox共孵育24h。
[0079]
(b)离心收集微泡(mv),所得微泡平均分为两部分,一部分用ripa裂解液裂解mv后,用bca蛋白定量试剂盒检测mv中的蛋白含量。另一部分用纯甲醇破坏mv结构(用40khz非接触式超声仪超声10min,破坏囊泡膜结构)释放dox后,离心去除mv碎片,用hplc(高效液相色谱法)(流动相为0.1%(v/v)三氟乙酸水溶液:乙腈=75:25(v/v),流速1ml/min,荧光检测波长470/585nm)检测dox含量,三次重复,并根据测量结果计算药物包载率;其中,载药量的计算公式如下:载药量=包载入载体dox质量/载体质量
×
100%。
[0080]
结果如表2所示:结果显示投药浓度为100μg/ml,载药量最大。因此,本发明以100μg/ml为最佳投药浓度。
[0081]
表2载药量
[0082]
投药浓度(μg/ml)3002001005010蛋白含量(μg)49.5642.3131.8125.318.19dox含量(μg)3.973.883.582.180.33载药量(%)8.019.1811.258.634.05
[0083]
效果实施例1
[0084]
比较未包载的dox与mv
org-dox
对类器官杀伤作用。
[0085]
(1)将实施例1制备的mv
org-dox
按照dox终浓度为5000、2500、1000、500、250、100、50、25、10、0nm分别与实施例1步骤(2)获得的类器官悬液共孵育24h,测定细胞存活率,检测二者对肿瘤细胞杀伤效果,同时以相应浓度的dox与类器官共孵育24h为对照。
[0086]
结果如图4所示:结果显示,与mv
org-dox
相比,未包载的dox的细胞杀伤和肿瘤靶向效果都较差,mv
org-dox
中dox的ic50值从58.71nm降到了4.52nm,结果证明该药物递送体系能够进入快速类器官细胞内,能够有效提高肿瘤化疗杀伤效果。
[0087]
(2)
①
构建胰腺癌类器官异位移植小鼠模型:待类器官(实施例1)生长到合适大小(直径200~400μm),吸出培养基每孔加入1ml细胞回收液cell recovery solution,吹打分散基质胶,冰上孵育30min,离心收集后每2孔细胞用30μl matrigel基质胶分散,注射到小鼠(balb/c裸鼠,雄性,体重20g左右,来源于广东省医学实验动物中心)胰腺,10天后即可进行实验。
[0088]
②
将dox和实施例1制备的mv
org-dox
通过尾静脉注射(以dox计,注射量为5mg/kg)到上述人胰腺癌类器官异位移植小鼠体内,用双光子活体显微成像系统检测肿瘤内药物荧光强度,记录注射后第120、128、136、144min的荧光强度。
[0089]
结果如图5所示:与mv
org-dox
双光子成像结果相比,游离dox虽能到达肿瘤,但会被快速清除,而mv
org-dox
不仅能大量聚集到肿瘤,且能滞留较长时间,达到肿瘤靶向的效果(图中荧光显示药物在小鼠肿瘤内分布情况)。
[0090]
效果实施例2
[0091]
比较人肿瘤细胞系miapaca-2构建的肿瘤微泡载药体系mv
mia-dox
与mv
org-dox
对类器官杀伤作用。
[0092]
(1)用人胰腺癌细胞系miapaca-2构建肿瘤微泡载药体系mv
mia-dox
,具体步骤如下:
[0093]
①
获取人胰腺癌细胞系miapaca-2(购自atcc),按照atcc说明培养细胞,传代3次以上,稳定细胞状态。
[0094]
②
待细胞生长到80%密度,将该细胞悬液置于hl-2000 hybridization oven组合型分子杂交箱中(内室规格356
×
273
×
273mm,内置8w、254nm紫外线光源5个),紫外灯照射30min,加入dox(终浓度为10mm)继续培养24h后收集培养基。
[0095]
③
先将培养基3000rpm
×
5min离心去除大的细胞以及碎片,然后13000rpm
×
30min离心收集沉淀,沉淀用pbs缓冲液分散(离心后的微泡以100μl/孔浓度用pbs分散)后即为mv
mia-dox
。
[0096]
(2)将mv
mia-dox
和实施例1制备的mv
org-dox
(按照dox计算,终浓度为5000、2500、1000、500、250、100、50、25、10、0nm)分别加入到实施例1步骤(2)获得的类器官中共孵育24h,测定细胞存活率,检测二者对肿瘤细胞杀伤效果,同时以dox与类器官共孵育24h为对照。
[0097]
结果如图4所示:结果显示,与mv
mia-dox
相比mv
org-dox
肿瘤杀伤效果更佳,将mv
mia-dox
ic50值从28.21nm降到了4.52nm(ic50值是根据存活率拟合曲线计算出来的,doxic50=58.71nm,mv
mia-dox ic50=28.21nm,mv
org-dox
=4.52nm)。结果证明mv
org-dox
对人体肿瘤有更好的靶向性和药物递送效果。
[0098]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1