一种纳米级超声/磁共振双模态造影剂和其制备方法及应用
1.本
技术实现要素:
属于医药技术领域。涉及一种纳米级双模态造影剂的制备方法及性质,造影剂采用乳化溶剂挥发法制备,可用于肿瘤病灶的超声成像、mri成像诊断及肿瘤的靶向治疗,是一类诊疗一体化的新型多功能影像学纳米造影剂。
背景技术:
2.该双模态造影剂主要进行超声成像与cest mr 成像。
3.纳米泡是指粒径处于纳米范围内的超声造影剂。当粒径小于700 nm时,由于高渗透性长滞留效应(enhanced permeability and retention, epr)的存在,纳米泡就有可能穿透肿瘤的血管壁间隙,从而实现血管外组织的成像。制备纳米泡所用的气体,早期是用空气或者氧气等,但是这些气体在体内的稳定性较差,需要现配现用,且制备成纳米泡后图像的对比度较差;后来采用氟碳烷烃类(如全氟戊烷,全氟丙烷及全氟丁烷等),它显著提高了成像的对比度,且成像时间长,具有良好的体内外稳定性。制备纳米泡所用的生物相容性材料,主要包括天然高分子材料(如磷脂,胆固醇等)与合成高分子材料(如聚乳酸,聚乙二醇,聚丙烯酸及聚乳酸-羟基乙酸共聚物等),这些材料不会产生溶血效应,具有无毒或者低毒等优点。纳米泡除了作为超声造影剂,增强成像效果外,亦可以作为药物递送系统的载体,并具有开放血脑屏障的作用。
4.cest成像是磁共振成像的分支之一,成像原理是当外界饱和射频脉冲(频率与待测物质子的共振频率相同)照射至待测物时,待测物的质子被饱和并与水发生质子交换,这种过程会不断地累积持续直至动态平衡。最终结果是水与待测物的磁共振信号都会下降,只是水质子信号下降更为明显。cest mr成像的最大优点是可以监测体内ph的动态变化,这对于一些导致体内酸碱平衡的疾病(如肾炎等)的检测更为敏感。cest mr成像造影剂分为内源性与外源性对比剂,内源性对比剂主要是体内的氨基酸、多肽以及蛋白质等,其中含有可以交换的酰胺和羟基质子,但是这些物质在体内的浓度较低,所以成像效果不太明显,需加入外源性对比剂提高成像对比度;外源性对比剂主要由嘧啶类(如5,6-二氢尿嘧啶),碘类(如碘帕醇)和金属螯合物(如镧系元素的螯合物)等组成,这些化合物的质子相对于水的共振频率要高出很多,使得cest mr成像灵敏度更高,成像对比度亦比内源性对比剂更好。不过,外源性对比剂的毒性较大,若长期使用会对人体产生危害。
5.实验表明:水杨酸作为外源性对比剂可以改善cest mr成像的效果,但是水杨酸对眼,皮肤和肾的毒性较大,为了降低水杨酸的毒副作用,本专利选用生物相容性材料包载水杨酸,使其粒径处在纳米范围内,这样不仅可以减缓水杨酸的毒副作用,而且也可以使水杨酸纳米粒子富集于肿瘤血管与组织,从而实现靶向成像。
6.目前有关造影剂的发明专利已有很多,如中国发明专利cn101683272a公开了一种超声敏感载药纳米泡,但其实质上是采用透析法结合超声共振法制备的载氟碳化合物的聚合物胶束,并不是真正意义上的包膜纳米泡,且没有动物在体试验或细胞试验数据证明其作用效果。中国发明专利cn101954096b公开了一种能够增强超声、ct和mri成像的含壳核结
构纳米粒的脂质乳剂,但其实质是载液体氟碳化合物和纳米磁球的脂质乳剂,不是真正意义上的包膜纳米泡,也不具有靶向性。该脂质乳剂采用传统的薄膜水化-分散乳化-超声制备工艺,难以准确控制粒径,粒径分布宽,制备工艺重现性差。中国发明专利cn 111632154 a公开了一种包载全氟丙烷的纳米泡,采用超声声振法制备,其粒径为101
±
2.7 nm,体外两个月粒径稳定性较好。同时给出了体外和体内的成像数据,但是,超声成像无法检测出肿瘤组和血管的ph变化。本专利的最大优势在于采用聚乙二醇-聚乳酸同时包载全氟戊烷与水杨酸,制备成纳米级双模态造影剂,不仅可以实现epr效应,还能同时进行超声成像与cest mr成像。另外,造影剂在4℃条件下可存放一个月,粒径变化较小,在临床诊断方面有极大的应用潜力。
发明内容
7.为了解决上述技术问题,本发明的目的在于提供一纳米级双模态造影剂的制备方法及应用。
8.本发明所制备的造影剂粒径均一可控,体内外稳定性好,能增强超声成像和cest磁共振成像。本发明还提供了该纳米粒的制备方法,其制备条件温和,制备工艺重现性好。
9.本发明提供的方案如下:一种纳米级双模态造影剂,由载体材料、囊心填充物、表面活性剂、乳化剂和水相组成;所述载体材料为聚乙二醇-聚乳酸,为油相o2相;所述囊心填充物为液态全氟戊烷,为油相o1相;所述囊心填充物为水杨酸,为油相o2相;所述表面活性剂为span20、span40、span60、span80、span85等;所述乳化剂为o/w型乳化剂,包括十二烷基硫酸钠(sds)、聚乙烯醇(pva)、泊洛沙姆188与吐温80等;由里向外依次为o2相、o1相和水相;所述聚乙二醇-聚乳酸含量为0.64~1.1wt%,液态全氟戊烷含量为5.2%~11.0wt%,水杨酸含量为0.059~0.12 wt%,余量为水相。优选的,所述聚乙二醇-聚乳酸含量为0.92~1.1wt%,液态全氟戊烷含量为9.2%~11.0wt%,水杨酸含量为0.090~0.12 wt%,余量为水相。
10.上述纳米粒的粒径范围为100~500 nm。优选的,纳米粒的粒径范围为200~400 nm,多分散指数pdi≤0.55。纳米粒填充物质为全氟戊烷(c5f12)和水杨酸,全氟戊烷常温下为液体,沸点29.5℃,在体内发生液-气相转变成为气体。
11.上述聚乙二醇-聚乳酸的相对分子量为16000~26000。聚乙二醇-聚乳酸可通过化学偶联肿瘤特异性靶向因子实现肿瘤靶向,肿瘤特异性靶向因子为叶酸、乳铁蛋白、乳铁蛋白受体单链抗体、转铁蛋白、转铁蛋白受体单链抗体、甲胎蛋白(afp)受体单抗、rgd肽或各种癌细胞的单克隆抗体等。
12.本发明的另一目的在于提供上述纳米级双模态造影剂的制备方法,其特征在于,包括以下步骤:(1)将聚乙二醇-聚乳酸作为载体材料溶于三氯甲烷中,并滴两滴span80,后将适量水杨酸溶于无水乙醇并加入上述共聚物溶液中成为油1即o1相;液态全氟戊烷作为油2即
o2相;在冰水浴中以高剪切混合两相,使o2相均匀分散在o1相中,形成o2/o1初乳;(2)将o2/o1初乳在冰水浴的超声处理下逐滴加入水相中,得到稳定复乳o2/o1/w,其中w相是指水相;(3)将o2/o1/w复乳在冰水浴的条件下磁力搅拌直至有机溶剂挥干,固化形成纳米粒;上述步骤(1)中,高剪切的剪切速率5000~20000 rpm。
13.上述步骤(2)中所述超声处理采用间歇式工作的方式,超声处理1~10s,间隔1~10s,工作时间为1~5min,超声功率设定为100~195w。优选的,超声处理2~8 s,间隔2~8 s,工作时间为3~5min,超声的功率设定130~195w。
14.本发明还提供了上述纳米粒在肿瘤诊断的双模态成像造影剂和抗肿瘤靶向药物中的应用。
15.纳米粒亦可负载的抗肿瘤药物作为抗肿瘤靶向药物,抗肿瘤药物包括紫杉醇、多西他赛、羟基喜树碱、阿霉素、丝裂霉素、他莫昔芬、5-氟尿嘧啶、甲氨蝶呤、阿糖胞苷、环磷酰胺、或铂类药物(顺铂、卡铂或奥沙利铂)等临床常用的抗肿瘤药物。
16.除此以外,纳米粒水分散体系中还可添加注射剂常用的添加剂以增加纳米粒的性能,如防腐剂叠氮钠、硫柳汞、苯酚等,添加剂可占纳米粒水分散体系总质量的0.5~2.0wt%。
17.本发明的有益效果:(1)载体材料选用聚乙二醇-聚乳酸,属于两亲性高分子,在水相与油相中皆具有良好的溶解性,具有生物相容性好,易于与靶向因子偶联等优点,通过选择适宜的分子量,可以调控其力学性能、降解时间等,从而制备力学性能适宜(韧性好、抗压性适中)、稳定性好和降解时间适宜的造影剂;(2)囊心填充物选用液态全氟戊烷,其在体温下发生液-气相转变,可形成含气纳米泡,并在超声作用下增强肿瘤病灶的超声成像效果;(3)与常规超声微泡对比剂比较,纳米粒可以穿越肿瘤血管内皮,并在靶向因子作用下直达特异性靶向肿瘤病灶;(4)所制备的纳米粒可以实现功能性负载;可以负载抗肿瘤药物,用于肿瘤的靶向治疗;(5)采用乳化溶剂挥发方法可以实现对纳米粒粒径的精确调控,制得的纳米粒的粒径高度均一,单分散性好,体内外稳定性好,血液循环时间长,可以实现肿瘤病灶的重复检查、动态监测及疗效评估;(6)乳化溶剂挥发方法制备条件温和,能够避免在制备中破坏多肽、蛋白质、抗体等靶向因子的生物活性;(7)通过控制超声的条件,乳化溶剂挥发方法制备工艺重现性好,不同批次纳米粒的粒径、pdi值波动极小,且制备工艺可以按比例放大,易于实现大规模制备。
附图说明
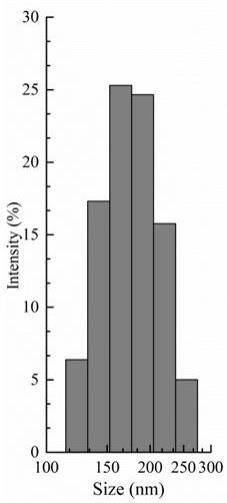
18.图1是本发明的技术方案中纳米粒的粒径分布图;图2是纳米粒4℃条件下放置1个月稳定性试验结果;
图3是37℃水浴条件下造影剂在乳胶手套中的成像图,其中3a为生理盐水,3b为耦合剂,3c为造影剂;图4是乳胶手套模具中不同温度下造影剂的体外超声图像;图5是裸鼠皮下肿瘤的超声成像图;5a为注射造影剂之前,5b为注射造影剂之后。
19.图6是不同ph和不同强度的饱和射频脉冲辐射下的体外cest mr成像。
20.图7是大鼠脑胶质瘤的cest mr成像。
具体实施方式
21.下面通过借助实施例更加详细地说明本发明,但以下实施例仅是说明性的,本发明的保护范围并不受这些实施例的限制。
22.本发明所制备的纳米粒以可生物降解的聚乙二醇-聚乳酸为包膜材料,以可在体内发生液-气相转变的全氟戊烷和水杨酸为囊心填充物质,采用乳化溶剂挥发方法制备。其中,按质量百分比计所述聚乙二醇-聚乳酸含量为0.64~1.1wt%,液态全氟戊烷含量为5.2%~11.0wt%,水杨酸含量为0.059~0.12 wt%,余量为水相。优选的,所述聚乙二醇-聚乳酸含量为0.92~1.1wt%,液态全氟戊烷含量为9.2%~11.0wt%,水杨酸含量为0.090~0.12 wt%,余量为水相。所述聚乙二醇-聚乳酸的分子量为16000~26000。纳米粒的粒径范围为100~1000 nm;优选的,纳米粒的粒径范围为200~400nm,多分散指数(pdi)≤0.55。
23.纳米粒注射进入体内后,液态氟碳化合物在体温下发生液-气相转变,形成含气纳米泡,通过靶向因子与肿瘤细胞的特异性结合,纳米泡富集在肿瘤病灶部位,从而改善肿瘤病灶超声成像效果。同时,纳米粒负载的常规cest mri对比剂——水杨酸,提高微小肿瘤病灶mri成像的准确性和灵敏性,改善肿瘤影像学早期诊断效果。纳米粒可以负载抗肿瘤药物,用于肿瘤的靶向治疗,作为抗肿瘤药物靶向输送材料,是一类新型的诊疗一体化的多功能影像学纳米对比剂。
24.纳米粒的基本制备过程如下:(1)将聚乙二醇-聚乳酸作为载体材料溶于三氯甲烷中,并滴两滴span80,后将适量水杨酸溶于无水乙醇并加入上述共聚物溶液中成为油1即o1相;液态全氟戊烷作为油2即o2相;在冰水浴中以高剪切混合两相,使o2相均匀分散在o1相中,形成o2/o1初乳;(2)将o2/o1初乳在冰水浴的超声处理下逐滴加入水相中,得到稳定复乳o2/o1/w,其中w相是指水相;(3)将o2/o1/w复乳在冰水浴的条件下磁力搅拌直至有机溶剂挥干,固化形成纳米粒。
25.上述步骤(1)中,高剪切的剪切速率5000~20000 rpm。
26.上述步骤(2)中所述超声处理采用间歇式工作的方式,超声处理1~10s,间隔1~10s,工作时间为1~5min,超声功率设定为100~195w。优选的,超声处理2~8 s,间隔2~8 s,工作时间为3~5min,超声的功率设定130~195w。
27.实施例1纳米级双模态造影剂的制备:(1)制备聚乙二醇-聚乳酸共聚物称取重结晶左旋丙交酯适量,加入到50 ml 单口圆底烧瓶中,加辛酸亚锡、聚乙二
醇6000适量,抽真空,充氮气两次,在氮气保护的条件下120 ℃反应2 h。反应后生成的固体用三氯甲烷溶解,沉淀于无水乙醚中,抽滤,如此反复三次,最后在40℃下真空干燥24 h。
28.(2)采用乳化溶剂挥发法制备纳米粒(
ⅰ
)将聚乙二醇-聚乳酸50mg作为载体材料溶于1ml三氯甲烷中,并滴两滴span80,后将30mg水杨酸溶于0.5ml无水乙醇并加入上述共聚物溶液中成为油1即o1相;用移液枪取液态全氟戊烷500μl作为油2即o2相;在冰水浴中以高剪切(转速为5000rpm,时间为3min)混合两相,使o2相均匀分散在o1相中,形成o2/o1初乳;(
ⅰⅰ
)将o2/o1初乳在冰水浴的超声处理下逐滴加入至水相(1%聚乙烯醇溶液5ml)中,得到稳定复乳o2/o1/w,其中w相是指水相,超声功率设定为195w,工作时间为3min,超声处理1s,间隔2s。
29.(
ⅰⅱ
)将o2/o1/w复乳在冰水浴的条件下磁力搅拌直至有机溶剂挥干,固化形成纳米粒;最后放置在4℃冰箱保存。
30.粒径及微观形貌分析:采用激光粒度仪(zetasizer/nano zs90,malvern公司)4℃时测定纳米粒的粒径,测得平均粒径为(223.8
±
2.5)nm,pdi为(0.153
±
0.020)。图1为激光粒度仪测得的纳米粒的粒径,图2为粒径分布图。
31.实施例2制备方法同实施例1,,区别在于:步骤(3)的(i)中聚乙二醇-聚乳酸共聚物用量为45mg,水杨酸含量34mg,全氟戊烷(pfp)用量为400μl,剪切速率为10000rpm;步骤(3)的(iii)中超声工作时间2s,间隔2s,工作时间4min,超声功率为150w。
32.实施例3制备方法同实施例1,,区别在于:步骤(3)的(i)中聚乙二醇-聚乳酸共聚物用量为40mg,水杨酸含量28mg,全氟戊烷(pfp)用量为450μl,剪切速率为18000rmp;步骤(3)的(iii)中超声工作时间1s,间隔1s,工作时间5min,超声功率为100w。
33.实施例4制备方法同实施例1,,区别在于:步骤(3)的(i)中聚乙二醇-聚乳酸共聚物用量为35mg,水杨酸含量26mg,全氟戊烷(pfp)用量为500μl,剪切速率为20000rmp;步骤(3)的(iii)中超声工作时间1s,间隔2s,工作时间3min,超声功率为195w。
34.实施例5一、纳米粒放置稳定性试验将实施例1制备的纳米粒置于4℃冰箱中保存,每隔一定时间取样采用激光粒度仪测定其粒径,评价纳米粒4℃条件下放置稳定性,试验结果见图2。由试验可知,纳米粒在4℃条件下放置1个月其粒径变化非常小,表明纳米粒在4℃条件下具有较好的稳定性。
35.二、37℃条件下纳米级双模态造影剂的超声成像试验将实施例1制备的造影剂及对照品生理盐水和耦合剂装入乳胶手套,置于37℃恒温水浴中,分别取样采用超声探头(ge-logiq7;探头型号 l10-5)的频率是10 mhz,机械指
数(mi)是0.4,成像模式是普通的b超模式。
36.结果见图3,在超声波的辐照下,造影剂在手套中呈现出一个个亮点(如图3c所示),这些均匀密集的亮点形成了超声高信号,能增强超声成像,而对照品生理盐水和耦合剂中,未见到亮点(如图3a,b所示)。
37.三、造影剂在不同温度下的体外超声成像试验将实施例 1 制备的造影剂置于20℃水浴中,水浴缓慢升温,分别在20℃、22℃、24℃、26℃、28℃、30℃、32℃、34℃、36℃和38℃下进行超声成像,考察造影剂不同温度条件下的变化趋势,试验结果见图4。由结果可知,随温度升高全氟戊烷发生气化,造影剂逐渐膨胀,23℃-36℃成像的图片上亮点增大,38℃时亮点又减弱,说明36℃时候,造影剂气化最完全,最适合超声成像。
38.四、体内超声成像试验将实施例1制备的造影剂注射至皮下瘤模型裸鼠,进行体内超声成像试验。
39.仪器型号:ge logiq 9 型彩色多普勒超声仪。主要测试参数:线阵探头,频率9mhz,mi0.50,采用编码反向谐波成像技术(pulse inversion harmonic imaging,pihi)。
40.试验结果:试验动物为皮下瘤模型裸鼠,由图5(5a为注射造影剂之前,5b为注射造影剂之后)可知,皮下瘤模型裸鼠注射造影剂后,肿瘤超声信号明显增强,显示了造影剂良好的肿瘤超声增强成像作用。
41.五、体外cest mr成像实验将实施例1制备的造影剂置于试管中,并用pbs溶液溶解并调节ph分别至6.0,6.4,7.0,7.6。然后用1%琼脂糖溶液固定试管,然后分别置于强度为1.0,2.0,2.5,3.0 和4.0 μt的饱和射频脉冲的辐射下进行cest mr成像。由结果可知,随着饱和射频脉冲的强度增加,cest mr信号增强(见图6a);随着ph 增大,cest mr 信号先增加后减小,在ph为6.4时,信号最强,成像对比度最好(见图6b)。
42.六、体内cest mr成像实验将实施例1制备的造影剂尾静脉注射至脑胶质瘤模型大鼠,进行体内体内cest mr成像实验。
43.仪器型号:7.0 t动物磁共振成像扫描仪。主要参数:重复时间为6000 ms;回波时间为27.63 ms;采用回波平面成像技术(echo planar imaging,epi)试验结果:试验动物模型为脑胶质瘤模型大鼠,由图7可知,脑胶质瘤模型大鼠注射造影剂后,肿瘤cest mr信号明显增强,且能持续2个小时,显示了造影剂良好的肿瘤cest mr成像作用。
44.以上所述,仅为本发明较佳的具体实施方式,但本发明保护的范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内所做的任何修改,等同替换和改进等,均应包含在发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1