一种植物木脂素或肠内酯与PD-1/PD-L1抑制剂联合用药物组合物及其应用
一种植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物及其应用
技术领域
1.本发明属于生物医药技术领域,尤其涉及一种植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物及其应用。
背景技术:
2.恶性肿瘤发病率高,异质性和侵袭性强,初始发病隐匿,易于转移,治疗后易于复发。其防治已成为困扰全世界的重大公共卫生问题。传统手术、放化疗或靶向治疗模式下的恶性肿瘤病人治疗效果差,绝大多数病人在治疗过程中出现耐药、复发及转移,加重了社会和经济负担。免疫治疗是目前抗击恶性肿瘤的新兴手段,被誉为“最具突破性”研究进展。
3.免疫检查点pd-1(programmed death receptor)和pd-l1(programmed death 1ligand)是肿瘤免疫治疗的研究热点。肿瘤细胞表面表达的pd-l1与t细胞表面的pd-1发生相互作用,抑制效应t细胞的激活、诱导fasl及免疫抑制细胞因子il-10的表达。pd-l1蛋白在多种恶性肿瘤中异常高表达。抑制pd-l1能够显著促进t细胞介导的肿瘤细胞凋亡。pd-l1还能够与foxp3+调节性t细胞协同发挥免疫抑制作用。在不同的恶性肿瘤亚型中,pd-l1的表达水平也存在异质性。例如在乳腺癌中,异常高表达的pd-l1与肿瘤分级、局部细胞毒性免疫反应以及病人预后相关。
4.大多数恶性肿瘤免疫原性弱、异质性强,对免疫治疗不敏感。亟需开发更为有效的治疗手段抑制恶性肿瘤免疫逃逸,增强肿瘤细胞对免疫治疗的敏感性。
技术实现要素:
5.为解决恶性肿瘤病人对免疫治疗不敏感的问题,本发明提供了一种植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物及其应用。
6.本发明的技术方案:
7.一种植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物,包括有效量的植物木脂素制剂或肠内酯制剂,还包括有效量的pd-1/pd-l1抑制剂。
8.进一步的,所述植物木脂素制剂包括含有木脂素前体的植物资源,所述木脂素前体能在机体内转化为肠内酯,所述植物资源包括脱脂亚麻籽、脱脂芝麻籽、脱脂油菜籽、黑麦麸、黑芝麻、芝麻、油菜籽、小麦麸、大麦麸、玉米麸、燕麦麸、牛蒡子粕和海藻中的一种或几种的组合。
9.进一步的,所述植物木脂素制剂包括含有木脂素前体的植物资源的水提物,所述木脂素前体能在机体内转化为肠内酯,所述植物资源包括脱脂亚麻籽、脱脂芝麻籽、脱脂油菜籽、黑麦麸、黑芝麻、芝麻、油菜籽、小麦麸、大麦麸、玉米麸、燕麦麸、牛蒡子粕和海藻中的一种或几种的组合。
10.进一步的,所述木脂素前体为开环异落叶松树脂酚、丁香树脂醇、牛蒡配基、落叶松脂醇、松脂酚或芝麻素。
11.进一步的,所述联合用药物组合物分为植物木脂素制剂和pd-1/pd-l1抑制剂两种单独的制剂,或肠内酯制剂和pd-1/pd-l1抑制剂两种单独的制剂。
12.进一步的,所述植物木脂素制剂或肠内酯制剂为每天给药,所述pd-1/pd-l1抑制剂为三天给一次药。
13.进一步的,植物木脂素制剂每天的给药量与pd-1/pd-l1抑制剂每三天的给药量的质量比为1:10-3
,肠内酯制剂每天的给药量与pd-1/pd-l1抑制剂每三天的给药量的质量比为1:2。
14.进一步的,所述植物木脂素制剂、肠内酯制剂或pd-1/pd-l1抑制剂还含有药学上可接受的载体或赋形剂。
15.一种植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物在制备抗肿瘤药物中的应用。
16.进一步的,所述肿瘤包括乳腺癌、淋巴瘤、黑色素瘤、肺癌、卵巢癌、宫颈癌、前列腺癌、肾癌、膀胱癌、脑胶质瘤、食管癌、胃癌、肝癌、胰腺癌和结直肠癌。
17.本发明的有益效果:
18.实验证实,植物木脂素或肠内酯联合pd-1/pd-l1抑制剂治疗可以增高具有抗癌功能的免疫细胞的占比,以抑制乳腺癌细胞免疫逃逸。亚麻木脂素联合pd-l1/pd-1抑制剂能够上调cd4和cd8阳性细胞比例,因此其抑制小鼠乳腺癌生长,抑癌效应优于亚麻木脂素或pd-l1/pd-1抑制剂单独用药。肠内酯联合pd-l1/pd-1抑制剂能够上调cd4和cd8阳性细胞的比例,因此其抑制小鼠乳腺癌生长的效应优于肠内酯或pd-l1/pd-1抑制剂单独用药。
19.本发明提供的植物木脂素或肠内酯与pd-1/pd-l1抑制剂联合用药物组合物及其应用为恶性肿瘤的免疫治疗提供了一种前所未有的有效辅助或协同治疗策略,能够加快植物木脂素或肠内酯从基础研究迈向临床实际应用转化。
附图说明
20.图1为实施例1各组小鼠体重变化对比图;
21.图2为实施例1各组小鼠肿瘤体积变化对比图;
22.图3为实施例1各组小鼠肿瘤组织外观对比照片;
23.图4为实施例1各组小鼠肿瘤质量对比图;
24.图5为实施例1各组小鼠肿瘤染色结果对比图;
25.图6为实施例1各组小鼠肿瘤中alkbh5蛋白表达水平对比图;
26.图7为实施例1各组小鼠肿瘤中eif5b蛋白表达水平对比图;
27.图8为实施例1各组小鼠肿瘤中pd-l1蛋白表达水平对比图;
28.图9为实施例1各组小鼠肿瘤中cd38蛋白表达水平对比图;
29.图10为实施例1各组小鼠肿瘤中cd4蛋白表达水平对比图;
30.图11为实施例1各组小鼠肿瘤中cd8的蛋白表达水平对比图;
31.图12为实施例2各组小鼠体重变化对比图;
32.图13为实施例2各组小鼠肿瘤体积变化对比图;
33.图14为实施例2各组小鼠肿瘤组织外观对比照片;
34.图15为实施例2各组小鼠肿瘤质量对比图;
35.图16为实施例2各组小鼠肿瘤染色结果对比图;
36.图17为实施例2各组小鼠肿瘤中alkbh5蛋白表达水平对比图;
37.图18为实施例2各组小鼠肿瘤中eif5b蛋白表达水平对比图;
38.图19为实施例2各组小鼠肿瘤中pd-l1蛋白表达水平对比图;
39.图20为实施例2各组小鼠肿瘤中cd38蛋白表达水平对比图;
40.图21为实施例2各组小鼠肿瘤中cd4蛋白表达水平对比图;
41.图22为实施例2各组小鼠肿瘤中cd8的蛋白表达水平对比图;
42.图23为实施例3各组小鼠粪便中细菌的门水平相对丰度柱形图;
43.图24为实施例3各组小鼠粪便中细菌的属水平相对丰度柱形图;
44.图25为实施例3各种小鼠粪便中属水平分类单元组成平均丰度前50位热图;
45.图26为实施例4各组样本中每个免疫细胞表面分子的表达量热图;
46.图27为实施例4根据质谱流式细胞结果分析得到的各组样本tsne降维分析图;
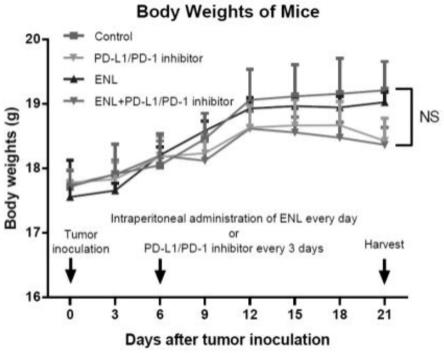
47.图28为实施例4根据质谱流式细胞结果分析各组样本单独聚类tsne图。
具体实施方式
48.下面结合实施例对本发明的技术方案做进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置,若未特别指明,本发明实施例中所用的原料等均可市售获得;若未具体指明,本发明实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
49.实施例1
50.本实施例通过小鼠实验考察了肠内酯(enl)制剂与pd-1/pd-l1抑制剂联合用药的抗肿瘤效果。
51.实验方法:
52.选取24只balb/c雌性小鼠,将4t1细胞接种于小鼠皮下。小鼠随机分成四组:对照组(control)、pd-l1/pd-1抑制剂组(pd-l1/pd-1inhibitor)、enl组以及enl联合pd-l1/pd-1抑制剂组(enl+pd-l1/pd-1inhibitor)。所有组别均为腹腔注射给药,其中enl每日给药,给药剂量为1mg/kg/只小鼠/日;pd-l1/pd-1抑制剂每三日给一次药,给药剂量为50ug/只小鼠/3日。对照组给予等量的配制溶剂进行腹腔注射。
53.监测小鼠体重变化,得到图1所示各组小鼠体重变化对比图,结果显示四组小鼠体重未见明显统计学差异。
54.经皮下成瘤后第6日开始测量各组小鼠肿瘤体积并开始给药,得到图2所示各组小鼠肿瘤体积变化对比图,结果显示自第12日开始,enl联合pd-l1/pd-1抑制剂组小鼠整体肿瘤体积小于对照组(p<0.01)。至第21日enl联合pd-l1/pd-1抑制剂组小鼠肿瘤体积最小,均具有统计学差异(p<0.05)。
55.处死小鼠,解剖肿瘤组织进行拍照,得到图3所示各组小鼠肿瘤组织外观对比照片;测量瘤体质量,得到图4所示各组小鼠肿瘤质量对比图;结果显示所有组别小鼠整体肿瘤质量均小于对照组(p<0.001),且enl联合pd-l1/pd-1抑制剂组小鼠肿瘤体积最小,与其它组别相比均具有统计学差异(p<0.05)。
56.对所得小鼠肿瘤进行alkbh5、eif5b、pd-l1、cd38、cd4和cd8免疫组织化学染色,染色方法为本领域常规染色方法。得到图5所示各组小鼠肿瘤染色结果对比图和图6-图11所示alkbh5、eif5b、pd-l1、cd38、cd4和cd8的蛋白表达水平对比图。结果显示:相较于对照组,enl以及enl联合pd-l1/pd-1抑制剂组中小鼠肿瘤alkbh5、eif5b、pd-l1、cd38均下调;联合治疗组cd4和cd8表达高于对照组和enl组(p<0.05)。
57.本实施例实验结果表明enl联合pd-l1/pd-1抑制剂能够上调cd4和cd8阳性细胞的比例,抑制小鼠乳腺癌生长的效应优于enl或pd-l1/pd-1抑制剂单独用药。
58.实施例2
59.本实施例通过小鼠实验考察了亚麻木脂素制剂与pd-1/pd-l1抑制剂联合用药的抗肿瘤效果。
60.实验方法:
61.选取24只balb/c雌性小鼠,将4t1细胞系接种于小鼠皮下。将小鼠随机分成四组:对照组(control)、pd-l1/pd-1抑制剂组(pd-l1/pd-1inhibitor)、亚麻木脂素组(flaxseed lignan)组以及亚麻木脂素联合pd-l1/pd-1抑制剂组(flaxseed lignan+pd-l1/pd-1inhibitor)。
62.本实施例使用的亚麻木脂素制剂制备方法为10g脱脂亚麻籽置于100ml纯水中,煮沸5min后收集液体得到亚麻木脂素制剂,亚麻木脂素制剂每日灌胃给药,灌胃体积为500ul/只小鼠/天;pd-l1/pd-1抑制剂每三日给一次药,给药剂量为50ug/只小鼠/3日。对照组给与等量的生理盐水灌胃以及配制溶剂进行腹腔注射。
63.监测小鼠体重变化,得到图12所示各组小鼠体重变化对比图,结果显示四组小鼠体重未见明显统计学差异(p>0.05)。
64.经皮下成瘤后第6日开始测量各组小鼠肿瘤体积并开始给药,得到图13所示各组小鼠肿瘤体积变化对比图,结果显示自第15日开始,联合治疗组小鼠整体肿瘤体积小于对照组(p<0.001)。第18日联合治疗组小鼠肿瘤体积小于pd-l1/pd-1抑制剂组以及亚麻木脂素单独用药组(p<0.05)。至第21日联合治疗组小鼠肿瘤体积最小,与其它各组相比均具有统计学差异(p<0.05)。
65.处死小鼠前留取小鼠粪便进行16s rdna测序。
66.处死小鼠,解剖肿瘤组织进行拍照,得到图14所示各组小鼠肿瘤组织外观对比照片;测量瘤体质量,得到图15所示各组小鼠肿瘤质量对比图;结果显示联合治疗组小鼠肿瘤质量最小,与其它组别相比均具有统计学差异(p<0.001)。
67.对所得小鼠肿瘤进行alkbh5、eif5b、pd-l1、cd38、cd4和cd8免疫组织化学染色,染色方法为本领域常规染色方法。得到图16所示各组小鼠肿瘤染色结果对比图和图17-图22所示alkbh5、eif5b、pd-l1、cd38、cd4和cd8的蛋白表达水平对比图。结果显示:相较于对照组,亚麻木脂素组以及亚麻木脂素联合pd-l1/pd-1抑制剂组中小鼠肿瘤alkbh5、eif5b、pd-l1、cd38均下调;联合治疗组cd4表达高于对照组和亚麻木脂素组(p<0.05);联合治疗组cd8表达高于对照组、单独亚麻木脂素组以及pd-l1/pd-1抑制剂单独用药组。
68.本实施例实验结果表明亚麻木脂素联合pd-l1/pd-1抑制剂能够上调cd4和cd8阳性细胞比例,抑制小鼠乳腺癌生长,抑癌效应优于亚麻木脂素或pd-l1/pd-1抑制剂单独用药。
69.实施例3
70.本实施例进一步对实施例2处死小鼠前收集的各组小鼠粪便进行16s rdna测序分析。
71.首先进行细菌门水平相对丰度柱形图比对,结果如图23所示,结果显示经亚麻木脂素处理后,verrucomicrobia(疣微菌门)丰度升高。
72.接下来进行细菌属水平相对丰度柱形图比对。结果如图24所示,相对于对照组,blautia(布劳特氏菌属)、bacteroides(拟杆菌属)和akkermansia(阿克曼菌属)在亚麻木脂素组和pd-l1/pd-1抑制剂组中丰度升高,在亚麻木脂素联合pd-l1/pd-1抑制剂组中最高。clostridium(梭菌属)在亚麻木脂素联合pd-l1/pd-1抑制剂组中的丰度明显升高。相对于对照组,lactobacillus(乳杆菌属)在亚麻木脂素组中减少,在亚麻木脂素联合pd-l1/pd-1抑制剂组中进一步减少。
73.接下来比较样本间的物种组成差异,对属水平的分类单元组成进行分析,默认使用平均丰度前50位的数据绘制热图,结果如图25所示,结果显示:亚麻木脂素联合pd-l1/pd-1抑制剂治疗可以使chelatococcus(螯台球菌属)、clostridium(梭菌属)、gemmiger(吉米菌属)、bifidobacterium(双歧杆菌属)、cupriavidus(贪铜菌属)、anoxybacillus(厌氧芽孢杆菌属)、blautia(布劳特氏菌属)以及parabacteroides(狄氏副拟杆菌属)丰度显著升高。能够显著增敏抗pd-1药物治疗效果的akkermansia(阿克曼菌属)在亚麻木脂素组以及亚麻木脂素联合pd-l1/pd-1抑制剂治疗组均高。能够在体内促进sdg向enl转化的eubacterium(真杆菌属)以及clostridium(梭菌属)丰度在亚麻木脂素组以及亚麻木脂素联合pd-l1/pd-1抑制剂治疗组也升高。
74.实施例4
75.本实施例通过进一步观测经木脂素或肠内酯处理后的小鼠肿瘤中浸润的免疫细胞情况考察了亚麻木脂素及肠内酯与pd-1/pd-l1抑制剂联合用药治疗抑制乳腺癌细胞免疫逃逸的效果。
76.取对照组、亚麻木脂素组、pd-l1/pd-1抑制剂组、enl组、enl联合pd-l1/pd-1抑制剂组以及亚麻木脂素联合pd-l1/pd-1抑制剂这6组小鼠的肿瘤组织进行cytof(质谱流式细胞术)检测。首先确定检测的panel,共包含42个免疫细胞相关的maker,marker以及对应的金属通道见表1。
77.表1
[0078][0079]
[0080]
将各组样本中每个marker的表达量汇总分析并绘制热图,结果如图26所示。
[0081]
将不同的marker根据细胞表型进行组合,共组合为36种细胞表型,分别人为命名为c01-c36,免疫细胞亚群注释见表2。
[0082]
表2
[0083]
[0084][0085]
然后将所有组别进行降维度合并,tsne降维分析,结果如图27所示,可以看到不同谱系的细胞可以明显区分。
[0086]
进一步对每组进行单独聚类,分别绘制聚类tsne图来评估6组肿瘤浸润免疫细胞在亚群上的不同差异,结果如图28所示。分析结果表明:亚麻木脂素联合pd-l1/pd-1抑制剂组可以使effector memory cd4
+
t(c06、c08号)、effector cd4
+
t(c09号)、memory cd8
+
t(c12、c13号)、granulocytes(c19号)和b细胞(c32、c33、c34号)占比增多,可以使m2型巨噬细胞(c29号)减少;enl联合pd-l1/pd-1抑制剂可以使memory cd8
+
t(c12、c13号)、granulocytes(c20,c21,c22,c23号)以及b细胞(c33号)比例增多,同样使m2型巨噬细胞减少(c29号)。说明植物木脂素或肠内酯联合pd-l1/pd-1抑制剂治疗可以增高抗癌免疫细胞占比,抑制乳腺癌细胞免疫逃逸。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1