一种鸡生殖前体细胞移植受体的制备方法
1.本发明涉及生物科技领域,尤其涉及一种鸡生殖前体细胞移植受体的制备方法。
背景技术:
2.鸡生殖前体细胞(如原始生殖细胞)移植对于家禽离体保种、保护濒危物种和制备基因修饰禽类意义重大。鸡胚胎期2.5天左右,用显微注射法将鸡原始生殖细胞注入鸡胚中,从而制备受体公鸡,公鸡性成熟(约6个月)才能采集精液进行配种,无法及时监测供体原始生殖细胞在受体公鸡睾丸中的发育情况。而且,供体原始生殖细胞与受体原始生殖细胞同时在受体公鸡睾丸发育,供体原始生殖细胞易被排斥,导致供体精子数量较少。因此,需要开发更合适的制备鸡生殖前体细胞移植受体公鸡的方法。
3.目前,钴源辐射睾丸和腹腔注射白消安均可以杀死内源性精原干细胞,是制备鸡生殖前体细胞移植受体公鸡的主要方法。然而,钴源辐射睾丸需要进行5次,存在一定辐射安全隐患,且繁琐、应激大。腹腔注射白消安重复性差,受体鸡只体重明显下降,还会直接引起受体造血系统损伤,严重时可直接导致受体死亡。
4.采用白消安来杀死内源性精原干细胞是一个可选方向,类似技术可见如下对比文件:
5.d1:zl201210343103.9公开了一种精原干细胞移植受体制备的方法,该方法通过睾丸注射白消安制备精原干细胞移植受体。应用该方法,不但能够成功快速制备精原干细胞移植受体,降低腹腔注射白消安法对动物骨髓、造血系统所造成的较大伤害,减少或避免动物死亡,还能减少药物使用量,降低成本。这种方法开辟出了一种新型精原干细胞移植受体制备方法。
6.d2:zl201810947058.5公开了无精子症小鼠模型的构建方法,包括如下步骤:(1)提供性成熟的雄性小鼠,体重为25~35g;(2)取白消安溶解于dmso,以生理盐水稀释得稀释液;(3)小鼠下腹部酒精消毒,晾干后,吸取步骤(2)所得稀释液并进针,回抽确认无误后,完成首次腹腔注射;之后,同一天内再间隔注射3次,35~37天后,即得所述无精子症小鼠模型。本发明的方法成模率高、稳定性好;依据本发明,已累计完成84只c57bl/6小鼠无精子症建模,经睾丸he染色鉴定成模总数为84/84,成模率为100%。
7.上述d1和d2都是以小鼠作为受体对象。
8.在研究过程中,我们发现,鸡的受体制备不能直接沿用小鼠的模型。
9.本案解决的技术问题是:如何制备鸡生殖前体细胞移植受体。
技术实现要素:
10.本发明的目的是提供一种鸡生殖前体细胞移植受体的制备方法,该方法的优势在于:公鸡睾丸注射白消安可以杀死内源性精原干细胞,睾丸变小、重量降低,而且不影响体重和血常规指数,公鸡睾丸内精曲小管膜底部和腺腔排空。
11.为了达到上述目的,本发明采用的技术方案是:
12.一种鸡生殖前体细胞移植受体的制备方法,采用只有一侧睾丸的性成熟的公鸡,向公鸡的睾丸内注射白消安溶液一段时间得到鸡生殖前体细胞移植受体。
13.在上述的鸡生殖前体细胞移植受体的制备方法中,注射量为30-50mg白消安/只睾丸。
14.在上述的鸡生殖前体细胞移植受体的制备方法中,注射量为40mg白消安/只睾丸。
15.在上述的鸡生殖前体细胞移植受体的制备方法中,所述白消安溶液的配置方法为:
16.先用dmso溶解白消安,再用等体积的无菌水稀释,现配现用。
17.在上述的鸡生殖前体细胞移植受体的制备方法中,注射白消安溶液30天后得到鸡生殖前体细胞移植受体。
18.在上述的鸡生殖前体细胞移植受体的制备方法中,睾丸上的注射位置为:
19.睾丸的上部、中部、下部以及靠近睾丸的输精管的位置。
20.在上述的鸡生殖前体细胞移植受体的制备方法中,只有一侧睾丸的性成熟的公鸡采用以下方法获得:
21.在公鸡1月龄时,阉掉一侧睾丸,只留一侧睾丸养殖到性成熟时。
22.与现有技术相比本发明的有益效果是:
23.本发明在采用单睾丸公鸡作为研究对象,对公鸡睾丸进行白消安注射,结果表明,公鸡睾丸注射白消安可以杀死内源性精原干细胞,睾丸变小、重量降低,而且不影响体重和血常规指数,注射后第30天,公鸡睾丸内精曲小管膜底部和腺腔排空,此时是注射生殖前体细胞最佳时间,未来注射鸡原始生殖细胞(pgc)到本发明获得的受体公鸡体内,有望缩短鸡原始生殖细胞在受体鸡发育时间,为家禽离体保种技术研究和基因修饰鸡制备奠定良好基础。
附图说明
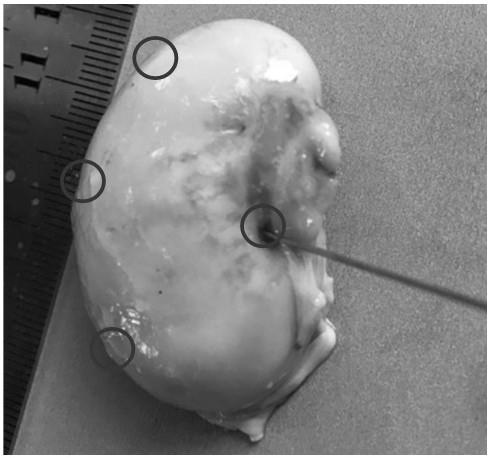
24.图1为实施例1和对比例3的白消安注射部位照片。
25.图2为实施例1白消安注射对公鸡体重的影响趋势图。
26.图3为实施例1注射不同剂量白消安30天后的睾丸大小照片。
27.图4为实施例1注射不同剂量白消安15、30和45天后的睾丸重量变化曲线。
28.图5为实施例1的白消安注射随时间对睾丸曲精细管的影响的照片。
29.图6为实施例1的bst-80组精曲小管膜底部和腺腔排空的显微照片。
30.图7为对比例1的白消安对公鸡睾丸大小的影响的照片。
31.图8为对比例1的白消安对公鸡睾丸曲精细管的影响的照片。
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.第一部分试验材料与方法
34.试验动物及材料
35.白消安(sigma,b1170000),dmso(sigma-aldrich),无菌水,注射器为500μl hamilton syringe(701n;hamilton bonaduz ag,switzerland)。台盼蓝(93595-50ml:0.4%),生理盐水。
36.移液枪(200ul、1000ul)和枪头,酒精棉球(高压),双抗,碘伏,15毫升离心管,涡旋振荡器,手套,口罩,水浴锅。
37.白消安溶液配制:先用dmso溶解白消安,再用等体积的无菌水稀释,现配现用。配好的溶液放在42℃水浴锅中温热,直至注射完成。注射前加入0.4%台盼蓝,用来观察注射的溶液是否充满整个睾丸。注射时要用涡旋器震动混匀溶液。溶液配制过程中请戴口罩和手套。
38.第二部分相关测试方法
39.2.1死亡率、体重和睾丸重量
40.分别于注射后15、30、60和90天称公鸡体重和统计死亡率。注射后15天,每组取2只鸡的睾丸,称重并测量睾丸大小。
41.2.2组织切片分析
42.注射15天后,取睾丸组织放入睾丸专用多聚甲醛中,进行he染色。每侧睾丸取上中下3个部位。采集时,1:2比例切开两部分后放入多聚甲醛中。
43.2.3精子计数和生育评估
44.注射后15天,采精,取1ml用pbs稀释后,在显微镜下计数。同时,连续5天采集精液,进行人工授精,每只公鸡配1只母鸡,收集种蛋,做好标记,入孵,观察种蛋受精率。
45.2.4血常规检测
46.采集2ml血液于edta抗凝管中轻轻颠倒数次防止血液凝固,于室温保存,送往广东省农业科学院动物卫生研究所进行血常规检测,分析红细胞数白细胞数(wbc)、(rbc)、血小板(plt)、血红蛋白浓度(hgb)的水平。
47.第三部分实施案例
48.受体鸡为5~6月龄、体重相近、阉掉一侧睾丸的s01系公鸡。试验前,公鸡称重并采集精液。
49.4组(每组5只):0mg白消安/只睾丸(bst-0),30mg白消安/只睾丸(bst-60),40mg白消安/只睾丸(bst-80),50mg白消安/只睾丸(bst-100)。其中bst-0用50%dmso配制,作为空白对照。
50.白消安注射部位为4个点(参考图1):上中下各注射一针、靠近输精管注射一针,每个部位注射0.3ml。
51.3.1阉掉一侧睾丸的s01系公鸡的阉割方法如下:
52.s01系公鸡在70日龄左右,阉掉左侧睾丸,只留右侧。并记录阉掉的那侧在哪边。睾丸前端自系膜与胸前气囊壁相联系,外侧有系膜与胸后气囊壁相联系,左右睾丸之间有系膜隔开,故套取睾丸之前,必须首先捣破和断离系膜,才能顺利摘除。具体方法如下:
53.左手执睾丸勺,将肠管向下向后拨开,即可看到右侧睾丸,如果睾丸大者不拨开肠管也能看见。右手用镊子把睾丸被膜捏离睾丸实质,用睾丸套尖端撕破被膜,使睾丸完全暴露于被膜之外。继之左手持睾丸勺将右侧睾丸附近的肠管向后拨开,即可见到与左侧睾丸
相隔的二层薄膜。右手用镊子避开血管将薄膜捏紧,适当向上拉,左手用睾丸勺的尖端撕破薄膜,放下镊子,将左手的睾丸勺移交给右手,用睾丸勺将左侧睾丸向上翻起。
54.3.2白消安注射方法如下:
55.局部解剖切口部位在右侧倒数一、二肋骨之间与髋关节水平线相交处上下,从外向内为皮肤、肌肉及腹膜,腹膜紧贴腹部气囊和胸后气囊壁。睾丸位于倒数第二、三肋骨头的下面、肾脏的前方,两睾丸之间有主动脉及后腔静脉分布。睾丸一般呈椭圆形或梭形,多为淡黄色,也有呈黑色、灰色或灰黑色的;其体积的大小,随月龄与品种不同而异。具体方法如下:
56.(1)保定。术者坐在小凳上将公鸡两翅交扣后,两翅踏于术者左脚下,把鸡腿并拢向后拉直,踏于术者右脚下,使公鸡成左侧卧位,背向术者。
57.(2)术部。从髋关节向前引一水平线,与最后二肋之间的相交处,是切口中点。
58.(3)手术式。
①
术部处理:先把切口及附近的羽毛全部拔掉,用冷水湿透周围羽毛,充分暴露切口。
②
切开术部:用左手拇指按准切口,右手持刀沿左手拇指前缘与肋骨平行作长2~3cm的切口,下刀至腹膜。
③
扩张切口:用扩创器扩开切口,调节扩创器到适当程度。
④
捣破腹膜:用睾丸套尖锐的一端朝腹膜向上挑紧,用阉鸡刀划破腹膜,同时分离腹部气囊壁,便切口通向腹腔深部。
59.(4)左手执睾丸勺,将肠管向下向后拨开,即可看到右侧睾丸,如果睾丸大者不拨开肠管也能看见。用注射器吸取配好的白消安或dmso溶液,注射到睾丸不同部位。
60.3.3检测结果
61.3.3.1睾丸注射白消安对公鸡体重和成活率的影响
62.图2可知,与bst-0组相比,6月龄s01公鸡睾丸注射白消安后第15、30、45和60天,bst-60、bst-80和bst-100组体重没有发生明显变化。在整个试验过程中,公鸡没有死亡现象发生。
63.图2为白消安注射对公鸡体重的影响(s01品系),横坐标为时间,纵坐标为体重。
64.3.3.2睾丸注射白消安对公鸡睾丸大小和重量的影响
65.屠宰时通过观察睾丸大小发现,注射白消安会明显减小睾丸的大小,睾丸随着白消安剂量的增加而变小(图3所示)。睾丸称重发现,注射白消安15天后,睾丸重量最小,随后重量慢慢增加(图4所示)。与bst-0组相比,bst-60、bst-80和bst-100组在注射后第15和30天,睾丸重量差异极显著(p《0.001)。在第45天时,与bst-0组相比,bst-80组差异不显著,而bst-60和bst-100组则差异显著(p《0.01)。
66.3.3.3睾丸组织切片分析
67.由图5组织切片结果表明,注射白消安后第15天,睾丸内源性精原干细胞部分被杀死;第30天时,精原干细胞大部分被杀死,精曲小管直径显著减小(p《0.01),特别是bst-80组睾丸精曲小管膜底部和腺腔排空;第45天,精原干细胞开始恢复,精曲小管大小也恢复;第60天,大部分精原干细胞恢复。
68.3.3.4睾丸注射白消安对公鸡受精率的影响
69.注射白消安后,精子数量及活性显著降低(p《0.01),种蛋受精率也显著下降(p《0.01),30天后降低到零。具体参考表1。
70.表1白消安对公鸡受精率的影响
[0071][0072]
结论:本实施例不需要对公鸡进行麻醉处理,只需要简单地在侧边开腔露出睾丸即可注射;而且当公鸡在1月龄左右阉掉一侧睾丸、只留一侧睾丸到性成熟时进行注射,才有最好效果。
[0073]
结果表明,公鸡睾丸注射白消安可以杀死内源性精原干细胞,睾丸变小、重量降低,而且不影响体重和血常规指数,注射后第30天,剂量为80mg/只的公鸡睾丸内精曲小管膜底部和腺腔排空(图6),此时是注射生殖前体细胞最佳时间。鸡胚显微注射法制备受体公鸡,性成熟(约6个月)才能采集精液进行配种,而且供体pgc与受体pgc同时在受体公鸡睾丸发育,供体pgc易被排斥。
[0074]
因此,未来注射鸡pgc到本研究获得的受体公鸡体内,有望缩短鸡pgc在受体鸡发育时间,为家禽离体保种技术研究和基因修饰鸡制备奠定良好基础。
[0075]
第四部分对比例1
[0076]
受体鸡为7月龄、体重相近的m06公鸡。公鸡称重,根据体重配制溶液,每侧睾丸注射1ml。3组(每组5只):0mg/kg(bst-0),0.3mg/kg(bst-30),0.6mg/kg(bst-60)。其中bst-0用50%dmso配制,作为空白对照。白消安注射部位为2个点:上下各注射一针,每个部位注射0.5ml。每只鸡2ml。
[0077]
4.1检测结果
[0078]
(1)睾丸注射白消安对公鸡体重和成活率的影响
[0079]
7月龄m06公鸡睾丸注射白消安后第15和30天,与bst-0组相比,bst-30和bst-60组体重没有发生明显变化。在整个试验过程中,公鸡没有死亡现象发生,具体可参考表2。
[0080]
表2白消安对公鸡体重的影响
[0081][0082]
4.2睾丸注射白消安对公鸡血常规指标影响
[0083]
由表3可知,与bst-0组相比,7月龄m06公鸡睾丸注射白消安后第15和30天,bst-30和bst-60组白细胞、红细胞、血小板和血红蛋白均没有发生明显变化。
[0084]
表3白消安对公鸡血常规指标的影响
[0085][0086]
4.3睾丸注射白消安对公鸡睾丸大小和重量的影响
[0087]
由表4和图7可知,与对照组相比,注射白消安后第15天,睾丸略微变小,重量也有所下降,但差异不是特别明显。值得注意的是,注射白消安第15天后的睾丸大小和重量是注射后第30天的2倍左右,可能是注射第15天后白消安在睾丸内代谢不完全导致。
[0088]
表4白消安对公鸡睾丸重量的影响
[0089][0090]
4.4睾丸组织切片分析
[0091]
由图8可知,白消安注射后第15天,bst-30和bst-60组公鸡睾丸曲精细管内,仍可见生精细胞和支持细胞,bst-60组公鸡睾丸部分曲精细管内出现生精细胞减少现象;白消安注射后第30天,bst-30和bst-90组公鸡睾丸曲精细管内与bst-0对照组无差异。
[0092]
图8为白消安对公鸡睾丸曲精细管的影响的照片。
[0093]
4.5睾丸注射白消安对公鸡受精率的影响
[0094]
由表5可知,与对照组相比,注射白消安后15~30天,公鸡受精率有下降趋势。
[0095]
表5白消安对公鸡受精率的影响
[0096][0097]
结论:7月龄m06公鸡睾丸注射白消安后,当注射量为0.6mg/kg时,睾丸部分曲精细管内出现生精细胞减少现象,但对睾丸大小、重量以及公鸡受精率影响不大,表明应该加大白消安注射量。
[0098]
第五部分对比例2
[0099]
受体鸡为5~6月龄、体重相近的m06公鸡。试验前,公鸡称重并采集精液。3组(每组5只):0mg/kg(bst-0),0.6mg/kg(bst-60),1.2mg/kg(bst-120)。其中bst-0用50%dmso配制,作为空白对照。白消安注射部位为3个点:上中下各注射一针,每个部位注射0.3ml。
[0100]
5.1睾丸注射白消安对公鸡体重和成活率的影响
[0101]
由表6可知,5~6月龄m06公鸡睾丸注射白消安后第15和30天,与bst-0组相比,bst-60和bst-120组体重没有发生明显变化。在整个试验过程中,公鸡没有死亡现象发生。
[0102]
表6白消安对公鸡体重的影响
[0103][0104]
5.2睾丸注射白消安对公鸡睾丸重量的影响
[0105]
由表7可知,与对照组相比,注射白消安后第15天,bst-120组公鸡睾丸重量有所下降,但差异不是特别明显。
[0106]
表7白消安对公鸡睾丸重量的影响
[0107][0108]
5.3睾丸注射白消安对公鸡受精率的影响
[0109]
由表8可知,与对照组相比,注射白消安后15~30天,bst-60公鸡受精率有下降趋势,但不明显。
[0110]
表8白消安对公鸡受精率的影响
[0111][0112]
结论:即使加大了2倍剂量,白消安对5~6月龄m06公鸡睾丸影响不大。
[0113]
第六部分对比例3
[0114]
受体鸡为5~6月龄、体重相近的w和h品系公鸡。试验前,公鸡称重并采集精液。5组(bst-120组3只,其余4组每组6只):0mg/只(bst-0),60mg/只(bst-60),80mg/只(bst-80),100mg/只(bst-100),120mg/只(bst-120)。其中bst-0用50%dmso配制,作为空白对照。白消安注射部位为4个点:上中下各注射一针,靠近输卵管注射一针,每个部位注射0.3ml。
[0115]
对比例1和2的结果表明,根据公鸡体重估算白消安的注射量,效果不好。由于不同品系公鸡成年后,体重不同,而睾丸大小与体重相关性不大。因此不需要根据公鸡体重来计算白消安的注射量。
[0116]
6.3睾丸注射白消安对公鸡体重和成活率的影响
[0117]
由表9可知,5~6月龄w和h公鸡睾丸注射白消安后第15、30、45和60天,与对照组bst-0相比,处理组体重没有发生明显变化。在整个试验过程中,公鸡没有死亡现象发生。
[0118]
表9白消安对公鸡体重的影响
[0119][0120]
6.2睾丸注射白消安对公鸡血常规指标影响
[0121]
由表10可知,与对照组bst-0相比,5~6月龄w和h公鸡睾丸注射白消安后第15、30、45和60天,处理组白细胞计数、红细胞计数、血小板和血红蛋白均没有发生明显变化,除了bst-120组红细胞计数显著少于对照组。
[0122]
表10白消安对公鸡血常规指标的影响
[0123][0124]
6.3睾丸注射白消安对公鸡睾丸重量的影响
[0125]
由表11可知,与对照组相比,注射白消安后第15和30天,随着剂量的增加,睾丸重量显著下降。注射后第45天,处理组睾丸重量开始上升,其中bst-60组睾丸恢复最快,但与对照组相比仍有较大差距;对照组睾丸重量是bst-80、bst-100和bst-120组睾丸重量的2倍以上。注射后第60天,bst-80睾丸重量与对照组基本一致,表明bst-80睾丸已经完全恢复,但bst-100睾丸重量只有对照组的一半,表明bst-100睾丸并未完全恢复。
[0126]
表11白消安对公鸡睾丸重量的影响(单侧睾丸)
[0127][0128]
6.4睾丸组织切片分析
[0129]
白消安注射后第15天,bst-30和bst-60组公鸡睾丸曲精细管内,仍可见生精细胞和支持细胞,bst-60组公鸡睾丸部分曲精细管内出现生精细胞减少现象;白消安注射后第30天,bst-30和bst-90组公鸡睾丸曲精细管内与bst-0对照组无差异。
[0130]
6.5睾丸注射白消安对公鸡受精率的影响
[0131]
由表12可知,与对照组相比,注射白消安后15~45天,公鸡受精率下降明显。
[0132]
表12白消安对公鸡受精率的影响
[0133][0134]
结论:5~6月龄w和h公鸡睾丸注射白消安后,对公鸡体重和血常规基本上没有影响。组织切片结果表明,随着注射剂量的增加,睾丸曲精细管内出现生精细胞和支持细胞减少现象,当剂量为80mg/只、100mg/只、120mg/只,注射白消安后第15天,睾丸内源性精原干细胞小部分被杀死;第30天时,精原干细胞部分被杀死,睾丸部分精曲小管膜底部和腺腔排空;第45天,剂量为60mg/只、80mg/只的公鸡睾丸内精原干细胞开始恢复;第60天,剂量为60mg/只、80mg/只的公鸡睾丸内大部分精原干细胞恢复,但是剂量为100mg/只和120mg/只没有恢复。注射白消安后,种蛋受精率明显下降。
[0135]
综上所述,对比例1-3的白消安的注射计量逐渐增大,在对比例3中,虽然观察到了精原干细胞部分被杀死,睾丸部分精曲小管膜底部和腺腔排空的现象,但是达不到完全排空的效果。
[0136]
要实现公鸡睾丸内精曲小管膜底部和腺腔排空,需要采用单睾丸的性成熟公鸡采用合适的剂量的白消安。
[0137]
本发明的方法的优势在于:公鸡睾丸只需要一次注射白消安即可以杀死内源性精原干细胞,睾丸变小、重量降低,而且不影响体重和血常规指数,公鸡睾丸内精曲小管膜底部和腺腔排空。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1