联合免疫用药物、温敏凝胶组合物、趋化因子颗粒及其应用
1.本发明涉及联合免疫用药物、温敏凝胶组合物、趋化因子颗粒及其应用。
背景技术:
2.以嵌合抗原受体t细胞(car-t)为代表的过继细胞疗法(act)在血液癌症的治疗中取得了可喜的成绩,但对实体瘤如肺癌、乳腺癌、肝癌等的疗效依旧不尽如人意。在car-t治疗中,将患者外周血中提取的t细胞进行基因改造,使其能特异性识别肿瘤细胞,在体外激活、增殖这些细胞后再回输至病人体内。目前过继t细胞在实体瘤治疗上遇到的主要制约因素有:1)过继t细胞对实体瘤的靶向性差;2)到达病灶处的过继t细胞不能有效浸润实体肿瘤;3)浸润肿瘤的过继t细胞在肿瘤微环境(tumor microenvironment,tme)中受到癌细胞的免疫抑制,从而功能降低、数量减少。
3.有研究尝试使用趋化因子加强过继t细胞对实体肿瘤的靶向性。趋化因子能通过免疫细胞表面g蛋白偶联受体刺激免疫细胞迁移。细胞毒性cd8+t淋巴细胞(ctl)是消灭肿瘤细胞的主要细胞,在激活的cd8+t细胞和记忆性cd8+t细胞表面均有较高的cxc-趋化因子受体3(cxcr3)表达,因此cxcr3介导的免疫细胞迁徙是抗肿瘤免疫的关键因素之一。cxcr3的主要配体为cxcl9、cxcl10和cxcl11。cxcl9又称γ干扰素诱导的单核因子(monokine induced by gamma interferon,mig),位于人4号染色体上,受ifn-γ诱导。但实体瘤的趋化因子表达较少,不能有效吸引t细胞迁移至实体肿瘤。
技术实现要素:
4.本发明在于提供联合免疫用药物、温敏凝胶组合物、趋化因子颗粒及其应用,本发明在实体瘤旁注射cxcl9趋化因子颗粒、pd1单抗和温敏聚合物的混合溶液,体温下形成装载cxcl9趋化因子颗粒、pd1单抗的免疫调节温敏水凝胶,使所载药物可在瘤旁长期可控释放,提高免疫细胞的肿瘤靶向性和抗肿瘤杀伤力。肿瘤穿透肽irgd可装载于温敏凝胶中或静脉注射,与免疫调节温敏凝胶联合使用,增强免疫细胞的肿瘤浸润能力。
5.为实现上述目的,本发明提供了如下技术方案:趋化因子颗粒,包括两亲性聚合物、趋化因子以及白蛋白载体,所述两亲性聚合物包括与白蛋白相结合的分子、亲水间隔基团以及与趋化因子反应的官能基团;
6.所述与白蛋白结合的分子包括亲脂二酰基链、亲脂酰基链、烷基链、脂肪酸、维生素e、含有avgalegprnqdwlgvprql序列的多肽。
7.作为优选,所述亲水间隔基团的结构如下所示:
[0008][0009]
其中,x为含有醚键的多个碳原子的碳链;
[0010]
作为优选,所述与趋化因子反应的官能基团包括能够与趋化因子的氨基、巯基或二硫键反应的官能基团。
[0011]
作为优选,所述与蛋白反应的官能基团如下所示:
[0012][0013]
其中,y为氧,或含有醚键的多个碳原子的碳链。
[0014]
作为优选,所述与蛋白反应的官能基团如下所示:
[0015][0016]
其中,z为含有多个碳原子的碳链。
[0017]
作为优选,所述趋化因子包括cxcl9、cxcl10和cxcl11中的一个或任意两个以上的组合。
[0018]
作为优选,所述白蛋白载体的粒径为1~1400nm。
[0019]
上述趋化因子颗粒的制备方法,包括如下步骤:
[0020]
1)、将趋化因子和两亲性聚合物进行混合使其反应,得到趋化因子修饰体;
[0021]
2)、用pbs配置bsa溶液和dtssp溶液,bsa和dtssp按照摩尔比1:(10~300)混合,进行搅拌反应,反应结束后进行离心处理,用pbs洗涤后制备得np;
[0022]
3)、向白蛋白载体np中加入所述趋化因子修饰体进行反应,进而得到趋化因子颗粒。
[0023]
上述所述的趋化因子颗粒的制备方法,包括如下步骤:
[0024]
1)、将趋化因子和两亲性聚合物进行混合使其反应,得到趋化因子修饰体;
[0025]
2)、将bsa溶液和dtssp溶液混合使其反应,并将反应后的样品溶液进行离心处理,用pbs重悬后制备得smp;
[0026]
3)、向白蛋白载体smp中加入所述趋化因子修饰体进行反应,进而得到趋化因子颗粒。
[0027]
温敏凝胶组合物,包括上述所述的趋化因子颗粒、pd-1单抗、以及温敏水凝胶。
[0028]
温敏凝胶组合物,包括上述所述的趋化因子颗粒、pd-1单抗、irgd多肽或包含c(crgdkgpdc)的多肽序列、以及温敏水凝胶。
[0029]
联合免疫用药物,包括瘤边施用的上述所述的温敏凝胶组合物和静脉施用的irgd或包含c(crgdkgpdc)的多肽序列。
[0030]
上述所述的趋化因子颗粒、上述所述的温敏凝胶组合物、上述所述的联合免疫用药物在过继细胞疗法和非过继细胞免疫疗法中的应用;其中,过继细胞包括car-t细胞、car-nk细胞、car-m细胞、tcr-t细胞、中性粒细胞;非过继细胞包括内生cd8
+
t细胞、内生cd4
+
t细胞、内生nk细胞、内生巨噬细胞、内生中性粒细胞。
[0031]
irgd能增强药物对肿瘤的靶向性和浸润能力。irgd是由9个氨基酸残基c(crgdkgpdc)组成的环状肽,全身循环过程中可以特异性与肿瘤细胞上过表达的整合素和神经纤毛蛋白-1(nrp-1)受体结合,激活nrp-1,增加肿瘤血管和组织的通透性。
[0032]
在tme中,肿瘤细胞通常会上调细胞表面pd-l1的表达。当t细胞表面受体pd-1与其
配体pd-l1结合时,免疫检查点信号通路会被激活,从而细胞活性会受到抑制,降低t细胞的抗癌免疫力。免疫检查点抑制剂如pd-1抗体(apd1)和pd-l1抗体都可以有效阻断pd-1信号通路,从而恢复t细胞的活性。
[0033]
可注射水凝胶体系可以局部、靶向递送药物和可控缓释药物,在提高药物疗效和减少全身毒性方面具有巨大潜力,且其生物相容性高,能够广泛应用于生物医学领域。温敏凝胶是超分子水凝胶中广泛的一类,通过疏水相互作用形成凝胶化。在一定温度范围内为液体,随着温度的变化可转化形成凝胶。
[0034]
二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)嵌段共聚物具有良好的生物相容性,应用过程中通常会引用羧基、氨基、马来酰亚胺或n-羟基磺基琥珀酰亚胺等基团对dspe-peg末端进行修饰,以便在其一端链接其他功能分子。
[0035]
综上所述,本发明具有以下有益效果:
[0036]
本发明运用可注射温敏聚合物plga-peg-plga,体温下在实体瘤旁形成水凝胶,长期可控释放装载趋化因子颗粒和免疫检查点抑制剂pd-1单抗(apd1),加强过继t细胞对实体肿瘤的靶向性和对肿瘤微环境(tme)中免疫抑制的抵抗力,并通过联用肿瘤穿透肽irgd,增强过继t细胞对实体瘤的浸润,从而高效治疗实体肿瘤。趋化因子颗粒由二硬脂酰磷酸乙醇胺-聚乙二醇-n-羟基琥珀酰亚胺(dspe-peg-nhs,dp-nhs)修饰的cxcl9(cxcl9-dp)和白蛋白亚微米粒载体(smp)构建而成(cxcl9-dp@smp)。在b16-ova皮下实体瘤小鼠模型中,共载cxcl9-dp@smp(cmp)和apd1的温敏凝胶(cmp/apd1@gel)联合irgd,比等量游离药物提高了21倍肿瘤中过继t细胞的数量,且这些过继t细胞高表达ifn-γ、granzyme b等功能型蛋白,具有肿瘤细胞杀伤力。该技术能适用于嵌合抗原受体t细胞(car-t)和t细胞受体t细胞(tcr-t)疗法等多种过继t细胞疗法,为增强过继t细胞疗法提供了新平台和新思路。
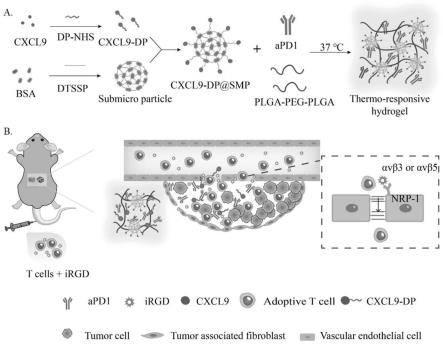
附图说明
[0037]
图1为免疫调节温敏水凝胶的(a)制备流程图与(b)体内增强过继t细胞抗肿瘤疗效示意图;
[0038]
图2为bsa载体的制备与表征、载药量测定。(a)不同反应摩尔比的bsa:dtssp所得纳米粒(np)粒径和pdi。(b)bsa np(1:200)的粒径分布。(c)亚微米粒(smp)的不同制备方法示意图。(d)不同制备方法下smp的粒径和pdi(n=3)。(e)bsa smp的粒径分布。(f)np和smp的zeta电位(n=3)。(g)np的tem图。(h)smp的tem图。(i)荧光显微镜下dp-fitc与smp的结合。(j)bsa载体上dp-fitc的载药量。(k)bsa np/smp上dp-cytochrome c-cy5的载药量;
[0039]
图3为温敏水凝胶的制备与相变温度、载药量测定。(a)水凝胶的相变图示。(b)不同质量比的温敏共聚物的相变温度。(c)每mg plga-peg-plga水凝胶所能载cytochrome c。(d)水凝胶对不同药物及载体的装载效率;
[0040]
图4为温敏凝胶的体外降解和药物释放动力学考察、趋化因子载体体外迁移实验。(a)温敏水凝胶在体外37℃生理环境中的降解。(b)cc-cy5在各载体体系中的释放动力学。(c)apd1-fitc在水凝胶中的释放动力学。(d)不同反应摩尔比dspe-peg-nhs对cxcl9的活性影响(e)transwell迁移实验示意图。(f)在不同时间点迁徙到下室的cd8+t细胞数量(n=3,****,p《0.0001);
[0041]
图5为温敏凝胶的小鼠体内生物降解。(a)未接瘤balb/c小鼠。(b)c57bl/6小鼠的
b16-ova皮下黑色素瘤边;
[0042]
图6为温敏凝胶的体内释放。(a)不同时间点的小鼠ivis荧光成像图。(b)荧光强度动力学的量化分析(n=5,*,p《0.05,**,p《0.01,***,p《0.001);
[0043]
图7为激活过程中ot-1小鼠脾细胞cd8和cxcr3的表达。(a)cd8+t细胞占比的流式直方图。(b)cd8+t细胞占比的量化分析。(c)细胞表达cxcr3的流式直方图。(d)表达cxcr3细胞占比的量化分析(n=4,*,p《0.05,**,p《0.01,****,p《0.0001);
[0044]
图8为趋化因子生物凝胶协同游离apd1与irgd,显著抑制皮下黑色素瘤生长。(a)实验日程安排。(b)荷瘤小鼠治疗期间的肿瘤体积变化。(c)体重相对变化。(d)生存曲线(n=5,*,p《0.05,**,p《0.01,***,p《0.001,****,p《0.0001);
[0045]
图9为共载药物组合生物凝胶的体内抑瘤效果评估。(a)实验日程安排。(b)荷瘤小鼠治疗期间的肿瘤体积变化。(c)体重相对变化。(d)生存曲线(n=6,**,p《0.01,***,p《0.001,****,p《0.0001);
[0046]
图10为共载药物组合生物凝胶的体内免疫学评价。(a)实验日程安排。(b)荷瘤小鼠治疗期间的肿瘤体积变化。(c)小鼠的离体肿瘤组织图片(n=7,*,p《0.05,***,p《0.001,****,p《0.0001);
[0047]
图11为肿瘤中免疫细胞的流式分析。(a)淋巴细胞中cd8+t细胞占比的每组代表性流式图。(b)淋巴细胞中cd8+t细胞占比的量化分析。(c)cd8+t细胞中过继t细胞(cd8+thy1.1+)占比的每组代表性流式图。(d)淋巴细胞中过继t细胞占比的量化分析。(e)cd8+t细胞中过继t细胞(cd8+thy1.1+)占比的量化分析。(f)每mg肿瘤中过继t细胞(cd8+thy1.1+)的量化分析。(g)每mg肿瘤中内生cd8+t细胞的量化分析(n=7,ns,无显著性差异,*,p《0.05,***,p《0.001,****,p《0.0001)。endo,内生;act,过继t细胞;
[0048]
图12为肿瘤中免疫细胞功能型蛋白表达。(a)cd8+t细胞ifn-γ表达占比的代表性流式图。(b)cd8+t细胞ifn-γ表达的量化分析。(c)cd8+t细胞granzyme b表达占比的代表性流式图。(d)cd8+t细胞granzyme b表达的量化分析(n=7,ns,无显著性差异,*,p《0.05,**,p《0.01,***,p《0.001,****,p《0.0001)。endo,内生;act,过继t细胞;
[0049]
图13为淋巴器官和外周血中免疫细胞分析。(a)淋巴结细胞中act(cd8+thy1.1+)占比的代表性流式图。(b)淋巴结细胞中act(cd8+thy1.1+)占比的量化分析。(c)脾脏淋巴细胞中act(cd8+thy1.1+)占比的代表性流式图。(d)脾脏淋巴细胞中act(cd8+thy1.1+)占比的量化分析。(e)外周血cd8+t细胞中act(cd8+thy1.1+)占比的代表性流式图。(f)外周血淋巴细胞中act(cd8+thy1.1+)占比的量化分析(n=7,ns,无显著性差异,*,p《0.05,**,p《0.01,***,p《0.001,****,p《0.0001)。act,过继t细胞;
[0050]
图14为共载药物组合生物凝胶的全身抑瘤效果评估。(a)实验日程安排。(b)荷瘤小鼠治疗期间原发性肿瘤体积变化。(c)远端肿瘤体积变化。(d)体重相对变化。(e)生存曲线(n=8,**,p《0.01,***,p《0.001,****,p《0.0001);
[0051]
图15为治愈小鼠的肿瘤再次挑战实验。(a)实验日程安排。(b)荷瘤小鼠肿瘤体积变化。(c)小鼠的离体肿瘤组织图片(n=8,****,p《0.0001)。
具体实施方式
[0052]
参照附图对本发明做进一步说明。
[0053]
本实施例公开了趋化因子颗粒,包括两亲性聚合物、趋化因子以及白蛋白载体,两亲性聚合物包括与白蛋白相结合的分子、亲水间隔基团以及与趋化因子反应的官能基团;
[0054]
与白蛋白结合的分子包括亲脂二酰基链、亲脂酰基链、烷基链、脂肪酸、维生素e、含有avgalegprnqdwlgvprql序列的多肽。
[0055]
其中,趋化因子包括cxcl9、cxcl10和cxcl11中的一个或任意两个以上的组合。白蛋白载体的粒径为1~1400nm。
[0056]
在一些实施方式中,亲水间隔基团的结构如下所示:
[0057][0058]
其中,x为含有醚键的多个碳原子的碳链;其中,n为1~200。
[0059]
进一步的,亲水间隔基团的结构如下所示:
[0060][0061]
在一些实施方式中,与趋化因子反应的官能基团包括能够与趋化因子的氨基、巯基或二硫键反应的官能基团。
[0062]
在一些实施方式中,与蛋白反应的官能基团如下所示:
[0063][0064]
其中,y为氧,或含有醚键的多个碳原子的碳链。
[0065]
进一步的,与蛋白反应的官能基团如下所示:
[0066][0067]
在一些实施方式中,与蛋白反应的官能基团如下所示:
[0068][0069]
其中,z为含有多个碳原子的碳链。
[0070]
进一步的,与蛋白反应的官能基团如下所示:
[0071][0072]
在一些实施方式中,两亲性聚合物包括dp-nhs和dp-mal。
[0073]
上述所述趋化因子颗粒的制备方法,包括如下步骤:
[0074]
1)、将趋化因子和两亲性聚合物进行混合使其反应,得到趋化因子修饰体;
[0075]
2)、用pbs配置bsa溶液和dtssp溶液,bsa和dtssp按照摩尔比1:(10~300)混合,进行搅拌反应,反应结束后进行离心处理,用pbs洗涤后制备得np;具体的,bsa和dtssp的摩尔比为1:10、1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:110、1:120、1:130、1:140、1:150、1:160、1:170、1:180、1:190、1:200、1:210、1:220、1:230、1:240、1:250、1:260、1:270、1:280、1:290和1:300。
[0076]
3)、向白蛋白载体np中加入所述趋化因子修饰体进行反应,进而得到趋化因子颗粒。
[0077]
上述所述的趋化因子颗粒的制备方法,包括如下步骤:
[0078]
1)、将趋化因子和两亲性聚合物进行混合使其反应,得到趋化因子修饰体;
[0079]
2)、将bsa溶液和dtssp混合使其反应,并将反应后的样品溶液进行离心处理,用pbs重悬后制备得smp;
[0080]
3)、向白蛋白载体smp中加入所述趋化因子修饰体进行反应,进而得到趋化因子颗粒。
[0081]
上述技术方案中,smp的制备包括3种不同的方法,如下所述:
[0082]
(1)一步法:按照1重量份的bsa溶液和2重量份的dtssp进行混合,反应3h;
[0083]
(2)两步法:按照0.5重量份的bsa和1重量份的dtssp进行混合,反应1.5h;再按照0.5重量份的bsa和1重量份的dtssp加入反应体系中,继续反应1.5h;
[0084]
(3)三步法:按照0.5重量份的bsa和1重量份的dtssp进行混合,反应1h;然后按照0.5重量份的bsa加入反应体系中,继续反应1h,最后再加入1重量份的dtssp反应1h;
[0085]
将反应后的样品溶液离心处理,用pbs重悬后制备得smp。
[0086]
温敏凝胶组合物,包括上述所述的趋化因子颗粒、pd-1单抗、以及温敏水凝胶。将趋化因子颗粒、pd-1单抗和温敏聚合物混合在pbs溶液中,在瘤旁注射混合溶液,体温下在瘤旁形成装载趋化因子颗粒、pd1单抗的免疫调节温敏水凝胶。
[0087]
温敏凝胶组合物,包括上述所述的趋化因子颗粒、pd-1单抗、irgd多肽或包含c(crgdkgpdc)序列的多肽、以及温敏水凝胶。将趋化因子颗粒、pd-1单抗、irgd多肽或包含c(crgdkgpdc)的多肽序列、温敏聚合物混合在pbs溶液中,在瘤旁注射混合溶液,体温下在瘤旁形成装载趋化因子颗粒、pd-1单抗、irgd多肽或包含c(crgdkgpdc)的多肽序列的免疫调节温敏水凝胶。
[0088]
联合免疫用药物,包括瘤边施用的上述所述的温敏凝胶组合物和静脉施用的irgd多肽或包含c(crgdkgpdc)的多肽序列。
[0089]
上述所述的趋化因子颗粒、上述所述的温敏凝胶组合物、上述所述的联合免疫用药物在过继细胞疗法和非过继细胞疗法中的应用;其中,过继细胞包括car-t细胞、car-nk细胞、car-m细胞、tcr-t细胞、中性粒细胞。非过继细胞包括内生cd8
+
t细胞、内生cd4
+
t细胞、内生nk细胞、内生巨噬细胞、内生中性粒细胞。
[0090]
该技术运用水凝胶巧妙联用趋化因子cxcl9、免疫检查点抑制剂pd-1单抗(apd1)和肿瘤穿透肽irgd,增强了过继t细胞对实体瘤的靶向性、浸润能力和瘤内免疫效应,从而高效治疗实体肿瘤。本技术用水凝胶装载cxcl9和apd1,并在实体瘤注射温敏水凝胶,使所载药物可在瘤旁长期可控释放。由于趋化因子cxcl9的分子量较小(仅12kda),会从水凝胶中快速释放。因此我们用dspe-peg(dp)修饰cxcl9,得到cxcl9-dp,并通过dspe与bsa的特异
结合,将cxcl9-dp链接到bsa亚微米粒(smp),得cxcl9-dp@smp。瘤边释放的cxcl9募集过继t细胞至实体瘤;irgd与特异性表达于肿瘤血管内皮上的αvβ整合素结合,激活神经毡蛋白nrp-1,增加肿瘤血管和组织的通透性,从而增强过继t细胞对实体瘤的浸润;水凝胶中释放的apd1帮助瘤内过继t细胞抵抗癌细胞的免疫抑制,提高疗效(图1b)。该方法能适用于多种过继t细胞疗法如car-t和tcr-t等,为实体瘤的治疗提供了新的思路。该体系制备方法简单,原材料生物可降解,具有很高的临床转化性。
[0091]
具体实施例:
[0092]
1.材料和方法
[0093]
1.1材料
[0094]
鼠源cxcl9,il-2and il-7购于peprotech(rocky hill,nj,usa)。anti-pd1(克隆号rmp1-14),anti-cd3(克隆号145-2c11)和anti-cd28(克隆号37.51)抗体购于bioxcell(lebanon,nh,usa)。ovalbumin peptide(257-264)购于invivogen(san diego,ca,usa)。easysep
tm mouse cd8+t cell isolation kit购于stemcell techonologies(vancouver,bc,canada)。ficoll-paque plus购于cytiva(pharmacia,uppsala,sweden)。live/dead fixable dead cell stain kit购于invitrogen(carlsbad,ca,usa)。anti-mouse cd183(cxcr3)apc,cd8a fitc/pe,thy1.1 apc/fitc,cd45 fitc,cd4 apc-cy7,cd69 bv421,ifn-γapc,ki67 bv421,granzyme b pe购于biolegend(san diego,ca,usa)。3,3'-二硫代双(磺基琥珀酰亚胺丙酸酯)(dtssp)购于abcam(cambridge,uk)。二硬脂酰磷脂酰乙醇胺(dspe)包括dspe-peg-nhs(mw of peg=2000)以及dspe-peg-fitc(mw of peg=2000)购于ponsure biotech(shanghai,china)。cy5 nhs ester(non-sulfonated)购于apexbio(houston,texas,usa)。plga1640-peg1500-plga1640西安瑞禧生物科技有限公司(shanxi,xian,china)。
[0095]
材料中英文缩写
[0096]
[0097][0098]
给药系统简称
[0099][0100]
1.2小鼠和细胞系
[0101]
c57bl/6雌性小鼠(6周龄)和balb/c雌性小鼠(6周龄)购于cavens(changzhou,china)。ot-1小鼠购于shanghai model organisms center(shanghai,china)并自行繁育。pmel-1小鼠购于jackson laboratory(maine,usa)并自行繁育。所有小鼠均饲养在spf级房
间中,每笼5只,饲料、饮用水充足。饲养房间明暗循环,各12小时(上午7:00-下午7:00),室温为25
±
1℃。所有动物实验方案均经苏州大学机构动物护理和使用委员会审查和批准。动物实验方案根据nih的实验动物护理和使用指南进行(nih publication no.85-23rev.1985)。b16-ova细胞系购于atcc(rockville,md,usa),用含10%胎牛血清(fbs)的dmem培养基培养。
[0102]
1.3bsa纳米粒(np)和亚微米粒(smp)的制备和表征
[0103]
用pbs配置bsa(1mg/ml)和dtssp(10mg/ml)溶液。bsa和dtssp分别按照摩尔比1:10、1:20、1:50、1:100、1:200、1:300混合,加入搅拌子后,600rpm转速反应1h。将反应后的溶液置于50kda的超滤管,离心(4000rpm、4min),用pbs洗涤两次后制备得np。
[0104]
按照3种不同的方法制备smp:(1)一步法:取1mg bsa溶液和2mg dtssp溶液,反应3h;(2)两步法:取0.5mg bsa溶液和1mg dtssp溶液反应1.5h,再加入0.5mg bsa溶液和1mg dtssp溶液继续反应1.5h;(3)三步法:取0.5mg bsa溶液和1mg dtssp溶液反应1h,然后加入0.5mg bsa溶液后继续反应1h,最后再加入1mg dsstp溶液反应1h。将反应后的样品溶液离心(23000rpm、10min),用pbs重悬后制备得smp。
[0105]
用激光纳米粒度及电位仪(90plus particle size analyzer,brookhaven)测量制备的np和smp的水合粒径和zeta电位,具体如下表1和表2所示。取20μl合适浓度的np和smp滴于铜网片上,室温烘干后使用透射电子显微镜(ht7700,hitachi)观察其形貌特征。
[0106]
表1:白蛋白与dtssp反应摩尔比和制备所得的白蛋白np载体粒径
[0107][0108]
表2:不同的制备方法所得的白蛋白smp载体粒径
[0109][0110][0111]
1.4bsa np/smp的dspe-peg-fitc(dp-fitc)装载量
[0112]
取5份制备好的1mg np和smp,分别加入10、20、40、60和80μg的dp-fitc后,统一反应体积至1ml pbs,置于四维旋转仪(be-1100,kylin-bell)反应0.5h。np反应液用50kda超滤管超滤(4500rpm,4min),取下层滤液;smp反应液离心(23000rpm、10min),取上清。全波长多功能酶标仪(m1000pro,tecan)检测各组样品中fitc荧光强度(ex=470nm,em=530nm),由此计算未装载到bsa颗粒上的dp-fitc及dp-fitc在bsa颗粒上的装载量。
[0113]
1.5dp修饰趋化因子cxcl9(cxcl9-dp)和dp修饰模型荧光蛋白cc-cy5(cc-cy5-dp)
的制备
[0114]
将cxcl9与dp-nhs(反应摩尔比1:1,1:2,1:5,1:10)在pbs溶液中混合,于四维旋转仪上室温反应过夜,制备得cxcl9-dp。
[0115]
采用与cxcl9分子量相似、等电位点接近的蛋白细胞色素c(cytochrome c,cc)为模型蛋白。将连有cy5荧光分子的cc-cy5与dp-nhs(摩尔比1:5)在pbs溶液中混合,于四维旋转仪上反应过夜,制备得cc-cy5-dp。
[0116]
1.6cxcl9-dp、cc-cy5-dp与np、smp的结合
[0117]
在方法2.3制备的np或smp中,分别加入方法2.5中制备的cxcl9-dp或cc-cy5-dp,置于四维旋转仪室温混合0.5h,得cxcl9-dp@np,cxcl9-dp@smp,cc-cy5-dp@np,cc-cy5-dp@smp。
[0118]
1.7bsa np/smp的dp修饰蛋白载药量
[0119]
取5份1mg np或smp,分别加入10、20、40和80μg cc-cy5或含有相应质量cc-cy5的cc-cy5-dp,统一反应体积至1ml pbs,置于四维旋转仪混合0.5h。np反应液用50kda超滤管超滤(4500rpm,4min),取下层滤液;smp反应液离心(23000rpm、10min),取上清。检测cy5荧光强度(ex=620nm,em=670nm),计算滤液中cc-cy5质量及链接至np/smp上的cc-cy5质量。
[0120]
1.8温敏水凝胶(gel)的制备
[0121]
称取5份10mg plga-peg-plga多聚物,加入不同体积的pbs,涡旋直至聚合物充分溶解,配制浓度为14%w/v、16%w/v、18%w/v、20%w/v和22%w/v的多聚物溶液。将不同浓度的多聚物溶液置于金属浴中,从室温25℃开始升温,每次升温2℃,升温后等待系统稳定10min,观察多聚物溶液的状态,记录相变温度。
[0122]
各种体外水凝胶的制备方法:称取plga-peg-plga多聚物溶解于各种制备好的载体溶液中(w/v%=16%),一边涡旋一边用枪尖搅动,持续操作直至聚合物充分溶解,培养皿放置37℃的金属浴上,制备成plga-peg-plga多聚物凝胶。
[0123]
1.9温敏水凝胶载药量测定
[0124]
测定0.125、0.25、0.5、1、2、4、6mg/ml细胞色素c(cc)在280nm处的吸收值(nanodrop 2000,eppendorf),绘制标准曲线。称取8mg plga-peg-plga多聚物,分别与1mg、2mg、3mg、4mg和6mg cc粉末混合于pbs中,配置成16%w/v的plga-peg-plga溶液,加热至37℃成胶。用200μl pbs洗涤水凝胶表面,测定洗涤液在280nm处的吸收值,通过标准曲线计算洗涤液中未载入温敏凝胶的cc质量,最终得到水凝胶的载药量。
[0125]
混合1mg np(或smp)与cc-cy5-dp(含15μg cc-cy5)于pbs溶液中,四维旋转仪上反应0.5h后,得cc-cy5-dp@np和cc-cy5-dp@smp。将cc-cy5-dp@np、cc-cy5-dp@smp、15μg游离cc-cy5溶液分别加入8mg plga-peg-plga多聚物混合,配置成16%w/v的plga-peg-plga溶液,加热至37℃成胶。用pbs洗涤水凝胶表面,检测洗涤液中cy5荧光强度(ex=620nm,em=670nm),计算未载入的cc-cy5质量及水凝胶载药量。同样,将30μg游离apd1-fitc与8mg plga-peg-plga多聚物混合于pbs溶液中,加热至37℃成胶,用同样的方法计算温敏凝胶对apd1的载药量。
[0126]
1.10温敏水凝胶所载蛋白的释放曲线
[0127]
将cc-cy5与dp-nhs按照摩尔比1:5反应,合成cc-cy5-dp。制备含等量15μg cc-cy5的不同载体(cc-cy5-dp@np,cc-cy5-dp@smp,cc-cy5@gel,cc-cy5-dp@np@gel和cc-cy5-dp@
smp@gel),设置游离cc-cy5作为对照组。
[0128]
将各组样品(总体积均为200μl)置于透析袋(mwco=300kda)中,将透析袋随后置于装有20ml pbs的离心管中,将离心管置于恒温振荡仪中(37℃,100rpm)释放7天(d).分别在2h、8h、1d、2d、3d、4d、6d和7d从离心管中取200μl溶液,测定cy5荧光强度,并补加200μl相同温度的pbs。按如下公式计算各组样品cc-cy5的累计释放百分比。
[0129][0130]
其中,ern为某时间点cc-cy5的累计释放百分比;ve为释放介质的置换体积,即200μl;v0为释放介质的总体积,即20ml;fcc-cy5为起始透析袋内cc-cy5的荧光总量;fn为第n次置换取样的的样品荧光读数。
[0131]
30μg apd1-fitc与8mg plga-peg-plga混合在pbs溶液中,37℃成胶。将装载apd1-fitc水凝胶用同样的方法释放7day,分别在2h、8h、1d、2d、3d、4d、6d和7d从离心管中吸取200μl溶液检测fitc荧光,并补加200μl相同温度的pbs。计算apd1-fitc的累计释放百分比。
[0132]
1.11趋化因子水凝胶对t细胞体外迁移的影响评估
[0133]
取20μl cxcl9样品液(@25ng/ml)与dp-nhs(反应摩尔比1:1,1:2,1:5,1:10)在pbs溶液中混合,终体积为1ml,于四维旋转仪上反应过夜。按照elisa试剂盒说明书检测各样品中cxcl9活性。
[0134]
将0.1%明胶溶液铺在倒置的transwell小室(3415,costar)上,接种ms1内皮细胞(1
×
105)在小室正面培养。2天后,加入tnf-α(20ng/ml),激活小室中的ms1细胞,上调其粘附分子的表达量。4h后,上室每孔加含有2.5
×
105个cd8+t细胞的200μl含有il-2(10ng/ml)和il-7(10ng/ml)的rpmi 1640完全培养基。下室分7组:
①
no cxcl9;
②
free cxcl9;
③
cxcl9-dp;
④
cxcl9-dp@np;
⑤
cxcl9-dp@np@gel;
⑥
cxcl9-dp@smp;
⑦
cxcl9-dp@smp@gel(除
①
组无cxcl9,其余组均含等量0.25μg cxcl9。保持上下室液面齐平。每天从下室取10μl培养基进行细胞计数,第4天取完样后将上室液体吸出,重新加含有2.5
×
105个cd8+t细胞的上述rpmi 1640完全培养基,下室液体吸出一半,换新鲜上述rpmi 1640完全培养基,第5天继续取样。
[0135]
1.12温敏水凝胶体外生理环境中的降解
[0136]
称取50mg plga-peg-plga多聚物溶于丽春红染色液(10%),配置成质量浓度为16%的聚合物溶液(w/v%=16%)。将聚合物置于培养皿中,加热至37℃成胶,制备得包载丽春红的温敏水凝胶。将培养皿浸泡在pbs中并置于摇床上(37℃、100rpm),在不同时间点拍照记录水凝胶形态变化。
[0137]
1.13温敏凝胶的体内生物降解
[0138]
将b16-ova细胞溶于无菌pbs中(4
×
106个/ml),1:1体积加入基质胶(356234,costar)。在每只c57bl/6雌鼠皮下接种2
×
105个b16-ova细胞。接种后第7天,将5mg smp与60μg cc-cy5-dp混合,置于四维旋转仪反应0.5h,将反应溶液缓慢加入40mg plga-peg-plga,制备成凝胶溶液(w/v%=16%)。于瘤旁或无肿瘤小鼠皮下注射50μl凝胶溶液,在体温下成胶。在注射15min、2d、4d、6d和8d后,安乐死小鼠,并对凝胶注射部位及其周边解剖、拍照。
[0139]
1.14温敏凝胶的体内释放
[0140]
将balb/c小鼠随机分成以下6组:
①
cc-cy5;
②
cc-cy5@gel;
③
cc-cy5@np;
④
cc-cy5@np@gel;
⑤
cc-cy5@smp;
⑥
cc-cy5@smp@gel。在小鼠右背部皮下注射50μl不同样品溶液(含等量44μg cc-cy5),给药后0h、8h、1d、2d、3d、6d、7d和8d,用小动物活体成像仪(ivis lumina ii)考察小鼠背部cy5荧光强度(ex=620nm,em=670nm)。
[0141]
1.15ot-1/pmel-1小鼠t细胞的激活、培养与表征
[0142]
将ot-1(或pmel-1)小鼠安乐死后,取出脾脏,在70μm细胞滤网上研磨、润洗,离心(700g、4min)。细胞沉淀用ack红细胞裂解液处理后,再次离心,重悬于含ova257-264 peptide(或gp100)(1μg/ml),il-2(10ng/ml)和il-7(1ng/ml)的rpmi 1640培养基中,调整细胞密度为2
×
106个/ml。37℃孵育3天后,用ficoll-paque plus梯度离心法纯化淋巴细胞,收集得到的细胞在含有il-2(10ng/ml)和il-7(10ng/ml)的rpmi 1640培养基中继续培养,每2天换液。在细胞激活0、3、4、5天分别取1
×
106个细胞流式抗体染色,检测ot-1小鼠cd8+t细胞比例和cxcr3+的表达量。
[0143]
1.16趋化因子温敏凝胶的体内抑瘤效果
[0144]
将b16-ova细胞溶于无菌pbs中(4
×
106个/ml),1:1体积加入基质胶,在c57bl/6小鼠皮下接种2
×
105个。接种第5天,按100mg/kg的剂量给荷瘤小鼠腹腔注射环磷酰胺,以清除小鼠体内的淋巴细胞。将荷瘤小鼠随机分成6组,每组相关药物的注射剂量分别是激活5天的ot-1cd8+t(5
×
106个)、apd1(30μg)、irgd(200μg)、cxcl9(15μg)。cmp(dspe-peg2000-cxcl9连接smp)。接种肿瘤细胞第6天,按如下分组第一次药物。给药4天后,第
①
组每只小鼠尾静脉200μl无菌pbs,其余组每只小鼠尾静脉注射5
×
106激活5天的ot-1cd8+t细胞。
[0145]
①
尾静脉注射cd8+t+apd1
[0146]
②
尾静脉注射cd8+t+apd1+irgd
[0147]
③
尾静脉注射cd8+t+apd1+皮下注射游离cxcl9
[0148]
④
尾静脉注射cd8+t+apd1+irgd+皮下注射游离cxcl9
[0149]
⑤
尾静脉注射cd8+t+apd1+皮下注射cmp@gel(载15μg cxcl9)
[0150]
⑥
尾静脉注射cd8+t+apd1+irgd+皮下注射cmp@gel(载15μg cxcl9)
[0151]
每2日观察小鼠的生存状况,并记录治疗期间各组小鼠的体重和肿瘤尺寸变化。将肿瘤体积超过1000mm3做为每只小鼠的实验终止点。
[0152]
1.17共载cxcl9和apd1温敏凝胶的体内抑瘤效果研究
[0153]
将b16-ova细胞溶于无菌pbs中(1
×
107个/ml),4:1体积加入基质胶,在c57bl/6小鼠皮下接种8
×
105个。接种后第6天,按100mg/kg的剂量给荷瘤小鼠腹腔注射环磷酰胺,以清除小鼠体内的淋巴细胞。将荷瘤小鼠随机分成6组,每组相关药物的注射剂量分别是激活5天的ot-1cd8+t(5
×
106个)、apd1(30μg)、irgd(200μg)、cxcl9(15μg)。接种肿瘤细胞第7天,按如下分组第一次药物。给药4天后,第
①
组每只小鼠尾静脉200μl无菌pbs,其余组每只小鼠尾静脉注射5
×
106激活5天的ot-1cd8+t细胞。
[0154]
①
尾静脉注射pbs
[0155]
②
尾静脉注射cd8+t
[0156]
③
尾静脉注射cd8+t+irgd+皮下注射cmp@gel(载15μg cxcl9)
[0157]
④
尾静脉注射cd8+t+irgd+apd1+皮下注射cmp@gel(载15μg cxcl9)
[0158]
⑤
尾静脉注射cd8+t+irgd+皮下注射cmp/apd1@gel(载15μg cxcl9+30μg apd1)
[0159]
⑥
尾静脉注射cd8+t+皮下注射cmp/apd1/irgd@gel(载15μg cxcl9+30μg apd1+200μg irgd)
[0160]
每2日观察小鼠的生存状况,并记录治疗期间各组小鼠的体重和肿瘤尺寸变化。将肿瘤体积超过1000mm3做为每只小鼠的实验终止点。
[0161]
1.18共载cxcl9和apd1的温敏凝胶在体内免疫学评价
[0162]
将b16-ova细胞溶于无菌pbs中(1.25
×
107个/ml),4:1体积加入基质胶,在c57bl/6小鼠皮下接种1
×
106个。接种后第7天,按100mg/kg的剂量给荷瘤小鼠腹腔注射环磷酰胺,以清除小鼠体内的淋巴细胞。将荷瘤小鼠随机分成4组,每组相关药物的注射剂量分别是激活5天的pmel-1 cd8+t(5
×
106个)、apd1(30μg)、irgd(200μg)、cxcl9(15μg)。接种肿瘤细胞第8天,按如下分组第一次药物。给药4天后,第
①
组每只小鼠尾静脉200μl无菌pbs,其余组每只小鼠尾静脉注射5
×
106激活5天的pmel-1 cd8+t细胞。
[0163]
①
尾静脉注射pbs
[0164]
②
尾静脉注射cd8+t
[0165]
③
尾静脉注射cd8+t+irgd+apd1+皮下注射游离cxcl9
[0166]
④
尾静脉注射cd8+t+irgd+皮下注射cmp/apd1@gel(载15μg cxcl9+30μg apd1)
[0167]
每2日记录各组小鼠的体重和肿瘤体积变化。第二次给药2天后,安乐死小鼠,收集肿瘤,脾脏,腹股沟淋巴结和外周血。裂红后的外周血和脾脏细胞、淋巴结细胞分别用流式抗体染色,检测thy1.1、cd8a、cd4、cd45的表达量。碾磨肿瘤所得细胞用ebiosciencetm cell stimulation cocktail(invitrogen)37℃孵育6h,流式染色检测细胞thy1.1、cd8a、cd25、ifn-γ、granzyme b等的表达量。
[0168]
1.19共载cxcl9和apd1温敏凝胶的远端瘤抑制效果
[0169]
将b16-ova细胞溶于无菌pbs中(1
×
107个/ml),4:1体积加入基质胶,在c57bl/6小鼠皮下两端接种,接种数量为8
×
105个。接种第6天,按100mg/kg的剂量给荷瘤小鼠腹腔注射环磷酰胺,以清除小鼠体内的淋巴细胞。将荷瘤小鼠随机分成4组,每组相关药物的注射剂量分别是激活5天的ot-1cd8+t(5
×
106个)、apd1(30μg)、irgd(200μg)、cxcl9(15μg)。接种肿瘤细胞第7天,按如下分组第一次药物。给药4天后,第
①
组每只小鼠尾静脉200μl无菌pbs,其余组每只小鼠尾静脉注射5
×
106激活5天的ot-1cd8+t细胞。
[0170]
①
尾静脉注射pbs
[0171]
②
尾静脉注射cd8+t
[0172]
③
尾静脉注射cd8+t+irgd+apd1+皮下注射游离cxcl9
[0173]
④
尾静脉注射cd8+t+irgd+皮下注射cmp/apd1@gel(载15μg cxcl9+30μg apd1)
[0174]
每2日观察小鼠的生存状况,并记录治疗期间各组小鼠的体重和肿瘤尺寸变化。将肿瘤体积超过1000mm3做为每只小鼠的实验终止点。
[0175]
1.20治愈小鼠的肿瘤再次挑战实验(rechallenge)
[0176]
将b16-ova细胞溶于无菌pbs中(1.25
×
107个/ml),4:1体积加入基质胶,在c57bl/6小鼠皮下接种,接种数量为1
×
106个。将治愈的c57bl/6小鼠与同周龄健康c57bl/6小鼠共同构建rechallenge荷瘤模型。分别在接瘤第11天,14天,18天,21天,24天,27天尾静脉注射游离apd1(30μg)。接瘤第8天开始,每2日观察小鼠的生存状况,并记录治疗期间各组小鼠的体重和肿瘤尺寸变化。将肿瘤体积超过1000mm3做为每只小鼠的实验终止点。
[0177]
2.实验结果
[0178]
2.1bsa np/smp粒径和zeta电位及载药量测定
[0179]
3,3'-二硫代双(磺基琥珀酰亚胺丙酸酯)(dtssp)两端的n-羟基琥珀酰亚胺(nhs)官能团能与蛋白中的氨基发生酰胺反应,将单体血清白蛋白(bsa)交联形成载体颗粒。调节bsa与dtssp的摩尔反应比例,可得到不同粒径的纳米粒(np)和亚微米粒(smp),且所得颗粒粒径分布均匀,pdi均小于0.3(图2a,表1)。当bsa:dtssp反应摩尔比例为1:200时,所得np粒径~340nm(图2b),选择此比例进行后续np实验。我们尝试3种不同方法制备smp(图2c),方法3得到的smp粒径最大,约为891nm,且分布均匀(图2d-e,表2)。np和smp的电位分别为-2.2
±
0.8mv和-1.5
±
0.9mv(图2f)。通过tem观察np/smp的形态,np/smp呈现球形结构,tem中显示np粒径约为270nm,smp粒径约为700nm,与粒径仪测定的水合粒径结果趋势吻合(图2g-h)。
[0180]
将连有fitc荧光分子的dspe-peg(dp-fitc)与bsa smp共孵育后,dp-fitc能通过dspe链接至bsa载体(图2i)。保持np/smp总量不变(1mg),能结合到np/smp上的dp-fitc量与加入的dp-fitc呈剂量依赖性。当dp-fitc加入量超过40μg,dp-fitc与bsa的结合趋于饱和。每mg np能最多结合约36μg dp-fitc,每mg smp最多结合约34μg dp-fitc(图2j)。
[0181]
细胞色素c(cytochrome c,cc)由108个氨基酸残基组成,蛋白分子量为12.3kda,等电点为8.7,赖氨酸残基数量为16个。cxcl9由105个氨基酸残基组成,蛋白分子量为12.2kda,等电点为9.8,赖氨酸残基数量为21个。因此,cc适合作为cxcl9的模型蛋白来开展理化性质方面的研究。将带有荧光分子cy5的cc与dp反应,可得cc-cy5-dp。cc-cy5-dp@np代表cc-cy5-dp与np的结合,cc-cy5@smp代表cc-cy5与smp的结合。cc-cy5-dp通过dspe与np/smp特异性结合,np可装载32μg cc-cy5/mg np,smp可装载39μg cc-cy5/mg smp,是通过静电吸附所载cc量(cc-cy5@smp)的3倍以上(图2k)。
[0182]
2.2温敏水凝胶的制备与表征
[0183]
plga-peg-plga多聚物的水溶液升温后会发生相变,形成不可流动的胶体,继续加热会析出白色物质,降温后相变可逆(图3a)。plga-peg-plga多聚物水溶液在14%(质量/体积,m/v)至22%(m/v)的浓度间均可在37℃成胶,w/v%比越高,成胶温度越低。为保证室温不成胶,而在体温下迅速成胶,后续实验的水凝胶采用w/v%为16%(图3b)。温敏水凝胶可最多包载~0.35mg cc/mg plga-peg-plga(图3c)。水凝胶对于15μg游离cc-cy5,装载在bsa np和smp上的等量cc-cy5的包封率都接近100%,说明bsa载体并不影响趋化因子的装载。水凝胶对apd1的装载效率也近乎100%,说明蛋白药物的分子量和类别对水凝胶的载药效率无明显影响(图3d)。
[0184]
2.3温敏凝胶的体外降解和药物释放动力学考察
[0185]
将含有丽春红(10%)的温敏共聚物溶液在培养皿表面呈car-t字样铺列,37℃成胶,随后加入pbs,淹没过水凝胶,并放置在摇床上(100rpm,37℃),每天观察。在8天的观察期内,前4天温敏凝胶未出现较明显变化,4天后随着时间的推移,水凝胶逐渐开始降解(图4a)。
[0186]
接着我们考察游离cc-cy5,链接在bsa np和smp上的cc-cy5(cc-cy5-dp@np,cc-cy5-dp@smp)和装载于温敏凝胶中的cc-cy5的体外释放动力学(cc-cy5@gel,cc-cy5-dp@np@gel和cc-cy5-dp@smp@gel)。样品均置于一端扎紧的透析袋(mw=300kda)中,保证液体
cy5-dp@smp组释放曲线类似,但装载cc-cy5-dp@smp的水凝胶组能显著提高药物的滞留效果。cc-cy5-dp@smp@gel组2天后维持了80%的荧光信号,且8天后仍有20%的信号,与体外释放动力学结果吻合。
[0191]
2.6ot-1小鼠t细胞激活后cd8和cxcr3的表达
[0192]
从ot-1转基因小鼠体内获取的cd8+t细胞可以特异识别mhc i类分子-ova257-264抗原肽复合物,因而能识别和杀伤b16-ova肿瘤细胞。为了探究脾脏中的细胞在体外激活扩增过程中cxcr3+和cd8+t细胞的占比情况,优化t细胞激活条件,我们将ot-1小鼠脾脏碾碎、裂红后,与ova257-264抗原肽和细胞因子共孵育,激活培养3天后ficoll提纯淋巴细胞并接着培育、增殖。ot-1小鼠脾脏细胞裂红后,只有25%的cd8+t细胞,激活3天并ficoll提纯后,cd8+t细胞的占比可达70%。继续培养至第5天,cd8+t细胞的占比达到了98%(图7a-b)。ot-1小鼠初始脾细胞只有7.21%的细胞上表达cxcl9的受体cxcr3。孵育3天后,cxcr3的表达细胞也仅为8.8%,但培养至第5天,cxcr3+细胞占比达到了59%(图7c-d)。因此选用此激活方式培养第5天的ot-1小鼠脾脏细胞做为过继到小鼠体内的t细胞。
[0193]
2.7趋化因子生物凝胶体内抑瘤效果
[0194]
为了探究cxcl9-dp@smp@gel(cmp@gel)在体内的疗效,我们在c57bl/6雌性小鼠皮下构建b16-ova肿瘤模型,在肿瘤体积约35mm3开始治疗。分别设置尾静脉注射cd8+t+apd1组(t+apd1),尾静脉注射cd8+t+apd1+irgd组(t+apd1+irgd),尾静脉注射cd8+t+apd1+皮下注射游离cxcl9组(t+apd1+cxcl9),尾静脉注射cd8+t+apd1+irgd+皮下注射游离cxcl9组(t+apd1+cxcl9+irgd),尾静脉注射cd8+t+apd1+皮下注射cmp@gel组(t+apd1+cmp@gel),尾静脉注射cd8+t+apd1+irgd+皮下注射cmp@gel组(t+apd1+cmp@gel+irgd)(图8a)。
[0195]
t+apd1+cxcl9组表现出比t+apd1更好的抗肿瘤效果,证明cxcl9的趋化募集cd8+t细胞能力都有助于加强过继t细胞的抑瘤效果。t+apd1+irgd组比较t+apd1组,以及t+apd1+cmp@gel+irgd组比较t+apd1+cmp@gel组的结果证明,irgd肽的肿瘤血管穿透性能提高过继t细胞对实体肿瘤的疗效。t+apd1+cxcl9+irgd组与t+apd1+cxcl9和t+apd1+irgd的结果证明,相较于irgd和cxcl9的单独使用,两者联用可进一步增强治疗效果。t+apd1+cmp@gel+irgd组与t+apd1+cxcl9+irgd组的结果证明,水凝胶的缓释可以促进cxcl9的长时间瘤旁释放,从而持续募集过继t细胞到达肿瘤部位,显著提高疗效(图8b)。治疗过程中各组小鼠体重均无明显下降,说明各组均无明显毒性,验证了该剂量凝胶及药物的体内安全性(图8c)。生存曲线可以看出,t+apd1+irgd组、t+apd1+cxcl9组、t+apd1+cxcl9+irgd组、t+apd1+cmp@gel组和t+apd1+cmp@gel+irgd组都相对于t+apd1组在一定程度上抑制了肿瘤的生长。但t+apd1+cmp@gel+irgd组疗效最佳,有80%(4/5只)小鼠的肿瘤被清除(图8d),显著延长了小鼠的生存期。
[0196]
2.8共载多种药物的温敏凝胶的体内抑瘤效果
[0197]
上述体内抑瘤实验结果已经证明irgd肽的使用和用温敏凝胶装载趋化因子cxcl9能显著提高过继t细胞对实体肿瘤的疗效(图8)。接着我们进一步验证apd1在治疗中是否必要,以及apd1和irgd肽是否可以与cxcl9共载在水凝胶中,进一步提升疗效。由于图8中t+apd1+cmp@gel+irgd组治疗效果显著,为了能够显现优化后生物凝胶疗效的提高,此次实验我们在肿瘤体积达到60mm3才开始治疗。分别设置pbs组,尾静脉注射cd8+t组(t only),尾静脉注射cd8+t+irgd+皮下注射cmp@gel组(t+irgd+cmp@gel),尾静脉注射cd8+t+irgd+
apd1+皮下注射cmp@gel组(t+irgd+apd1+cmp@gel),尾静脉注射cd8+t+皮下注射共载cmp、apd1和irgd的温敏凝胶组(t+cmp/apd1/irgd@gel),尾静脉注射cd8+t+irgd+皮下注射共载cmp与apd1温敏凝胶组(t+irgd+cmp/apd1@gel)(图9a)。t+irgd+apd1+cmp@gel组和t+irgd+cmp@gel组的结果证明,免疫检查点抑制apd1对提高实体瘤的疗效是必要的。t+irgd+cmp/apd1@gel组与t+irgd+apd1+cmp@gel组的结果证明,相较于尾静脉注射游离apd1,装载在水凝胶中的apd1更有利于增强联合疗法的治疗效果。t+cmp/apd1/irgd@gel组与t+irgd+cmp/apd1@gel组的结果证明,游离irgd肽与装载在温敏凝胶中的irgd的抑瘤曲线在统计的时间点内无统计学差异(图9b),但t+cmp/apd1/irgd@gel组中仅16.7%小鼠的肿瘤被完全清除,而t+irgd+cmp/apd1@gel组66.7%小鼠的肿瘤消失(图9d)。治疗过程中各组小鼠体重均无明显下降,说明药物的体内安全性(图9c)。
[0198]
2.9共载cxcl9和apd1温敏凝胶的体内免疫学评价
[0199]
为了研究共载cmp和apd1的温敏凝胶联合irgd后的体内免疫学效果,我们在c57bl/6雌性小鼠皮下构建b16-ova肿瘤模型,提取pmel-1小鼠的脾细胞,用gp100多肽激活,在肿瘤体积达到85mm3后,注射激活的pmel-1 thy1.1+cd8+t细胞进行过继t细胞治疗。分别设置空白组(pbs),尾静脉注射cd8+t组(t only),尾静脉注射cd8+t+irgd+apd1+皮下注射游离cxcl9组(t+irgd+apd1+cxcl9),尾静脉注射cd8+t+irgd+皮下注射cmp/apd1@gel组(t+irgd+cmp/apd1@gel)。共载cxcl9与apd1的生物凝胶组比统计量药物显著降低肿瘤尺寸(图10a-c)。在初次治疗后6天,对小鼠肿瘤、脾脏、淋巴结和外周血中的细胞进行分析。在肿瘤中,各组cd8+t细胞在淋巴细胞中的占比无统计学差异(图11a-b)。共载药物凝胶组(t+irgd+cmp/apd1@gel组)比同剂量游离药物大幅提升了肿瘤浸润过继t细胞(act)的数量,act在淋巴细胞和cd8+t细胞中的占比分别是游离药物组的4.1和3.4倍(图11c-e)。更重要的是,在t+irgd+cmp/apd1@gel组每mg实体瘤的过继t细胞数量比游离药物t+irgd+apd1+cxcl9组提高了近21倍(图11f)。此外,药物共载免疫凝胶也能显著增加每mg实体瘤中内生cd8+t细胞的数量,t+irgd+cmp/apd1@gel组是游离药物t+irgd+apd1+cxcl9组的6倍(图11g)。凝胶组不仅比游离药物组提高了过继t细胞的数量,t+irgd+cmp/apd1@gel组过继t细胞ifn-γ(图12a-b)、granzyme b(图12c-d)的表达量是t+irgd+cmp/apd1@gel组内生cd8+t细胞表达量的1.5、3.5倍,具有更强的肿瘤细胞杀伤力。温敏凝胶相较游离药物,也提高了腹股沟淋巴结(图13a-b)、脾脏(图13c-d)和血液(图13e-f)中的过继t细胞占比,其分别是游离药物组的2.4、2.6和1.8倍。
[0200]
2.10免疫调节温敏凝胶的远端瘤治疗效果
[0201]
为了研究共载温敏凝胶疗法是否可以激发全身抗癌免疫反应,从而治疗非凝胶附近的肿瘤,达到全身性治疗和治疗已转移肿瘤的效果,我们设计了远端瘤治疗实验。在c57bl/6小鼠的背部右侧接种b16-ova“近端肿瘤”,在小鼠左侧接种“远端肿瘤”,在肿瘤体积约55mm3开始治疗,在“近端肿瘤”附近注射免疫凝胶。分别设置空白组(pbs),尾静脉注射cd8+t组(t only),尾静脉注射cd8+t+irgd+apd1+皮下注射游离cxcl9组(t+irgd+apd1+cxcl9),尾静脉注射cd8+t+irgd+皮下注射cmp/apd1@gel组(t+irgd+cmp/apd1@gel)(图14a)。治疗后,87.5%小鼠的右侧近端肿瘤被成功消除(图14b)。更有意义的是,温敏凝胶也清除了62.5%小鼠的远端肿瘤,且凝胶组平均肿瘤体积仅为游离药物组的4%(图14c)。治疗60天,t+irgd+cmp/apd1@gel组小鼠存活率为62.5%(5/8只)(图14e)。上述结果证明了温
敏凝胶可触发全身免疫反应,治疗全身性或扩散转移的肿瘤(图14),而非局限于凝胶注射部位附近的肿瘤。
[0202]
2.11免疫调节温敏凝胶促进抗肿瘤免疫记忆的产生
[0203]
在之前试验中被凝胶组治愈的c57bl/6小鼠皮下(90天后),再次接种b16-ova肿瘤细胞,进行肿瘤再次挑战实验。在同周龄健康c57bl/6小鼠皮下接种肿瘤细胞做为对照组。分别在接瘤后第11天、14天、18天、21天、24天和27天,尾静脉注射apd1(图15a)。12.5%的治愈组小鼠在肿瘤再次挑战后未有肿瘤生成,另有50%的治愈组小鼠肿瘤生长后被apd1完全消除,而每只对照组小鼠的肿瘤都生长起来。最终,治愈组小鼠的肿瘤平均体积仅为对照组的17%(图15b-c)。这些数据说明前期过继t细胞和免疫凝胶治疗能显著延迟肿瘤的再次发生,并且使小鼠对apd1治疗具有更强的响应性。这证明免疫温敏凝胶有利于抗癌免疫记忆的产生,能预防肿瘤复发和显著提高免疫检查点抑制剂对复发肿瘤的治疗效果。
[0204]
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1