一类新结构类型的硫氧还蛋白还原酶抑制剂及用途
1.本发明公开了一类新结构类型的硫氧还蛋白还原酶抑制剂及在疾病治疗(尤其是抗肿瘤和抗菌)中的用途。属于医药领域。
背景技术:
2.目前所报道的硫氧还蛋白还原酶抑制剂结构类型单一,不利于靶向硫氧还蛋白还原酶的药物发展和其生物学功能探究(med.res.rev.,2019,39:5-39)。因此,发展新化学类型硫氧还蛋白还原酶抑制剂并揭示其抗癌或者抗菌作用机制对药物研发和硫氧还蛋白还原酶生物学功能探究意义显著。
3.癌症是当今社会危害人类健康和生命的重大疾病之一。癌症的治疗不仅是医学的一大挑战,而且也导致了严重的社会与经济问题。近年来,利用癌细胞与正常细胞不同的生化特征实现恶性肿瘤的化学药物治疗备受学者关注。比如利用癌细胞与正常细胞之间抗氧化酶硫氧还蛋白还原酶的表达差异(trends pharmacol sci.,2017,38(9):794-808),发展特异性地靶向硫氧还蛋白还原酶的候选分子已经是靶向抗癌药物研究的热点之一。
4.现代抗菌化学疗法始于20世纪30年代,在接下来的四十年中,几乎发现了目前使用的所有的抗菌药物的类型。然而,对这些药物的细菌耐药性是目前国际公认的永久性和严重性的问题(nat rev microbiol,2010,8(7):501-510)。因此,发现具有新颖作用方式的药物对于应对耐药性产生的威胁至关重要。基于目前许多抗菌药物的耐药与机体的氧化还原系统有关(j med chem,2017,60(8):3221-3240),靶向机体氧化还原系统发展新作用类型且避免化疗耐药的新抗菌药物至关重要。
5.作为机体氧化还原系统的关键调控蛋白之一,硫氧还蛋白还原酶是一种同源二聚体的含硒蛋白,属于吡啶核苷酸-二硫键氧化还原酶的黄素蛋白家族,它的结构包含fad辅基、nadph结合位点、以及二硫醇/二硫键基序的氧化还原活性位点。哺乳动物硫氧还蛋白还原酶是较大的蛋白质(每个亚基约55kda),且具有与谷胱甘肽还原酶类似的结构和催化机制。哺乳动物硫氧还蛋白还原酶和谷胱甘肽还原酶之间最显著的区别是,哺乳动物硫氧还蛋白还原酶在其碳末端带有一个额外的延伸序列(~16个氨基酸),其中包含一个独特但必不可少的硒半胱氨酸(sec)残基(proc.natl.acad.sci.u.s.a.1996,93:1006-1011;proc.natl.acad.sci.u.s.a.2000,97:5854-5859)。半胱氨酸通过硒醇硫醇/硒烯硫醚交换反应形成另一个氧化还原活性位点。人类中至少存在三种哺乳动物的硫氧还蛋白还原酶亚型-细胞质和细胞核中的硫氧还蛋白还原酶1,线粒体中的硫氧还蛋白还原酶2和睾丸组织特异的硫氧还蛋白还原酶3(也称为硫氧还蛋白谷胱甘肽还原酶)。尽管细胞定位不同,但硫氧还蛋白还原酶1和硫氧还蛋白还原酶2具有相似的结构和催化机理。
6.基于hanahan和weinberg对癌症特征的描述(cell,2001,144:646-674),对于肿瘤的发展,细胞至少必须进行一些必要的改变,例如维持增殖信号,逃避生长抑制剂,抵抗细胞死亡,使复制永生,诱导血管生成,激活侵袭和转移,能量代谢的重新编程以及逃避免疫破坏(cell,2001,144:646-674)。越来越多的例子表明,氧化还原信号实际上参与了癌症的
所有上述特征(antioxid.redox signal.,2016,25:300-325)。由于硫氧还蛋白还原酶和硫氧还蛋白(trx)系统是细胞氧化还原调节网络的核心参与者之一,因此大量研究和临床观察表明硫氧还蛋白还原酶/trx系统与癌症发展密切相关(curr.opin.pharmacol.,2007,7:392-397;semin.cancer biol.,2006,16:420-426;trends pharmacol sci.,2017,38(9):794-808)。
7.根据癌症的发生阶段,trx系统在癌症的发展和传播中可以具有双向功能。在早期阶段,系统的直接抗氧化功能及其对其他抗氧化酶的支持可通过防御异种生物引起的氧化应激来预防正常的细胞恶性肿瘤。但是,一旦健康细胞启动了肿瘤表型,硫氧还蛋白还原酶/trx的水平升高便会促进肿瘤的发展和转移,因为它们具有促生长,抗凋亡和支持血管生成的功能(cancer cell,2006,10:175-176;trends pharmacol sci.,2017,38(9):794-808)。因此,多数研究发现相对于正常组织,trx系统在肿瘤组织中过表达(trends pharmacol sci.,2017,38(9):794-808)。据报道,目前许多临床抗癌药物也会抑制硫氧还蛋白还原酶(chem.res.toxicol.,2012,25:1502-1511;free radic.biol.med.,2005,39:696-703)。高水平的硫氧还蛋白还原酶/trx对维持肿瘤表型和转移至关重要。认为转染功能性trx也会促进癌细胞增殖(cancer res.,1996,56:5765-5770)。与癌细胞对trx系统的高度依赖相一致,研究发现突变trx的功能位点,即阴性突变体trx(c32s/c35s)的转染或硫氧还蛋白还原酶的耗竭会导致肿瘤进展和转移的延迟(antioxid.redox signal.,2015,22:938-950;j.biol.chem.,2006,281:13005-13008),这说明在此情况下,硫氧还蛋白还原酶/trx的活性为是细胞生存和致瘤能力的关键介质。
8.trx系统通过直接中和活性氧或通过还原抗氧化小分子为其他抗氧化剂提供电子的间接作用,在抗氧化剂防御中发挥重要作用(biochem.biophys.res.commun.,2000,277:443-447;biochim.biophys.acta,2009,1790:495-526)。trx系统的抗氧化功能有益于癌细胞的存活,因为与正常细胞相比,癌细胞通常具有更高水平的活性氧(cancer res.,1991,51:794-798)。活性氧含量高使得癌细胞比正常细胞对活性氧更敏感,这为活性氧介导的癌症治疗奠定了基础(cancer cell,2006,10:241-252)。目前许多癌症治疗方法,如化疗和放疗,都与活性氧的产生有关。高水平的trx/硫氧还蛋白还原酶也有助于抵抗这些抗癌疗法(clin.cancer res.,2005,11:8425-8430;cancer res.,1995,55:4293-4296),并且已证明靶向抑制硫氧还蛋白还原酶/trx可以提高治疗效果(cancer res.,2010,70:1941-1950)。综上所述,癌细胞中高水平的trx系统有助于保护细胞免受氧化应激和ros介导的癌症治疗。
9.凋亡信号激酶1(ask1)是一种mapkkk,可导致jnk和p38 map激酶途径的激活。还原态的trx可以与ask1结合,以抑制其活化(embo j.,1998,17:2596-2606)。此外,还原态的trx与ask1的结合可以进一步使得该激酶直接进行泛素化介导的降解(circ.res.,2002,90:1259-1266)。caspases是细胞凋亡的执行者,属于半胱氨酸蛋白酶家族,其活性关键取决于其活性位点中硫醇盐的存在。值得注意的是,trx已被证明可以通过催化procaspase 3和caspase 3的s-亚硝基化而直接抑制细胞凋亡(nat.chem.biol.,2005,1:154-158)。最近证明,还原态的trx1可以与细胞凋亡诱导因子(aif)结合,以抑制aif介导的dna损伤(free radic.biol.med.,2015,87:125-136)。更有趣的是,靶向硫氧还蛋白还原酶的某些亲电抑制剂,如1-氯-2,4-二硝基苯(j.biol.chem.,1995,270:3479-3482),姜黄素
(toxicol.appl.pharmacol.,2012,262:341-348),紫草素(free radic.biol.med.,2014,70:182-193),有机砷化合物(j.med.chem.,2014,57:5203-5211)和小白菊内酯(j.biol.chem.,2016,291:10021-10031)可能会修饰第二个残基,通过获得功能使硫氧还蛋白还原酶酶从抗氧化剂转变为活性氧产生剂。据报道,这种硒受损的硫氧还蛋白还原酶具有促进细胞凋亡的直接能力(j.biol.chem.,2003,278:15966-15972)。总之,靶向硫氧还蛋白还原酶/trx抑制可能促进癌细胞的凋亡。
10.增殖失调是肿瘤形成的标志之一(cell,2001,144:646-674),癌细胞对持续进行dna合成以维持其快速增殖的需求很高。癌细胞中高水平的trx系统有助于为dna合成提供脱氧核糖核苷酸(j.biol.chem.,1964,239:3436-3444)。肿瘤抑制磷酸酶和张力蛋白同源物(pten)是pi3k-akt途径的负调节剂,trx1直接与pten的c2结构域结合并抑制其脂质磷酸酶活性(arch.biochem.biophys.,2004,429:123-133),而pten的失活会导致akt活性升高和异常的生长调节。因此,硫氧还蛋白还原酶/trx水平的升高可能有助于刺激癌细胞的增殖。此外,trx系统激活了几个通常与细胞生长、细胞存活、及血管生成有关的转录因子,如p53、核因子κb(nf-κb)、活化蛋白1(ap-1)、低氧诱导因子1α(hif-1α)和组蛋白脱乙酰基酶(hdac)(free radic.biol.med.,2014,66:75-87),从而刺激细胞的异常增殖。
11.总之,靶向抑制硫氧还蛋白还原酶/硫氧还蛋白的活性是目前癌症治疗中很有前景的策略之一。因此,已经有许多靶向硫氧还蛋白还原酶/硫氧还蛋白系统的分子,被开发为用于癌症治疗的潜在治疗剂或作为现有抗癌疗法的辅助剂(med.res.rev.,2019,39:5-39;free radic.biol.med.,2012,52:257-265)。
12.抗生素等抗菌药物在预防和治疗细菌感染性疾病中起着不可替代的作用。但是,由于抗生素等的使用不当,细菌的耐药性已成为全世界公共卫生的主要挑战。诸如谷胱甘肽之类的小硫醇分子可以直接与某些抗生素反应并结合,从而有助于药物的敏感性和耐药性。即细菌抗氧化系统在抗菌药物耐药中发挥着很重要的作用。越来越多的证据表明,某些抗生素的抗菌活性与活性氧之间有着密切的联系(j med chem,2017,60(8):3221-3240)。而硫氧还蛋白和谷胱甘肽系统是维持细胞活性氧水平的两个主要细胞二硫键还原酶系统。因此,这两个硫醇依赖性抗氧化剂系统可能会影响抗生素的敏感性和耐药性(curr med chem,2020,27(12):1940-1954)。比如细菌硫氧还蛋白还原酶可以将电子从nadph转移到trx,从而使其能够调节各种关键细胞蛋白的功能,包括核糖核苷酸还原酶(rnr),蛋氨酸-s-亚砜还原酶(msr),硫醇过氧化物酶(tpx),细菌铁蛋白迁移蛋白(bcp),而bcp在抗氧化剂防御以及dna合成和修复中至关重要(curr med chem,2020,27:1-18)。因此,靶向硫氧还蛋白还原酶发展新型耐药的抗菌药物已经成为目前研究的热点之一。
技术实现要素:
13.本发明的第一目的在于提供一类新结构类型的硫氧还蛋白还原酶抑制剂,这类硫氧还蛋白还原酶抑制剂与目前已经报道的硫氧还蛋白还原酶抑制剂在结构母核和作用位点上有所不同。
14.本发明的第二目的是所提供的这类新化学类型的硫氧还蛋白还原酶抑制剂会靶向以前并未报道的新作用靶点,产生显著的药理活性(尤其是抗肿瘤和抗菌活性),且选择性好。硫氧还蛋白还原酶是具有该类结构化学分子发挥上述药理学活性的新靶点。
15.本发明的实施例是这样实现的:
16.本发明所述的一类新结构类型的硫氧还蛋白还原酶抑制剂所含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)基团,而且丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)基团在抑制硫氧还蛋白还原酶中起到关键作用,其结构式为:
[0017][0018]
式中r1、r2是芳环衍生物、杂环衍生物或者脂肪链衍生物取代基。
[0019]
一类新结构类型的硫氧还蛋白还原酶抑制剂的制备方法,包括:
[0020]
构筑上述结构母核,并连接上述所述的以及药物研究所接受的取代基;或者将带有上述取代基及药物研究所接受的取代基的中间体直接构筑含上述母核的药物分子及其盐。
[0021]
一类新结构类型的硫氧还蛋白还原酶抑制剂的新作用靶点,在其药理作用上的应用,包括:
[0022]
选择性地杀死肿瘤细胞及感染的细菌;或者在此新靶点下产生的新的药理学作用。
[0023]
本发明实施例的有益效果是:
[0024]
本发明实施提供了一类含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制剂,结构骨架不同于目前已知的硫氧还蛋白还原酶抑制剂,这类新化学类型的硫氧还蛋白还原酶抑制剂可以被癌细胞或者细菌中过表达的蛋白选择性地识别;一种含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制剂的制备方法,构筑带有前述取代基的丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)类分子,制得新化学类型的硫氧还蛋白还原酶抑制剂。在这些新型的硫氧还蛋白还原酶抑制剂被肿瘤细胞或者细菌中过表达蛋白特异性识别后,可以选择性地杀死肿瘤细胞或者感染的细菌,或者产生其他以硫氧还蛋白还原酶为靶点的新药理学作用,而对正常细胞影响比较小。最终达到新化学类型硫氧还蛋白还原酶靶向治疗的效果。
附图说明
[0025]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0026]
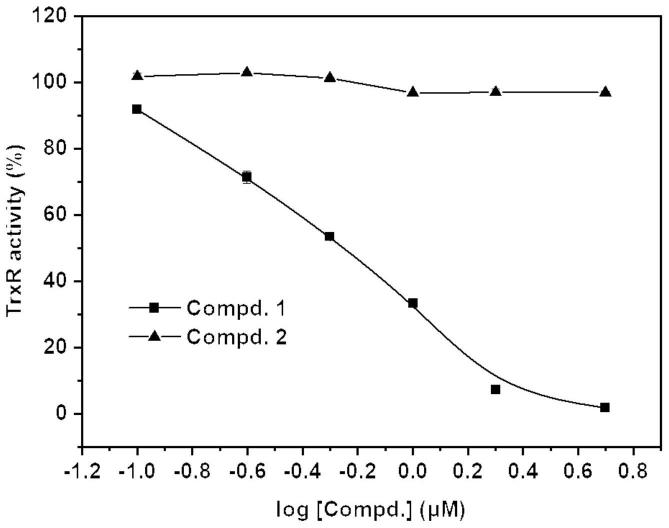
图1为含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制剂的代表分子(compd.1)对纯硫氧还蛋白还原酶活性的抑制情况。
[0027]
图2为含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制剂的代表分子(compd.1)抑制人宫颈癌hela细胞内硫氧还蛋白还原酶活性。
[0028]
图3为含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制剂的代表分子(compd.1)对人宫颈癌细胞系hela细胞、人肝癌细胞系hepg 2细胞、人肺癌细胞系a549细胞和人原髓细胞白血病hl-60细胞作用48h后的肿瘤细胞生长曲线。
[0029]
图4为含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)新结构类型的硫氧还蛋白还原酶抑制
剂的代表分子(compd.1)对金黄色葡萄球菌(staphylococcus aureus)作用24h后的生长曲线图。
具体实施方式
[0030]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0031]
下面对本发明实施例的一类新结构类型的硫氧还蛋白还原酶抑制剂及其用途进行具体说明。
[0032]
硫氧还蛋白还原酶是一种同源二聚体的含硒蛋白,在其c端共有一个独特但必不可少的硒代半胱氨酸残基。硫氧还蛋白还原酶及其内源性底物硫氧还蛋白在调节机体各种细胞氧化还原调控中起着至关重要的作用。大量的证据表面硫氧还蛋白还原酶的过度激活/功能异常与各种疾病(例如癌症、细菌感染、神经退行性疾病)的发生和发展密切相关。因此,寻找并发展新化学类型的硫氧还蛋白还原酶小分子调节剂引起了大家越来越多的兴趣。一类新结构类型的硫氧还蛋白还原酶抑制剂可以靶向新靶点硫氧还蛋白还原酶,选择性地杀死肿瘤细胞或者感染的细菌,或者产生其它新的药理学作用,而对正常细胞影响比较小。
[0033]
本发明实施例提供了一类新结构类型的硫氧还蛋白还原酶抑制剂,其结构含丙炔酰胺(2-炔酰胺、丙-2-炔酰胺),而且丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)在抑制硫氧还蛋白还原酶中起到关键作用,其结构式为:
[0034][0035]
式中r1、r2是芳环衍生物、杂环衍生物或者脂肪链衍生物取代基。
[0036]
本发明实施例公布了一类新结构类型的硫氧还蛋白还原酶抑制剂。
[0037]
本发明实施例还提供了这类新结构类型的硫氧还蛋白还原酶抑制剂的新作用靶点,在其药理作用上的应用,包括:
[0038]
选择性地杀死肿瘤细胞及感染的细菌;或者在此新靶点下产生的新的药理学作用。
[0039]
实施例1
[0040]
本实施例提供了一类新结构类型的硫氧还蛋白还原酶抑制剂的功能基团,其结构式为:
[0041][0042]
式中r1、r2是芳环衍生物、杂环衍生物或者脂肪链衍生物取代基。
[0043]
实施例2
[0044]
本实施例提供了丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)的新结构类型的硫氧还蛋白还原酶抑制剂靶向硫氧还蛋白还原酶的作用位点。
[0045]
下面以化合物(compd.1)为例进行说明。
[0046]
如图1所示,compd.1可以与纯硫氧还蛋白还原酶作用,并降低其酶的活性。而对照分子(对照化合物,compd.2)却不能抑制硫氧还蛋白还原酶的活性,说明丙炔酰胺(2-炔酰胺、丙-2-炔酰胺)对抑制硫氧还蛋白还原酶活性很重要。
[0047]
此外,代表化合物1(compd.1)作用于人宫颈癌细胞系hela细胞一定时间后,收集细胞,裂解后提取蛋白,采用胰岛素终点还原法检测细胞内的硫氧还蛋白还原酶活性,如图2所示,发现compd.1也能很好地抑制细胞内硫氧还蛋白还原酶的活性。
[0048]
本实施例的具体操作方法如下:
[0049]
采用dtnb法检测纯硫氧还蛋白还原酶(trxr)的活性,将nadph预还原的硫氧还蛋白还原酶与不同浓度的药物加入到96孔板中,总体积为50μl。在室温下孵育一定的时间后,接着加入50μl含有nadph和dtnb的混合液于每孔中,终浓度分别为0.2mm和2mm,然后立即测定前3min内的吸光度值(412nm)的增加,与加入药物等量的dmso作为对照,硫氧还蛋白还原酶的活性用相比对照的百分比来表示。
[0050]
采用胰岛素终点还原法检测细胞内的硫氧还蛋白还原酶活性,将细胞种于100mm的培养皿中,待细胞融合度为70-80%左右时,加入不同浓度的药物处理一定时间,然后收集细胞,并用pbs洗2次,用ripa缓冲液提取蛋白,采用考马斯亮蓝法测定细胞中总蛋白的浓度。将含有20μg总蛋白的细胞裂解液、nadph、胰岛素以及硫氧还蛋白(trx)的混合液加入到96孔板中,nadph、trx、胰岛素的浓度分别为660μm、15μm、300μm,100mm tris-hcl,ph 7.6,edta的浓度为3mm,总体为50μl;在涡旋器上充分混匀,然后在37℃孵育0.5h;然后加入100μl含有1mm dtnb的6m的盐酸胍溶液,室温下放置5min后测定412nm处的吸光度值。不加trx的作为空白,其他条件一样,最后从每个样品中减去相对应空白的吸光度值,即可得到细胞内硫氧还蛋白还原酶的活性。
[0051]
实施例3
[0052]
如图3所示,这类新结构类型的硫氧还蛋白还原酶抑制剂,以代表化合物1(compd.1)为例,对多种肿瘤细胞,包括人宫颈癌细胞系hela细胞、人肝癌细胞系hepg 2细胞、人肺癌细胞系a549细胞和人原髓细胞白血病hl-60细胞,都表现出很好的生长抑制作用,药物作用48h后的肿瘤细胞生长曲线如图3所示。
[0053]
本实施例具体采用以下操作方法:
[0054]
mtt比色法,是一种检测细胞存活和生长的方法。将每孔5
×
103至1
×
104个细胞(根据细胞种类及作用时间选取不同细胞数)与试验药物种于96孔板中,每孔总体积为100μl,每个药物浓度平行4-6份,使用0.1%的溶媒(一般是dmso)作为对照,在5%co2、95%湿度和37℃的培养条件下培养指定时间。接着用多道移液枪向每孔加入10μl mtt(终浓度:5mg/
ml)继续孵育4小时,mtt与活细胞线粒体中的琥珀酸脱氢酶完全反应,生成蓝紫色结晶甲瓒,用多道移液枪向每孔加入100μl提取缓冲液(即三联溶液含10%sds、0.1%hcl及5%异丁醇),继续过夜培养(一般在8-12小时之间),使蓝紫色的甲瓒结晶完全溶解,在570nm处测定吸光度值,对照组吸光度最好在0.8-1之间,按照:细胞存活率(%)=(od药物组-od空白)/(od对照-od空白)
×
100,计算细胞存活率。
[0055]
实施例4
[0056]
如图4所示,这类新化学类型的硫氧还蛋白还原酶抑制剂,以代表化合物1(compd.1)为例,对金黄色葡萄球菌(staphylococcus aureus)表现出很好的生长抑制作用,药物作用24h后的金葡菌的生长曲线如图4所示,通过测量600nm处的吸光度值,发现不同浓度的compd.1对金黄色葡萄球菌的生长产生抑制作用。compd.1通过靶向细菌硫氧还蛋白还原酶对金黄色葡萄球菌的起到抗菌作用,对compd.1作用的金黄色葡萄球菌提取物进行采用dtnb法进行测定硫氧还蛋白还原酶的活性,发现compd.1能很好地抑制细菌中的硫氧还蛋白还原酶活性。
[0057]
实施例4的具体操作方法如下:
[0058]
使金黄色葡萄球菌正常生长(37℃,220rpm),直到通过分光光度计法测定600nm处的od值为0.4时,将其稀释100倍,在96孔板中,用不同浓度的药物处理,37℃孵育24小时后,测定600nm处的吸光度值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1