巴戟天提取物在制备II型5α-还原酶抑制剂中的应用的制作方法
巴戟天提取物在制备ii型5
α-还原酶抑制剂中的应用
技术领域
1.本发明属于医药技术领域,尤其涉及巴戟天提取物在制备ii型5α-还原酶抑制剂中的应用。
背景技术:
2.巴戟天(morinda officinalis how),为双子叶植物纲、龙胆目、茜草科、巴戟天属植物。中医中,巴戟天主治阳痿遗精、宫冷不孕、月经不调、风湿麻痹、筋骨瘘软,主要可应用于生殖系统的疾病。巴戟天是一类药食同源植物,由于其安全性高、具有较好的抗氧化、抗炎及抗肿瘤的活性,在食品、药品等方面有广泛的应用。巴戟天的主要化学成分为蒽醌类化合物、环烯醚萜类化合物、寡糖类化合物三大类。
3.5α-还原酶(5α-reductase,5ar)是依赖于还原型辅酶ii(nadph)的膜蛋白酶,已知人的5α-还原酶有ⅰ型(5ar1)和ⅱ型(5ar2)两种同功酶,其中,5ar1主要分布在人体中的雄激素非依赖性器官中,例如肝脏和脑;5ar2则大量存在与毛囊毛根鞘、前列腺、附睾等雄激素依赖性器官中。在人体内,5ar2催化正常睾酮(t)转化为活性更强的双氢睾酮(dht),由此产生的dht能够与雄激素受体结合并作用于特定的核基因的转录和表达。dht作用于前列腺组织的分化和生长、男性生殖器的生长、面部和身体上毛发的生长,并参与若干疾病诸如良性前列腺增生、前列腺癌、雄激素性脱发和痤疮等雄激素疾病。
4.良性前列腺增生(benign prostatic hyperplasia,bph)亦称前列腺增生症,是由于人体内雄激素与雌激素平衡失调,前列腺上皮和/或间质细胞过度增殖引起的前列腺腺体非肿瘤性的异常增生,属于老年男性常见病、多发病。临床主要表现为尿频、尿急、尿后余沥不尽、排尿困难或尿潴留等下尿路梗阻症状(lower urinary tract symptoms,luts)。目前使用国际前列腺症状评分(ipss)的调查表来评估此类症状并从而评估疾病的严重度。若不能恰当治疗,良性前列腺增生可随时间而发展,导致更严重的后果。尿潴留可确定由于膀胱残余尿中细菌的生长导致的前列腺炎的发生,和由于残余尿中盐的形成导致的肾结石。并且,膀胱排空不彻底和慢性尿潴留可显著损害肾功能,并随之出现梗阻型尿路病。
5.目前治疗前列腺疾病的主要方法有三种:一是物理治疗,即使用医疗器械,通过微波、激光、远红外线等高温手段使前列腺内部循环加速,从而达到缓解前列腺疾病的症状,但此种疗法会破坏前列腺的生理功能,多次使用只会加大治疗难度;二是外科治疗,即通过前列腺会阴封闭注射、前列腺灌注、前列腺切除等方式治疗前列腺疾病,此种方式同样会使前列腺的生理功能遭到破坏;三是通过药物治疗,西药主要为α-1受体阻滞剂和5α-还原酶抑制剂,这些药可有效抑制二氢睾酮(dht)的含量,但适应症范围相对局限,也存在药物不良反应如生理功能异常等;并且无论中药还是西药,都难以穿越前列腺上皮的脂膜,进入前列腺腺泡中达到冶疗作用,长期服用此药物,就会导致药物的残渣和毒素遗留前列腺内,长此以往,无疑会给前列腺带来更大的伤害。同时,前列腺癌的重要指标之一前列腺特异性抗原(psa)会受到前列腺增生治疗药物,如保列治的影响,从而影响对前列腺癌的判断。
6.雄激素性脱发(aga)是既侵袭男性也侵袭女性的皮肤病。在男性情况下,30岁以上
者逾30%和50岁以上者逾50%罹患此病。aga甚至可以较低发生率侵袭,临床症状普遍较轻,比如头皮整个上部毛发的弥漫性稀疏。雄激素性脱发的病理机制尚未清晰,若干因素都可能在该病中起作用,比如年龄和遗传。此外,个体中的脱发现象和雄激素活性之间存在某种联系,5α-还原酶将睾酮转化为dht是主要因素。事实上,毛囊中存在的dht能够与雄激素结合并在毛发的生命周期中诱导生长期持续时间的减少和静止期的延长。导致的结果是毛发的长度和直径减小(小型化)。静止期(telagen phase)和脱发之后,生长期的恢复也将延迟。不同生命周期中小型化症的复发将导致毛球的最终死亡和毛发的不可逆脱落。
7.目前,通过局部或全身给药米诺地尔,是最常见的雄激素性脱发的治疗手段之一。最初用于高血压治疗的血管扩张药米诺地尔似乎能够直接作用于毛囊角质形成细胞的增殖和分化,诱导生长期的延长。米诺地尔常与其它活性物质联合使用,但治疗中止后,其作用效果随时间推移而减弱。且该药物的扩展应用增加了副作用的风险,比如刺激、皮疹还有严重的瘙痒。此外,非那雄胺也用于aga的全身性治疗。然而,这些治疗方式周期长,用量大,费用高,且药物有较大副作用,包括前列腺的各种生理功能会受到阻碍。
8.鉴于上述治疗方法所存在的并发症以及不良反应,研究人员把目光转向了副作用小,可长期使用的天然植物类药物。
技术实现要素:
9.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明第一个方面提出一种ⅱ型5α-还原酶抑制剂,其活性成分包括巴戟天提取物。巴戟天提取物可以显著抑制5α-还原酶活性,降低动物组织及血清中的dht含量。因此,以巴戟天提取物为主要活性的成分的ⅱ型5α-还原酶抑制剂可应用于治疗雄激素依赖性疾病,如良性前列腺增生、雄激素脱发及痤疮等的产品中。本发明实验数据证明巴戟天提取物能显著诱导人前列腺基质良性增生细胞和人前列腺增生上皮细胞活力下降,显著抑制人皮脂腺细胞增殖以及显著促进人乳头真皮细胞的增殖。
10.本发明的第二个方面提出了巴戟天提取物在制备ⅱ型5α-还原酶抑制剂中的应用。
11.本发明的第三个方面提出了巴戟天提取物在制备双氢睾酮抑制剂中的应用。
12.本发明的第四个方面提出了巴戟天提取物在制备前列腺增生和/或雄激素性脱发和/或痤疮制品中的应用。
13.根据本发明的第一个方面,提出了一种ⅱ型5α-还原酶抑制剂,所述ⅱ型5α-还原酶抑制剂的活性成分包括巴戟天提取物。
14.在本发明的一些实施方式中,所述巴戟天提取物的质量浓度为0.5mg/ml~2.5mg/ml。
15.在本发明的一些优选的实施方式中,所述巴戟天提取物为醇浸水提提取物。本发明中,巴戟天醇浸水提提取物的主要成分包括檄树素甙,维他命c和醣酯类等。
16.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得滤液,除菌后制得巴戟天提取物。
17.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得第一次滤液和滤渣;再向所述滤渣加水煮沸
后过滤得第二次滤液,浓缩所述第一次滤液和所述第二次滤液,再次过滤,除菌后制得巴戟天提取物。
18.在本发明的一些更优选的实施方式中,所述醇包括乙醇、正丁醇中的至少一种。
19.在本发明的一些更优选的实施方式中,所述醇的浓度为90%~98%。
20.在本发明的一些更优选的实施方式中,所述醇与所述巴戟天的体积质量比为(4~8):1。
21.在本发明的一些更优选的实施方式中,所述水与所述巴戟天的体积质量比为(5~9):1。
22.根据本发明的第二个方面,提出了巴戟天提取物在制备ⅱ型5α-还原酶抑制剂中的应用。
23.在本发明的一些实施方式中,所述巴戟天提取物的质量浓度为0.5mg/ml~2.5mg/ml。
24.在本发明的一些优选的实施方式中,所述巴戟天提取物为醇浸水提提取物。本发明中,巴戟天醇浸水提提取物的主要成分包括檄树素甙,维他命c和醣酯类等。
25.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得滤液,除菌后制得巴戟天提取物。
26.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得第一次滤液和滤渣;再向所述滤渣加水煮沸后过滤得第二次滤液,浓缩所述第一次滤液和所述第二次滤液,再次过滤,除菌后制得巴戟天提取物。
27.在本发明的一些更优选的实施方式中,所述醇包括乙醇、正丁醇中的至少一种。
28.在本发明的一些更优选的实施方式中,所述醇的浓度为90%~98%。
29.在本发明的一些更优选的实施方式中,所述醇与所述巴戟天的体积质量比为(4~8):1。
30.在本发明的一些更优选的实施方式中,所述水与所述巴戟天的体积质量比为(5~9):1。
31.根据本发明的第三个方面,提出了巴戟天提取物在制备双氢睾酮抑制剂中的应用。
32.在本发明的一些实施方式中,所述巴戟天提取物的质量浓度为0.5mg/ml~2.5mg/ml。
33.在本发明的一些优选的实施方式中,所述巴戟天提取物为醇浸水提提取物。本发明中,巴戟天醇浸水提提取物的主要成分包括檄树素甙,维他命c和醣酯类等。
34.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将所述巴戟天提取物的制备方法为:巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得滤液,除菌后制得巴戟天提取物。
35.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得第一次滤液和滤渣;再向所述滤渣加水煮沸后过滤得第二次滤液,浓缩所述第一次滤液和所述第二次滤液,再次过滤,除菌后制得巴戟天提取物。
36.在本发明的一些更优选的实施方式中,所述醇包括乙醇、正丁醇中的至少一种。
37.在本发明的一些更优选的实施方式中,所述醇的浓度为0.5mg/ml~2.5mg/ml。
38.在本发明的一些更优选的实施方式中,所述醇与所述巴戟天的体积质量比为(4~8):1。
39.在本发明的一些更优选的实施方式中,所述水与所述巴戟天的体积质量比为(5~9):1。
40.根据本发明的第四个方面,提出了巴戟天提取物在制备防治前列腺增生和/或雄激素性脱发和/或痤疮制品中的应用。
41.在本发明的一些实施方式中,所述巴戟天提取物的质量浓度为0.5mg/ml~2.5mg/ml。
42.在本发明的一些优选的实施方式中,所述巴戟天提取物为醇浸水提提取物。本发明中,巴戟天醇浸水提提取物的主要成分包括檄树素甙,维他命c和醣酯类等。
43.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得滤液,除菌后制得巴戟天提取物。
44.在本发明的一些更优选的实施方式中,所述巴戟天提取物的制备方法为:将巴戟天粉碎后,用乙醇浸泡,并加水煮沸,过滤后得第一次滤液和滤渣;再向所述滤渣加水煮沸后过滤得第二次滤液,浓缩所述第一次滤液和所述第二次滤液,再次过滤,除菌后制得巴戟天提取物。
45.在本发明的一些更优选的实施方式中,所述醇包括乙醇、正丁醇中的至少一种。
46.在本发明的一些更优选的实施方式中,所述醇的浓度为90%~98%。
47.在本发明的一些更优选的实施方式中,所述醇与所述巴戟天的体积质量比为(4~8):1。
48.在本发明的一些更优选的实施方式中,所述水与所述巴戟天的体积质量比为(5~9):1。
49.在本发明的一些更优选的实施方式中,所述制品包括保健品、药品或日用品的任意一种。
50.在本发明的一些更优选的实施方式中,所述制品还包括药学上或日化中可接受的佐剂和/或赋形剂。
51.本发明的有益效果为:
52.本发明开发得到一种主要活性物质为巴戟天提取物的ⅱ型5α-还原酶抑制剂,可显著抑制5α-还原酶活性,降低动物组织及血清中的dht含量,还能显著诱导人前列腺基质良性增生细胞和人前列腺增生上皮细胞活力下降,显著抑制人皮脂腺细胞增殖以及显著促进人乳头真皮细胞的增殖,对前列腺疾病、雄激素性脱发或痤疮等雄激素疾病的防治具有显著的作用。
附图说明
53.下面结合附图和实施例对本发明做进一步的说明,其中:
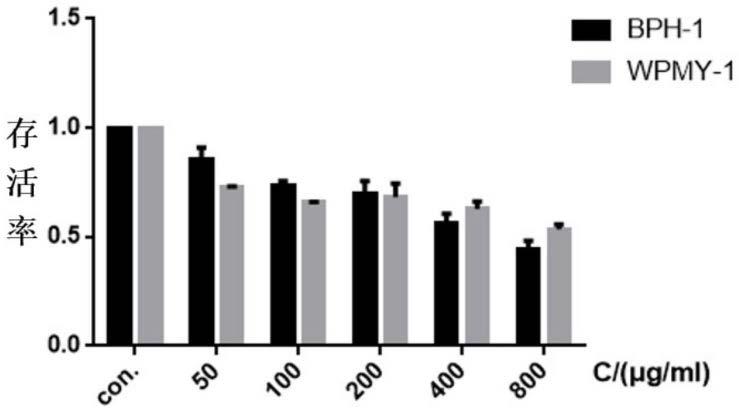
54.图1为本发明实施例1巴戟天提取物对异常增生的前列腺上皮及基质细胞的细胞活性抑制的作用效果。
55.图2为本发明实施例2巴戟天提取物对乳头状真皮细胞的促增殖活性的作用效果。
56.图3为本发明实施例3巴戟天提取物对人皮脂腺细胞的增殖抑制活性的作用效果。
57.图4为本发明实施例4巴戟天提取物对5α-还原酶活性抑制的作用效果。
58.附图标记:图2中“*”、“**”、“***”表示与空白对照组相比,实验组的内容差异有统计学意义,且分别对应为“p《0.05”;“p《0.01”;“p《0.001”;图3中,”#”表示与空白对照组相比,模型组的内容差异有统计学意义,p《0.05;“*”表示与模型组相比,实验组的内容差异有统计学意义,“p《0.05”;图4中”#”表示与空白对照组相比,模型组的内容差异有统计学意义,p《0.05;“*”、“**”表示与模型组相比,实验组的内容差异有统计学意义,且分别对应为“p《0.05”;“p《0.01”。
具体实施方式
59.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
60.实施例1
61.本实施例进行了巴戟天提取物的抗增殖活性体外研究,具体过程为:
62.1、实验目的
63.本实验采用mtt法测定巴戟天提取物对异常增生的前列腺上皮及基质细胞的细胞活性抑制作用,利用体外实验初步验证巴戟天提取物对前列腺增生细胞的抗增殖活性。
64.2、实验材料与方法
65.(1)实验材料
66.以市购所得增生的人前列腺基质细胞(wpmy-1)和增生的人前列腺上皮细胞(bph-1)为实验细胞。
67.巴戟天提取物的制备方法:将巴戟天粉碎,加入乙醇浸泡,再加入第一次水煮沸,过滤得第一次滤液及药渣;在药渣中加入第二次水煮沸,过滤得第二次滤液,将两次滤液混合浓缩,第三次过滤后除菌,得巴戟天提取物,冷冻保存。
68.(2)实验分组
69.细胞实验分为空白对照组及巴戟天提取物组。
70.在补充有10%胎牛血清和10μl/ml的链霉素/青霉素的dmem培养基中培养了bph-1细胞和wpmy-1细胞;培养维持在37℃下、5%co2的培养箱中,每2~3天更换培养基;然后将bph-1和wpmy-1细胞接种于96孔板上,培养24h后,根据不同分组的药物浓度,将药物单独和组合地加入96孔板中,处理细胞48h。
71.(3)细胞活力检测
72.通过mtt比色测定评价细胞活力,通过四唑盐的比色测定测量处理后的细胞活力,评价细胞通过线粒体琥珀酸脱氢酶还原3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四氮唑(mtt)的能力。mtt进入细胞并进入线粒体中,在线粒体中被还原为有颜色的不溶产物甲臜(formazan)。为了使颜色可见,通过添加dmso将有颜色的甲臜颗粒溶解。mtt裂解反应需在完整的细胞中进行,且其与细胞的代谢活性程度成比例。
73.在37℃、5%co2条件下将细胞与溶于培养基的100μl的mtt溶液(500μg/ml)一起孵育4h之后,除去上清液并添加150μl的dmso。然后,通过酶标仪在570nm的波长下测量光密度(o.d.)。
74.细胞活力表达为相对与未处理的空白对照组的光密度的百分比,对于每种样品,均进行三次重复实验。
75.3、实验结果
76.结果如图1所示,巴戟天提取物浓度为0~800μg/ml时,对bph-1细胞及wpmy-1细胞均有抑制作用,且具有浓度依赖性,在浓度为800μg/ml时,对bph-1细胞及wpmy-1细胞的抑制率可达到50%以上。
77.实施例2
78.本实施例进行巴戟天提取物对乳头状真皮细胞的促增殖活性研究,具体过程为:
79.1、实验目的
80.乳头状真皮细胞是特殊分化的间充质细胞,其在毛发的生长周期中具有重要作用。这些细胞的刺激和增殖促进了生长期中的毛发生长,此类细胞可用作评价毛发生长促进剂的模型细胞。
81.2、材料和方法
82.巴戟天提取物的制备方法:将巴戟天粉碎,加入乙醇浸泡,再加入第一次水煮沸,过滤得第一次滤液及药渣;在药渣中加入第二次水煮沸,过滤得第二次滤液,将两次滤液混合浓缩,第三次过滤后除菌,得巴戟天提取物,冷冻保存。
83.在补充有10%胎牛血清和10μl/ml的链霉素/青霉素的dmem培养基中培养来自人毛囊的乳头状真皮细胞(dp细胞);培养维持在37℃下、5%co2的培养箱中,每2~3天更换培养基;然后将dp细胞接种于96孔板上,培养24h后,根据不同分组的药物浓度(药物浓度同实施例1),将药物加入96孔板中,处理细胞48h。通过mtt比色法测定药物处理后的细胞活力,以维生素c作为阳性药物组(10μg/ml)。
84.3、实验结果
85.结果如图2所示,巴戟天提取物浓度为200~800μg/ml时,对乳头状真皮细胞的增殖有明显的促进作用,在800μg/ml的浓度下,促增殖率可达到25.8%。
86.实施例3
87.本实施例进行巴戟天提取物对人皮脂腺细胞的增殖抑制活性研究,具体过程为:
88.1、实验目的
89.毛囊皮脂腺单元构成了对于雄激素的作用更加敏感的皮肤结构。具体地,皮脂腺细胞具有显著的5α-还原酶活性,因此将此细胞用作雄激素依赖性皮肤疾病(如痤疮)的靶细胞和模型。
90.2、材料和方法
91.巴戟天提取物的制备方法:将巴戟天粉碎,加入乙醇浸泡,再加入第一次水煮沸,过滤得第一次滤液及药渣;在药渣中加入第二次水煮沸,过滤得第二次滤液,将两次滤液混合浓缩,第三次过滤后除菌,得巴戟天提取物,冷冻保存。
92.在补充有10%胎牛血清,10μl/ml的链霉素/青霉素和5μg/ml的重组人表皮生长因子的dmem培养基中培养人永生化皮脂腺细胞(sz95皮脂腺细胞系);培养维持在37℃下、5%
co2的培养箱中,每2~3天更换培养基;然后将sz95皮脂腺细胞接种于96孔板上,培养24h后,根据不同分组的药物浓度(药物浓度同实施例1),将药物加入96孔板中,并且除空白组以外,其余组细胞均添加10-6
m睾酮以建立细胞异常增殖模型,处理细胞9天。通过mtt比色法测定药物处理后的细胞活力。
93.3、实验结果
94.如图3所示,添加睾酮后模型组细胞的增殖率明显提高,增殖率为31%。诱导增殖后,药物组加入梯度浓度的巴戟天提取物进行处理,在浓度为800μg/ml的浓度下,增殖抑制率可达到19.85%。
95.实施例4
96.本实施例进行巴戟天提取物对5α-还原酶活性的抑制作用研究,具体过程为:
97.1、实验目的
98.本实验采用动物细胞模型进一步进行机理研究,验证巴戟天提取物对于双氢睾酮(dht)及5α-还原酶活性的抑制作用。
99.2、材料和方法
100.(1)实验材料
101.sd大鼠腹腔注射丙酸睾酮构建良性前列腺增生膜型。
102.巴戟天提取物的制备方法:将巴戟天粉碎,加入乙醇浸泡,再加入第一次水煮沸,过滤得第一次滤液及药渣;在药渣中加入第二次水煮沸,过滤得第二次滤液,将两次滤液混合浓缩,第三次过滤后除菌,得巴戟天提取物,冷冻保存。
103.(2)实验方法
104.细胞实验分为空白对照组、巴戟天提取物组及阳性组。
105.实验分为空白对照组(con)、模型组(modoel,bph)及巴戟天提取物高低浓度组(12.5mg/kg,25mg/kg)。首先腹腔注射丙酸睾酮4周构建良性前列腺增生膜型,后4周用生理盐水或目标药物进行灌胃。实验结束后,取前列腺组织进行指标分析。
106.(3)相关指标检测
107.前列腺组织双氢睾酮(dht)和5α-还原酶(5α-reductase)的含量均采用elisa试剂盒进行测定。
108.3、实验结果
109.如图4可知,巴戟天提取物在动物体内能显著抑制5α-还原酶的表达,从而降低睾酮t向双氢睾酮的转化率。
110.实施例5
111.本实施例制备了一种抗脱发洗剂,具体过程为:
112.1.原料如表1所示。
113.表1
114.序号原料名称重量(%)1天然脂肪醇硫酸铵(k12,质量浓度为70%)72天然脂肪醇醚硫酸钠(aess,质量浓度为70%)143珠光浆(dm2000,广州市道明化学有限公司)64吡啶硫铜锌(zpt 50%)1
5有机硅乳液(nrs-1699)46阳离子瓜尔胶(c-14s)0.37椰油酸单乙醇酰胺(cmea)28巴戟天提取物291,3-二羟甲基-5,5-二甲基己内酰脲0.110酸性胡兰0.0000111柠檬酸0.212柠檬香精0.413消毒软化水余量
115.2.抗脱发洗剂制备方法:
116.(1)将组分1~7,9混合,加热至80℃,电子搅拌器混合30min至混合均匀,为a组分;
117.(2)将组分10-13混合,加热至60℃,混合均匀,为b组分;
118.(3)将a、b组分混合,电子搅拌器混合30min,并缓慢降温至50℃,加入组分8,用均质器搅拌5min即得脱发洗剂。
119.上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1