一种赖诺普利缓释片剂的制备方法与流程
1.本发明涉及一种赖诺普利缓释片剂的制备方法,属于药物制剂领域。
背景技术:
2.赖诺普利为依那普利拉的赖氨酸衍生物,属于第三代血管紧张素转换酶抑制剂,赖诺普利可抑制血管紧张素转换酶的活性,使血管紧张素ⅱ和醛固酮的浓度降低,升高血浆肾素活性,导致外周血管扩张和血管阻力下降,从而产生降压效应,主要适用于治疗原发性高血压。
3.高血压疾病的发作具有昼夜节律的特点,人体的血压在24小时内呈现节律变化,在清晨醒后数小时内迅速升至峰值,半夜至凌晨降至谷值,晨峰现象是血压的两个重要特征之一。认识人体血压的节律变化规律,对临床上进行高血压的治疗具有重要的指导意义。因此,理想的降压药物,除具有较好的依从性外,应能在24小时内平稳降压,显著降低高血压患者清晨血压,使其安全度过心脑血管事件的高发时段,有效保护心、脑及肾等靶器官功能。针对人体的血压节律变化,选择合适的药物以及在合理给药时间,使药物作用与疾病发生的节律相一致,从而达到最佳的治疗效果和降低药物不良反应的目的。
4.中国专利cn107281461a公开了一种赖诺普利缓释片及其制备方法,所述赖诺普利缓释片,由含有赖诺普利的片芯和包裹在片芯外的包衣层组成,所述包衣层由非水溶性包衣材料制成,所述片芯包括以下重量份的物质:赖诺普利5~10份、多孔碳材料40~70份。该专利得到的赖诺普利缓释片,难以在24小时内保持较好的缓释效果。
5.中国专利cn105055358a公开的一种赖诺普利缓释片的制备,由赖诺普利1%~4%、骨架材料54%~66%、预胶化淀粉18%~24%、微晶纤维素14.2%~17.6%、硬脂酸镁0.4%~0.8%;骨架材料为卡波姆。该专利得到的赖诺普利缓释片,药物释放较快,难以在24小时全时段内保持平稳释药浓度。
6.以上可以看到,目前赖诺普利缓释片仍存在缓释效果差,难以保证24小时内释药速度的平稳性。
技术实现要素:
7.针对上述现有技术存在的不足,本发明提供一种赖诺普利缓释片剂的制备方法,实现以下发明目的:制备出缓释效果好,能在24小时内平稳释药的赖诺普利缓释片剂。
8.为实现上述发明目的,本发明采取以下技术方案:一种赖诺普利缓释片剂的制备方法,包括原药乳液制备、原药粉末制备、载药粒料制备、压片4个步骤。
9.以下是对上述技术方案的进一步改进:步骤1、原药乳液制备将赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水混合,搅拌溶解完全后得到原药水相;将乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸溶解于二氯甲烷中得
到油相,在35000~55000转/分剪切速率下,将油相缓慢加入原药水相中,剪切分散30~50分钟后得到原药乳液;所述原药水相中赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水的质量比为5~15:1~8:2~4.5:90~130;所述油相中乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸、二氯甲烷的质量比为1~6:4~10:50~90;所述聚乳酸的分子量为11000~18000g/mol;所述原药乳液中油相与原药水相的质量比为1~4:10。
10.步骤2、原药粉末制备将原药乳液进行喷雾造粒,控制进风温度110~145℃,雾化压力80~120kpa,得到粒径20~60微米粉末,将粉末于75~90℃下干燥1.5~4小时,得到原药粉末。
11.步骤3、载药粒料制备将硬脂酸、氢化蓖麻油混合,加热至80~95℃,熔化成液体,5000~8000转/分搅拌速度下,向其中缓慢加入原药粉末,然后再依次加入硬脂酸镁、柠檬酸三乙酯、单硬脂酸甘油酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素,加料完毕后持续搅拌2~4小时,降至室温,得到块状固体,将块状固体放于-40~-15℃下冷冻2~6小时,然后在-13~-5℃下粉碎成粒径50~90微米的载药粒料;所述硬脂酸、氢化蓖麻油、原药粉末、硬脂酸镁、柠檬酸三乙酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素、单硬脂酸甘油酯的质量比为5~10:13~20:25~35:1~5:5~10:2~8:1~5:6~12。
12.步骤4、压片将载药粒料压制成片剂,得到硬度为9~10.5kg的赖诺普利片剂。
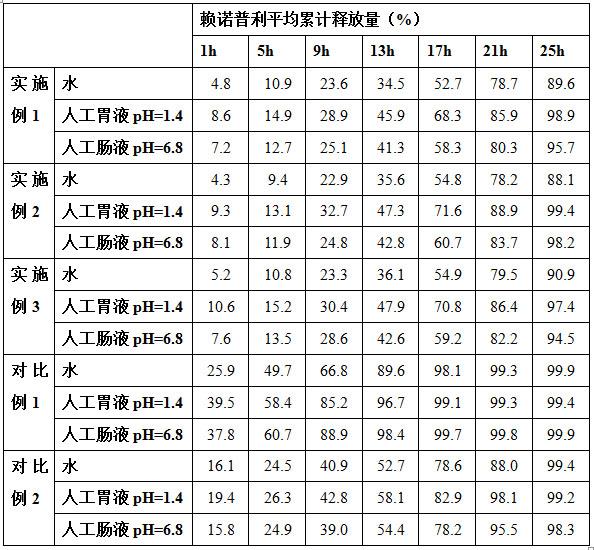
13.与现有技术相比,本发明取得以下有益效果:1、 本发明制备出了缓释效果好,能在24小时内平稳释药的赖诺普利缓释片剂,在水中1h、5h、9h、13h、17h、21h、25h时赖诺普利平均累计释放量分别为4.3~5.2%、9.4~10.9%、22.9~23.6%、34.5~36.1%、52.7~54.9%、78.2~79.5%、88.1~90.9%,在人工胃液中1h、5h、9h、13h、17h、21h、25h时赖诺普利平均累计释放量分别为8.6~10.6%、13.1~15.2%、28.9~32.7%、45.9~47.9%、68.3~71.6%、85.9~88.9%、97.4~99.4%,在人工肠液中1h、5h、9h、13h、17h、21h、25h时赖诺普利平均累计释放量分别为7.2~8.1%、11.9~13.5%、24.8~28.6%、41.3~42.8%、58.3~60.7%、80.3~83.7%、94.5~98.2%;2、本发明通过喷雾干燥工艺,用羟丙基-β-环糊精、乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸对赖诺普利进行了包覆,这有效延长了赖诺普利的释放时间,极大的改善了缓释效果;3、本发明用硬脂酸、氢化蓖麻油作为骨架材料,并结合邻苯二甲酸醋酸纤维素、辛烯基琥珀酸淀粉钠的粘接作用,在单硬脂酸甘油酯和柠檬酸三乙酯的乳化分散作用下,使赖诺普利原药粉末均匀分散在骨架材料之中,最终制备出了具有良好缓释作用的赖诺普利片剂。
具体实施方式
14.以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
15.实施例1:一种赖诺普利缓释片剂的制备方法包括以下步骤:1、原药乳液制备将赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水混合,搅拌溶解完全后得到原药水相;将乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸溶解于二氯甲烷中得到油相,在45000转/分剪切速率下,将油相缓慢加入原药水相中,剪切分散40分钟后得到原药乳液;所述原药水相中赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水的质量比为10:5:3:110;所述油相中乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸、二氯甲烷的质量比为3:7:75;所述聚乳酸的分子量为16000g/mol;所述原药乳液中油相与原药水相的质量比为2:10。
16.2、原药粉末制备将原药乳液进行喷雾造粒,控制进风温度130℃,雾化压力100kpa,得到粒径40微米粉末,将粉末于85℃下干燥3小时,得到原药粉末。
17.3、载药粒料制备将硬脂酸、氢化蓖麻油混合,加热至85℃,熔化成液体,7000转/分搅拌速度下,向其中缓慢加入原药粉末,然后再依次加入硬脂酸镁、柠檬酸三乙酯、单硬脂酸甘油酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素,加料完毕后持续搅拌3小时,降至室温,得到块状固体,将块状固体放于-30℃下冷冻4小时,然后在-10℃下粉碎成粒径80微米的载药粒料;所述硬脂酸、氢化蓖麻油、原药粉末、硬脂酸镁、柠檬酸三乙酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素、单硬脂酸甘油酯的质量比为8:18:30:4:8:5:3:10。
18.4、压片将载药粒料压制成片剂,得到硬度为9.5kg的赖诺普利片剂。
19.实施例2:一种赖诺普利缓释片剂的制备方法包括以下步骤:1、原药乳液制备将赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水混合,搅拌溶解完全后得到原药水相;将乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸溶解于二氯甲烷中得到油相,在35000转/分剪切速率下,将油相缓慢加入原药水相中,剪切分散30分钟后得到原药乳液;所述原药水相中赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水的质量比为5:1:2:90;所述油相中乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸、二氯甲烷的质量比为1:4:50;所述聚乳酸的分子量为11000g/mol;所述原药乳液中油相与原药水相的质量比为1:10。
20.2、原药粉末制备将原药乳液进行喷雾造粒,控制进风温度110℃,雾化压力80kpa,得到粒径20微米粉末,将粉末于75℃下干燥1.5小时,得到原药粉末。
21.3、载药粒料制备将硬脂酸、氢化蓖麻油混合,加热至80℃,熔化成液体,5000转/分搅拌速度下,向其中缓慢加入原药粉末,然后再依次加入硬脂酸镁、柠檬酸三乙酯、单硬脂酸甘油酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素,加料完毕后持续搅拌2小时,降至室温,得到块状固体,将块状固体放于-40℃下冷冻2小时,然后在-13℃下粉碎成粒径50微米的载药粒料;所述硬脂酸、氢化蓖麻油、原药粉末、硬脂酸镁、柠檬酸三乙酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素、单硬脂酸甘油酯的质量比为5:13:25:1:5:2:1:6。
22.4、压片将载药粒料压制成片剂,得到硬度为9kg的赖诺普利片剂。
23.实施例3:一种赖诺普利缓释片剂的制备方法包括以下步骤:1、原药乳液制备将赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水混合,搅拌溶解完全后得到原药水相;将乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸溶解于二氯甲烷中得到油相,在55000转/分剪切速率下,将油相缓慢加入原药水相中,剪切分散50分钟后得到原药乳液;所述原药水相中赖诺普利、维生素e聚乙二醇琥珀酸酯、羟丙基-β-环糊精、去离子水的质量比为15:8:4.5:130;所述油相中乙酸羟丙甲基纤维素琥珀酸酯、聚乳酸、二氯甲烷的质量比为6:10:90;所述聚乳酸的分子量为18000g/mol;所述原药乳液中油相与原药水相的质量比为4:10。
24.2、原药粉末制备将原药乳液进行喷雾造粒,控制进风温度145℃,雾化压力120kpa,得到粒径60微米粉末,将粉末于90℃下干燥4小时,得到原药粉末。
25.3、载药粒料制备将硬脂酸、氢化蓖麻油混合,加热至95℃,熔化成液体,8000转/分搅拌速度下,向其中缓慢加入原药粉末,然后再依次加入硬脂酸镁、柠檬酸三乙酯、单硬脂酸甘油酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素,加料完毕后持续搅拌2~4小时,降至室温,得到块状固体,将块状固体放于-15℃下冷冻6小时,然后在-5℃下粉碎成粒径90微米的载药粒料;所述硬脂酸、氢化蓖麻油、原药粉末、硬脂酸镁、柠檬酸三乙酯、辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素、单硬脂酸甘油酯的质量比为10:20:35:5:10:8:5:12。
26.4、压片将载药粒料压制成片剂,得到硬度为10.5kg的赖诺普利片剂。
27.对比例1:实施例1基础上,不进行原药乳液制备和原药粉末制备两个步骤实施例1基础上,不进行步骤1和步骤2;
步骤3中,实施例1基础上将30份原药粉末替换成30份粒径40微米的赖诺普利粉末,其它操作同于实施例1;步骤4操作同于实施例1。
28.对比例2:实施例1基础上,将辛烯基琥珀酸淀粉钠、邻苯二甲酸醋酸纤维素等量替换为羟丙基甲基纤维素步骤1、2操作同于实施例1;步骤3中,实施例1基础上将5份辛烯基琥珀酸淀粉钠和3份邻苯二甲酸醋酸纤维素替换为8份羟丙基甲基纤维素,其它操作同于实施例1;步骤4操作同于实施例1。
29.释放度测试按《中国药典》2010中规定的方法,对实施例1、2、3和对比例1、2中得到的赖诺普利片剂进行释放度测试,结果见下表:
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1