阿可拉定纳米晶及其制备方法与流程
本发明属于药物纳米晶制备领域,具体为阿可拉定纳米晶制备方法及应用。
背景技术:
1、阿可拉定(icaritin,ict),又称脱水淫羊藿素,是从传统中药淫羊藿中提取分离出的异戊二烯黄酮类化合物。阿可拉定分子式为c21h22o7,几乎不溶于水。除此之外,阿可拉定具有促进心肌细胞分化、调节免疫以及预防骨折损伤等作用,加之晚期肝癌原创新药阿可拉定iii期临床试验达到研究终点,因此阿可拉定新型制剂市场前景十分广阔。
2、阿可拉定生物利用度很低,绝对生物利用度仅有4.3%左右,口服后在胃肠道内发生部分降解,吸收入血后大部分阿可拉定迅速代谢成24种代谢物(主要为ii相代谢物)。因此设计安全有效且使用方便的阿可拉定新制剂具有重要的临床价值。
3、纳米晶是指将“纯”药物颗粒制备成粒径为1~1000nm的晶体,是一种纳米级颗粒的胶状分散体系。该体系无需载体材料,依靠少量稳定剂维持其稳定性,具有颗粒小、比表面积大、载药量高、服用剂量准确等优点。
4、阿可拉定纳米晶有望增大药物比表面积,提高溶解度,从而改善吸收速度,提高生物利用度。肌肉注射阿可拉定纳米晶可避免首过效应,增大阿可拉定的有效浓度,有望实现使用更少剂量的药物剂量来达到相同的治疗效果,从而降低副反应发生。
技术实现思路
1、本发明的目的在于提供一种工艺简单、快速、环保、成本低的制备阿可拉定纳米晶的方法。制得的纳米晶体以0.1%~1%的泊洛沙姆188作为稳定剂,peg 3350作为冻干保护剂,并且其分散性良好,粒径大小均匀,残留溶剂少,可显著提高阿可拉定的溶出度与生物利用度。
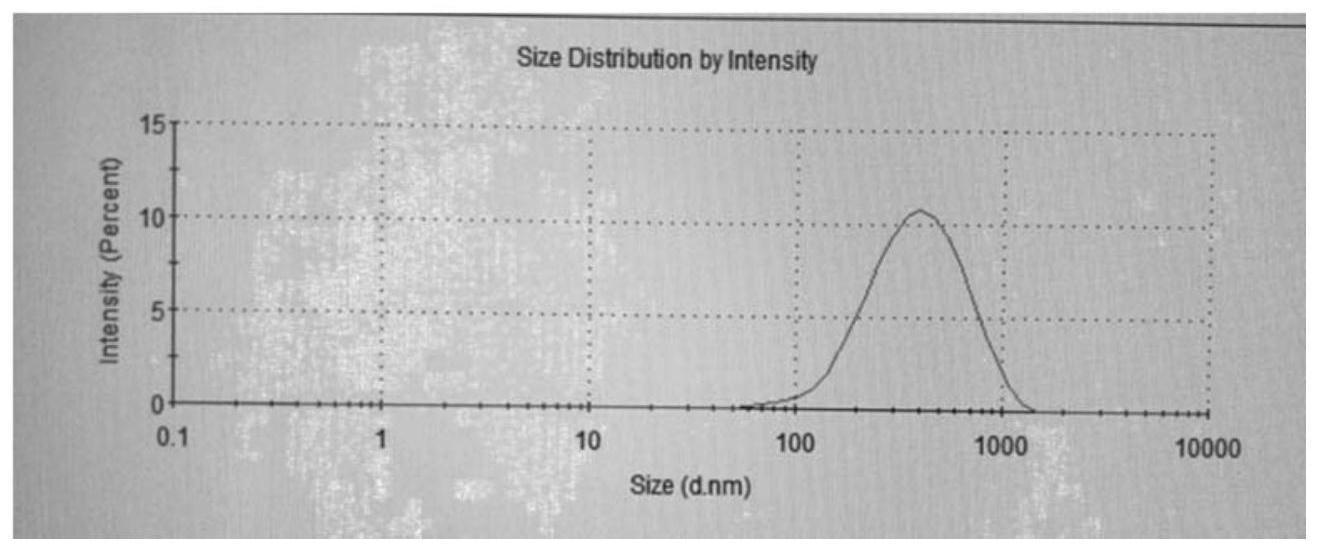
2、本发明制备的阿可拉定纳米晶粒径为100~800nm,优选粒径范围在100~500nm,更优选100~400nm。
3、本发明本发明所涉及的研磨法制备方法为:
4、(1)配制含稳定剂的水溶液;
5、(2)将阿可拉定加入含稳定剂的水溶液中,进行分散;
6、(3)将分散后的混合物进行纳米化,得到纳米混悬液;
7、(4)在制得的纳米混悬液中加入冻干保护剂,真空冷冻干燥后得到阿可拉定纳米晶体冻干粉。
8、本处方工艺中所涉及的稳定剂为卵磷脂、吐温80、n-甲基-d-葡萄糖胺(meg)、聚维酮k12(pvp-k12)、白蛋白、泊洛沙姆188(f68)中的一种,优选f68,吐温80,更优选f68。
9、制备方法为反溶剂法、高压均质法、介质研磨法。优选反溶剂法、介质研磨法,更优选介质研磨法。
10、本处方工艺中所涉及的水相为水、生理盐水、磷酸盐缓冲液中的一种,优选为水。
11、本处方工艺中所涉及的研磨工艺为:0.4~0.6mm研磨珠为4.5ml,在转速为300~1000rpm条件下搅拌0.5~2.5h。
12、本处方工艺中所涉及f68的浓度为0.1%~1%。
13、本发明本发明所涉的反溶剂制备方法为:
14、(1)配制含稳定剂的水溶液,制得水相;
15、(2)将阿可拉定溶于有机溶剂,制得有机相;
16、(3)将有机相缓慢加入水相中混合并持续搅拌,得到阿可拉定纳米混悬液;
17、(4)用旋转蒸发仪将阿可拉定纳米混悬液中的有机溶剂去除。
18、(5)将去除有机溶剂的纳米混悬液中加入冻干保护剂,真空冷冻干燥得到阿可拉定纳米晶体冻干粉。
19、本处方工艺中所涉及的反溶剂法,稳定剂为卵磷脂、吐温80、维生素e聚乙二醇琥珀酸酯(tpgs)、meg、pvp-k12、白蛋白、f68中的一种,优选吐温80、白蛋白,更优选白蛋白。
20、本处方工艺中所涉反溶剂法,有机溶剂为甲醇、乙醇、丙酮、乙醇和丙酮的组合,优选乙醇、丙酮、乙醇和丙酮的组合,更优选乙醇、乙醇和丙酮的组合,最优选乙醇和丙酮的组合。
21、本处方工艺中所涉及的混合方法为含药有机相缓慢加入水相,在转速为100~800rpm条件下搅拌5~20min。
22、本处方工艺中所涉及的稳定剂白蛋白的浓度为0.1%~1%。
23、本处方工艺中所涉及的旋蒸温度为35~40℃。
24、本处方工艺中所涉及阿可拉定浓度为5~30mg/ml,优选5~20mg/ml。
25、本处方工艺中所涉及冻干保护剂为甘露醇、海藻糖、乳糖、葡萄糖、蔗糖、聚乙二醇3350(peg3350)、白蛋白。优选甘露醇、白蛋白、peg3350,更优选peg3350、白蛋白,最优选peg3350。
26、本处方工艺中所涉及吐温80的浓度为0.1%~1%,制得的阿可拉定纳米晶粒径为200~500nm,优选粒径范围在150~250nm,所制得的纳米晶中阿可拉定含量为5~20mg/ml。
27、本处方工艺中所涉及的冻干保护剂为甘露醇、海藻糖、乳糖、葡萄糖、蔗糖、peg3350、白蛋白,优选甘露醇,更优选peg3350。
28、本处方工艺中所涉及的阿可拉定纳米晶粒径为100~800nm,优选粒径范围在100~600nm,更优选100~400nm。
29、本处方工艺中所涉及的阿可拉定纳米晶在肌肉注射剂型中的用途,其特征在于所述的注射剂为混悬液或冻干粉针。
30、本发明的有益效果是:
31、本发明的制备工艺操作简洁、高效、无污染,并且条件温和,所得产品具有分散性好,粒径大小均匀,残留溶剂少等优势。
32、本发明方法制备得到的阿可拉定纳米晶混悬液及其冻干制剂能够显著减小药物的粒径,增加药物溶出度和生物利用度。制备得到的阿可拉定纳米晶冻干品在室温避光条件下可以稳定保存。
33、本发明制备的阿可拉定冻干制剂,在水中可迅速复溶成纳米混悬液,且与冻干前相比粒径没有显著变化。
34、本发明制备的阿可拉定冻干制剂可以进一步制备成片剂、胶囊剂、粉针剂等多种形式的制剂。
35、本发明肌肉注射给药后,纳米晶可以较传统注射剂获得更好的药物浓度、更长的血浆半衰期和更高的血药浓度-时间曲线下面积(auc)。
技术特征:
1.一种阿可拉定纳米晶体的制备方法,其特征在于如下步骤:
2.根据权利要求1所述的阿可拉定纳米晶的制备方法,其特征为:本处方工艺中所涉及的稳定剂为卵磷脂、吐温80、n-甲基-d-葡萄糖胺(meg)、聚维酮k12(pvp-k12)、白蛋白、泊洛沙姆188(f68)中的一种,优选f68,吐温80,更优选f68;进一步选择f68的浓度为0.1%~1%;可以选择处方工艺中所涉及的水相为水、生理盐水、磷酸盐缓冲液中的一种,优选水。
3.根据权利要求1所述的阿可拉定纳米晶的制备方法,其特征为:制备方法为反溶剂法、高压均质法、介质研磨法。优选反溶剂法、介质研磨法,更优选介质研磨法;可以选择介质研磨法所需0.4~0.6mm研磨珠为4.5ml,在转速为300~1000rpm条件下搅拌0.5~2.5h。
4.根据权利要求3所述的阿可拉定纳米晶的制备方法,反溶剂法的步骤为:
5.根据权利要求4所述的阿可拉定纳米晶的制备方法,其特征为:反溶剂法所需的稳定剂为卵磷脂、吐温80、维生素e聚乙二醇琥珀酸酯(tpgs)、meg、pvp-k12、白蛋白、f68中的一种,优选吐温80、白蛋白,更优选白蛋白;所述反溶剂法有机溶剂为甲醇、乙醇、丙酮、乙醇和丙酮的组合,优选乙醇、丙酮、乙醇和丙酮的组合,更优选乙醇、乙醇和丙酮的组合,最优选乙醇和丙酮的组合。
6.根据权利要求5所述的阿可拉定纳米晶的制备方法,其特征为:含药有机相缓慢加入水相,在转速为100~800rpm条件下搅拌5~20min;所述稳定剂白蛋白的浓度为0.1%~1%;所述旋蒸温度为35~40℃。
7.根据权利要求1-6所述的阿可拉定纳米晶的制备方法,其特征在于:所制得的纳米晶中阿可拉定浓度为5~30mg/ml,优选5~20mg/ml。
8.根据权利要求1-6任一所述的阿可拉定纳米晶的制备方法,其特征为:处方工艺中所涉及的冻干保护剂为甘露醇、海藻糖、乳糖、葡萄糖、蔗糖、聚乙二醇3350(peg3350)、白蛋白。优选甘露醇、白蛋白、peg3350,更优选peg3350、白蛋白,最优选peg3350。
9.根据权利要求1-6任一所述的阿可拉定纳米晶的制备方法,其特征在于:制得的阿可拉定纳米晶粒径为100~800nm,优选粒径范围在100~600nm,更优选100~400nm。
10.根据权利要求1-6任一项所述的制备方法制备的阿可拉定纳米晶,在肌肉注射剂型中的用途,其特征在于所述的注射剂为混悬液或冻干粉针。
技术总结
本发明提供了难溶性药物阿可拉定纳米晶制备方法。采用介质研磨法或反溶剂法制备得到阿可拉定纳米混悬液,加入冻干保护剂得到纳米冻干粉。本发明制得的阿可拉定纳米混悬液及其冻干品能够显著减小药物粒径,增加药物的溶解度。使用冻干保护剂冻干后,可长期稳定保存,使用时将其复溶即可恢复冻干前的状态。本发明的制备工艺简洁、高效、无污染。所制得的纳米晶经过粒径分布测定、扫描电镜、体内外实验等实验,结果表明其生物利用度大幅提高,证明其具有广阔的应用前景。
技术研发人员:付信珍,刘珂
受保护的技术使用者:山东铂源生物医药有限公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!