一种医用生物细胞采集取样装置及方法
1.本发明涉及医疗设备技术领域,尤其涉及一种医用生物细胞采集取样装置及方法。
背景技术:
2.消化道肿瘤是比较常见的病症。消化道的肿瘤主要分布于食管、胃、十二指肠以及大小肠。若患者出现有肿瘤增生,首先要注意检查是属于恶性肿瘤还是良性肿瘤。若上述肿瘤增生是良性肿瘤,一般可以直接通过手术的方法进行切除处理,且预后会比较好;若上述肿瘤增生是恶性肿瘤且被发现地较晚,则治愈会比较困难。因此消化道肿瘤需要尽早发现并及时进行治疗,否则处于中晚期的消化道肿瘤容易出现有蔓延加重以及后期危及生命的现象。目前,对于食道、胃、小肠、结肠和直肠的肿瘤检查,医务人员主要依靠胃镜、肠镜和x光检查等检查装置,然而这些仪器只有在医疗条件较好的医院才能进行,普通医院没有办法配备相应的医疗设备,并且患者会承受较大的痛苦,同时还会存在一些检查盲区,所以就需要一种医用生物细胞采集取样装置。
3.例如公开号为cn108245200b的中国专利文献公开了一种消化道肿瘤细胞采集器。该采集器包括上部细胞采集室、胃部细胞采集室、肠部细胞采集室和总控制器,所述上部细胞采集室、所述胃部细胞采集室和所述肠部细胞采集室均为立体月牙形,三者共同围成一个椭球形。所述椭球形内部设置总控制器,所述上部细胞采集室最外部包裹可溶胶囊壳,所述可溶胶囊壳内部安装电动门,所述电动门表面安装压力传感器,所述电动门内部设置第一腔室,所述第一腔室外侧表面设置取样凹槽。但是,该发明仍存在以下技术不足:1)由于该发明的细胞刷需要对消化道内壁进行刮取,因而细胞刷需具有一定的硬度才能够完成刮取动作,但是,在细胞刷具有一定的硬度的情况下,若在细胞刷刮向消化道内壁的表面时细胞刷与消化道内壁的表面之间的夹角小于九十度的话,则细胞刷(比如细胞刷的刷杆)容易刺向消化道内壁,进而造成患者消化道发生医源性损伤(比如刺破消化道表层而出血),并会增加患者的不适感;此外,带血的细胞样本往往需要进行特殊处理才能使用,这不仅增加了医护人员的工作量,而且容易增加医护人员的感染风险;2)由于该发明的取样凹槽固定连接于采集室中,即取样凹槽的开口方向无法自动地适应取样凹槽以及与取样凹槽对应的细胞刷的运动方向,例如当细胞刷刮落细胞以及组织液时由于取样凹槽的开口方向垂直于或背离取样凹槽所在点位的运动方向,从而使得取样凹槽仅能收集细胞刷所刮落的少部分细胞以及组织液,或者完全无法捕获细胞刷所刮落的细胞以及组织液。
4.此外,一方面由于对本领域技术人员的理解存在差异;另一方面由于申请人做出本发明时研究了大量文献和专利,但篇幅所限并未详细罗列所有的细节与内容,然而这绝非本发明不具备这些现有技术的特征,相反本发明已经具备现有技术的所有特征,而且申请人保留在背景技术中增加相关现有技术之权利。
技术实现要素:
5.由于现有细胞取样装置的细胞刷需要对消化道内壁进行刮取,因而细胞刷需具有一定的硬度才能够完成刮取动作,但是,在细胞刷具有一定的硬度的情况下,若在细胞刷冲向消化道内壁的表面时细胞刷与消化道内壁的表面之间的夹角小于九十度的话,则细胞刷(比如细胞刷的刷杆)容易刺向消化道内壁而造成取样时出血,进而造成患者消化道发生医源性损伤(比如刺破消化道表层而造成出血),并增加患者的不适感;此外,带血的细胞样本往往需要进行特殊处理才能使用,这不仅增加了医护人员的工作量,而且容易增加医护人员的感染风险。更重要的是,现有细胞取样装置的取样凹槽固定连接于采集室中,即取样凹槽的开口方向无法自动地适应取样凹槽以及与取样凹槽对应的细胞刷的运动方向,例如当细胞刷刮落细胞(以及组织液时)由于取样凹槽的开口方向垂直于或背离取样凹槽所在点位的运动方向,从而使得取样凹槽仅能收集细胞刷所刮落的少部分细胞以及组织液,或者完全无法捕获细胞刷所刮落的细胞以及组织液。
6.针对现有技术之不足,本发明提供了一种医用生物细胞采集取样装置及方法。本装置至少包括多个采集室。
7.多个采集室能够构造成椭球体。椭球体能够进入患者的消化道。椭球体靠近消化道的表面设置有多个取样凹槽。取样凹槽之间设置有细胞刷。细胞刷至少能够用于刮落消化道内的细胞。取样凹槽用于捕获细胞刷所刮落的细胞和/或消化道内的组织液。控制部设置于椭球体的内部。椭球体内设置有惯性单元,以用于测量椭球体的运动状态。在椭球体能够沿消化道的轴向进行纵向的移动和/或沿椭球体的长轴转动的情况下,控制部被配置为能够基于椭球体的运动状态调控取样凹槽的开口方向和/或细胞刷所朝向的方向,以避免细胞刷对患者的消化道造成医源性损伤的同时通过取样凹槽以最大的采集面采集细胞刷刮落的细胞和/或消化道内的组织液。
8.根据一个优选实施方式,本装置还能够包括驱动部。驱动部设置于所述椭球体的表面。所述驱动部被配置为能够驱动所述椭球体沿所述消化道的轴向进行纵向的移动和/或沿所述椭球体的长轴转动,以使得所述细胞刷能够通过所述椭球体自身的运动而刮落所述椭球体所经过的消化道内壁表面的细胞,并通过所述取样凹槽采集所述细胞刷刮落的细胞和/或所述消化道内的组织液。
9.根据一个优选实施方式,所述椭球体的运动状态至少包括:所述椭球体沿所述消化道的轴向方向进行纵向移动的第一速度,以及沿所述椭球体其自身的长轴转动的第二速度。所述细胞刷的根部设置有第一转向部,以用于调控所述细胞刷所指向的方向,以使得所述细胞刷所指向的方向与所述细胞刷所对应的第一转向部所在点位的运动方向之间的第一夹角大于九十度。
10.根据一个优选实施方式,所述控制部能够基于所述椭球体的运动状态向所述细胞刷所对应的第一转向部发送用于调控所述细胞刷所朝向的方向与所述细胞刷所对应的第一转向部所在点位的运动方向之间的第一夹角的第一数据指令。所述第一转向部能够实时地获取所述第一数据指令,并基于所述第一数据指令调控所述细胞刷所指向的方向,以使得所述细胞刷所指向的方向与所述细胞刷所对应的第一转向部所在点位的运动方向之间的第一夹角大于九十度而避免所述细胞刷对患者的消化道造成医源性损伤。
11.控制部能够实时地通过惯性单元采集与所述细胞刷的刷杆和由所述椭球体的第
一速度与所述细胞刷根部的第一转向部所在点位的第二速度所形成的第三速度的方向之间的夹角。
12.通过该配置方式,当控制部检测到所述细胞刷的刷杆与由所述细胞刷根部的所述第一速度与第二速度所形成的第三速度的方向之间的夹角小于九十度时,所述控制部能够基于所述椭球体的运动状态向所述细胞刷所对应的第一转向部发送用于调控所述细胞刷的刷杆与所述细胞刷所对应的第一转向部所在点位的运动方向之间的第一夹角的第一数据指令,以避免细胞刷的刷杆以细胞刷的刷杆的方向与第一速度的方向之间的夹角呈锐角的方式直接刺向所经过的消化道内壁,最终避免细胞刷取样时造成消化道内壁出血,进而造成医源性损伤而增加患者负担的情况发生。
13.根据一个优选实施方式,所述取样凹槽的根部设置有第二转向部,以用于调控所述取样凹槽的开口方向而调整所述取样凹槽的开口方向与所述取样凹槽所对应的第二转向部所在点位的运动方向之间所形成的第二夹角。
14.所述惯性单元还能够测量所述取样凹槽的开口方向与所述取样凹槽所对应的第二转向部所在点位的运动方向之间的第二夹角,并能够将所述第二夹角实时地发送至所述控制部。
15.根据一个优选实施方式,所述控制部能够基于所述取样凹槽的开口方向与所述取样凹槽所对应的第二转向部所在点位的运动方向之间所形成的第二夹角向所述取样凹槽所对应的第二转向部发送第二数据指令,所述第二数据指令用于调控所述取样凹槽的开口方向,以使得在所述细胞刷刮落细胞的过程中所述取样凹槽的开口方向与所述取样凹槽所对应的第二转向部所在点位的运动方向之间的第二夹角始终在阈值角度范围内,而有利于所述取样凹槽以最大的采集面采集所述细胞刷刮落的细胞和/或所述消化道内的组织液。
16.通过上述配置方式,控制部能够实时地采集与所述取样凹槽的开口方向和由所述椭球体的第一速度与所述取样凹槽的第二转向部所在点位的第二速度所形成的第三速度的方向之间的夹角,并在检测到所述取样凹槽的开口方向与由所述椭球体的所述第一速度与取样凹槽的第二转向部的第二速度所形成的第三速度的方向之间的夹角大于九十度时,所述控制部能够向所述取样凹槽的第二转向部发送用于调控由取样凹槽的开口方向与所述取样凹槽的第二转向部所在点位的运动方向之间所形成的夹角的第二数据指令,以使得由取样凹槽的开口方向与由所述细胞刷所对应的第一转向部所在点位的第一速度与第二速度所形成的第三速度的方向之间所形成的夹角在阈值角度范围内,而使得取样凹槽的开口方向在椭球体在消化道内移动和/或转动的过程中始终面向由所述椭球体的第一速度与所述取样凹槽的第二转向部所在点位的第二速度所形成的第三速度的方向,从而利于取样凹槽的开口以最大的采集面采集细胞刷所刮过的消化道内壁的细胞和组织液。
17.根据一个优选实施方式,所述采集室能够呈环状分布于所述椭球体靠近素数消化道的一侧表面。所述采集室所形成的圆环所在的平面与所述椭球体的长轴垂直或大致垂直,以有利于位于所述椭球体表面的细胞刷在所述椭球体沿所述消化道的轴向进行纵向移动时刮取所述消化道内壁的细胞。
18.根据一个优选实施方式,所述采集室面向所述消化道的一侧包裹有可溶胶囊壳。所述可溶胶囊壳能够在与所述消化道内的消化液接触之后溶解,以使得所述采集室内的细胞刷能够与所述消化道接触。
19.根据一个优选实施方式,所述取样凹槽之间均设置有微型灯光组件和微型摄像头。所述微型灯光组件用于在所述椭球体进入患者的消化道内后照亮所述椭球体所经过的消化道。所述微型摄像头用于拍摄所述椭球体所经过的消化道的图像。
附图说明
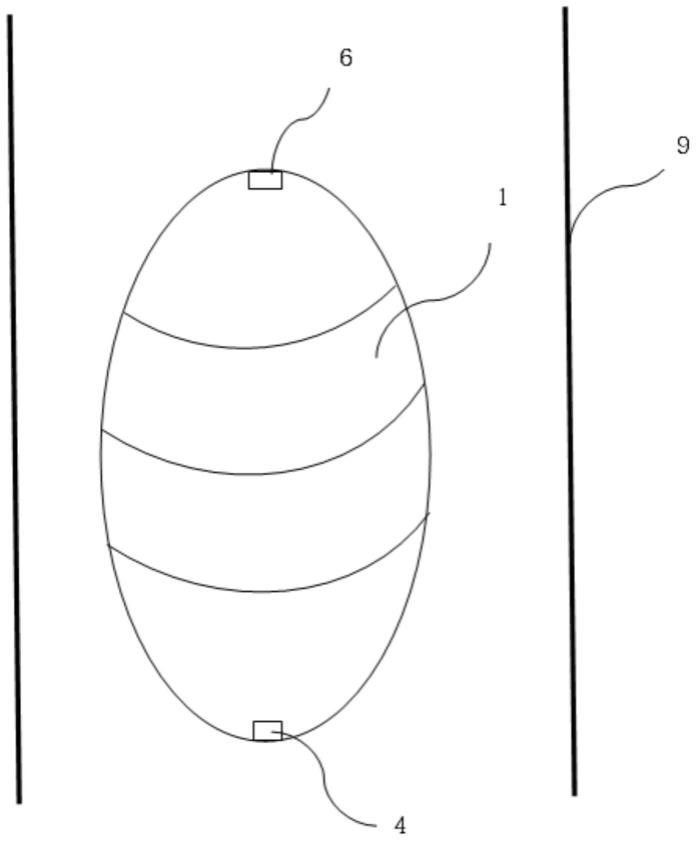
20.图1是本发明提供的一种优选实施方式的整体结构意图;
21.图2是本发明的采集室的一种优选实施方式的内部结构示意图;
22.图3是本发明的取样凹槽和细胞刷的一种优选实施方式的示意图。
23.附图标记列表
24.1:采集室;
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2:取样凹槽
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3:细胞刷;
25.4:控制部;
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5:惯性单元;
ꢀꢀꢀꢀꢀꢀꢀ
6:驱动部;
26.301:第一转向部;
ꢀꢀꢀꢀꢀꢀ
201:第二转向部;
ꢀꢀꢀꢀꢀ
9;消化道。
具体实施方式
27.下面结合附图进行详细说明。
28.图1、图2和图3示出一种医用生物细胞采集取样装置。
29.如图1所示,本装置至少包括采集室1。多个采集室1能够构造成椭球体。椭球体能够进入患者的消化道9。
30.如图2所示,椭球体靠近消化道9的表面设置有多个取样凹槽2。取样凹槽2之间设置有细胞刷3。细胞刷3至少能够用于刮落消化道9内的细胞。取样凹槽2用于捕获细胞刷3所刮落的细胞和/或消化道9内的组织液。控制部4设置于椭球体的内部。椭球体内设置有惯性单元5,以用于测量椭球体的运动状态。
31.在椭球体能够沿消化道9的轴向进行纵向的移动和/或沿椭球体的长轴转动的情况下,控制部4被配置为能够基于椭球体的运动状态调控取样凹槽2的开口方向和/或细胞刷3所朝向的方向,以避免细胞刷3对患者的消化道9造成医源性损伤的同时通过取样凹槽2以最大的采集面采集细胞刷3刮落的细胞和/或消化道9内的组织液。
32.优选地,采集室1可以分为上部细胞采集室1、胃部细胞采集室1和肠部细胞采集室1。上部细胞采集室1、胃部细胞采集室1和肠部细胞采集室1所在的平面可以分别垂直于沿椭球体的长轴方向。
33.优选地,采集室1的数量和种类可以根据实际应用需求而灵活地设置。
34.例如,所述上部细胞采集室1、所述胃部细胞采集室1和所述肠部细胞采集室1可以均为立体月牙形,且上述三者共同围成一个椭球体。
35.上述椭球体是椭圆绕其长轴旋转所形成的立体结构。
36.采集取样装置大致呈椭球体,以使得椭球体能沿平行或大致平行于所述消化道9的轴向的方式进行纵向的移动。
37.优选地,取样凹槽2可以呈半椭球形。
38.优选地,取样凹槽2也可以采用其他易于收集细胞刷3所刮落的细胞和消化道9内的组织液的形状。
39.优选地,椭球体沿长轴方向的最大长度大于患者的消化道9的最大直径。
40.优选地,细胞刷3设置于采集室1的靠近椭球体的外部表面的一侧。
41.优选地,惯性单元5设置于椭球体的几何中心。优选地,惯性单元5能够测量椭球体的几何中心沿消化道9的轴向进行纵向移动的第一速度。优选地,惯性单元5还能够测量椭球体绕消化道9的轴向方向或椭球体自身的长轴方向旋转的第二速度。
42.根据一个优选实施方式,如图1所示,本装置还能够包括驱动部6。驱动部6设置于所述椭球体的表面。
43.所述驱动部6被配置为能够驱动所述椭球体沿所述消化道9的轴向进行纵向的移动,和/或沿所述椭球体的长轴转动,以使得所述细胞刷3能够通过所述椭球体自身的运动而刮落所述椭球体所经过的消化道9内壁表面的细胞,并通过所述取样凹槽2采集所述细胞刷3刮落的细胞和/或所述消化道9内的组织液。
44.优选地,驱动部6可以仅设置于椭球体沿其长轴方向的端部,以使得椭球体仅能沿着平行或大致平行于所述消化道9的轴向的方式进行纵向的移动。
45.优选地,驱动部6还可以设置于椭球体的周向表面,以使得椭球体能够绕其自身长轴的方向进行转动。驱动部6的数量和配置的位置可以根据实际需求灵活地设定。
46.例如,细胞刷3可以利用本装置自身的运动在消化道9内刷取病灶黏膜细胞,尤其是溃疡面、出血灶及活检后创面的细胞,
47.通过上述方式,当本装置进入患者的消化道9内之后,细胞刷3能够利用本装置自身的运动(例如沿消化道9的轴向进行纵向的移动和/或沿椭球体自身的长轴转动)在消化道9内(比如消化道9内的病灶表面)反复刷动以获取细胞(尤其是病变细胞),从而与活检病理学检查互为补充,并降低肿瘤初筛的漏诊率。
48.根据一个优选实施方式,所述椭球体的运动状态至少包括:所述椭球体沿所述消化道9的轴向方向进行纵向移动的第一速度,以及沿所述椭球体其自身的长轴转动的第二速度。
49.如图3所示,所述细胞刷3的根部设置有第一转向部301,以用于调控所述细胞刷3所指向的方向,以使得所述细胞刷3所指向的方向与所述细胞刷3所对应的第一转向部301所在点位的运动方向之间的第一夹角大于九十度。
50.所述惯性单元5还能够测量所述细胞刷3的方向与所述细胞刷3所对应的第一转向部301所在点位的运动方向之间的第一夹角。
51.所述惯性单元5能够实时地将所述第一夹角发送至控制部4。
52.位于椭球体的周向表面上的点位沿所述椭球体其自身的长轴转动的第二速度会随着其与长轴方向上的端部的距离的不同而不同。
53.优选地,细胞刷3所对应的第一转向部301所在点位的运动方向由惯性单元5的第一惯性子单元测量。
54.优选地,所述细胞刷3所指向的方向在椭球体上的方向由惯性单元5的第二惯性子单元测量。
55.细胞刷3至少由刷杆和刷毛组成。所述刷毛可以均匀地分布于刷杆的周向表面。
56.细胞刷3的方向是指刷杆的方向。
57.优选地,每一个细胞刷3的根部均与第一转向部301活动连接。
58.所述细胞刷3所对应的第一转向部301所在点位的运动方向可以与椭球体沿消化
道9的轴向方向进行纵向移动的第一速度相同或不同。
59.所述细胞刷3所对应的第一转向部301所在点位的运动方向可以与椭球体的周向表面上的点位绕所述椭球体其自身的长轴转动的第二速度相同或不同。
60.优选地,第一转向部301还能够使得细胞刷3沿其刷杆的轴向方向转动,以提高细胞刷3的刷毛刮落消化道9内壁组织(尤其是病变细胞)的效率。
61.根据一个优选实施方式,所述控制部4能够基于所述椭球体的运动状态向所述细胞刷3所对应的第一转向部301发送用于调控所述细胞刷3所朝向的方向与所述细胞刷3所对应的第一转向部301所在点位的运动方向之间的第一夹角的第一数据指令。
62.所述第一转向部301能够实时地获取所述第一数据指令,并基于所述第一数据指令调控所述细胞刷3所指向的方向,以使得所述细胞刷3所指向的方向与所述细胞刷3所对应的第一转向部301所在点位的运动方向之间的第一夹角大于九十度而避免所述细胞刷3对患者的消化道9造成医源性损伤。
63.优选地,位于椭球体周向表面的细胞刷3所对应的第一转向部301所接收的第一数据指令可以各不相同。
64.位于椭球体周向表面的各细胞刷3所对应的第一转向部301所在点位的运动方向和/或速度可以相同或不同。
65.优选地,每一个细胞刷3均配备有第一转向部301。
66.控制部4能够实时地通过惯性单元5采集所述细胞刷3的刷杆所指向的方向与由所述椭球体的第一速度与所述细胞刷3所对应的第一转向部301所在点位的第二速度所形成的第三速度的方向之间所形成的夹角。
67.当控制部4检测到所述细胞刷3的刷杆所指向的方向与由所述椭球体的第一速度与所述细胞刷3所对应的第一转向部301所在点位的第二速度所形成的第三速度的方向之间所形成的夹角小于九十度时,所述控制部4向所述细胞刷3所对应的第一转向部301发送第一数据指令,以使得所述细胞刷3的刷杆所指向的方向与由所述椭球体的第一速度与所述细胞刷3所对应的第一转向部301所在点位的第二速度所形成的第三速度的方向之间所形成的夹角大于九十度并小于一百八十度。第三速度即为所述细胞刷3根部的第一转向部301所在点位的合速度。
68.例如,如图3所示,在椭球体沿消化道9的轴向移动的第一速度(即图3中的速度v)不为零,而椭球体绕消化道9的轴向方向旋转的第二速度(图3未示出)为零的情况下,若控制部4检测到细胞刷3的刷杆的方向与第一速度的方向之间的夹角小于九十度,则控制部4向该细胞刷3所对应的第一转向部301发送第一数据指令,以使得细胞刷3的刷杆所指向的方向与第一速度(即图3中的速度v)的方向之间的夹角能够大于九十度且小于一百八十度,从而使得细胞刷3的刷杆所指向的方向与椭球体沿消化道9的轴向移动的第一速度的方向相背离,从而避免细胞刷3的刷杆以细胞刷3的刷杆所指向的方向与第一速度的方向之间的夹角呈锐角的方式直接刺向所经过的消化道9内壁,最终避免细胞刷3取样时造成消化道9内壁出血,进而造成医源性损伤而增加患者负担的情况发生。
69.根据一个优选实施方式,如图3所示,所述取样凹槽2的根部设置有第二转向部201,以用于调控所述取样凹槽2的开口方向而调整所述取样凹槽2的开口方向与所述取样凹槽2所对应的第二转向部201所在点位的运动方向之间所形成的第二夹角。
70.所述惯性单元5还能够测量所述取样凹槽2的开口方向与所述取样凹槽2所对应的第二转向部201所在点位的运动方向之间的第二夹角,并能够将所述第二夹角实时地发送至所述控制部4。
71.优选地,所述取样凹槽2的开口方向由所述惯性单元5的第三惯性子单元测量。
72.优选地,每一个细胞刷3所对应的第一转向部301以紧邻的方式设置于该细胞刷3所对应的取样凹槽2的第二转向部201的附近。
73.根据一个优选实施方式,所述控制部4能够基于所述取样凹槽2的开口方向与所述取样凹槽2所对应的第二转向部201所在点位的运动方向之间所形成的第二夹角向所述取样凹槽2所对应的第二转向部201发送第二数据指令。所述第二数据指令用于调控所述取样凹槽2的开口方向,以使得在所述细胞刷3刮落细胞的过程中所述取样凹槽2的开口方向与所述取样凹槽2所对应的第二转向部201所在点位的运动方向之间的第二夹角始终在阈值角度范围内,而有利于所述取样凹槽2以最大的采集面采集所述细胞刷3刮落的细胞和/或所述消化道9内的组织液。
74.所述第二转向部201能够实时地获取所述第二数据指令,并基于所述第二数据指令调控所述取样凹槽2的开口的朝向,以使得在所述细胞刷3刮落细胞的过程中所述取样凹槽2的开口方向与所述取样凹槽2所对应的第二转向部201所在点位的运动方向之间的第二夹角始终在阈值角度范围内。
75.优选地,第二转向部201能够使得取样凹槽2的远离第二转向部201的一端绕取样凹槽2所在点位的法线进行三百六十度的旋转。
76.优选地,第二转向部201还能够调控取样凹槽2的轴向方向与取样凹槽2所在点位的切平面之间的夹角。
77.优选地,细胞刷3所对应的取样凹槽2及其第二转向部201紧邻地设置于细胞刷3所对应的第一转向部301。
78.优选地,第二转向部201设置于取样凹槽2远离其开口的一端。
79.第二转向部201能够接收来自所述控制部4的第二数据指令,并基于所述第二数据指令调控所述取样凹槽2的开口的方向。
80.一个细胞刷3能够与至少一个取样凹槽2对应。
81.优选地,控制部4能够通过惯性单元5实时地采集与所述取样凹槽2的开口方向和由椭球体的第一速度与取样凹槽2的第二转向部201所在点位的第二速度所形成的第三速度的方向之间所形成的夹角。
82.当控制部4检测到所述取样凹槽2的开口方向与由所述椭球体的所述第一速度与取样凹槽2的第二转向部201的第二速度所形成的第三速度的方向之间所形成的夹角大于九十度时,所述控制部4能够基于所述椭球体的运动状态向所述取样凹槽2的第二转向部201发送用于调控所述取样凹槽2的开口方向的第二数据指令,以使得所述取样凹槽2的开口方向与由所述椭球体的第一速度与取样凹槽2的第二转向部201的第二速度所形成的第三速度的方向之间的夹角小于九十度。
83.例如,如图3所示,在椭球体沿消化道9的轴向平移的第一速度(即图3中的速度v)不为零,而椭球体绕消化道9的轴向方向旋转的第二速度(图3未示出)为零的情况下,当控制部4检测到取样凹槽2的开口方向与椭球体沿消化道9的轴向平移的第一速度的方向垂直
时,控制部4能够向上述取样凹槽2所对应的第二转向部201发送第二数据指令。第二转向部201能够实时地接收来自控制部4的第二数据指令,并基于所述第二数据指令调控所述取样凹槽2的开口方向,并使得取样凹槽2的开口方向与第一速度(即图3中的速度v)的方向之间的角度小于九十度。
84.优选地,接收到第二数据指令的第二转向部201能够使得取样凹槽2的开口方向与第三速度的方向之间的夹角在阈值角度范围内。阈值角度范围可以根据实际应用场景灵活地选定。例如阈值角度范围可以为三十度至四十五度之间。
85.采集面为取样凹槽2的开口在第三速度的方向上的投影面积。
86.通过上述配置方式,控制部4能够实时地采集与所述取样凹槽2的开口方向和由所述椭球体的第一速度与所述取样凹槽2的第二转向部201所在点位的第二速度所形成的第三速度的方向之间的夹角,并在检测到所述取样凹槽2的开口方向与由所述椭球体的所述第一速度与取样凹槽2的第二转向部201的第二速度所形成的第三速度的方向之间的夹角大于九十度时,所述控制部4能够向所述取样凹槽2的第二转向部201发送用于调控由取样凹槽2的开口方向与所述取样凹槽2的第二转向部201所在点位的运动方向之间所形成的夹角的第二数据指令,以使得由取样凹槽2的开口方向与由所述细胞刷3所对应的第一转向部301所在点位的第一速度与第二速度所形成的第三速度的方向之间所形成的夹角在阈值角度范围内,而使得取样凹槽2的开口方向在椭球体在消化道9内移动和/或转动的过程中始终面向由所述椭球体的第一速度与所述取样凹槽2的第二转向部201所在点位的第二速度所形成的第三速度的方向,从而利于取样凹槽2的开口以最大的采集面采集细胞刷3所刮过的消化道9内壁的细胞和组织液。
87.根据一个优选实施方式,所述采集室1能够呈环状分布于所述椭球体靠近素数消化道9的一侧表面。所述采集室1所形成的圆环所在的平面与所述椭球体的长轴垂直或大致垂直,以有利于位于所述椭球体表面的细胞刷3在所述椭球体沿所述消化道9的轴向进行纵向移动时刮取所述消化道9内壁的细胞。
88.优选地,所述上部细胞采集室1、所述胃部细胞采集室1和所述肠部细胞采集室1分别呈环状分布于所述椭球体沿其径向向外的一侧。
89.优选地,上部细胞采集室1、所述胃部细胞采集室1和所述肠部细胞采集室1均靠近椭球体的短轴,以使得上部细胞采集室1、所述胃部细胞采集室1和所述肠部细胞采集室1所形成的圆环的直径能够最大化,从而使得所述上述各采集室1所形成的椭球体在沿所述消化道9的轴向进行纵向移动时能够与所述消化道9保持最大的接触面,进而通过各采集室1所设置的细胞刷3刮取消化道9内壁更多的细胞,和/或消化道9内的组织及组织液。
90.根据一个优选实施方式,所述采集室1面向所述消化道9的一侧包裹有可溶胶囊壳。所述可溶胶囊壳能够在与所述消化道9内的消化液接触之后溶解,以使得所述采集室1内的细胞刷3能够与所述消化道9接触。
91.优选地,所述胃部细胞采集室1和所述肠部细胞采集室1均与所述上部细胞采集室1的内部结构相同。上述三者的区别仅在于:上部细胞采集室1表面的溶解胶囊壳为唾液溶解胶囊壳;所述胃部细胞采集室1表面的溶解胶囊壳为胃溶胶囊壳;所述肠部细胞采集室1表面的溶解胶囊为肠溶胶囊壳。
92.根据一个优选实施方式,所述取样凹槽2之间均设置有微型灯光组件和微型摄像
头。所述微型灯光组件用于在所述椭球体进入患者的消化道9内后照亮所述椭球体所经过的消化道9。所述微型摄像头用于拍摄所述椭球体所经过的消化道9的图像。
93.优选地,所述微型摄像头能够以无线传输的方式将消化道9图像传输至外部的接收器并显示,以用于医务人员能够及时地观察到本装置在患者的消化道9内所拍摄的消化道9内部的图像。
94.所述取样凹槽2底部设置第一腔室门。所述第一腔室内部设置第二腔室。所述第二腔室外侧表面设置第二腔室。所述第二腔室中部设置控制室。所述控制室内部固定蓄电池、主控制器和无线发射器。
95.所述第二腔室内部设置第三腔室。所述第三腔室外侧表面设置第三腔室门。所述主控制器与所述压力传感器、所述微型灯光组件、所述微型摄像头和所述无线发射器均为电连接。所述蓄电池与所述压力传感器、所述微型灯光组件、所述微型摄像头、所述主控制器和所述无线发射器均为电连接。
96.所述控制部4与所述上部细胞采集室1、所述胃部细胞采集室1、所述肠部细胞采集室1内部的所述主控制器均为电连接。
97.所述第一腔室门、所述第二腔室门和所述第三腔室门均为单向门,且仅能向腔室内侧摆动。所述第一腔室门小于所述第二腔室门。所述第二腔室门小于所述第三腔室门。所述第二腔室门设置在所述第二腔室的端部。所述第三腔室门设置在所述第三腔室的端部。
98.所述取样凹槽2的个数为多个,且均匀分布在所述第一腔室的外侧表面。所述压力传感器的个数为多个。
99.本发明还提供一种医用生物细胞采集取样方法,所述方法如下:
100.在需要进行肿瘤筛查时,患者在肿瘤筛查前一天先禁食,并在晚上服泻药,以清理肠胃并在检查日空腹;
101.在检查日患者需将本装置在口中含住一定的时间,以使唾液溶解胶囊壳溶解,从而触发上部细胞采集室1上的压力传感器而将信号通过上部细胞采集室1内的主控制器传输给控制部4,控制部4发送指令打开上部细胞采集室1内的电动门;
102.然后患者将本装置吞服。之后上部细胞采集室1就可以通过毛刷刮落上部消化道9内壁细胞,并填满圆形凹槽,再由人体内部压力的作用,依次打开第一腔室门、第二腔室门、第三腔室门,并将上部消化道9内壁细胞经过第二腔室而最后进入第三腔室储存。微型灯光组件用来照亮消化道9内壁;
103.微型摄像头用来拍摄消化道9内壁景象并将拍摄画面传输到控制部4,控制无线发射器将信息传输到医务人员的无线接收终端;
104.当本装置流入胃部时,胃部的胃液使胃液溶解胶囊壳溶解,进而触发胃部细胞采集室1上的压力传感器,之后控制部4发送指令关闭上部细胞采集室1的电动门,同时打开胃部细胞采集室1的电动门,从而进行胃部范围内的细胞采集;
105.当本装置移动至肠部时,肠部的肠分泌液使肠溶解胶囊壳溶解,进而触发肠部细胞采集室1上的压力传感器,之后控制部4发送指令关闭胃部细胞采集室1的电动门,同时打开肠部细胞采集室1的电动门,从而进行肠部范围内的细胞采集;
106.最后,本装置被排出体外。
107.需要注意的是,上述具体实施例是示例性的,本领域技术人员可以在本发明公开
内容的启发下想出各种解决方案,而这些解决方案也都属于本发明的公开范围并落入本发明的保护范围之内。本领域技术人员应该明白,本发明说明书及其附图均为说明性而并非构成对权利要求的限制。本发明的保护范围由权利要求及其等同物限定。本发明说明书包含多项发明构思,诸如“优选地”、“根据一个优选实施方式”或“可选地”均表示相应段落公开了一个独立的构思,申请人保留根据每项发明构思提出分案申请的权利。在全文中,“优选地”所引导的特征仅为一种可选方式,不应理解为必须设置,故此申请人保留随时放弃或删除相关优选特征之权利。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1