一种用于面部填充的透明质酸-胶原蛋白复合交联微球的制备方法与流程
1.本发明涉及高分子材料技术领域,特别涉及一种透明质酸-胶原蛋白复合交联微球的制备方法。
背景技术:
2.随着生活水平的提高,人们对“美”的追求也逐步提升,针对面部、颈部皱纹的填充产品成为了市场的宠儿。
3.胶原蛋白具有促进细胞增殖生长的功能,其在人体内水解会转变为多种氨基酸,水解得到的氨基酸又可参与人体自身胶原蛋白的合成,同时还能作为营养物质为机体提供营养。但胶原蛋白作为注射填充物本身没有较好的力学性能,且在人体蛋白酶的作用下迅速发生降解,其维持效果极短。尽管可通过交联提高其抗降解能力,但交联后的胶原蛋白质地松软,起不到支撑塑形的作用,植入后容易发生位移从而影响其使用。因此,市面上基本没有将胶原蛋白作为植入材料的产品。透明质酸由于其优异的生物相容性、可修饰性、可生物降解性等,已被广泛应用于医疗美容、药物载体等领域,尤其是通过对其进行交联用于注射整形领域已在市面上得到广泛的认可。但单一的交联透明质酸类凝胶仅能起到填充和补水的作用,而不能参与或促进人体自身细胞的增殖。将胶原蛋白和透明质酸进行复合交联,形成的凝胶能够在填充的过程中释放营养物质,给填充处肌肤更好的状态。
4.目前制备透明质酸-胶原蛋白复合凝胶的主要方法是在碱性环境下,通过交联剂作用完成交联。中国专利cn 103333349 a公开了一种注射用透明质酸-胶原蛋白复合水凝胶的制备方法,其通过在碱性条件下混合透明质酸钠、胶原蛋白和交联剂进行交联,交联后通过物理粉碎得到颗粒状成品,并证明了其具有一定的促进细胞生长的作用。但其仅通过物理的破碎来制备成凝胶颗粒,颗粒的形态不规整、比表面积大、且均匀性不好控制,在使用过程中,易因为颗粒表面不平整而引起红肿等副反应。而透明质酸-胶原蛋白复合交联微球呈圆润的球状,表面光滑无棱角,能够大大减少面部填充副反应的发生。
5.当前市场上暂无透明质酸-胶原蛋白复合交联制得的微球,因此,开发一种简便、环保、安全的透明质酸-胶原蛋白复合微球方法是本领域亟待解决的技术问题。
技术实现要素:
6.有鉴于此,本发明提供一种透明质酸-胶原蛋白复合交联微球制备方法。
7.本发明技术方案如下:
8.一种用于面部填充的透明质酸-胶原蛋白复合交联微球制备方法,包括如下步骤:
9.s1.称取透明质酸钠、重组胶原蛋白和交联剂,在碱性溶液中混合至完全溶解成为均一的粘溶液;
10.s2.将s1所得粘溶液置于注射器内,使用滤网将其过滤细化,细化后转至带有亲水亲油平衡值为2-8的乳化剂的油相中,高速剪切混合体系使所述体系乳化;
11.s3.将s2所得乳化体系转移至烧杯中,恒温水浴交联形成微球;
12.s4.将s3所得微球离心,离心后用水溶性有机溶剂洗去微球表面油相,再用生理盐水洗去有机溶剂;
13.s5.将s4所得微球透析纯化,即得所述透明质酸-胶原蛋白复合微球。
14.进一步的,上述的制备方法,其中,步骤s1中,碱性溶液为氢氧化钠溶液,ph为10-13;透明质酸钠在粘溶液中的质量百分数为15-30%;重组胶原蛋白在粘溶液中的质量百分数为5-10%;交联剂为1,4-丁二醇二缩水甘油醚,在粘溶液中的质量百分数为0.5-2%。
15.进一步的,上述的制备方法,其中,步骤s1中,透明质酸钠、重组胶原蛋白和交联剂同时加入所述碱性溶液进行混合,混合温度0-6℃。
16.进一步的,上述的制备方法,其中,步骤s2中,所述过滤细化进行2-3次,滤网孔径120-200目;进行所述高速剪切乳化时,乳化机转速在10分钟内从0逐渐升高至2000-5000rpm,乳化时长30分钟。
17.进一步的,上述的制备方法,其中,步骤s2中,乳化剂选自丙二醇脂肪酸酯或羟基化羊毛脂;油相选自二甲基硅油、液体石蜡、椰子油或异十三烷;乳化剂在所述油相中的质量百分数为5-15%;粘溶液与油相的体积比为1:3-1:5。
18.进一步的,上述的制备方法,其中,步骤s3中,恒温水浴为40-50℃,反应时长2-4小时。
19.进一步的,上述的制备方法,其中,步骤s4中,离心机转速为8000rpm,离心时长5-10分钟,水溶性有机溶剂选自乙醇或丙二醇。
20.进一步的,上述的制备方法,其中,步骤s5中,所述透析纯化包括以下步骤:
21.20-35℃下,将ph为6.8-7.6,渗透压为270-350mosmol/kg的磷酸盐缓冲液加入循环水浴锅,循环压力0.2-0.4bar;
22.开启循环进行动态透析,每隔1-2小时更换一次磷酸盐缓冲液,共更换6-10次;
23.透析结束后称重获取目标含量及粒径大小的透明质酸-胶原蛋白复合交联微球。
24.进一步的,上述的制备方法,其中,透明质酸钠分子量为1
×
10
6-1.5
×
106da,重组胶原蛋白分子量为3.5
×
10
5-7.5
×
105da。
25.本发明的有益效果如下:本发明公开的制备方法反应条件温和,简便易操作,所制得的透明质酸-胶原蛋白复合交联微球粒径均匀,使用性能优良,能够减少填充后不良反应的发生率,在填充塑形的同时补充肌肤营养,得到更佳的填充效果。
具体实施方式
26.下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。下述实施例中使用的透明质酸钠购自华熙生物科技股份有限公司;重组胶原蛋白购自江苏江山聚源生物技术有限公司。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold springharbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。
27.实施例1
28.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重
组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
29.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
30.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
31.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
32.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
33.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
34.(7)获取目标产物:透析结束后称重,获得微球。
35.实施例2
36.(1)制备水相:称取分子量1.0
×
106da的透明质酸钠1.5g、分子量为3.5
×
105da的重组胶原蛋白0.5g和1,4-丁二醇二缩水甘油醚(bdde)0.05g,0℃下混合分散到ph=10的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用200目滤网。
37.(2)制备油相:称取二甲基硅油30ml,加入丙二醇脂肪酸酯1.5g,常温下搅拌至完全溶解。
38.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至2000rpm,乳化时长30分钟。
39.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,40℃水浴加热2小时。
40.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心5分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
41.(6)透析纯化:20℃下,将微球置于循环水浴锅中,加入ph=6.8,渗透压=270mosmol/kg的磷酸盐缓冲液,循环压力0.2bar下开启循环进行动态透析,每隔1小时更换一次磷酸盐透析液,共更换6次。
42.(7)获取目标产物:透析结束后称重,获得微球。
43.实施例3
44.(1)制备水相:称取分子量1.5
×
106da的透明质酸钠3.0g、分子量为7.5
×
105da的重组胶原蛋白1.0g和1,4-丁二醇二缩水甘油醚(bdde)0.2g,6℃下混合分散到ph=13的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
45.(2)制备油相:称取液体石蜡50ml,加入羟基化羊毛酯6.75g,常温下搅拌至完全溶
解。
46.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至5000rpm,乳化时长30分钟。
47.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,50℃水浴加热4小时。
48.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心10分钟,离心后收集微球,用丙二醇洗去残留的油相,再用生理盐水洗去丙二醇。
49.(6)透析纯化:20℃下,将微球置于循环水浴锅中,加入ph=7.6,渗透压=350mosmol/kg的磷酸盐缓冲液,循环压力0.4bar下开启循环进行动态透析,每隔2小时更换一次磷酸盐透析液,共更换10次。
50.(7)获取目标产物:透析结束后称重,获得微球。
51.对比例1
52.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠1.0g、分子量为5
×
105da的重组胶原蛋白0.3g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
53.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
54.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
55.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
56.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
57.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
58.(7)获取目标产物:透析结束后称重,获得微球。
59.对比例2
60.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠3.5g、分子量为5
×
105da的重组胶原蛋白1.5g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
61.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
62.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
63.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
64.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用
乙醇洗去残留的油相,再用生理盐水洗去乙醇。
65.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
66.(7)获取目标产物:透析结束后称重,获得微球。
67.对比例3
68.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下先将bdde加入到ph=12的氢氧化钠溶液中溶解,再加入透明质酸钠和重组胶原蛋白,至混合物总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
69.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
70.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
71.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
72.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
73.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
74.(7)获取目标产物:透析结束后称重,获得微球。
75.对比例4
76.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
77.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯1g,常温下搅拌至完全溶解。
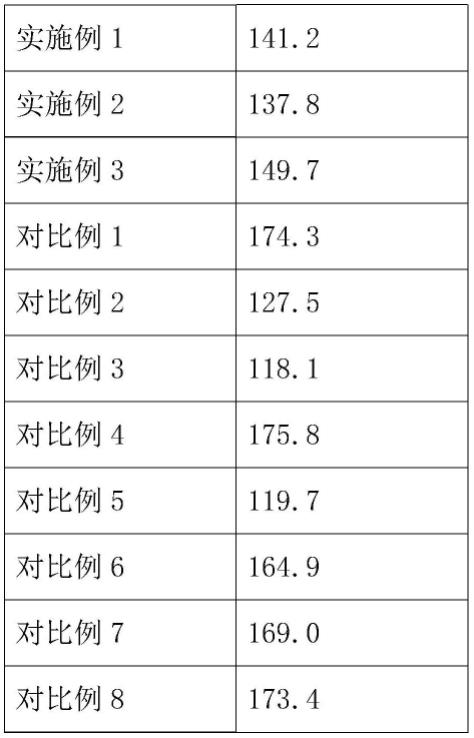
78.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
79.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
80.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
81.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
82.(7)获取目标产物:透析结束后称重,获得微球。
83.对比例5
84.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
85.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯7.2g,常温下搅拌至完全溶解。
86.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
87.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
88.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
89.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
90.(7)获取目标产物:透析结束后称重,获得微球。
91.对比例6
92.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
93.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
94.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长10分钟。
95.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
96.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
97.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
98.(7)获取目标产物:透析结束后称重,获得微球。
99.对比例7
100.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
101.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
102.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长60分钟。
103.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
104.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
105.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换8次。
106.(7)获取目标产物:透析结束后称重,获得微球。
107.对比例8
108.(1)制备水相:称取分子量1.2
×
106da的透明质酸钠2.5g、分子量为5
×
105da的重组胶原蛋白0.8g和1,4-丁二醇二缩水甘油醚(bdde)0.1g,2℃下混合分散到ph=12的氢氧化钠溶液中至总重量为10g,搅拌溶解,充分溶解均匀至得到均一的粘溶液后,将其置于注射器内,使用不同孔径大小的滤网过滤细化,第一次采用120目滤网,第二次采用150目滤网,第三次采用200目滤网。
109.(2)制备油相:称取椰子油40ml,加入丙二醇脂肪酸酯3.6g,常温下搅拌至完全溶解。
110.(3)乳化:将过滤细化后的水相加入油相,置于乳化机上,乳化剂转速在10分钟内从0升至3000rpm,乳化时长30分钟。
111.(4)水浴交联:乳化结束后,将乳化体系转移至烧杯中,45℃水浴加热3小时。
112.(5)去除油相:交联结束后,将烧杯中体系8000rpm离心7分钟,离心后收集微球,用乙醇洗去残留的油相,再用生理盐水洗去乙醇。
113.(6)透析纯化:25℃下,将微球置于循环水浴锅中,加入ph=7.2,渗透压=300mosmol/kg的磷酸盐缓冲液,循环压力0.3bar下开启循环进行动态透析,每隔1.5小时更换一次磷酸盐透析液,共更换3次。
114.(7)获取目标产物:透析结束后称重,获得微球。
115.性能测试
116.(1)粒径分布
117.使用激光粒度分析仪,以水为载体,采用湿法测定模式测定各实施例和对比例制备的透明质酸钠-胶原蛋白复合交联微球的粒径分布。
118.表2不同制备工艺所得交联微球粒径分布
119.制备工艺平均粒径(μm)实施例1147实施例2153实施例3139对比例1466对比例2378
对比例3512对比例4558对比例5442对比例6664对比例7496对比例8673
120.微球平均粒径反映了微球大小及粒径分布。实施例1-3平均粒径均小于200,而对比例1-8平均粒径大于300。上述结果说明,相较于实施例,各对比例制得的微球平均粒径偏大。
121.(2)吸水溶胀度
122.将制备的透明质酸钠-胶原蛋白复合交联微球浸泡于足量的纯化水中,待充分吸水溶胀至溶胀平衡后称量其吸水饱和后的重量。吸水溶胀度%=吸水饱和后的重量/浸泡前重量。
123.表3不同制备工艺所得微球吸水溶胀度
[0124][0125][0126]
吸水溶胀度反映了微球吸水后膨胀的幅度,是评价微球的性能指标之一,与微球粒径及交联度相关。由上表可见,实施例1-3微球吸水溶胀度在140-150%,对比例1、4、6、7、
8溶胀度大于160%,对比例2、3、5溶胀度小于130%,推测可能原因为:对比例1透明质酸、重组胶原蛋白用量小,微球交联度小,溶胀度偏高;对比例2透明质酸、重组胶原蛋白用量大,微球交联度大,溶胀度偏低;对比例3交联剂与透明质酸钠、重组胶原蛋白非同步加入,导致微球交联均匀性下降,粒径增大且分布不均,溶胀度也偏低;对比例4乳化剂用量小,乳化体系不稳定,导致所成微球交联度小,粒径偏大且分布不均,溶胀度偏高;对比例5乳化剂用量过大,乳液体系粘稠,微球交联均匀性下降,粒径增大,且分布不均,溶胀度也偏低;对比例6乳化时间短,乳化体系不稳定,导致所成微球交联度小,粒径偏大且分布不均,溶胀度偏高;对比例7乳化时间过长,被乳化分子发生团聚,粒径增大,溶胀度也偏大;对比例8透析时间过短,获得的微球粒径偏大且分布不均,溶胀度偏大。
[0127]
(3)粘弹性
[0128]
取制得的透明质酸-胶原蛋白复合微球,使用discovery hr-1混合型流变仪进行样品检测,使用25℃的温度,0.2%的应变进行振荡测试,以扫描频率为横坐标,取1hz位置所对应的g’值及g”值。
[0129]
表4不同制备工艺所得微球粘弹性
[0130]
制备工艺g’(pa
·
s)g”(pa
·
s)实施例148755实施例253848实施例346259对比例1218101对比例277936对比例384227对比例4226112对比例574833对比例6207105对比例7198103对比例8224110
[0131]
g’及g”反应了微球的机械性能。如上表所示,实施例1-3的g’在400-500之间,g”在40-60之间;对比例1、4、6、7、8的g’在250以下,g”大于100;对比例2、3、5的g’超过700,g”小于40。以上结果反映出对比例1、4、6、7、8所制得的微球机械性能不佳,不利于维持填充效果。而实施例的微球机械性能较好,不仅可单独用于填充,也可在制备时加入小分子营养物质,如l-肌肽、维生素、氨基酸等,小分子营养物质可均匀分布在微球内,填充后随微球降解,缓慢释放,进一步补充肌肤营养。
[0132]
(4)皮肤过敏实验
[0133]
7周大的balb/c小鼠随机分组如下表,实验前用脱毛剂将各组小鼠背部脱毛。将受试的一定量复合微球用凡士林稀释后涂在各组小鼠左侧背部脱毛区,并采用适当方法固定6小时。第7天和第14天以同样的方法重复一次。在末次给药致敏后14天,将与上述等量受试物涂于小鼠背部右侧脱毛区,6小时后去掉受试物,即刻观察,然后于24h、48h、72h再次观察皮肤过敏状况。
[0134]
按表5皮肤刺激反应评分标准,对所观察的皮肤刺激情况进行评分,并按表6致敏
率分类的分类判断其致敏率。致敏率的计算:出现皮肤红斑与水肿(不论轻重)的动物例数除以受试动物总数。
[0135]
表5皮肤刺激反应评分标准
[0136][0137][0138]
表6致敏率分类
[0139][0140]
表7不同制备工艺所得微球致敏率
[0141][0142][0143]
如表7所示,所有制备工艺制得的微球都没有过敏反应的发生,表明透明质酸-胶原蛋白复合交联微球对小鼠不具有致敏性。
[0144]
(5)体内实验
[0145]
在七周大的雄性裸鼠注射实施例及对比例制备方法制得的微球,观察注射处外观,注射60天后处死,切开注射处皮肤,提取剩余凝胶,称重测量剩余凝胶百分比。
[0146]
表5不同制备工艺所得凝胶体内实验结果
[0147][0148][0149]
注射当日,各组小鼠注射处外观相似,皆有黄豆粒大小的凸起;在注射后一周内,对比例1、3、4、6、7组的小鼠皮下凸起大幅度缩小,触摸时基本无凸起感。实施例1-3组小鼠及对比例2、5组小鼠皮下凸起不同程度地缩小,触摸凸起,对比例2、5组小鼠凸起处质感较硬,实施例1-3组小鼠凸起处质感较柔软自然。上述现象显示,与对比例相比,实施例1-3所得凝胶填充效果更佳。
[0150]
尽管上面已经示出和描述了本技术的实施例,理解的是,上述实施例是示例性的,不能理解为对本技术的限制,本领域的普通技术人员在本技术的范围内对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1