和厚朴酚的医药用途
和厚朴酚的医药用途
1.本技术是2020年09月27日提交的发明专利申请的分案申请,原申请的申请号:202011033093 .x、发明名称:和厚朴酚的医药用途。
技术领域
2.本发明涉及医药领域,具体是涉及和厚朴酚的医药用途。更具体地,本发明涉及和厚朴酚在抑制髓母细胞瘤中的用途,本发明还涉及和厚朴酚用于毛发生长以及用于促进白发变黑的用途。
背景技术:
3.和厚朴酚,英文名为honokiol,化学名为3',5-二-2-丙烯基-1,1'-联苯-2,4'-二酚,结构式如下:。
4.和厚朴酚是从厚朴(magnolia officinalis rehd.et wils.)的皮中提取分离出来的一种具有广泛生物活性的小分子化合物,其主要生物活性包括抗炎、抗微生物、抗溃疡、抗氧化、抗焦虑、抗抑郁、抗血栓、抗衰老和降低胆固醇等。
5.鉴于和厚朴酚有着广泛的药用价值,有必要进一步研究和厚朴酚的新用途。
技术实现要素:
6.经过大量的实验研究,发明人发现了和厚朴酚的新用途,和厚朴酚可用于抑制髓母细胞瘤。因此,本发明的一个目的是提供和厚朴酚在制备用于抑制髓母细胞瘤的药物中的用途。
7.根据本发明的用于抑制髓母细胞瘤的用途,其中所述和厚朴酚被制备成和厚朴酚脂质体(lip-hnk或lip-hk),优选为注射用和厚朴酚脂质体。
8.根据本发明的用于抑制髓母细胞瘤的用途,其中所述和厚朴酚抑制髓母细胞瘤的细胞增殖。
9.根据本发明的用于抑制髓母细胞瘤的用途,其中所述和厚朴酚诱导髓母细胞瘤的细胞凋亡。一方面,所述和厚朴酚通过ros/erk/p38mapk途径诱导髓母细胞瘤的细胞凋亡,其中所述和厚朴酚诱导的髓母细胞瘤细胞凋亡涉及ros生成,所述和厚朴酚通过在髓母细胞瘤细胞内产生过量的ros进而抑制erk/p38mapk信号通路。另一方面,所述和厚朴酚通过
caspase(含半胱氨酸的天冬氨酸蛋白水解酶)依赖的途径诱导髓母细胞瘤的细胞凋亡。
10.根据本发明的用于抑制髓母细胞瘤的用途,其中所述和厚朴酚诱导髓母细胞瘤的细胞周期阻滞。具体地,所述和厚朴酚诱导髓母细胞瘤的细胞g1周期阻滞。
11.本发明研究了lip-hnk对髓母细胞瘤细胞增殖的抑制作用及其机制。lip-hnk还可诱导髓母细胞瘤细胞g1周期阻滞和caspase依赖的细胞凋亡,但对正常细胞无明显细胞毒性。lip-hnk已被证实能抑制肿瘤细胞系的生长,但是lip-hnk用于抑制髓母细胞瘤尚未有报道,lip-hnk对髓母细胞瘤细胞死亡作用的分子机制尚未研究。lip-hnk对髓母细胞瘤的这种抑制作用可能是通过诱导细胞内活性氧(ros)和线粒体膜电位损失介导的。同时,lip-hnk对erk、p38的磷酸化均有剂量依赖性的抑制作用。更重要的是,研究发现lip-hnk对线粒体膜电位、ros生成以及erk、p38磷酸化的影响可被ros抑制剂显著逆转,表明lip-hnk通过产生过量的ros影响髓母细胞瘤细胞和erk/p38mapk信号传导。因此,本发明的发明人首次阐明髓母细胞瘤通过ros/erk/p38mapk途径诱导髓母细胞瘤细胞凋亡,为lip-hnk成为髓母细胞瘤治疗的新的治疗潜力提供了基础科学依据。
12.此外,经过大量的实验研究,发明人还发现和厚朴酚可用于促进毛发生长。因此,本发明的又一个目的是提供和厚朴酚在制备用于促进毛发生长的药物中的用途。
13.根据本发明的用于促进毛发生长的用途,其中所述和厚朴酚被制备成和厚朴酚脂质体,优选为注射用和厚朴酚脂质体。
14.根据本发明的用于促进毛发生长的用途,其中毛发生长的部位可以是头部。
15.本发明研究了和厚朴酚对毛发生长的影响,实验证明和厚朴酚能够促进毛发生长,具体为和厚朴酚加快毛发生长速度,增长毛囊长度,并且对肝脏、肾脏没有毒副作用。
16.另外,经过大量的实验研究,发明人还发现和厚朴酚可用于促进白发变黑。因此,本发明的又一个目的是提供和厚朴酚在制备用于促进白发变黑的药物中的用途。
17.根据本发明的用于促进白发变黑的用途,其中所述和厚朴酚被制备成和厚朴酚脂质体,优选为注射用和厚朴酚脂质体。
18.本发明研究了和厚朴酚对白发变黑的影响,实验证明和厚朴酚能够促进白发变黑,且对肝肾无毒副作用。
19.本发明的再一目的在于提供用于抑制髓母细胞瘤/促进毛发生长/促进白发变黑的和厚朴酚脂质体。
20.根据本发明的和厚朴酚脂质体,其中所述和厚朴酚脂质体为注射用和厚朴酚脂质体。
21.根据本发明的和厚朴酚脂质体,其中所述和厚朴酚脂质体可以是如下剂型:冻干粉制剂,包括注射冻干粉制剂,口服冻干粉制剂;片剂,包括速释片剂和缓释片剂;胶囊剂,包括硬胶囊,软胶囊、缓释胶囊和肠溶胶囊;透皮制剂,等等。
22.根据本发明的和厚朴酚脂质体,其中所述和厚朴酚脂质体可以通过如下途径给药:静脉注射、肌内注射、皮下注射、口服给药、眼部给药、肺部给药、经皮给药和鼻腔给药等。
附图说明
23.图1a-图1c示出了lip-hnk抑制髓母细胞瘤的细胞增殖。
24.图2a-图2e示出了lip-hnk诱导髓母细胞瘤的细胞周期阻滞。
25.图3a-图3d示出了lip-hnk诱导髓母细胞瘤的凋亡细胞死亡。
26.图4a-图4f示出了lip-hnk诱导的髓母细胞瘤细胞凋亡涉及ros生成。
27.图5a-图5c示出了lip-hnk通过在髓母细胞瘤细胞内产生过量的ros进而抑制erk/p38mapk信号通路。
28.图6a-图6c示出了lip-hnk通过caspase依赖的途径诱导髓母细胞瘤细胞的凋亡细胞死亡。
29.图7示出了生理盐水组与和lip-hnk组不同时间毛发生长情况。
30.图8示出了不同处理时间点小鼠背部皮肤组织毛囊he切片。
31.图9示出了lip-hnk对小鼠肝肾无毒副作用。
32.图10示出了和厚朴酚促进毛发生长以及白发变黑。
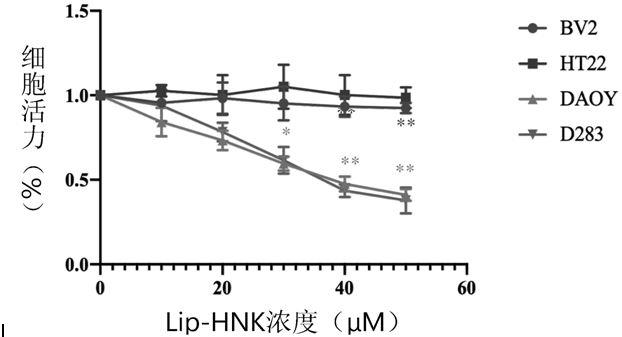
具体实施方式
33.下面提供实验实施例以进一步说明和厚朴酚的医药用途。
34.实验实施例1:和厚朴酚用于抑制髓母细胞瘤1.实验材料及仪器:和厚朴酚脂质体来源于成都金瑞基业生物科技有限公司;人髓母细胞瘤细胞(daoy细胞和d283细胞)小鼠小胶质细胞bv2细胞,小鼠海马神经元细胞ht22细胞购自于北京协和医院基础所细胞库。
35.pbs 磷酸盐缓冲液,4%多聚甲醛,0.5%结晶紫,甲醇,无水乙醇,cck-8,活性氧试剂盒,胎牛血清(gbico),以及抗体:caspase-3(货号:ab13847),c-caspase-3(ab32042),erk(ab17942),p-erk(ab201015),p38(ab170099),二抗均购自于abcam公司;p-p38(8690t),cdk4(12790)购自cell signaling technology公司;gapdh(中杉金桥),hoechst 33342、碘化丙啶pi、凋亡试剂盒均购自于bd公司;jc-10试剂盒(ca310-100,索莱宝公司),ripa裂解液(r0020,索莱宝),pvdf膜(iseq00010索莱宝),96孔板、六孔板、培养皿购自于康宁公司;荧光显微镜,酶标仪,流式细胞仪(bd biosciences,san jose,ca,usa),电泳仪,电转仪,细胞培养箱,均来源于北京天坛医院基础与转化研究实验室。
36.2. 实验方法及结果分别进行以下细胞实验来分析和厚朴酚脂质体对髓母细胞瘤的作用及机制。
37.细胞活力测定用cck-8法检测细胞活力,daoy细胞和d283细胞以2
×
103细胞/孔的速度接种在96孔板上24小时,然后用不同浓度的lip hnk处理48h。在处理结束前,每孔加入10μl cck-8溶液。培养1小时后,在450 nm处测量吸光度。
38.克隆形成试验克隆形成试验中,将daoy细胞以1
×
103个细胞/孔的密度放置在6孔板中,在37℃下与不同浓度的lip hnk孵育。然后每天更换新鲜培养基,并培养14天。用4%多聚甲醛固定,0.5%结晶紫染色15min后,观察克隆数。
39.图1a-图1c示出了lip-hnk抑制髓母细胞瘤的细胞增殖,其中图1a示出以不同浓度的lip-hnk(0、20,30,40,50μm)处理髓母细胞瘤细胞(daoy、d283)和正常细胞(bv2、ht22)的
细胞活力曲线图;图1b示出通过lip-hnk处理诱导的细胞形态变化;图1c示出daoy细胞的克隆形成试验的代表性图像。
40.细胞周期分析将daoy细胞和d283细胞以5
×
105个细胞/孔的密度接种到6孔板上,并用不同浓度的lip hnk处理48小时。收集漂浮和粘附的细胞,70%乙醇中固定的细胞至少在负20度放置24小时。待所有细胞完成固定之后,进行周期检测。具体步骤为:取固定之后的细胞,加入5毫升冷pbs,1500 rpm 离心10分钟。移去上清,留下细胞沉淀。再用2毫升冷pbs重悬细胞沉淀,1500 rpm离心10分钟,得到细胞沉淀。最后,用2毫升冷2% fbs/pbs重悬细胞沉淀,1500 rpm离心10 分钟,得到细胞沉淀。用适量的pi/rnaase染液重悬细胞,室温避光染色30分钟之后上机检测。
41.hoechst 33342染色hoechst33342染色,daoy细胞和d283细胞用不同浓度的lip-hnk(0、20、30、40μm)预处理48h,用冷pbs洗涤,冷甲醇固定,hoechst33342(1μg/ml)染色15min,荧光显微镜观察凋亡细胞的形态特征。
42.annexin v和pi染色法检测细胞凋亡使用凋亡检测试剂盒(annexin v-pi:bd biosciences,san jose,ca,usa)测定凋亡细胞死亡。用不同浓度的lip-hnk(0、20、30、40μm)处理5
×
105daoy细胞和d283细胞48h,取贴壁细胞和分离细胞,pbs洗涤一次,37℃下用annexin v-fitc和碘化丙啶(pi)染色15min,流式细胞仪检测细胞凋亡。
43.图2a-图2e示出了lip-hnk诱导髓母细胞瘤的细胞周期阻滞,其中图2a和图2c示出用不同浓度的lip-hnk处理daoy细胞和d283细胞的细胞周期分布;图2b和图2d示出通过流式细胞术分析的daoy细胞和d283细胞的细胞周期分布(%)的代表性图像;图2e示出lip-hnk处理daoy细胞和d283细胞48小时后通过western blot检验p21蛋白表达水平。
44.图3a-图3d示出了lip-hnk诱导髓母细胞瘤的凋亡细胞死亡,其中图3a示出通过荧光显微镜对daoy细胞的核结构的分析;图3b示出pi染色(红色)和hoechst 33342染色(蓝色)的比值,代表细胞死亡率;图3c示出通过annexin v/pi流式细胞术分析确定凋亡细胞死亡;图3d示出凋亡细胞百分比。
45.细胞内ros检测daoy细胞和d283细胞经不同浓度的lip-hnk(0、20、30、40μm)处理48h,然后用冷pbs洗涤,在37℃的黑暗条件下在10μm dcfh-da中培养30分钟。使用流式细胞仪(bd biosciences,san jose,ca,usa)测量dcf荧光,并使用flowjo10分析数据。细胞内dcf的荧光强度代表ros水平,用image j定量荧光强度。
46.图4a-图4f示出了lip-hnk诱导的髓母细胞瘤细胞凋亡涉及ros生成,其中图4a示出利用dcfh-da染色通过荧光显微镜测得的lip-hnk处理的细胞中的ros生成;图4b示出三组中(对照,lip-hnk和lip-hnk+nac(n-乙酰-l-半胱氨酸)),相对dcf荧光强度表示为lip-hnk和lip-hnk+nac 组的荧光强度相对于对照组荧光强度的倍数;图4c示出通过流式细胞术测量nac对和厚朴酚脂质体诱导的ros生成的抑制作用;图4d示出用cck-8测定的细胞活力百分比;图4e和图4f示出通过流式细胞术分析用annexin v/pi染色细胞。
47.图5a-图5c示出了lip-hnk通过在髓母细胞瘤细胞内产生过量的ros进而抑制erk/
p38mapk信号通路,其中图5a示出lip-hnk处理后的daoy细胞和d283细胞的p-erk、erk、p-p38、p38的蛋白水平;图5b示出lip-hnk通过erk/p38 mapk磷酸化作用对髓母细胞瘤细胞发挥作用,将髓母细胞瘤细胞用40μm lip-hnk和5mm nac共处理后,通过免疫印迹检测p-erk、erk、p-p38、p38的蛋白水平;图5c示出通过免疫印迹检测凋亡相关因子(包括裂解caspase3、caspase3、bax和bcl-2)的蛋白水平。
48.线粒体膜电位测定线粒体膜电位用jc-10试剂盒测定。daoy细胞和d283细胞(2
×
105)接种,lip-hnk处理48h,然后用jc-10在37℃孵育30分钟,用pbs洗涤两次。流式细胞仪检测mmp(线粒体膜电位)的变化。阳性对照用cccp(活性氧阳性对照试剂)处理。
49.图6a-图6c示出lip-hnk通过caspase依赖的途径诱导髓母细胞瘤细胞的凋亡细胞死亡,其中图6a示出通过western blot评价凋亡蛋白(bcl-2、bax、caspase-3和裂解caspase-3)的表达水平;图6b示出由至少三组独立实验获得的数据,其中数值为平均值
±ꢀ
sd,相对于对照组,*: p 《 0.05,**: p 《 0.01;图6c示出利用荧光线粒体探针jc-10评估mmp,其中通过流式细胞术分析红/绿荧光强度。
50.以上实验结果表明,lip-hnk对髓母细胞瘤细胞具有抑制作用。一方面,lip-hnk通过ros/erk/p38mapk途径诱导髓母细胞瘤细胞凋亡;另一方面,lip-hnk还可诱导髓母细胞瘤细胞g1周期阻滞和caspase依赖的细胞凋亡,但对正常细胞无明显细胞毒性。lip-hnk对髓母细胞瘤的抑制作用是通过诱导细胞内ros和线粒体膜电位损失介导的。同时,lip-hnk对erk、p38的磷酸化均有剂量依赖性的抑制作用。lip-hnk对线粒体膜电位、ros生成以及erk、p38磷酸化的影响可被ros抑制剂显著逆转,表明lip-hnk通过产生过量的ros影响髓母细胞瘤细胞和erk/p38mapk信号传导,为lip-hnk成为髓母细胞瘤治疗的新的治疗潜力提供了基础科学依据。
[0051] 实验实施例2:和厚朴酚用于促进毛发生长1. 实验材料及仪器和厚朴酚脂质体来源于成都金瑞基业生物科技有限公司,c57bl/6小鼠购自于北京维通利华实验动物技术有限公司;4%多聚甲醛(厂家:碧云天;货号p0099)、5%水合氯醛(上海远慕r18184)、脱毛膏、注射器、pbs,蒸馏水/自来水,二甲苯,梯度乙醇,中性树胶,石蜡,石蜡包埋机,切片机,烘片机,显微镜均来源于北京天坛医院基础与转化研究实验室。
[0052]
2. 实验方法及结果以6周龄c57bl/6、体重18-20g的小鼠作为实验动物,购买后使小鼠适应环境三日,然后给予背部脱毛处理,将和厚朴酚脂质体20mg/kg的浓度进行动物实验。采用he染色技术与spss软件统计对比不同给药天数(10天、14天、21天)不同处理组的小鼠毛发生长的情况,包括给药区域皮肤颜色变化的天数、开始长新的毛发的天数、毛囊的长度等,以分析和厚朴酚脂质体对小鼠毛发再生的影响。具体实验如下:1)不同时间小鼠毛发生长情况6周龄c57bl/6小鼠称量体重后给予5%水合氯醛麻醉,然后用脱毛膏给予背部脱毛,脱毛后完成拍照,脱毛后第二天以后每日分别进行腹腔注射生理盐水及和厚朴酚脂质体(20mg/kg),每日观察皮肤及毛发生长情况,毛发生长后进行毛发测量,在脱毛后第0,10,14,21天分别拍照,取皮肤及肝肾组织进行石蜡包埋,同时留取组织液氮内保存。图7以及表
1和表2表明,和厚朴酚脂质体组皮肤变黑的时间及毛发生长时间均短于生理盐水对照组。
[0053]
表1给药后小鼠给药区域皮肤颜色变黑的时间表2给药后小鼠的新生毛发开始生长的时间2)不同处理时间点小鼠背部皮肤组织毛囊he切片将脱毛后第0,10,14,21天的皮肤组织石蜡包埋后进行he染色。
[0054]
石蜡包埋:取新鲜皮肤组织,并用刀片单向切割成约3-5mm
×
3-5mm
×
10-20mm大小组织块;固定:将切好的组织块放入4%多聚甲醛中固定,以组织块与4%多聚甲醛体积比 1:20 为宜;固定完毕后,用pbs洗3次,每次5分钟;脱水透明:此步骤应根据不同组织设置合适时间,基本流程如下:75%乙醇—85%乙醇—95%乙醇1—95%乙醇2—无水乙醇1—无水乙醇2—二甲苯1—二甲苯2—二甲苯3;浸蜡:将石蜡融化,温度保持在57℃左右;包埋:将组织块放入盛有蜡液的模具中,所需组织切面与底部平行,因蜡液在冷环境中易凝固,此步尽量要快。
[0055]
he染色方法及步骤:(1)切片浸入二甲苯中5-10min;(2)切片浸入二甲苯中5-10min;(3)100%酒精1min;(4)100%酒精1min;(5)95%酒精1min;(6)95%酒精1min;(7)90%酒精1min;(8)80%酒精1min;(9)自来水洗1min;(10)浸入苏木素染液浸染10-15min;(11)自来水洗30sec-1min;(12)1%盐酸酒精分化30sec;(13)流水冲洗15min以上;(14)1%伊红酒精染3-5min;(15)90%或95%酒精分化30sec;(16)95%酒精30sec-1min;(17)95%酒精30sec-1min;(18)95%酒精30sec-1min;(19)100%酒精1min;(20)100%酒精1-2min;(21)碳酸二甲苯1min;(22)二甲苯1-2min;(23)二甲苯1-2min;(24)二甲苯1-2min;(25)中性树胶封固。
[0056]
图8显示,和厚朴酚脂质体组毛囊生长周期较生理盐水对照组提前,并且毛囊数量较生理盐水对照组明显增多。而且,表3表明,和厚朴酚脂质体组毛囊长度大于生理盐水对照组毛囊长度。
[0057]
表3 不同处理时间小鼠毛囊长度分析3)肝肾毒性
为了进一步明确和厚朴酚脂质体在促进毛发生长的同时是否具有毒性反应,我们将肝肾组织石蜡包埋后进行he染色(肝肾组织he染色操作与皮肤组织he染色操作相同)。图9显示,与生理盐水对照组相比,给予和厚朴酚脂质体腹腔注射后无明显肝肾毒性,且小鼠无死亡,体重无影响。
[0058]
此外,在和厚朴酚脂质体用于治疗脑胶质瘤的临床研究中,发明人发现和厚朴酚可以促进毛发生长以及白发变黑。图10示出静脉注射和厚朴酚脂质体后患者的毛发生长增加且白发变黑。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1