隐丹参酮类物质及其联用组合物的应用
1.本发明涉及抗肿瘤药物技术领域,具体而言,涉及一种隐丹参酮类物质及其联用组合物的应用。
背景技术:
2.nad(p)h:醌氧化还原酶-1(nad(p)h:quinone oxidoreductase 1,nqo1)(ec1.6.99.2),首次发现于上世纪五十年代。nqo1在早期文献中,又被称为dt-硫辛酰胺脱氢酶(dt-diaphorase)、维生素k还原酶(vitamin k reductase)、phylloquinone reductase、menadione reductase、azo dye reductase、x-ray inducible transcript 3(xip3)、nicotinamide menadione oxidoreductase等。nqo1的单拷贝基因定位于第16号染色体,全长20kb,包含6个外显子和5个内含子,编码相对分子量为30kd左右的nqo1蛋白。nqo1是一种黄素酶,酶分子以双聚体形式存在,每个亚基含有一个黄素腺嘌呤二核甘酸(fad)分子。在细胞内,nqo1主要定位于细胞质,也存在于线粒体、内质网、微粒体、高尔基体、细胞核等亚细胞器。在生理条件下,nqo1可作为维生素k循环中的维生素k还原酶,参与维生素k氢醌依赖性凝血因子的肝脏翻译后修饰。nqo1也可由nadh或nad(p)h提供电子,催化外源性的醌类化合物还原为氢醌类,从而降低醌类的潜在毒性。但nqo1在催化某些醌类化合物,尤其是萘醌类,如β-拉帕醌、napabucasin(bbi608)等时,在催化过程中,发生氧化还原循环(futile redox cycling),诱导产生大量活性氧(reactive oxygen species,ros),后者诱导dna损伤、parp1高度激活和nad
+
的耗竭,诱导肿瘤细胞死亡,最终产生抗肿瘤作用。
3.nqo1体内表达广泛,但表达多呈现低水平。已经证实,在很多恶性肿瘤组织中,nqo1的表达显著增加:如与正常组织相比,》80%的非小细胞肺癌(nsclc)中nqo1的表达可增加200倍;》80%的胰腺癌中nqo1表达增加100倍;60%的前列腺癌中nqo1表达增加10倍;60%的乳腺癌中nqo1表达增加10倍;50%的结直肠癌中nqo1表达增加10倍等等。nqo1的表达与肿瘤患者的预后有密切的相关性。
4.因此,通过nqo1激活药物可实现对nqo1高表达的肿瘤细胞明显的选择性杀伤。而nqo1激活药物治疗或预防肿瘤目前主要还存在nqo1激活药物药效低、药物不敏感或药物耐受、复发导致的疗效差、毒副作用强、治疗失败等诸多临床实际应用问题,制约了其应用和发展。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种隐丹参酮类物质及其联用组合物的应用,以改善上述技术问题。
7.本发明是这样实现的:
8.第一方面,本发明提供了隐丹参酮类物质在制备nqo1高表达恶性肿瘤化疗增敏药
物中的应用。
9.第二方面,本发明还提供了隐丹参酮类物质和nqo1激活药物组成的联用组合物在制备nqo1高表达恶性肿瘤的治疗和/或预防药物中的应用。
10.第三方面,本发明还提供了含有隐丹参酮类物质和nqo1激活药物的联用组合物在制备nqo1高表达恶性肿瘤耐药逆转药物和/或预后防复发的药物中的应用。
11.第四方面,本发明还提供了含有隐丹参酮类物质和nqo1激活药物的联用组合物在制备以下任一功能的药物中的应用:
12.(1)降低细胞活力;(2)降低细胞内atp含量;(3)增加ldh的释放;(4)增加pi染色细胞数;(5)诱导肿瘤细胞死亡;(6)抑制肿瘤的生长;(7)降低肿瘤细胞中nad
+
和/或nadh水平。
13.第五方面,本发明还提供了一种抗nqo1高表达恶性肿瘤的产品,其包括隐丹参酮类物质和nqo1激活药物。
14.需要说明的是,以上应用和产品中的隐丹参酮类物质包括隐丹参酮、其可药用的盐或酯、其衍生物以及其衍生物在药学上可接受的盐中的至少一种。优选地,隐丹参酮类物质为隐丹参酮。
15.本发明具有以下有益效果:通过将隐丹参酮类物质(例如隐丹参酮)与nqo1激活药物(例如β-拉帕醌等)联合使用,其可明显增加nqo1高表达恶性肿瘤细胞对nqo1激活药物的敏感性,引发爆发式的coalism、增效或协同抗肿瘤效果,实现爆发式地提高多种nqo1激活药物对nqo1高表达细胞的杀伤效果,从而使得各nqo1激活药物的使用量远低于当前临床的药物使用量,达到低剂量、高效率的杀死nqo1高表达肿瘤细胞的效果。并且由于隐丹参酮毒性低,丹参中含量丰富、提取制备容易、质量控制简单,能明显降低化疗过程中nqo1激活药物对患者的毒副作用,降低化疗药物用量,显著降低治疗成本和费用。因此,隐丹参酮类物质(例如隐丹参酮)在制备nqo1高表达的恶性肿瘤的治疗和/或预防药物、nqo1高表达的恶性肿瘤耐药逆转药物和/或预后防复发的药物方面应用前景诱人,潜在商业价值高。
附图说明
16.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
17.图1为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达非小细胞肺癌a549细胞和h460细胞以及nqo1无表达的非小细胞肺癌h596细胞的细胞毒性作用,**p《0.01,***p《0.001,****p《0.0001;
18.图2为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达乳腺癌mcf-7细胞和hcc1937细胞以及nqo1无表达的乳腺癌mda-mb-231细胞的细胞毒性作用,**p《0.01,***p《0.001,****p《0.0001;
19.图3为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达胰腺癌miapaca-2细胞和nqo1无表达的胰腺癌panc-1细胞的细胞毒性作用,**p《0.01,****p《0.0001;
20.图4为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达肝癌hepg2细胞和
nqo1无表达肝癌hep3b细胞的细胞毒性作用,*p《0.05,***p《0.001,****p《0.0001;
21.图5为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达结直肠癌ht29细胞、前列腺癌pc3细胞、宫颈癌hela细胞的细胞毒性作用,*p《0.05,**p《0.01,***p《0.001,****p《0.0001;
22.图6为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1高表达卵巢癌ovcar3细胞、白血病k562细胞、恶性黑色素瘤a375细胞的细胞毒性作用,**p《0.01,***p《0.001,****p《0.0001;
23.图7为隐丹参酮联用不同浓度β-拉帕醌或bbi608,对nqo1无表达的膀胱癌t24细胞和骨肉瘤mg-63细胞的细胞毒性作用,**p《0.01;
24.图8为隐丹参酮的类似物丹参酮iia联用不同浓度β-拉帕醌,对nqo1高表达非小细胞肺癌a549和乳腺癌mcf7细胞的细胞毒性作用,**p《0.01,***p《0.001,****p《0.0001;
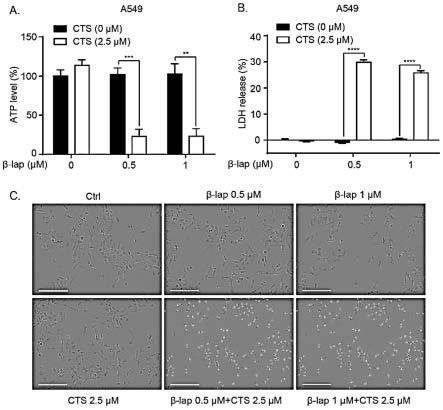
25.图9为隐丹参酮联用不同浓度β-拉帕醌,对nqo1高表达非小细胞肺癌a549细胞内atp、ldh释放以及pi渗透的作用,**p《0.01,***p《0.001,****p《0.0001;
26.图10为隐丹参酮联用不同浓度β-拉帕醌,对nqo1高表达非小细胞肺癌a549细胞nad
+
、nadh以及计算的联合指数(combination index,ci)结果,**p《0.01,****p《0.0001;
27.图11为隐丹参酮联用β-拉帕醌及bbi608,在a549细胞异种移植斑马鱼肿瘤模型中对肿瘤的抑制作用,p《0.05,**p《0.01,***p《0.001,****p《0.0001。
具体实施方式
28.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
29.下面对本发明提出的隐丹参酮类物质及其联用组合物的应用进行具体说明。
30.本发明的一些实施方式提供了隐丹参酮类物质在制备nqo1高表达恶性肿瘤化疗增敏药物中的应用,该隐丹参酮类物质包括隐丹参酮、其可药用的盐或酯、其衍生物以及其衍生物在药学上可接受的盐中的至少一种。
31.需要说明的是,本发明中的隐丹参酮类物质定义为具有和隐丹参酮类似化学结构、相同功效或相似功效的物质,如丹参酮iia、异隐丹参酮、新隐丹参酮、脱氧基新隐丹参酮等。
32.一些实施方式中,隐丹参酮类物质为隐丹参酮。隐丹参酮来源丰富、活性多样,安全性高,具有良好的研究和开发价值。隐丹参酮(cryptotanshinone,cts)(cas号:35825-57-1)的化学结构为:
33.34.通过小鼠急性毒性试验显示,隐丹参酮灌胃给药至1.5g/kg时未发现供试小鼠有中毒症状和死亡,测得的ld50>30g/kg。小鼠慢性毒性试验显示,隐丹参酮灌胃给药200mg/kg/天,连续30天,对小鼠存活率、生长发育、造血功能、生化指标等均无明显影响。这些试验结果提示隐丹参酮具有良好的安全性。
35.发明人为了解决nqo1激活药物开发方面现有技术的缺陷和不足,经过大量的研究和实践,最终提供了隐丹参酮能够作为一种化疗增敏药物来与nqo1激活药物联合使用。并通过实验发现,低浓度(例如0.25μm-2.5μm)的隐丹参酮单独对nqo1高表达的恶性肿瘤细胞无明显或很弱的杀伤作用。当隐丹参酮与nqo1激活药物联合使用时,在nqo1高表达肿瘤细胞,隐丹参酮与nqo1联合使用,引发了爆发式的杀伤效果,可呈现:1)coalism作用:在隐丹参酮与nqo1激活药物单独均无杀伤作用的浓度,二者联合呈现明显的杀伤作用;2)增效作用:在隐丹参酮单独无杀伤作用的浓度,与nqo1激活药物有杀伤作用的浓度联合,隐丹参酮明显增加后者的杀伤作用,明显降低后者的ic50值;3)协同作用:在隐丹参酮与nqo1激活药物单独均有杀伤作用的浓度,二者联合呈现明显的协同杀伤作用,ci(联合指数)明显低于1,甚至低至0.3,呈强协同作用。因此,通过研究发现隐丹参酮是一个很好的nqo1高表达恶性肿瘤化疗增敏药物,可用于增加nqo1高表达恶性肿瘤细胞对nqo1激活药物的敏感性;采用包含隐丹参酮与nqo1激活药物联合使用应用于制备nqo1高表达恶性肿瘤化疗药物,可以解决由于nqo1激活药物药效低、药物不敏感或药物耐受、复发导致的疗效差、毒副作用强、治疗失败等诸多临床实际应用问题。其中,鉴于1)隐丹参酮的安全性好,且含有隐丹参酮的丹参酮胶囊已是临床应用药物;2)nqo1激活药物如β-拉帕醌、bbi608等是临床应用或临床试验中的药物。因此,隐丹参酮与nqo1激活药物的联合用药可快速推进到nqo1高表达恶性肿瘤的临床试验中,应用前景诱人,潜在商业价值高。
36.需要说明的是,化疗增敏药物用于增加nqo1高表达恶性肿瘤细胞对抗癌药物的敏感性。隐丹参酮可作为化疗增敏药物与抗癌药物联合配伍使用。
37.本发明的一些实施方式还提供了隐丹参酮类物质(例如隐丹参酮)和nqo1激活药物组成的联用组合物在制备nqo1高表达恶性肿瘤的治疗和/或预防药物中的应用。
38.本发明的一些实施方式还提供了含有隐丹参酮类物质和nqo1激活药物的联用组合物在制备nqo1高表达恶性肿瘤耐药逆转药物和/或预后防复发的药物中的应用。
39.本发明的一些实施方式还提供了含有隐丹参酮类物质和nqo1激活药物的联用组合物在制备以下任一功能的药物中的应用:
40.(1)降低细胞活力;(2)降低细胞内atp含量;(3)增加ldh的释放;(4)增加pi染色细胞数;(5)诱导肿瘤细胞死亡;(6)抑制肿瘤的生长;(7)降低肿瘤细胞中nad
+
和/或nadh水平。
41.本发明的一些实施方式还提供了隐丹参酮类物质在增敏和/或杀死nqo1高表达恶性肿瘤细胞的分析试剂、生化试剂或检测试剂中的应用。
42.需要说明的是,前述应用中的隐丹参酮类物质均包括隐丹参酮、其可药用的盐或酯、其衍生物以及其衍生物在药学上可接受的盐中的至少一种。优选隐丹参酮类物质为隐丹参酮。
43.具体地,上述nqo1激活药物为激活nqo1活性的药物,nqo1激活药物为激活剂或底物。
44.一些实施方式中,nqo1激活药物包括但不限于以下物质或其可药用的盐或酯、其衍生物、其衍生物在药学上可接受的盐、其溶剂化物中的至少一种:
45.β-拉帕醌、bbi608、deoxynyboquinon(dnq)、isobutyl-deoxynyboquinone(ib-dnq)、2,3-二甲氧基-1,4-萘醌(dmnq)、2-methoxy-1,4-naphtoquinone(mnq)、甲萘醌、丹参二醇a(tsa)、丹参二醇b(tsb)、丹参二醇c(tsc)、白花丹醌、异白花丹醌、6,7-difluoro-9-oxo-9h-indeno[1,2-b]pyrazine-2,3-dicarbonitrile、6-fluoro-9-oxo-9h-indeno[1,2-b]pyrazine-2,3-dicarbonitrile、6,7-dimethoxy-9-oxo-9h-indeno[1,2-b]pyrazine-2,3-dicarbonitrile、2-substituted3,7,8-trimethylnaphtho[1,2-b]furan-4,5-diones、百里醌、2-((4-benzylpiperazin-1-yl)methyl)naphtho[2,1-d]oxazole-4,5-dione、托可醌、2-(((4-fluorophenyl)amino)methyl)-3-methylnaphtho[1,2-b]furan-4,5-dione(yk-01)、莎草醌、2-甲氧基-6-乙酰基-7-甲基胡桃酮(mam)、ent-14α-o-[(5-methoxy-1-methyl-4,7-dioxo-4,7-dihydro-1h-indol)-3-methoxyacyl)-butyryl]}-1,7-epoxy-6,7,15-trioxo-6,20-epoxy-6,7-seco-16-kaurene、3,7,8-trimethylnaphtho[1,2-b]furan-4,5-dione、9,10-phenanthrenequinone、kp372-1、dunnione、lavendamycin、deoxykalafungin、quinoclamine、链黑菌素、(e)-3-(pyridin-3-yl)-n-(4-(((1,6,6-trimethyl-10,11-dioxo-6,7,8,9,10,11-hexahydro-phenanthro[1,2-b]furan-2-yl)methyl)amino)phenethyl)acrylamide、pronqodine a、17-dmag、6-phenyl-8h-benzo[g]quinazolino[4,3-b]quinazolin-8-one、rh1、2-phenyl-n-(quinolin-2-yl)quinazolin-4-amine、eo9、6-chloro-7-(4-chloro-2-butynyloxy)-5,8-quinolinedione、6-chloro-7-(3-phenyl-2-propynyloxy)-5,8-quinolinedione、cb1954、6,7-di(1-methyl-2-propynyloxy)-5,8-quinolinedione、6,7-di(3-ethynylphenyloxy)-5,8-quinolinedione、6,7-di(4-benzoiloxy-2-butynyloxy)-5,8-quinolinedione、6,7-di(4-cinnamoyloxy-2-butynyloxy)-5,8-quinolinedione、6-((4-(4-methylpiperazin-1-yl)phenyl)amino)quinoline-5,8-dione、(e)-methyl 3-(3-(((5,8-dioxo-5,8-dihydroquinolin-6-yl)amino)methyl)phenyl)acrylate、7-((4-(4-methylpiperazin-1-yl)phenyl)amino)quinoline-5,8-dione、7-((2-(1h-indol-3-yl)ethyl)amino)quinoline-5,8-dione;
[0046]
优选地,所述nqo1激活药物包括以下物质或其可药用的盐或酯、其衍生物、其衍生物在药学上可接受的盐、其溶剂化物中的至少一种:
[0047]
β-拉帕醌、bbi608、dnq、ib-dnq、dmnq、mnq、tsa、tsb、tsc、mam、kp372-1、dunnione、lavendamycin、链黑菌素;
[0048]
优选地,nqo1激活药物包括β-拉帕醌和bbi608中的至少一种。
[0049]
需要说明的是,以上实施方式中的nqo1激活药物能够用其可药用的盐或酯、其衍生物、其衍生物在药学上可接受的盐、其衍生物的纳米级物质中的一种或几种的组合来进行替代,达到相同或相近的治疗效果,其均应当属于本发明保护的范围。
[0050]
进一步地,承前述,nqo1高表达恶性肿瘤包括但不限于非小细胞肺癌、乳腺癌、胰腺癌、肝癌、结直肠癌、前列腺癌、宫颈癌、卵巢癌、恶性黑色素瘤和白血病中的任意一种。一些实施方式中,nqo1高表达恶性肿瘤进一步选自非小细胞肺癌、胰腺癌、乳腺癌、肝癌、结直肠癌、宫颈癌和前列腺癌中的任意一种。
[0051]
优选地,nqo1高表达恶性肿瘤选自非小细胞肺癌、乳腺癌、胰腺癌和前列腺癌中的任意一种。
[0052]
进一步地,本发明的一些实施方式还提供了一种抗nqo1高表达恶性肿瘤的产品,其包括隐丹参酮类物质和nqo1激活药物,该隐丹参酮类物质包括隐丹参酮、其可药用的盐或酯、其衍生物以及其衍生物在药学上可接受的盐中的至少一种;隐丹参酮类物质优选为隐丹参酮。
[0053]
具体地,产品为药物、试剂盒、保健药品或保健食品,隐丹参酮类物质和nqo1激活药物的摩尔比200:1~1:20,优选为20:1~1:5,更优选为5:1~1:1。
[0054]
一些实施方式中,上述产品为试剂盒,隐丹参酮类物质为隐丹参酮,试剂盒的使用方法中,隐丹参酮的使用浓度为0.25μm~4μm,更优选0.25μm~2.5μm。研究结果显示,当隐丹参酮为2.5μm时,隐丹参酮与nqo1激活药物(如β-拉帕醌)组合物,对nqo1高表达恶性肿瘤细胞的杀伤作用可高达80%以上;上述隐丹参酮和nqo1激活药物配伍方式的使用浓度远低于当前实验研究中隐丹参酮和nqo1激活药物单独使用时的浓度。
[0055]
具体地,本发明的一些实施方式还提供了一种nqo1高表达恶性肿瘤的治疗药物,包含有效量的隐丹参酮类物质和nqo1激活药物;隐丹参酮类物质包括隐丹参酮、其可药用的盐或酯、其衍生物、其衍生物在药学上可接受的盐、其衍生物的纳米级物质中的一种或几种的组合。nqo1激活药物为β-拉帕醌、bbi608、dnq、ib-dnq、dmnq、mnq、tsa、tsb、tsc、mam、kp372-1、dunnione、lavendamycin、链黑菌素其可药用的盐或酯、其衍生物、其衍生物在药学上可接受的盐、其衍生物的纳米级物质中的一种或几种的组合。
[0056]
一些实施方式中,药物可为口服制剂或注射制剂。
[0057]
该药物还可包括可接受的药用载体和/或药学上可接受的赋形剂;可制成各种药学上可接受的制剂,包括片剂(控释片、缓释片)、颗粒剂、胶囊剂(硬胶囊、软胶囊)、丸剂、汤剂等口服制剂,冻干粉针制剂等注射剂。
[0058]
具体地,药用载体包括但并不限于以下的一种或多种:盐水、缓冲液、葡萄糖、水、甘油、乙醇、低分子量右旋糖酐、聚乙二醇400、聚乙二醇6000、环糊精、甘露醇、乳糖、葡萄糖、蔗糖、氯化钠、山梨醇。
[0059]
需要说明的是,隐丹参酮和nqo1激活药物配伍组成的药物的制备方法不做严格限制。在无菌条件下,可制成针剂,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法制备得到;可制成片剂和胶囊剂,通过常规方法制备得到。
[0060]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0061]
β-拉帕醌、bbi608是nqo1激活药物的代表化合物,它们对nqo1高表达的恶性肿瘤具有良好的治疗效果,已经开展多项临床试验。但临床试验结果显示,β-拉帕醌具有引发贫血和高铁血红蛋白血症的毒副作用;bbi608具有腹痛、腹泻、疲劳和脱水的毒副作用,这限制了它们临床剂量增加,进而降低了治疗效果,但是现有技术中尚缺乏对它们增效减毒的有效药物。而发明人研究发现,隐丹参酮与β-拉帕醌或bbi608联用,能明显增加它们对nqo1高表达肿瘤细胞的毒性,抑制肿瘤的生长。因此,本发明实施例将它们的联合用于制备抗nqo1高表达肿瘤的药物。
[0062]
需要说明的是,虽然本发明实施例或实验例仅列举了隐丹参酮与β-拉帕醌或bbi608联用的治疗效果,但是其他的nqo1激活药物与隐丹参酮联用用于抗nqo1高表达的恶
性肿瘤也在本发明实施例的保护范围内。
[0063]
实验材料:
[0064]
1、实验细胞株
[0065]
a549人非小细胞肺癌细胞株、h460人大细胞肺癌细胞株、hepg2和hep3b人肝癌细胞株、hela人宫颈癌细胞株、a375人皮肤黑色素瘤细胞株及t24人膀胱癌细胞株购自美国atcc细胞库。nci-h596人肺腺鳞癌细胞株及k562人慢性髓系白血病细胞株购自北京协和细胞资源中心。ht29人结肠癌细胞株、mg-63人成骨肉瘤细胞株、mcf7和mda-mb-231人乳腺癌细胞株购自中国科学院上海细胞库。miapaca-2人胰腺导管癌细胞株和panc-1人胰腺癌细胞株获赠于澳门大学健康科学学院陈强教授。hcc1937人乳腺癌细胞株获赠于澳门大学健康科学学院邓初夏教授。pc3人前列腺癌细胞株、ovcar3人卵巢癌细胞分别获赠于澳门大学中华医药研究院王颖教授、陆金健教授。
[0066]
2、细胞培养及nqo1蛋白表达:
[0067]
a549、h460、nci-h596、hcc1937、hela、k562和pc3细胞用完全培养基(含10%fbs和1%双抗的rpmi-1640培养基)进行常规细胞培养,mcf7和mda-mb-231、panc-1、hepg2、hep3b、a375细胞用完全培养基(含10%fbs和1%双抗的dmem培养基),miapaca-2细胞用完全培养基(含10%fbs,2.5%马血清及1%双抗的dmem培养基),ht29和t24细胞用完全培养基(含10%fbs及1%双抗的5a培养基),ovcar3细胞用完全培养基(含20%fbs和1%双抗的dmem培养基),mg-63细胞用完全培养基(含10%fbs和1%双抗的mem培养基),培养时采用37℃恒温、5%co2的条件进行。上述肿瘤细胞株中nqo1表达水平,采用western blotting方法检测。各个细胞株nqo1表达的检测结果与符合已经发表文献,并分别置于图1-7的左上角。
[0068]
3、药物母液配制实验:
[0069]
取隐丹参酮(购自成都普菲德生物技术有限公司,纯度》98%)粉末、β-拉帕醌(购自selleck chemicals公司,纯度》98%)粉末和bbi608(购自上海阿拉丁生化科技股份有限公司,纯度》98%)粉末,称重,并用dmso溶液溶解至终浓度10mmol。
[0070]
实验例1
[0071]
隐丹参酮与β-拉帕醌或bbi608联合对非小细胞肺癌细胞的毒性
[0072]
利用mtt检测方法检测隐丹参酮与β-拉帕醌联合对非小细胞肺癌(nsclc)细胞株(a549、h460、h596细胞)的细胞活力的影响。
[0073]
mtt法测试步骤:取对数生长期细胞(a549、h460)按密度8
×
103细胞/孔接种于96孔板,h596细胞按密度4
×
103细胞/孔接种于96孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,用2.5μm隐丹参酮联合不同浓度的β-拉帕醌(0μm,0.25μm,0.5μm,1μm,2μm,4μm)或不同浓度的bbi608(0nm,50nm,100nm,200nm,400nm,800nm),处理12h后,吸弃细胞培养液,每孔加入100μl mtt溶液(1mg/ml,低血清培养基稀释),置于37℃培养箱中继续孵育4h,吸弃mtt溶液,每孔加入100μl dmso溶解甲臢结晶,于室温摇床上孵育10min,用酶标仪检测od 570nm的吸光度,计算细胞存活率。
[0074]
检测结果参见图1。其中,图1中a-c为隐丹参酮与β-拉帕醌(β-lap)联用、d-f为隐丹参酮与bbi608联用的mtt检测结果图。
[0075]
根据图1可知,隐丹参酮单独对a549,h460和h596细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。隐丹参酮
与β-拉帕醌或bbi608联合后,显著增强了对nqo1高表达的a549和h460细胞的细胞毒性,而对nqo1无表达的h596的细胞毒性无明显影响。隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达的非小细胞肺癌细胞呈现了coalism、增效或协同作用。
[0076]
实验例2
[0077]
隐丹参酮与β-拉帕醌或bbi608联合对乳腺癌细胞的毒性
[0078]
利用mtt检测方法检测隐丹参酮与β-拉帕醌或bbi608联合对乳腺癌(mcf7、hcc1937、mda-mb-231细胞)的细胞活力的影响。
[0079]
mtt检测法与实验例1提供的mtt检测法的操作基本一致,区别在于:mcf7和hcc1937按密度8
×
103细胞/孔接种于96孔板,mda-mb-231细胞按密度5
×
103细胞/孔接种于96孔板。药物处理时,mcf7和mda-mb-231使用含1%fbs的dmem培养基,hcc1937细胞使用含1%fbs的rpmi1640培养基。
[0080]
检测结果参见图2。其中,图2中a-c为隐丹参酮与β-拉帕醌联用、d-f为隐丹参酮与bbi608联用的mtt检测结果图。
[0081]
根据图2可知,隐丹参酮单独对mcf7、hcc1937、mda-mb-231细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。隐丹参酮与β-拉帕醌或bbi608联合后,显著增强了对nqo1高表达的mcf7和hcc1937细胞的细胞毒性,而对nqo1无表达的mda-mb-231的细胞毒性无明显影响。隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达的乳腺癌细胞呈现了coalism、增效或协同作用。
[0082]
实验例3
[0083]
隐丹参酮与β-拉帕醌或bbi608联合对胰腺癌细胞的毒性
[0084]
利用mtt检测方法检测隐丹参酮与β-拉帕醌或bbi608联合对胰腺癌(miapaca-2和panc-1细胞)的细胞活力的影响。
[0085]
mtt检测法与实验例1提供的mtt检测法的操作基本一致。
[0086]
检测结果参见图3。其中,图3中a和b为隐丹参酮与β-拉帕醌联用、c和d为隐丹参酮与bbi608联用的mtt检测结果图。
[0087]
根据图3可知,隐丹参酮单独对miapaca-2和panc-1细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。隐丹参酮与β-拉帕醌或bbi608联合后,显著增强了对nqo1高表达的miapaca-2细胞的细胞毒性,而对nqo1无表达的panc-1的细胞毒性无明显影响。隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达的胰腺癌细胞呈现了coalism、增效或协同作用。
[0088]
实验例4
[0089]
隐丹参酮与β-拉帕醌或bbi608联合对肝癌细胞的毒性
[0090]
利用mtt检测方法检测隐丹参酮与β-拉帕醌或bbi608联合对肝癌(hepg2和hep3b细胞)的细胞活力的影响。
[0091]
mtt检测法与实验例3提供的mtt检测法的操作基本一致。
[0092]
检测结果参见图4。其中,图4中a和b为隐丹参酮与β-拉帕醌联用、c和d为隐丹参酮与bbi608联用的mtt检测结果图。
[0093]
根据图4可知,隐丹参酮单独对hepg2和hep3b只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。隐丹参酮与β-拉帕醌或bbi608联合
后,显著增强了对nqo1高表达的hepg2细胞的细胞毒性,而对nqo1无表达的hep3b的细胞毒性无明显影响。隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达的肝癌细胞呈现了coalism、增效或协同作用。
[0094]
实验例5
[0095]
隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达结肠癌细胞、前列腺癌细胞、宫颈癌细胞、卵巢癌细胞、白血病细胞、恶性黑色素瘤细胞的毒性
[0096]
利用mtt检测方法检测隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达癌细胞(ht29、pc3、hela、ovcar3、k562、a375细胞)的细胞活力的影响。
[0097]
mtt检测法与实验例1提供的mtt检测法的操作基本一致,区别在于:ht29使用含1%fbs的5a培养基,pc3和k562细胞使用含1%fbs的rpmi1640培养基。ovcar3、hela及a375细胞使用含1%fbs的dmem培养基。hela细胞给与bbi608的浓度为(0nm,0.2μm,0.4μm,0.8μm,1.6μm,3.2μm)。
[0098]
检测结果参见图5,图6。其中,图5中a-c为隐丹参酮与β-拉帕醌联用、d-f为隐丹参酮与bbi608联用的mtt检测结果图。图6中a-c为隐丹参酮与β-拉帕醌联用、d-f为隐丹参酮与bbi608联用的mtt检测结果图。
[0099]
根据图5和图6可知,隐丹参酮单独对ht29、pc3、hela、ovcar3、k562、a375细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。隐丹参酮与β-拉帕醌或bbi608联合后,对这些nqo1高表达细胞显示出明显的细胞毒性。隐丹参酮与β-拉帕醌或bbi608联合对nqo1高表达的结肠癌、前列腺癌、宫颈癌、卵巢癌、恶性黑色素瘤和白血病细胞呈现了coalism、增效或协同作用。
[0100]
实验例6
[0101]
隐丹参酮与β-拉帕醌或bbi608联合对nqo1无表达癌细胞的毒性
[0102]
利用mtt检测方法检测隐丹参酮与β-拉帕醌或bbi608联合对nqo1无表达癌细胞(t24和mg-63细胞)的细胞活力的影响。
[0103]
mtt检测法与实验例1提供的mtt检测法的操作基本一致,区别在于:t24和mg-63细胞分别使用含1%fbs的5a培养基及含1%fbs的mem培养基。
[0104]
检测结果参见图7。其中,图7中a-c为隐丹参酮与β-拉帕醌联用、d-f为隐丹参酮与bbi608联用的mtt检测结果图。
[0105]
根据图7可知,隐丹参酮单独对t24和mg-63细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌与bbi608分别也只在较高浓度时才出现明显毒性作用。尤其是,隐丹参酮与β-拉帕醌或bbi608联合后,对这些nqo1无表达细胞的毒性未显示出明显的增强的作用(仅t24细胞在一个浓度时有增强作用)。隐丹参酮与β-拉帕醌或bbi608联合对nqo1低表达的t24和mg-63细胞未显示出协同增效作用。
[0106]
实验例7
[0107]
丹参酮iia与β-拉帕醌联合对nqo1高表达癌细胞的毒性
[0108]
利用mtt检测方法检测隐丹参酮的类似物丹参酮iia与β-拉帕醌联合对nqo1高表达的a549和mcf-7细胞的细胞活力的影响。
[0109]
mtt检测法与实验例1和2提供的mtt检测法的操作基本一致。区别在于:用2.5μm丹参酮iia联合以下浓度的β-拉帕醌(0μm,0.25μm,0.5μm,1μm,1.5μm,2μm)。
[0110]
检测结果参见图8。其中,图8中a和b为丹参酮iia与β-拉帕醌联用的mtt检测结果图。
[0111]
根据图8可知,丹参酮iia单独对a549和mcf-7细胞的细胞活力没有或只呈现微弱的毒性作用。β-拉帕醌也只在较高浓度时才出现明显毒性作用。丹参酮iia与β-拉帕醌联合后,对这些nqo1高表达细胞的毒性也显示出一定的增强作用,但增效作用比上述的隐丹参酮的作用弱。
[0112]
实验例8
[0113]
隐丹参酮联用不同浓度β-拉帕醌对nqo1高表达a549的杀伤作用
[0114]
分别用atp、ldh释放及pi(propidium iodide,碘化丙啶)染色检测方法检测隐丹参酮联用不同浓度β-拉帕醌对a549细胞活力的影响。
[0115]
atp法测试步骤:取对数生长期细胞按密度8
×
103细胞/孔接种于96孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,用2.5μm隐丹参酮联合不同浓度的β-拉帕醌(0μm,0.5μm,1μm)处理3h后,更换50μl新鲜培养基,每孔加入50μl atp检测溶液(promega),于室温摇床上孵育5min,按照试剂盒说明书,用酶标仪检测化学发光值。
[0116]
ldh释放检测方法的步骤:取对数生长期细胞按密度8
×
103细胞/孔接种于96孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,用2.5μm隐丹参酮联合不同浓度的β-拉帕醌(0μm,0.5μm,1μm)处理12h。到预定的检测时间点前1h,在“样品最大酶活性对照孔”中加入原培养液体积的10%的试剂盒提供的ldh释放试剂,反复吹打数次混匀,在培养箱中继续孵育1h。将培养板用多孔板离心机400g离心5min。分别取上清液80μl,加入到新的96孔板中,各孔分别加入40μl ldh检测工作液,混匀,室温避光孵育30min,用酶标仪490nm处测定吸光度。
[0117]
pi染色检测细胞死亡步骤:取对数生长期细胞按密度8
×
103细胞/孔接种于96孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,用2.5μm隐丹参酮联合不同浓度的β-拉帕醌(0μm,0.5μm,1μm)处理12h。加入50μg/ml的pi染色工作液,染色10min后拍照。
[0118]
检测结果参见图9。其中,图9中a为atp水平的检测结果图,b为ldh检测结果图,c为pi染色结果图。
[0119]
根据图9可知,隐丹参酮与不同浓度β-拉帕醌联用在a549细胞中能显著降低细胞内atp含量(a),增加ldh的释放(b),并显著增加pi染色阳性细胞数目(c)。
[0120]
实验例9
[0121]
隐丹参酮联用β-拉帕醌对a549细胞中nad
+
、nadh水平的影响与ci的计算
[0122]
步骤:取对数生长期细胞按密度4
×
105细胞/孔接种于6孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,用2.5μm隐丹参酮联合0.5μmβ-拉帕醌处理1h。随后,吸弃培养基,pbs洗2-3次,裂解后,吸取20μl裂解液至96孔板中,用作nad
+
和nadh的总量的测定;随后另取50μl裂解液60℃水浴30min,室温离心5min,取出20μl离心后的裂解液于上述96孔版中,用作nadh的含量测定;每孔加入90μl乙醇脱氢酶工作液,37℃避光孵育10min,随后每孔加入10μl显色液,37℃避光孵育30min,用酶标仪450nm处测定吸光度。
[0123]
使用compusyn软件计算隐丹参酮与不同浓度β-拉帕醌联用的ci值。
[0124]
ci值评价方法:(1)取a549对数生长期细胞按密度8
×
103细胞/孔接种于96孔板,5%co2,37℃过夜生长。在含1%fbs的rpmi1640培养基中,分别单独给与不同浓度隐丹参酮
(0μm,2.5μm,5μm,10μm,20μm),不同浓度β-拉帕醌(0μm,0.25μm,0.5μm,1μm,2μm,4μm)及2.5μm隐丹参酮联合不同浓度的β-拉帕醌(0μm,0.25μm,0.5μm,1μm,1.5μm,2μm)处理12h后,吸弃细胞培养液,每孔加入100μl mtt溶液(1mg/ml,低血清培养基稀释),置于37℃培养箱中继续孵育4h,吸弃mtt溶液,每孔加入100μl dmso溶解甲臜结晶,于室温摇床上孵育10min,用酶标仪检测od 570nm的吸光度,计算细胞存活率。(2)将所测得的细胞存活率与对应浓度输入compusyn软件进行ci值计算。
[0125]
检测结果参见图10。其中,图10中a和b为nad
+
及nadh检测结果图,c和d分别为mtt结果和软件计算的ci值。
[0126]
根据图10可知,隐丹参酮联合0.5μmβ-拉帕醌处理组能够显著降低nadh及总的nadh和nad
+
水平(a和b)。在隐丹参酮与β-拉帕醌浓度比在2.5μm/0.25-2μm的范围内显示了显著的协同效果(c),计算获得的ci值在0.1-0.8之间(d)。
[0127]
实验例10
[0128]
动物实验
[0129]
步骤:将dii荧光标记的a549细胞接种到斑马鱼幼鱼的卵黄囊中(100个/只),12h后使用0.25μm隐丹参酮,0.1μmβ-拉帕醌,0.25μm隐丹参酮联合0.1μmβ-拉帕醌及100μm顺铂处理,或给与0.25μm隐丹参酮,0.01μm bbi608,0.25μm隐丹参酮联合0.01μm bbi608及100μm顺铂处理,定期观察肿瘤面积,用药2天后拍照,统计计算。
[0130]
检测结果参见图11。其中,图11中a和d分别为隐丹参酮联合β-拉帕醌及bbi608实验中的代表性结果,b和e分别代表隐丹参酮联合β-拉帕醌及bbi608实验中荧光密度的统计结果,c和f分别为隐丹参酮联合β-拉帕醌及bbi608实验中荧光面积的统计结果。
[0131]
根据图11中a,b和c可知,0.25μm隐丹参酮联合0.1μmβ-拉帕醌可显著地抑制肿瘤生长,与100μm顺铂处理组作用相当,而单独隐丹参酮或单独β-拉帕醌处理组展现了较弱的抑制肿瘤生长的作用;根据图11中d,e和f可知,0.25μm隐丹参酮联合0.01μm bbi608可显著地抑制肿瘤生长,与100μm顺铂处理组作用相当,而单独隐丹参酮或单独bbi608处理组展现了较弱的抑制肿瘤生长的作用。
[0132]
因此,隐丹参酮与nqo1激活药物联用可以显著降低nqo1高表达肿瘤细胞的活力,但对nqo1低表达肿瘤细胞联用效果不明显。隐丹参酮与β-拉帕醌联用显著降低了nqo1高表达a549细胞的atp含量、增加了ldh的释放以及细胞膜的损伤,降低了nadh及nad
+
的水平,继而诱导肿瘤细胞死亡。此外,隐丹参酮与nqo1激活药物联用能够抑制nqo1高表达肿瘤的生长,降低肿瘤体积。因此,隐丹参酮可以作为nqo1高表达恶性肿瘤化疗增敏药物应用,进一步扩大了隐丹参酮的应用范围。
[0133]
综上所述,本发明实施例提供了隐丹参酮在制备nqo1高表达恶性肿瘤化疗增敏药物中的应用,将隐丹参酮和nqo1激活药物进行定量配伍联用,可爆发式地提高nqo1激活药物的作用效果,以高效低毒地治疗nqo1高表达恶性肿瘤;且上述联用的药物使用量远低于当前实验研究的药物使用量。另外,隐丹参酮是一种天然的二萜菲醌类化合物,主要来源于中药丹参,天然含量高且易于制备,毒性很低,应用性强。此外,nqo1在恶性肿瘤中的高表达非常普遍,如肺癌、胰腺癌、肝癌、结直肠癌等均有高表达。nqo1激活药物已经处于临床试验阶段,如果通过临床试验获批,将极大促进基于该靶点的恶性肿瘤的化疗药物开发。但nqo1激活药物的毒副作用是其剂量和药效限制的关键一环。因此,本发明实施例用隐丹参酮制
备的化疗增敏药物不仅高效低毒,而且专一性强、见效快;且隐丹参酮和nqo1激活药物联用在制备nqo1高表达恶性肿瘤治疗药物、耐药逆转药物或预后防复发的药物中具有重要的意义和广泛的应用前景,为靶向治疗nqo1高表达恶性肿瘤提供了新思路,并可能为临床上高效治疗nqo1高表达恶性肿瘤提供新技术、新方法和新手段。
[0134]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1