抑郁障碍的治疗的制作方法
抑郁障碍的治疗
1.本技术是申请日为2018年5月22日,申请号为201880048161.4,发明名称为“抑郁障碍的治疗”的申请的分案申请。
2.相关申请的交叉引用
3.本技术要求2017年5月24日提交的美国临时申请第62/510,481号和2018年3月23日提交的美国专利申请第15/933,673号的权益和优先权,这些申请通过引用以其整体并入本文。
技术领域
4.提供了可用于抑郁障碍的加波沙朵或其药学上可接受的盐的制剂。
5.背景
6.肠胃外剂型被意图作为注射剂或输注剂施用。常见的注射剂类型是静脉内(进入静脉)、皮下(在皮肤下)和肌内(进入肌肉)。输注剂通常通过静脉内途径给予。肠胃外制剂通常包含赋形剂以增强或维持活性成分的溶解度(增溶剂)和/或稳定性(缓冲剂、抗氧化剂、螯合剂、冷冻保护剂和冻干保护剂)。赋形剂在肠胃外制剂中也是重要的,以确保安全性(抗微生物防腐剂)、使注射后的疼痛和刺激最小化(张度剂)以及控制或延长药物递送(聚合物)。然而,赋形剂也可能产生负面作用,诸如药物溶解度、活性和/或稳定性的损失。
7.加波沙朵(4,5,6,7-四氢异噁唑并[5,4-c]吡啶-3-醇)(thip))在美国专利第4,278,676号、第4,362,731号、第4,353,910号以及wo 2005/094820中描述并且是一种选择性gabaa受体激动剂,具有对包含δ-亚基的gabaa受体的偏好。在20世纪80年代早期,加波沙朵是一系列初步研究(pilot study)的主题,这些初步研究测试了其作为镇痛药和抗焦虑药的功效,以及对迟发性运动障碍、亨廷顿氏病(huntington's disease)、阿尔茨海默病和痉挛状态的治疗的功效。在20世纪90年代,加波沙朵进入用于治疗失眠的后期开发阶段,但在三个月的功效研究中未能在入睡开始(sleep onset)和睡眠维持方面显示出显著作用。另外,具有药物滥用史的接受加波沙朵的患者经历了精神病学不良事件的急剧增加。由于这些负面结果,加波沙朵的研发被终止。
[0008]
抑郁障碍是跨越年龄和性别界限(gender line)影响个体的最盛行和普遍形式的精神疾病之一。本领域中,对可以提供对抑郁障碍的治疗的安全且有效的药物组合物仍然存在需求。抑郁障碍是以悲伤或嗜睡严重到足以干扰正常的日常功能为特征的情绪障碍。症状包括,仅举几例,持续一天的大部分时间或所有时间的情绪抑郁、焦虑或悲伤感觉、对所有或几乎所有活动的兴趣减少、导致体重增加或体重减轻的显著增加或降低的食欲、失眠、易怒、疲劳、无价值的感觉、无助的感觉、无法集中注意力(inability to concentrate),以及反复想到死亡或自杀。上文提到的症状的存在、严重程度、频率和持续时间基于具体病例而变化。要被诊断为患有抑郁症,这些症状通常存在至少两周。抑郁障碍包括重度抑郁障碍(mdd)、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神病性抑郁症、破坏性情绪失调障碍(disruptive mood dysregulation disorder)、难治性抑郁症和由于另一种医学状况引起的抑郁障碍。
[0009]
重度抑郁障碍(mdd),也被称为单相抑郁症或重度抑郁症,是一种以持续的悲伤感觉或对外界刺激缺乏兴趣为特征的抑郁障碍。在mdd中,抑郁症的症状,诸如上文描述的那些,可能每天或几乎每天显现,并且可能持续一整天。持续性抑郁障碍(也被称为心境恶劣(dysthymia))是一种可持续至少约两年的抑郁情绪。被诊断为患有持续性抑郁障碍的人可能具有重度抑郁症的发作以及症状不太严重的时期。产后抑郁症发生在妊娠分娩后。患有产后抑郁症的女性经历充分发展(full-blown)的重度抑郁症。伴随产后抑郁症的极度悲伤、焦虑和疲惫的感觉可能使这些新妈妈难以为她们自己和/或她们的婴儿完成日常的护理活动。经前焦虑障碍包括与月经周期相关的情绪和焦虑症状,在经前阶段期间发作并且具有月经后的无症状间隔期。这些症状在过去一年中的大多数月经周期期间存在。表现可能与经前综合征的那些表现相似,但更严重,引起临床上显著的不适和/或社会或职业功能的明显损伤。这种障碍可能开始于月经初潮后的任何时间;它可能在临近绝经时恶化,但通常在绝经后停止。季节性情感障碍(sad)被归类为直接由一年中所处的时间引发的抑郁症。它最常发生在秋季或冬季的月份,当阳光不容易获得时。精神病性抑郁症是伴随妄想或幻觉的抑郁症。妄想可能包括承认不可原谅的过错或罪行、具有不可治愈的或可耻的障碍或被迫害。破坏性情绪失调障碍(dmdd)是一种极度易怒、愤怒和频繁激烈的脾气爆发的儿童状况。dmdd症状通常超出是“喜怒无常的(moody)”儿童,即患有dmdd的儿童经历需要临床关注的严重损伤。由于另一种医学状况引起的抑郁障碍可以包括与慢性疼痛、慢性应激、创伤后应激障碍和/或疾病,例如癌症、帕金森氏病、肌萎缩性脊髓侧索硬化症和多发性硬化相关的那些障碍。
[0010]
其他医学状况包括fmr1前突变综合征。它由脆性x智力低下基因(fmr1)上的突变和脆性x智力低下蛋白的缺乏引起,这继而导致许多突触蛋白翻译的抑制减少。脆性x综合征(fxs)可能是智力残疾最常见的遗传原因,并且也是自闭症最常见的单基因原由。脆性x相关的震颤/共济失调综合征(fxtas)是一种迟发性障碍,通常发生在50岁后。fmr1基因中的突变增加了发展fxtas的风险。类似地,fmr1基因中的突变与脆性x相关的原发性卵巢功能不全(fxpoi)相关,脆性x相关的原发性卵巢功能不全(fxpoi)是卵巢不能以全部能力发挥功能的状况。fxtas和fxpoi两者都是fmr1前突变综合征的结果。fmr1突变涉及在fmr1基因内扩增的被称为cgg三联体重复的dna区段。在正常情况下,该dna区段被重复5次至约44次,其中45-54次重复被认为是过渡区。在患有fmr1前突变综合征的人中,cgg区段可以被重复55次至200次。多于200次重复的扩增(全突变)引起上文提到的脆性x综合征。几种另外的医学、情感和认知挑战,包括抑郁症也已被描述为在具有前突变的个体中以比在一般人群中预期的频率更高的频率发生。参见例如wheeler等人,journal of neurodevelopmental disorders 2014,6:30。
[0011]
难治性抑郁症发生在对以下耐药的患有抑郁症的患者中:标准药物治疗,包括三环类抗抑郁药、maoi、ssri、snri以及双重和三重吸收抑制剂和/或抗焦虑药物,以及非药物治疗诸如心理疗法、电惊厥疗法、迷走神经刺激和/或经颅磁刺激。对治疗耐受的患者可被认定为尽管经历了一种或更多种标准药物或非药物治疗但未能感受到一种或更多种抑郁症症状(例如,持续性焦虑或悲伤感觉、无助的感觉、绝望、悲观)减轻的患者。
[0012]
因此,本公开内容提供了可用于治疗抑郁障碍的药物组合物和方法,所述抑郁障碍诸如重度抑郁障碍、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神
病性抑郁症、破坏性情绪失调障碍、难治性抑郁症和由于另一种医学状况引起的抑郁障碍。
[0013]
概述
[0014]
本文提供了加波沙朵或其药学上可接受的盐的制剂,包括肠胃外制剂,用于治疗抑郁障碍。还提供了用加波沙朵的制剂治疗抑郁障碍的方法,所述抑郁障碍包括重度抑郁障碍、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神病性抑郁症、破坏性情绪失调障碍和/或由于另一种医学状况引起的抑郁障碍。本文还提供了治疗治疗耐药性患者中的抑郁症或治疗难治性抑郁症的方法。
[0015]
附图简述
[0016]
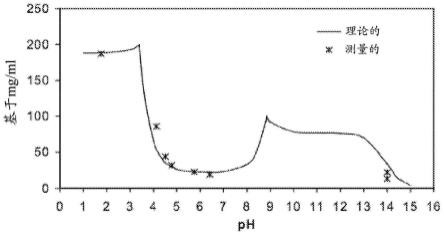
图1示出了加波沙朵在不同ph值的理论溶解度和测量溶解度。
[0017]
详细描述
[0018]
本文提供了加波沙朵及其药学上可接受的盐的药物组合物,用于治疗抑郁障碍,包括重度抑郁障碍、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神病性抑郁症、破坏性情绪失调障碍和/或由于另一种医学状况引起的抑郁障碍。本文还提供了治疗难治性抑郁症的方法,例如治疗不对和/或未曾对至少一种或至少两种其它抗抑郁化合物或治疗剂的进程充分响应的患有抑郁障碍的患者的方法。如本文使用的“抑郁障碍”包括难治性抑郁症。
[0019]
在实施方案中,提供了通过向患者施用加波沙朵或其药学上可接受的盐的药物组合物治疗抑郁障碍,例如重度抑郁障碍、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神病性抑郁症、破坏性情绪失调障碍和/或由于另一种医学状况引起的抑郁障碍的方法。在实施方案中,提供了通过向患者施用加波沙朵或其药学上可接受的盐的药物组合物治疗难治性抑郁症的方法。在实施方案中,本文提供了可用于通过向有相应需要的患者施用加波沙朵或其药学上可接受的盐的肠胃外组合物治疗抑郁障碍的方法。在实施方案中,本文提供了可用于通过向有相应需要的患者施用加波沙朵或其药学上可接受的盐的肠胃外组合物治疗难治性抑郁症的方法。
[0020]
本文描述了通过向有相应需要的患者施用包含加波沙朵或其药学上可接受的盐的药物组合物治疗抑郁障碍,包括重度抑郁障碍、持续性抑郁障碍、产后抑郁症、经前焦虑障碍、季节性情感障碍、精神病性抑郁症、破坏性情绪失调障碍、由于另一种医学状况引起的抑郁障碍和/或难治性抑郁症的方法。由于另一种医学状况引起的抑郁障碍包括与慢性疼痛、慢性应激、创伤后应激障碍、fmr1前突变综合征和/或疾病,例如癌症、帕金森氏病、肌萎缩性脊髓侧索硬化症和多发性硬化相关的那些障碍。
[0021]
在实施方案中,治疗重度抑郁障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗持续性抑郁障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗产后抑郁症的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗经前焦虑障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗季节性情感障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗精神病性抑郁症的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗破坏性情绪失调障碍的方法包括向有相应需要的患
者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗由于另一种医学状况引起的抑郁障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗由于fmr1前突变综合征引起的抑郁障碍的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗难治性抑郁症的方法包括向有相应需要的患者施用加波沙朵或其药学上可接受的盐的药物组合物。
[0022]
许多药物以固定剂量以规律的间隔被施用,以达到治疗功效。它的作用持续时间由其血浆半衰期反映。由于功效通常取决于在中枢神经系统内的充分暴露,因此施用具有短的半衰期的cns药物可能需要频繁的维持给药。有利地,本文公开了通过施用加波沙朵或其药学上可接受的盐来治疗抑郁障碍的方法。例如,在实施方案中,提供了治疗抑郁障碍的方法,该方法包括向有相应需要的患者施用包含约0.05mg至约75mg的加波沙朵或其药学上可接受的盐的药物组合物,其中该组合物提供的改善持续到施用至患者之后多于6小时。
[0023]
例如,剂量可以包括的加波沙朵或其药学上可接受的盐的量在约,例如,1mg至30mg、1mg至20mg、1mg至15mg、0.01mg至10mg、0.1mg至15mg、0.15mg至12.5mg、或0.2mg至10mg的范围,其中0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.5mg、1.0mg、1.75mg、2mg、2.5mg、2.75mg、3mg、3.5mg、3.75mg、4mg、4.5mg、4.75mg、5mg、5.5mg、6mg、6.5mg、7mg、7.5mg、8mg、8.5mg、9mg、10mg、11mg、12mg、15mg、20mg、25mg和30mg的剂量是具体的剂量实例。
[0024]
通常,加波沙朵或其药学上可接受的盐的剂量被每天一次或每天两次施用至有相应需要的患者。本文描述的方法和组合物可以提供降低的给药频率和减少的不良事件和/或增加的功效。在实施方案中,剂量是约,例如,0.1mg/天-20mg/天、或0.2mg/天-15mg/天、或0.5mg/天-10mg/天、或0.75mg/天-5mg/天,例如0.2mg/天、0.5mg/天、0.75mg/天、1mg/天、1.5mg/天、2mg/天、3mg/天、4mg/天、5mg/天、6mg/天、7mg/天、8mg/天、9mg/天、10mg/天、11mg/天、12mg/天、13mg/天、14mg/天、15mg/天、16mg/天、17mg/天、18mg/天、19mg/天或20mg/天。在实施方案中,加波沙朵或其药学上可接受的盐、或其衍生物或类似物在婴儿中以0.2mg至1mg的剂量施用或在成人中以1mg-20mg的剂量施用,每天一次。
[0025]
提供了通过向有相应需要的受试者施用有效量的加波沙朵、其药学上可接受的盐、其衍生物或类似物或者其组合治疗抑郁障碍的方法。有效量或治疗有效量可以是足以治疗、抑制或减轻抑郁障碍的一种或更多种症状,诸如降低以下的频率或严重程度的剂量:悲伤或嗜睡、情绪抑郁、焦虑或悲伤感觉、对所有或几乎所有活动的兴趣减少、导致体重增加或体重减轻的显著增加或降低的食欲、失眠、易怒、疲劳、无价值的感觉、无助的感觉、无法集中注意力以及反复想到死亡或自杀;或者足以提供期望的药理学和/或生理学作用,例如,降低、抑制或逆转一种或更多种引起神经功能异常的潜在病理生理学机制、增加多巴胺水平或信号传导或其组合的剂量。精确的剂量将根据多种因素,诸如受试者依赖性变量(例如,年龄、免疫系统健康、临床症状等)变化。
[0026]
在实施方案中,本文描述的方法有效降低、延缓或预防抑郁障碍的一种或更多种其他临床症状,抑郁障碍例如产后抑郁症、季节性情感障碍、持续性抑郁障碍、经前焦虑障碍、精神病性抑郁症、破坏性情绪失调障碍、难治性抑郁症和/或由于另一种医学状况引起的抑郁障碍。
[0027]
在实施方案中,提供了具有低剂量的加波沙朵或其药学上可接受的盐的组合物和治疗方法,使得为患者提供与抑郁障碍相关的一种或更多种有益效果,诸如减少的悲伤、减少的疲劳、增加的情绪、增加的注意力、减少的失眠、减少的易怒、减少的焦虑或悲伤感觉、减少的无价值的感觉、减少的无助的感觉、减少的自杀想法、增加的行为控制和/或增加的认知能力。本文提供了允许以潜在有限的或实质上很少的负面副作用(例如睡眠中断)有效治疗抑郁障碍的给药方案。例如,本文提供了治疗有相应需要的患者中的抑郁障碍的方法,该方法可以不引起睡眠中断。在实施方案中,本文描述的方法可以提供对抑郁障碍的有效治疗而不中断慢波睡眠。在实施方案中,提供了治疗抑郁障碍而不引起失眠或入睡困难的方法。在概念验证研究中,发现加波沙朵与艾司西酞普兰(escitalopram)(lexapro
tm
)(一种熟知的抗抑郁药)的组合在患有严重的重度抑郁障碍的患者的治疗中相比于单独的艾司西酞普兰未提供另外的益处。参见kasper等人,int j neuropsychopharmacol.2012jul;15(6):715-25。因此,本文描述的方法可以提供对抑郁障碍的治疗,这可以被认为是出人意料且意想不到的。
[0028]
本文描述的方法对于治疗儿童以及对于治疗在婴儿或儿童期间发作的障碍可以是有用的。在实施方案中,所公开的方法的受试者是学步幼儿(toddler)、学龄前儿童、学龄儿童、10至12岁之间的少年(tween)或青少年。在实施方案中,受试者为18岁或更年幼、12岁或更年幼、10岁或更年幼、8岁或更年幼、6岁或更年幼、4岁或更年幼、2岁或更年幼、1岁或更年幼。在实施方案中,受试者是超过十八岁的成人。
[0029]
在实施方案中,加波沙朵作为加波沙朵一水合物提供。本领域技术人员将容易地理解,药物组合物中活性成分的量将取决于所提供的加波沙朵的形式。例如,包含5.0mg、10.0mg或15.0mg加波沙朵的药物组合物对应于5.6mg、11.3mg或16.9mg加波沙朵一水合物。
[0030]
在实施方案中,加波沙朵是结晶的,诸如结晶盐酸盐、结晶氢溴酸盐或结晶两性离子一水合物。在实施方案中,加波沙朵作为结晶一水合物提供。
[0031]
在实施方案中,治疗抑郁障碍的方法包括向有相应需要的患者施用包含约0.05mg至约50mg加波沙朵或其药学上可接受的盐的药物组合物。在实施方案中,治疗抑郁障碍的方法包括向有相应需要的患者施用包含约0.1mg至约30mg加波沙朵或其药学上可接受的盐的药物组合物。
[0032]
在实施方案中,药物组合物包含0.1mg至25mg、0.1mg至20mg、0.1mg至15mg、0.5mg至25mg、0.5mg至20mg、0.5mg至15mg、1mg至25mg、1mg至20mg、1mg至15mg、1.5mg至25mg、1.5mg至20mg、1.5mg至15mg、2mg至25mg、2mg至20mg、2mg至15mg、2.5mg至25mg、2.5mg至20mg、2.5mg至15mg、3mg至25mg、3mg至20mg、3mg至15mg加波沙朵或其药学上可接受的盐。
[0033]
在实施方案中,药物组合物包含5mg至20mg、5mg至10mg、4mg至6mg、6mg至8mg、8mg至10mg、10mg至12mg、12mg至14mg、14mg至16mg、16mg至18mg、或18mg至20mg加波沙朵或其药学上可接受的盐。
[0034]
在实施方案中,药物组合物包含0.1mg、0.25mg、0.5mg、1mg、2.5mg、3mg、4mg、5mg、7mg、7.5mg、10mg、12.5mg、15mg、17.5mg、20mg加波沙朵或其药学上可接受的盐或者包含是此类剂量的倍数的量。在实施方案中,药物组合物包含2.5mg、5mg、7.5mg、10mg、15mg或20mg加波沙朵或其药学上可接受的盐。
[0035]
在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受
的盐的总量是1mg至50mg。在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受的盐的总量是1mg至20mg。在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受的盐的总量是5mg、10mg或15mg。在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受的盐的总量是1mg至50mg。在实施方案中,受试者可以以低剂量开始并且剂量递增。以这种方式,可以确定药物在受试者中是否被良好耐受。用于儿童的剂量可以比用于成人的剂量低。在实施方案中,用于儿童的加波沙朵的剂量可以是0.1mg/kg至1mg/kg。
[0036]
在实施方案中,本文提供了治疗抑郁障碍的方法,所述抑郁障碍例如mdd、产后抑郁症、季节性情感障碍、持续性抑郁障碍、经前焦虑障碍、精神病性抑郁症、破坏性情绪失调障碍、难治性抑郁症和/或由于另一种医学状况引起的抑郁障碍,该方法包括向有相应需要的患者施用包含加波沙朵或其药学上可接受的盐的药物组合物,其中该组合物提供抑郁障碍的至少一种症状的改善。在实施方案中,所提供的方法还可以出人意料地且意想不到地降低或预防有相应需要的受试者中的抑郁症症状。在实施方案中,所提供的方法可以降低或预防一种或更多种不同类型的抑郁障碍。
[0037]
在实施方案中,与不存在治疗(例如,治疗之前)相比,或与用可选择的常规治疗的治疗相比,本文描述的方法在治疗之后可以减少受试者中的抑郁障碍的一种或更多种症状。
[0038]
在实施方案中,本文提供了治疗抑郁障碍的方法,其中在向患者施用药物组合物施用之后,为患者提供了持续多于4小时的至少一种症状的改善。在实施方案中,根据本公开内容提供了在向患者施用药物组合物之后持续多于6小时的至少一种症状的改善。在实施方案中,根据本公开内容提供了在向患者施用药物组合物之后持续多于,例如8小时、10小时、12小时、15小时、18小时、20小时或24小时的至少一种症状的改善。在实施方案中,根据本公开内容提供了在向患者施用药物组合物之后持续至少例如8小时、10小时、12小时、15小时、18小时、20小时或24小时的至少一种症状的改善。在实施方案中,根据本公开内容提供了在向患者施用药物组合物之后持续12小时的至少一种症状的改善。
[0039]
在实施方案中,本文提供了治疗抑郁障碍的方法,所述抑郁障碍例如mdd、产后抑郁症、季节性情感障碍、持续性抑郁障碍、经前焦虑障碍、精神病性抑郁症、破坏性情绪失调障碍、难治性抑郁症和/或由于另一种医学状况引起的抑郁障碍,该方法包括向有相应需要的患者施用加波沙朵或其药用盐,其中组合物为患者提供次日功能的改善。
[0040]
在实施方案中,本文提供了治疗抑郁障碍的方法,所述抑郁障碍例如mdd、产后抑郁症、季节性情感障碍、持续性抑郁障碍、经前焦虑障碍、精神病性抑郁症、破坏性情绪失调障碍、难治性抑郁症和/或由于另一种医学状况引起的抑郁障碍,该方法包括向有相应需要的患者施用加波沙朵或其药用盐,其中在施用之后约2周或更短时间、1周或更短时间、1天或更短时间、或1小时或更短时间(例如15分钟或更短时间、半小时或更短时间)内使患者解除一种或更多种抑郁症症状。在实施方案中,这样的方法可以在施用之后约1天或更长时间、1周或更长时间、或2周或更长时间内使患者解除至少一种抑郁症症状。在实施方案中,本文提供了一种方法,该方法包括向患有抑郁症的患者肠胃外施用有效量的加波沙朵或其药用盐,其中与施用不同的抗抑郁化合物的同一患者相比,该患者的一种或更多种抑郁症症状在首次施用加波沙朵或其药用盐之后更早地基本上解除。
[0041]
在实施方案中,本文提供了治疗抑郁障碍的方法,其中在施用药物组合物之后约4小时,患者体内活性物质例如加波沙朵或其药学上可接受的盐的量小于所施用剂量的约75%。在实施方案中,本文提供了方法,其中在施用药物组合物之后约例如6小时、8小时、10小时、12小时、15小时或20小时,患者体内加波沙朵或其药学上可接受的盐的量小于约75%。
[0042]
在实施方案中,本文提供了治疗抑郁障碍的方法,其中在施用药物组合物之后约4小时,患者体内活性物质例如加波沙朵或其药学上可接受的盐的量小于所施用剂量的约80%。在实施方案中,本文提供了方法,其中在施用药物组合物之后约例如6小时、8小时、10小时、12小时、15小时或20小时,患者体内活性物质例如加波沙朵或其药学上可接受的盐的量小于所施用剂量的约80%。
[0043]
在实施方案中,本文提供了治疗抑郁障碍的方法,其中在施用药物组合物之后约4小时,患者体内活性物质例如加波沙朵或其药学上可接受的盐的量在所施用剂量的约65%至约85%之间。在实施方案中,在施用药物组合物之后约例如6小时、8小时、10小时、12小时、15小时或20小时之后,患者体内活性物质例如加波沙朵或其药学上可接受的盐的量在所施用剂量的约65%至约85%之间。
[0044]
在实施方案中,本文提供了治疗抑郁障碍的方法,该方法包括向有相应需要的患者施用包含活性物质例如加波沙朵或其药学上可接受的盐的药物组合物,其中该组合物提供具有小于约500ng/ml的c
max
的体内血浆概况(in vivo plasma profile)。在实施方案中,该组合物提供的改善持续到施用至患者之后多于6小时。
[0045]
在实施方案中,该组合物提供具有小于约,例如450ng/ml、400ng/ml、350ng/ml或300ng/ml的c
max
的体内血浆谱,并且其中该组合物提供患者的次日功能的改善。在实施方案中,该组合物提供具有小于约,例如250ng/ml、200ng/ml、150ng/ml或100ng/ml的c
max
的体内血浆谱,并且其中该组合物提供患者的次日功能的改善。
[0046]
在实施方案中,本文提供了治疗抑郁障碍的方法,该方法包括向有相应需要的患者施用药物组合物,其中该组合物提供具有小于约900ng
·
hr/ml的auc
0-∞
的一致体内血浆谱。在实施方案中,该组合物提供患者的次日功能的改善。在实施方案中,该组合物提供具有小于约,例如850ng
·
hr/ml、800ng
·
hr/ml、750ng
·
hr/ml或700ng
·
hr/ml的auc
0-∞
的体内血浆谱,并且其中该组合物提供患者的次日功能的改善。在实施方案中,该组合物提供在施用之后持续多于6小时的对一种或更多种症状的改善。
[0047]
在实施方案中,本文提供了治疗抑郁障碍的方法,该方法包括向有相应需要的患者施用包含活性物质例如加波沙朵或其药学上可接受的盐的药物组合物,其中该组合物提供具有小于约,例如650ng
·
hr/ml、600ng
·
hr/ml、550ng
·
hr/ml、500ng
·
hr/ml或450ng
·
hr/ml的auc
0-∞
的体内血浆谱。在实施方案中,该组合物提供具有小于约,例如400ng
·
hr/ml、350ng
·
hr/ml、300ng
·
hr/ml、250ng
·
hr/ml或200ng
·
hr/ml的auc
0-∞
的体内血浆谱。在实施方案中,该组合物提供具有小于约,例如150ng
·
hr/ml、100ng
·
hr/ml、75ng
·
hr/ml或50ng
·
hr/ml的auc
0-∞
的体内血浆谱。在实施方案中,在组合物被施用至患者之后,该组合物提供持续多于,例如4小时、6小时、8小时、10小时或12小时的患者的次日功能的改善。
[0048]
在实施方案中,本文提供了治疗抑郁障碍的方法,该方法包括向有相应需要的患者施用包含加波沙朵或其药学上可接受的盐的第一药物组合物和包含加波沙朵或其药学
上可接受的盐的第二药物组合物。在一些实施方案中,第二药物组合物提供具有比第一药物组合物小至少约20%的平均auc
0-∞
的体内血浆谱。
[0049]
在实施方案中,第一药物组合物和/或第二药物组合物被每天一次、每天两次或每天三次、或者每隔一天施用。在实施方案中,第一药物组合物或第二药物组合物在晚上被提供给患者。在实施方案中,第二药物组合物包含的加波沙朵的量是第一药物组合物中的加波沙朵或其药学上可接受的盐的量的至少三分之一。在实施方案中,第二药物组合物包含的加波沙朵的量是在第一药物组合物中提供的加波沙朵或其药学上可接受的盐的量的至少一半。
[0050]
在实施方案中,第一药物组合物或第二药物组合物在晚上一次且在早上一次被提供给患者。在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受的盐的总量是1mg至100mg。在实施方案中,在24小时时间段内被施用至受试者的加波沙朵或其药学上可接受的盐的总量是1mg至75mg。在实施方案中,在24小时时间段内被施用至受试者的活性物质,例如加波沙朵或其药学上可接受的盐的总量小于约75mg、50mg、25mg、20mg、10mg或5mg。在实施方案中,在24小时时间段内被施用至受试者的活性物质,例如加波沙朵或其药学上可接受的盐的总量小于15mg。
[0051]
在实施方案中,加波沙朵或其药学上可接受的盐可以与有效量的以下的一种或更多种组合施用:多巴胺活性抗抑郁剂、多巴胺活性增强剂、血清素-去甲肾上腺素再吸收抑制剂(snrt)、去甲肾上腺素再吸收抑制剂、单胺氧化酶抑制剂、三环类抗抑郁药、四环类抗抑郁药和选择性血清素再吸收抑制剂(ssri)。抗抑郁药包括但不限于西酞普兰(citalopram)、艾司西酞普兰(escitalopram)、帕罗西汀(paroxetine)、氟伏沙明(fluvoxamine)、舍曲林(sertraline)、去甲文拉法辛(desvenlafaxine)、度洛西汀(duloxetine)、左旋米那普仑(levomilnacipran)、米那普仑(milnacipran)、托芬那辛(tofenacin)、文拉法辛(venlafaxine)、维拉佐酮(vilazodone)、沃替西汀(vortioxetine)、依托哌酮(etoperidone)、曲唑酮(trazodone)、瑞波西汀(reboxetine)、维洛沙嗪(viloxazine)、阿米替林(amitriptyline)、氧阿米替林(amitriptylinoxide)、氯米帕明(clomipramine)、地昔帕明(desipramine)、二苯西平(dibenzepin)、二甲他林(dimetacrine)、度硫平(dosulepin)、多虑平(doxepin)、丙咪嗪(imipramine)、洛非帕明(lofepramine)、美利曲辛(melitracen)、硝沙西平(nitroxazepine)、去甲替林(nortriptyline)、诺昔替林(noxiptiline)、哌泊非嗪(pipofezine)、普罗替林(protriptyline)、曲米帕明(trimipramine)、阿莫沙平(amoxapine)、马普替林(maprotiline)、米安色林(mianserin)、米氮平(mirtazapine)、司普替林(setiptiline)、异卡波肼(socarboxazid)、苯乙肼(phenelzine)、反苯环丙胺(tranylcypromine)、司来吉兰(selegiline)、美曲吲哚(metralindole)、吗氯贝胺(moclobemide)、吡吲哚(pirlindole)、托洛沙酮(toloxatone)、氨磺必利(amisulpride)、鲁拉西酮(lurasidone)、喹硫平(quetiapine)、阿戈美拉汀(gomelatine)、二苯美伦(bifemelane)、安非他酮(bupropion)、氯胺酮(ketamine)、坦度螺酮(tandospirone)和替尼沙秦(teniloxazine)。
[0052]
在实施方案中,本文的组合物适合于肠胃外施用,包括,例如,肌内(i.m.)、静脉内(i.v.)、皮下(s.c.)、腹膜内(i.p.)或鞘内(i.t.)。本文的肠胃外组合物必须是无菌的,以便通过注射、输注或植入到身体内施用,并且可以被包装在单剂量或多剂量容器中。
[0053]
在实施方案中,提供了用于肠胃外施用至受试者的液体药物组合物,该液体药物组合物包含约0.005μg/ml至约500μg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,组合物包含例如约0.005μg/ml至约250μg/ml、约0.005μg/ml至约200μg/ml、约0.005μg/ml至约150μg/ml、约0.005μg/ml至约100μg/ml、或约0.005μg/ml至约50μg/ml的浓度的加波沙朵或其药学上可接受的盐。
[0054]
在实施方案中,组合物包含例如约0.05μg/ml至约50μg/ml、约0.1μg/ml至约50μg/ml、约0.05μg/ml至约25μg/ml、约0.05μg/ml至约10μg/ml、约0.05μg/ml至约5μg/ml、或约0.05μg/ml至约1μg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,组合物包含例如约0.05μg/ml至约15μg/ml、约0.5μg/ml至约10μg/ml、约0.5μg/ml至约7μg/ml、约1μg/ml至约10μg/ml、约5μg/ml至约10μg/ml、或约5μg/ml至约15μg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,用于肠胃外施用的药物组合物被配制为约,例如,10ml、20ml、25ml、50ml、100ml、200ml、250ml或500ml的总体积。在实施方案中,组合物被包含在袋、玻璃小瓶、塑料小瓶或瓶中。
[0055]
在实施方案中,提供了通过向有相应需要的受试者施用肠胃外药物组合物治疗抑郁障碍的方法,该肠胃外药物组合物包含约0.05μg/ml至约500μg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,组合物被置于密封的玻璃容器内。
[0056]
在实施方案中,提供了用于肠胃外施用的组合物,该组合物包含约0.05mg至约100mg加波沙朵或其药学上可接受的盐。在实施方案中,药物组合物包含约,例如,0.1mg至25mg、0.1mg至20mg、0.1mg至15mg、0.5mg至25mg、0.5mg至20mg、0.5mg至15mg、1mg至25mg、1mg至20mg、1mg至15mg、1.5mg至25mg、1.5mg至20mg、1.5mg至15mg、2mg至25mg、2mg至20mg、2mg至15mg、2.5mg至25mg、2.5mg至20mg、2.5mg至15mg、3mg至25mg、3mg至20mg、3mg至15mg加波沙朵或其药学上可接受的盐。
[0057]
在实施方案中,用于肠胃外施用的药物组合物包含约,例如,5mg至20mg、5mg至10mg、4mg至6mg、6mg至8mg、8mg至10mg、10mg至12mg、12mg至14mg、14mg至16mg、16mg至18mg、或18mg至20mg加波沙朵或其药学上可接受的盐。在实施方案中,用于肠胃外施用的药物组合物包含约,例如,0.1mg、0.25mg、0.5mg、1mg、2.5mg、3mg、4mg、5mg、7mg、7.5mg、10mg、12.5mg、15mg、17.5mg、20mg加波沙朵或其药学上可接受的盐或者包含是此类剂量的倍数的量。组合物可以被包含在袋、玻璃小瓶、塑料小瓶或瓶中。
[0058]
在实施方案中,用于肠胃外施用至受试者的药物组合物包含约0.005mg/ml至约500mg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,组合物包含例如,约0.05mg/ml至约50mg/ml、约0.05mg/ml至约100mg/ml、约0.005mg/ml至约500mg/ml、约0.1mg/ml至约50mg/ml、约0.1mg/ml至约10mg/ml、约0.05mg/ml至约25mg/ml、约0.05mg/ml至约10mg/ml、约0.05mg/ml至约5mg/ml、或约0.05mg/ml至约1mg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,组合物包含例如,约0.05mg/ml至约15mg/ml、约0.5mg/ml至约10mg/ml、约0.25mg/ml至约5mg/ml、约0.5mg/ml至约7mg/ml、约1mg/ml至约10mg/ml、约5mg/ml至约10mg/ml、或约5mg/ml至约15mg/ml的浓度的加波沙朵或其药学上可接受的盐。在实施方案中,用于肠胃外施用的药物组合物被配制为约,例如,10ml、20ml、25ml、50ml、100ml、200ml、250ml或500ml的总体积。在实施方案中,组合物被包装并且储存在袋、玻璃小瓶、塑料小瓶或瓶中。
[0059]
在实施方案中,提供了包含加波沙朵或其药学上可接受的盐的药物组合物,其中加波沙朵或其药学上可接受的盐以小于约1.0m的摩尔浓度存在。在实施方案中,加波沙朵或其药学上可接受的盐以大于,例如,约0.0001m、约0.001m、约0.01m、约0.1m、约0.2m、大于约0.5m、大于约1.0m、大于约1.2m、大于约1.5m、大于约1.75m、大于约2.0m、或大于约2.5m的摩尔浓度存在。在实施方案中,加波沙朵或其药学上可接受的盐以例如,约0.00001m至约0.1m之间、约0.01m至约0.1m之间、约0.1m至约1.0m之间、约1.0m至约5.0m之间、或约5.0m至约10.0m之间的摩尔浓度存在。在实施方案中,加波沙朵或其药学上可接受的盐以小于,例如,约0.01m、约0.1m、约1.0m、约5.0m、或约10.0m的摩尔浓度存在。
[0060]
在实施方案中,当例如在25℃的水中测量时,组合物中的加波沙朵或其药学上可接受的盐的溶解度大于,例如,约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约30mg/ml、约40mg/ml、约50mg/ml、约75mg/ml、约100mg/ml、约150mg/ml。
[0061]
在实施方案中,当例如在25℃的水中测量时,组合物中的加波沙朵或其药学上可接受的盐的溶解度在,例如,约1mg/ml至约50mg/ml之间、约5mg/ml至约50mg/ml之间、约10mg/ml至约50mg/ml之间、约20mg/ml至约50mg/ml之间、约20mg/ml至约30mg/ml之间或约10mg/ml至约45mg/ml之间。
[0062]
在实施方案中,提供了用于肠胃外施用的药物组合物,其中药物组合物稳定至少6个月。在实施方案中,本文的药物组合物在例如3个月或6个月之后呈现出加波沙朵或其药学上可接受的盐不多于约5%的减少。在实施方案中,加波沙朵或其药学上可接受的盐降解的量不多于约,例如,2.5%、1%、0.5%或0.1%。在实施方案中,加波沙朵或其药学上可接受的盐的降解在至少六个月内小于约,例如,5%、2.5%、1%、0.5%、0.25%、0.1%。
[0063]
在实施方案中,提供了用于肠胃外施用的药物组合物,其中药物组合物保持可溶。在实施方案中,提供了稳定的、可溶的、局部部位(local site)相容的和/或可即用的(ready-to-use)药物组合物。在实施方案中,本文的药物组合物是可即用的,用于直接施用至有相应需要的患者。
[0064]
本文的肠胃外组合物可以包含一种或更多种赋形剂,例如溶剂、溶解度增强剂、悬浮剂、缓冲剂、等渗剂、稳定剂或抗微生物防腐剂。当使用时,肠胃外组合物的赋形剂将不会不利地影响组合物中使用的加波沙朵或其药学上可接受的盐的稳定性、生物利用度、安全性和/或功效。因此,提供了肠胃外组合物,其中剂型的任何组分之间不存在不相容性。
[0065]
因此,在实施方案中,提供了加波沙朵或其药学上可接受的盐的肠胃外组合物,该肠胃外组合物包含稳定量的至少一种赋形剂。例如,赋形剂可以选自缓冲剂、增溶剂、张度剂、抗氧化剂、螯合剂、抗微生物剂、防腐剂及其组合。本领域技术人员将理解,赋形剂可以具有多于一种功能并且被分类到一个或更多个特定的组中。
[0066]
在实施方案中,提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂以小于约,例如,10%、5%、2.5%、1%、或0.5%的重量百分比(w/v)存在。在实施方案中,赋形剂以约,例如,1.0%至10%之间、10%至25%之间、15%至35%之间、0.5%至5%之间、0.001%至1%之间、0.01%至1%之间、0.1%至1%之间、或0.5%至1%之间的重量百分比存在。在实施方案中,赋形剂以约,例如,0.001%至1%之间、0.01%至1%之间、1.0%至5%之间、10%至15%之间或1%至15%之间的重量百分比存在。
[0067]
在实施方案中,提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组
合物,其中赋形剂以例如,约0.01:1至约0.45:1、约0.1:1至约0.15:1、约0.01:1至约0.1:1和约0.001:1至约0.01:1的赋形剂与加波沙朵或药学上可接受的盐的摩尔比存在。在实施方案中,赋形剂以约0.0001:1至约0.1:1或约0.001:1至约0.01:1的赋形剂与加波沙朵或药学上可接受的盐的摩尔比存在。
[0068]
在实施方案中,提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括稳定量的缓冲剂。缓冲剂可以用于维持药物组合物的ph,其中加波沙朵或其药学上可接受的盐保持可溶、稳定的和/或生理学相容的。例如,在实施方案中,肠胃外组合物包含缓冲剂,其中组合物保持稳定的而没有显著的加波沙朵降解。在实施方案中,期望添加缓冲剂以用于控制ph以增强稳定性,而不显著催化或降解加波沙朵或其盐和/或在输注后引起患者的疼痛。
[0069]
在实施方案中,缓冲剂可以是柠檬酸盐、磷酸盐、乙酸盐、酒石酸盐、碳酸盐、谷氨酸盐、乳酸盐、琥珀酸盐、碳酸氢盐缓冲剂及其组合。例如,柠檬酸钠、无水柠檬酸三钠、柠檬酸三钠二水合物、柠檬酸钠脱水物、三乙醇胺(tris)、柠檬酸三钠五水合物、柠檬酸三钠二水合物、乙酸、柠檬酸、谷氨酸、磷酸可以被用作缓冲剂。在实施方案中,缓冲剂可以是氨基酸、碱金属或碱土金属缓冲剂。例如,缓冲剂可以是乙酸钠或磷酸氢盐。
[0070]
在实施方案中,本文提供了加波沙朵或其药学上可接受的盐的肠胃外组合物,其中组合物的ph在约4.0至约8.0之间。在实施方案中,组合物的ph在例如,约5.0至约8.0之间、约6.0至约8.0之间、约6.5至约8.0之间。在实施方案中,组合物的ph在例如,约6.5至约7.5之间、约7.0至约7.8之间、约7.2至约7.8之间或约7.3至约7.6之间。在实施方案中,加波沙朵的水性溶液的ph是例如,约6.8、约7.0、约7.2、约7.4、约7.6、约7.7、约7.8、约8.0、约8.2、约8.4或约8.6。
[0071]
在实施方案中,提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括增溶剂。例如,根据本发明的增溶剂可以包括,例如,氢氧化钠、l-赖氨酸、l-精氨酸、碳酸钠、碳酸钾、磷酸钠和/或磷酸钾。组合物中的增溶剂的量将是足够的,使得溶液在所有浓度保持可溶性的,即不变浑浊和/或形成沉淀物。
[0072]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括颗粒形成抑制剂(particulate formation inhibitor)。颗粒形成抑制剂是指具有抑制颗粒在肠胃外组合物中形成的期望特性的化合物。本发明的颗粒形成抑制剂包括乙二胺四乙酸(edta)及其盐,例如,乙二胺四乙酸钙二钠盐(优选地作为水合物)、乙二胺四乙酸二铵盐(优选地作为水合物)、乙二胺四乙酸二钾盐(优选地作为二水合物)、乙二胺四乙酸二钠盐(优选地作为二水合物,并且如果期望,作为无水形式)、乙二胺四乙酸四钠盐(优选地作为水合物)、乙二胺四乙酸三钾盐(优选地作为二水合物)、乙二胺四乙酸三钠盐(优选地作为水合物)和乙二胺四乙酸二钠盐,usp(优选地作为二水合物)。在实施方案中,本文描述的药物组合物具有有效量的颗粒形成抑制剂。在实施方案中,赋形剂可以包括,例如,氨基酸;尿素;醇;抗坏血酸;磷脂;蛋白,诸如血清白蛋白、胶原蛋白和明胶;盐,诸如edta或egta和氯化钠;脂质体;聚乙烯吡咯烷酮;糖类,诸如右旋糖酐、甘露糖醇、山梨糖醇;和甘油;丙二醇和聚乙二醇(即peg-4000、peg-6000);甘油;甘氨酸和/或脂质。
[0073]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括增溶剂。例如,增溶剂可以包括,但不限于酸,诸如羧酸、氨基酸。
在其他实例中,增溶剂可以是饱和羧酸、不饱和羧酸、脂肪酸、酮酸、芳香族羧酸、二羧酸、三羧酸、α-羟基酸、氨基酸及其组合。
[0074]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括增溶剂诸如甲酸、乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、壬酸、癸酸、月桂酸、硬脂酸、丙烯酸、二十二碳六烯酸、二十碳五烯酸、丙酮酸、苯甲酸、水杨酸、醛糖二酸、草酸、丙二酸、苹果酸、琥珀酸、戊二酸、己二酸、柠檬酸、乳酸、丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸及其组合。
[0075]
在实施方案中,增溶剂选自乙酸、其盐及其组合(例如,乙酸/乙酸钠),柠檬酸、其盐及其组合(例如,柠檬酸/柠檬酸钠),dl精氨酸、l-精氨酸和组氨酸。在实施方案中,增溶剂是dl-精氨酸。在实施方案中,增溶剂是l-精氨酸。在实施方案中,增溶剂是乙酸/乙酸钠。在实施方案中,增溶剂是柠檬酸/柠檬酸钠。
[0076]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂使组合物等渗。本文的等渗药物组合物可以通过添加适当量的氯化钠、葡萄糖、果糖(laevulose)、右旋糖、甘露糖醇或氯化钾、或氯化钙、或葡萄糖酸葡庚糖酸钙(calcium gluconoglucoheptonate)或其混合物来实现。例如,赋形剂可以包括一种或更多种张度剂,诸如例如氯化钠、氯化钾、甘油、甘露糖醇和/或右旋糖。张度剂可以用于使组织损伤和刺激最小化、减少血细胞溶血、和/或防止电解质失衡。例如,肠胃外组合物可以是包含氯化钠的水性溶液,其中组合物是等渗的。在实施方案中,等渗剂是氯化钠。在实施方案中,等渗剂的浓度在约0.01重量百分比和约2.0重量百分比之间。在实施方案中,药物组合物可以包含多达约10%的等渗剂。在实施方案中,药物组合物可以包含多达约,例如,0.25%、0.5%、1%、2.5%的等渗剂。在实施方案中,药物中的等渗剂的量在约,例如,0.01%至1%之间、0.1%至1%之间、0.25%至1%之间、或0.5%至1%之间。
[0077]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括自由基拮抗剂。在实施方案中,自由基拮抗剂是抗坏血酸、抗坏血酸衍生物、具有至少一个巯基的有机化合物、烷基多羟基化的化合物和环烷基多羟基化的化合物及其组合。
[0078]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括选自以下的自由基清除剂:硫代乙醇酸、硫代乙酸、二硫苏糖醇、还原型谷胱甘肽、硫脲、α-硫代甘油、半胱氨酸(cystein)、乙酰半胱氨酸、巯基乙磺酸及其组合。
[0079]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括核黄素、二硫苏糖醇、硫代硫酸钠、硫脲、抗坏血酸、亚甲蓝、焦亚硫酸氢钠、亚硫酸氢钠、没食子酸丙酯乙酰半胱氨酸、苯酚、丙酮合硫酸氢钠(acetone sodium bisulfate)、抗坏血酸、抗坏血酸酯、丁基羟基苯甲醚(bha)、丁基羟基甲苯(bht)、半胱氨酸、去甲二氢愈创木酸(nordihydroguiaretic acid)(ndga)、单硫代甘油、亚硫酸氢钠、焦亚硫酸钠、生育酚和/或谷胱甘肽。
[0080]
在实施方案中,本文提供了包含加波沙朵或其药学上可接受的盐以及赋形剂的药物组合物,其中赋形剂包括防腐剂。在实施方案中,防腐剂选自苯扎氯铵、苄索氯铵
(benzethonium chloride)、苯甲醇、氯丁醇、氯甲酚、间甲酚、苯酚、硝酸苯汞、乙酸苯汞、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯和硫柳汞。在其他实施方案中,防腐剂选自由以下组成的组:苯酚、间甲酚、苯甲醇、对羟基苯甲酸酯(例如,甲酯、丙酯、丁酯)、苯扎氯铵、氯丁醇、硫柳汞、苯汞盐(例如,乙酸盐、硼酸盐或硝酸盐)及其组合。
[0081]
在实施方案中,本文的组合物包含共溶剂。在一些情况下,加波沙朵的溶解度可以远低于治疗剂量,并且因此可以使用共溶剂系统。共溶剂是可以用于实现足够高的溶解度并且可以增加稳定性的溶剂的混合物。例如,共溶剂可以是水混溶的有机溶剂,诸如乙醇、丙烯、乙二醇、capmul pg、丙二醇、甘油、聚乙二醇、山梨糖醇、二甲基乙酰胺和/或二甲基亚砜(dmso)。在实施方案中,共溶剂可以构成药物组合物的多达约75%。在其他实施方案中,所使用的共溶剂的量构成药物组合物的多达约,例如,1%、5%、10%、15%、25%、40%、50%。
[0082]
可以例如通过在无菌条件下在搅拌机中混合加波沙朵和一种或更多种赋形剂(例如,缓冲剂、增溶剂、张度剂、抗氧化剂、螯合剂、抗微生物剂和/或防腐剂),直到获得均匀的共混物来制备剂型。然后可以将预先灭菌的小瓶用适当量的无菌共混物填充。然后可以在施用之前将预定量的无菌共混物与溶剂例如水、盐水、约5%-10%的糖(例如葡萄糖、右旋糖)溶液及其组合混合。另外,溶液可以被冷冻并且在进一步处理之前解冻。
[0083]
赋形剂可以以固体或溶液形式使用。当以固体形式使用时,可以如上文描述的将赋形剂和加波沙朵混合在一起,并且然后在肠胃外施用之前添加溶剂。当以溶液形式使用时,加波沙朵可以在肠胃外施用之前与赋形剂的溶液混合。
[0084]
本文的包含加波沙朵的肠胃外溶液可以通过在肠胃外流体诸如d5w、蒸馏水、盐水或peg中混合所需量的加波沙朵并且将该溶液的ph调整在6.8-8之间来制备,所述加波沙朵可以在使用之前被纯化。该过程可以在室温进行,或者为了增加浓度,溶液可以被适当地加温。其他溶剂诸如peg 400、peg 600、聚丙二醇或其他二醇类可以用于增强溶解度。所得溶液在冷却至室温之后可以通过已知手段,诸如使用例如0.45微米过滤器的超滤或环氧乙烷处理或加热进行灭菌,并且可以被包装到适合于分配无菌肠胃外制剂的安瓿、小瓶或预填充的注射器中。
[0085]
当施用时,本文的肠胃外组合物在人类患者中提供约1小时或更多小时(例如,约1.5小时或更多小时)的加波沙朵的最大血浆浓度(t
max
)的时间。在实施方案中,人类患者中的加波沙朵的t
max
在例如约1小时至约5小时之间、约1小时至约4小时之间、约1小时至约3小时之间、约1小时至约2小时之间的范围。在实施方案中,观察到人类患者中加波沙朵的t
max
小于约1.5小时。在实施方案中,观察到人类患者中加波沙朵的t
max
小于约3小时。在输注完成后,测量最大血浆浓度的时间。
[0086]
在本文的实施方案中,剂型包括从约1mg至约500mg加波沙朵,其中所述剂型的肠胃外施用(例如,肌内、静脉内、皮下、腹膜内或鞘内)提供包括大于约25ng
·
hr/ml的平均auc
0-∞
的加波沙朵的体内血浆谱。在实施方案中,剂型的单剂量施用提供包括大于约,例如,50ng
·
hr/ml、75ng
·
hr/ml、150ng
·
hr/ml、250ng
·
hr/ml、500ng
·
hr/ml、1000ng
·
hr/ml、或1500ng
·
hr/ml的平均auc
0-∞
的加波沙朵的体内血浆谱。
[0087]
在实施方案中,剂型包括从约1mg至约500mg加波沙朵,其中所述剂型的施用提供包括小于约10000ng/ml的平均c
max
的加波沙朵的体内血浆谱。在实施方案中,组合物的单剂
量施用提供小于约,例如,5000ng/ml、2500ng/ml、1000ng/ml、500ng/ml、250ng/ml、或100ng/ml的平均c
max
的加波沙朵的体内血浆谱。
[0088]
在实施方案中,用于肠胃外施用的药物组合物包含加波沙朵或其药学上可接受的盐,其中肠胃外施用呈现出以下药代动力学谱:t
max
在施用肠胃外组合物之后约1分钟至约120分钟;随后是持续约90分钟至约360分钟的持续时间的至少50%c
max
的血浆药物浓度。在实施方案中,在肠胃外施用加波沙朵后,血浆药物浓度为至少50%c
max
,持续例如约10分钟至约60分钟、约15分钟至约90分钟、约30分钟至约120分钟、约60分钟至约180分钟、约90分钟至约180分钟的持续时间。
[0089]
在实施方案中,稳定的药物组合物在小瓶或安瓿中以适合于肠胃外施用的单位剂型提供,该稳定的药物组合物具有溶解于无菌水中以形成溶液的治疗有效量的加波沙朵或其药学上可接受的盐,其中组合物除了加波沙朵或其药学上可接受的盐以外基本上不含任何赋形剂、有机溶剂、缓冲剂、酸、碱、盐。在实施方案中,药物组合物保持充分溶解并且能够直接施用。在实施方案中,药物组合物能够在不存在惰性气氛的情况下储存至少6个月。
[0090]
在实施方案中,本文提供了在小瓶或安瓿中的适合于肠胃外施用的呈单位剂型的稳定的药物组合物,该稳定的药物组合物具有溶解于无菌水中以形成溶液的治疗有效量的加波沙朵或其药学上可接受的盐,其中组合物除了加波沙朵或其药学上可接受的盐以外不含任何赋形剂、有机溶剂、缓冲剂、酸、碱、盐。在实施方案中,药物组合物保持充分溶解并且能够直接施用。在实施方案中,药物组合物能够在不存在惰性气氛的情况下储存至少6个月。
[0091]
在实施方案中,适合于肠胃外施用的稳定的药物组合物包含在具有225mosm/kg和350mosm/kg之间的渗透压浓度(osmolarity)和在7.0和8.0之间的范围内的ph的水性溶液中的加波沙朵或其药学上可接受的盐。在实施方案中,水性溶液具有在270和310之间的渗透压浓度。在实施方案中,水性溶液具有在7.2和7.8之间的范围内的ph。
[0092]
除非另外定义,本文使用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常理解的相同的含义。
[0093]
加波沙朵可以使用药学上可接受的盐包括酸加成盐、两性离子水合物、两性离子无水物、盐酸盐或氢溴酸盐或者以两性离子一水合物的形式来配制以用于施用至患者。酸加成盐包括但不限于,马来酸、富马酸、苯甲酸、抗坏血酸、琥珀酸、草酸、双亚甲基水杨酸(bis-methylenesalicylic)、甲磺酸、乙二磺酸、乙酸、丙酸、酒石酸、水杨酸、柠檬酸、葡糖酸、乳酸、苹果酸、扁桃酸、肉桂酸、柠康酸、天冬氨酸、硬脂酸、棕榈酸、衣康酸、乙醇酸、对氨基苯甲酸、谷氨酸、苯磺酸或茶碱乙酸的加成盐、以及8-卤代茶碱,例如8-溴-茶碱。在其他合适的实施方案中,可以使用无机酸加成盐,包括但不限于盐酸、氢溴酸、硫酸、氨基磺酸、磷酸或硝酸的加成盐。
[0094]“赋形剂”是除了药物组合物的活性药物物质(例如,加波沙朵)以外的物质,其已经被适当地评价安全性并且被包含在药物递送系统中以在其制造期间辅助药物递送系统的加工;保护;支持;增强稳定性、生物利用度或患者可接受性;辅助产品鉴定;或增强药物递送系统在储存或使用期间的整体安全性和有效性的任何其他属性。
[0095]“稳定剂”或“稳定量”是指被包含在肠胃外组合物中的、提供足够的稳定性但不会不利地影响组合物中使用的加波沙朵或药学上可接受的盐的生物利用度、安全性和/或功
效的一种或更多种赋形剂的量。
[0096]“稳定”意指在指定的时间段之后,例如在3个月或6个月之后,基本上不存在加波沙朵或其药学上可接受的盐的降解。
[0097]“可溶性的”意指加波沙朵的溶液不变浑浊和/或溶液中基本上不存在沉淀物。
[0098]“充分可溶性的”意指颗粒含量足够低,并且该材料足够无菌,使得它可用于肠胃外施用。例如,液体组合物中的颗粒的数目应是,例如,在10ml体积的溶剂中少于6,000个10μm颗粒,优选地少于10,000个、少于5,000个、少于3,000个、少于1,000个、或少于400个10μm颗粒。在一些实例中,液体组合物中的颗粒的数目应是以10ml体积计少于1000个、少于600个或少于200个25μm颗粒。
[0099]
本文的“局部部位相容的”应意指组合物在注射或输注部位是耐受的,因此使副作用,诸如局部皮肤刺激或静脉刺激,包括输注部位的炎性反应最小化。本文的肠胃外组合物可以具有比常规产品更少的副反应,诸如皮肤刺激或静脉炎。
[0100]“治疗(treating)”或“治疗(treatment)”是指缓解或延缓可能罹患或易患疾病或状况但尚未经历或显示疾病或状况的临床或亚临床症状的受试者中的疾病或状况的临床症状的出现。在某些实施方案中,“治疗(treating)”或“治疗(treatment)”可以指防止可能罹患或易患疾病或状况但尚未经历或显示疾病或状况的临床或亚临床症状的受试者中的疾病或状况的临床症状的出现。“治疗(treating)”或“治疗(treatment)”还是指抑制疾病或状况,例如阻止或减少其发展或其至少一种临床或亚临床症状。“治疗(treating)”或“治疗(treatment)”还是指缓解疾病或状况,例如引起疾病或状况或至少一种其临床或亚临床症状的消退。对待治疗的受试者的益处可以是统计学上显著的、数学上显著的或至少是对受试者和/或医师可感知的。尽管如此,预防性(prophylactic)(预防性(preventive))和治疗性(therapeutic)(治愈性(curative))治疗是本发明的两个独立的实施方案。
[0101]“药学上可接受的”是指“通常被认为是安全的”,例如是生理学上可耐受的并且当被施用至人类时通常不产生过敏或类似的不良反应(untoward reaction),诸如胃部不适等的分子实体和组合物。在实施方案中,该术语是指由联邦或州政府的管理机构批准的、作为经历上市之前审查并且被fda批准的根据联邦食品、药物和化妆品法案的第204(s)和409节的gras清单或类似清单、美国药典或另一种公认的药典用于动物并且更特别地用于人类的分子实体和组合物。
[0102]
如本文使用的,“纯化的”是指在减少或消除不相关物质(即污染物,包括从其获得该物质的天然材料)的存在的条件下已经被分离的物质。如本文使用的,术语“基本上不含”在该物质的分析测试的上下文中可操作地使用。优选地,基本上不含污染物的纯化的物质是至少95%纯的;更优选地至少97%纯的,并且仍更优选地至少99%纯的。纯度可以例如通过色谱法或本领域已知的任何其他方法来评价。在实施方案中,纯化的意指污染物的水平低于监管机构对于安全施用至人类或非人类动物的可接受的水平。
[0103]
提及本文的组合物的“可即用的”应意指呈重构形式的制品(preparation),具有标准化的浓度和质量,预填充在单次使用容器诸如玻璃小瓶、输注袋或注射器中,准备用于直接施用至患者。
[0104]
提及本文的组合物的“直接施用”应意指立即施用,即不经进一步稀释、不与其他物质预混或不以其他方式改变组合物或组合物的制剂。这样的组合物通常从输注装置直接
排出并且经由血管通路入口或通过中心管线施用。
[0105]“用量(dosage)”意图包括按照μg/kg/天、μg/kg/hr、mg/kg/天或mg/kg/hr表示的制剂。用量是根据特定用量方案施用的成分的量。“剂量(dose)”是以单位体积或质量施用至哺乳动物的剂的量,例如以剂的mg或μg表示的绝对单位剂量。剂量取决于制剂中的剂的浓度,例如摩尔/升(m)、质量/体积(m/v)或质量/质量(m/m)。两个术语密切相关,因为特定用量起因于制剂的一个或更多个剂量(a dose or doses)的施用方案。任何情况下的特定含义从上下文中将是明显的。
[0106]
如本文使用的“约(about)”或“约(approximately)”意指在如由本领域普通技术人员确定的特定值的可接受误差范围之内,其将部分地取决于该值如何被测量或确定,即测量系统的局限性。例如,根据本领域的实践,“约”可以意指在3个或多于3个标准偏差内。可选择地,“约”可以意指给定值的多达20%、优选地多达10%、更优选地多达5%、且仍更优选地多达1%的范围。可选择地,特别地,关于生物系统或过程,该术语可以意指在值的数量级内,优选地在值的5倍内、且更优选地在值的2倍内。
[0107]“患者”和“受试者”在本文中可互换使用,并且包括但不限于灵长类动物、犬科动物(canines)、猪、有蹄类动物(ungulates)、啮齿类动物(rodents)、家禽(poultry)和鸟类(avian)。
[0108]
本文的实施例被包括用于说明的目的,并且不应被解释为限制本文的公开内容。
实施例
[0109]
实施例1
[0110]
加波沙朵的溶解度评价
[0111]
加波沙朵可以作为无水两性离子或作为一水合物存在。可以与溶液平衡存在的固相将必然取决于溶液中的水活度(water activity)。如果将过量的加波沙朵添加至水中,过量部分作为固体加波沙朵一水合物沉淀,但如果将过量的加波沙朵添加至具有低水分含量的有机溶剂诸如甲醇、乙醇和异丙醇中,固体沉淀物将是无水的加波沙朵。已经确定了加波沙朵相对于ph的溶解度,并所计算出的曲线和测量值在图1中示出。由于测量的最低水溶解度大于10mg/ml,溶解度不被认为是吸收的限制因素。
[0112]
由于溶解度被定义为与固体平衡的溶液中的浓度,在有机溶剂中确定的溶解度将是无水物而不是一水合物的溶解度。因此,确定了加波沙朵一水合物在水/有机溶剂混合物中的溶解度。作为加波沙朵一水合物的药物物质的浓度通过液相色谱法来确定。表1中提供了在水和水-有机溶剂混合物中测量的加波沙朵一水合物的溶解度,以mg/ml计。
[0113]
表1.加波沙朵一水合物在水和水-有机溶剂混合物中的溶解度
[0114]
溶剂溶解度(mg/ml)水21.41∶1水/甲醇(v/v)4.61∶1水/乙醇(无水)(v/v)3.21∶1水/乙腈(v/v)4.21∶1水/2-丙醇(v/v)2.2
[0115]
表2中提供了相对于ph的水溶解度,以每ml的加波沙朵一水合物的mg数测量。
[0116]
表2.加波沙朵一水合物在水中的溶解度
[0117]
ph溶解度(mg/m1)4.733.75.223.55.521.86.421.46.822.07.223.97.526.57.830.1
[0118]
实施例2
[0119]
评估加波沙朵的抗抑郁功效
[0120]
这项前瞻性研究将用来评估加波沙朵缓解成人的抑郁症症状的剂量依赖性能力。具体地,将加波沙朵与安慰剂进行比较,并且评估与安慰剂相比对肠胃外加波沙朵的响应的程度和速率,通过hamilton抑郁评定量表(hamilton rating scale for depression)(ham-d-17或ham-d-28)上的变化测量。另外的评估将基于montgomery-asberg抑郁评定量表(madrs-10或madrs-15)和临床总体印象-严重程度和改善(clinical global impressions
‑‑
severity and improvement)(cgi-s和cgi-i)。
[0121]
该试验将在6周内进行,其中双盲治疗基于对加波沙朵或安慰剂的随机分配。为了评估对加波沙朵的响应的持久性(longevity),被分配活性药物的患者将被随访6周,安慰剂组将被随访3周。入选标准包括18-65岁的年龄范围;书面知情同意书;患者必须满足目前对于mdd的dsm-iv标准(通过对dsm-iv的临床定式访谈(structured clinical interview for dsm-iv),scid-iv);在筛选和基线访问时抑郁症状学快速评定量表-自评版(quick inventory of depressive symptomatology
‑‑
self-rated)(qids-sr)的评分为至少12;已用ssri和多巴胺能剂的组合治疗;或用适当剂量的具有多巴胺能作用机制的抗抑郁药,包括snri、maoi、tca或安非他酮根据acnp task force指南(ref)已经实现≥3个月的缓解,基于满足mdd的dsm-iv标准,目前处于复发(relapse)或复发(recurrence),而在至少过去4周内未改变剂量。在基线访问期间,患者在之前的4周内进行了稳定剂量的抗抑郁方案。
[0122]
在患者通过签署知情同意文件同意参与研究后,将记录全部的病史和精神病史,并且由通过职业测试(board-certified)的精神病医生进行身体检查。将执行筛选评定量表(screen rating scale)。经筛选并符合标准的患者将被要求在一周后返回以进行基线访问,届时将用上文概述的研究设计,对患者随机进行用安慰剂或加波沙朵的双盲治疗。每周患者都将被评估。受试者将被分配连续顺序的随机化数字。随机化列表将由计算机生成的随机数字列表提供,并且由研究的临床医生维护。此外,任何副作用或不良事件的存在将用saftee-si仔细地记录。记录过早停止的原因,包括主要药物的变化。研究期间服用的所有伴随药物以及剂量信息和开始和停止的日期被记录在病例报告表中。药物管理和临床评定将由研究的临床医生执行。
[0123]
在双盲研究结束时,完成双盲阶段的响应者和无响应者都将具有接受用加波沙朵的开放标签(open-label)辅助治疗的选择。同意接受持续3个月的用加波沙朵的开放标签
治疗的受试者每月将由通过职业测试的精神病医生查看,直到随访阶段结束。
[0124]
主要功效测量是17项hamilton抑郁评定量表(ham-d-17)评分或28项hamilton抑郁评定量表(ham-d-28)中的变化。次要功效测量将包括cgi-严重程度与临床或cgi-改善(cgi-i)的变化。另外的功效测量将是montgomery-asberg抑郁评定量表(madrs-10或madrs-15)中的变化。
[0125]
根据研究时间表给予以下手段(instrument):dsm-iv临床定式访谈、抗抑郁治疗史问卷、17项或28项hamilton抑郁量表(ham-d-17或ham-d-28)、临床总体印象-严重程度和改善(cgi-s、cgi-i)、10项或15项montgomery-asberg抑郁评定量表(mads-10或mads-15)、抑郁症状学快速评定量表(自我报告)(qids-sr)、认知和身体功能问卷、性功能问卷、生活质量满意度问卷-简化形式(quality of life satisfaction questionnaire-short form)(q-les-q)和sheehan残疾量表。
[0126]
对患者进行检查以表明对治疗“突发性抑郁(breakthrough depression)”(“btd”)的具体功效,突发性抑郁(“btd”)为涵盖性术语,其包括抑郁症复发(relapse)(在抗抑郁药响应的6个月内抑郁发作)和复发(recurrence)(在响应的6个月后抑郁发作)。此外,对,正在进行含有被分配的前多巴胺能剂的抗抑郁治疗方案、被分配加波沙朵的治疗的患有btd的患者评估不良事件数与安慰剂对照相比的显著差异,通过saftee-si以及生活质量、享受和满意度问卷(quality of life,enjoyment,and satisfaction questionnaire)(q-les-q)和sheehan残疾量表(sds)评分的更大改善测量。
[0127]
实施例3
[0128]
评估加波沙朵对患有fmr1前突变综合征的患者的抗抑郁功效
[0129]
这项前瞻性研究将用来评估加波沙朵缓解患有fmr1前突变综合征的成人的抑郁症症状的剂量依赖性能力。具体地,将加波沙朵与安慰剂进行比较,并且评估与安慰剂相比对肠胃外加波沙朵的响应的程度和速率,通过hamilton抑郁评定量表(ham-d-17或ham-d-28)上的变化测量。另外的评估将基于montgomery-asberg抑郁评定量表(madrs-10或madrs-15)和临床总体印象-严重程度和改善(cgi-s和cgi-i)。
[0130]
该试验将在6周内进行,其中双盲治疗基于对加波沙朵或安慰剂的随机分配。为了评估对加波沙朵的响应的持久性,被分配活性药物的患者将被随访6周,安慰剂组将被随访3周。入选标准包括18-65岁的年龄范围;重复55次至200次之间的fmr1 cgg区段(使用常规程序对所有受试者中的fmr1 cgg重复长度进行定量);书面知情同意;患者必须满足目前对于mdd的dsm-iv标准(通过dsm-iv临床定式访谈scid-iv);在筛选和基线访问时抑郁症状学快速评定量表-自评版(qids-sr)的评分为至少12;已用ssri和多巴胺能剂的组合治疗;或用适当剂量的具有多巴胺能作用机制的抗抑郁药,包括snri、maoi、tca或安非他酮根据acnp task force指南(ref)已经实现≥3个月的缓解,基于满足mdd的dsm-iv标准,目前处于复发(relapse)或复发(recurrence),而在至少过去4周内未改变剂量。在基线访问期间,患者在之前4周内已处于稳定剂量的抗抑郁方案。
[0131]
在患者通过签署知情同意文件同意参与研究后,将记录全部的病史和精神病史,并且由通过职业测试的精神病医生进行身体检查。将执行筛选评定量表。经筛选并符合标准的患者将被要求在一周后返回以进行基线访问,届时将用上文概述的研究设计,对患者随机进行用安慰剂或加波沙朵的双盲治疗。每周患者都将被评估。受试者被分配连续顺序
的随机化数字。随机化列表将由计算机生成的随机数字列表提供,并且由研究的临床医生维护。此外,任何副作用或不良事件的存在将用saftee-si仔细地记录。将记录过早停止的原因,包括主要药物的变化。研究期间服用的所有伴随药物以及剂量信息和开始和停止的日期被记录在病例报告表中。药物管理和临床评定将由研究的临床医生执行。
[0132]
在双盲研究结束时,完成双盲阶段的响应者和无响应者都将具有接受用加波沙朵的开放标签辅助治疗的选择。同意接受持续3个月的加波沙朵的开放标签治疗的受试者每月将由委员会认证的精神病医生查看,直到随访阶段结束。
[0133]
主要功效测量是17项hamilton抑郁评定量表(ham-d-17)评分或28项hamilton抑郁评定量表(ham-d-28)中的变化。次要功效测量将包括cgi-严重程度与临床或cgi-改善(cgi-i)的变化。另外的功效测量将是montgomery-asberg抑郁评定量表(madrs-10或madrs-15)中的变化。
[0134]
根据研究时间表给予以下手段:dsm-iv临床定式访谈、抗抑郁治疗史问卷、17项或28项hamilton抑郁量表(ham-d-17或ham-d-28)、临床总体印象-严重程度和改善(cgi-s、cgi-i)、10项或15项montgomery-asberg抑郁评定量表(mads-10或mads-15)、抑郁症状学快速评定量表(自我报告)(qids-sr)、认知和身体功能问卷、性功能问卷、生活质量满意度问卷-简化形式(q-les-q)和sheehan残疾量表。
[0135]
本领域技术人员将认识到,或能够只是使用常规的实验确定本文描述的具体实施方案的许多等同方案。此类等同方案意图被权利要求书涵盖。
[0136]
本发明还涉及以下项目:
[0137]
1.一种治疗抑郁障碍的方法,所述方法包括向有相应需要的患者施用包含加波沙朵或其药学上可接受的盐的药物组合物。
[0138]
2.如项目1所述的方法,其中所述抑郁障碍是重度抑郁障碍。
[0139]
3.如项目1所述的方法,其中所述抑郁障碍是持续性抑郁障碍。
[0140]
4.如项目1所述的方法,其中所述抑郁障碍是产后抑郁症。
[0141]
5.如项目1所述的方法,其中所述抑郁障碍是经前焦虑障碍。
[0142]
6.如项目1所述的方法,其中所述抑郁障碍是季节性情感障碍。
[0143]
7.如项目1所述的方法,其中所述抑郁障碍是精神病性抑郁症。
[0144]
8.如项目1所述的方法,其中所述抑郁障碍是破坏性情绪失调障碍。
[0145]
9.如项目1所述的方法,其中所述抑郁障碍是难治性抑郁症。
[0146]
10.如项目1所述的方法,其中所述抑郁障碍是由于另一种医学状况引起的抑郁障碍。
[0147]
11.如项目10所述的方法,其中所述由于另一种医学状况引起的抑郁障碍是fmr1前突变综合征。
[0148]
12.如项目1所述的方法,其中所述药物组合物是肠胃外制剂。
[0149]
13.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含约0.005μg/ml至约500μg/ml加波沙朵或其药学上可接受的盐。
[0150]
14.如项目13所述的方法,其中用于肠胃外施用的所述药物组合物包含约0.05μg/ml至约100μg/ml加波沙朵或其药学上可接受的盐。
[0151]
15.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含约
0.005mg/ml至约500mg/ml加波沙朵或其药学上可接受的盐。
[0152]
16.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含摩尔浓度小于约10.0m的加波沙朵或其药学上可接受的盐。
[0153]
17.如项目12所述的方法,其中所述组合物中的加波沙朵或其盐的溶解度在约1mg/ml至约50mg/ml之间。
[0154]
18.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物稳定至少六个月。
[0155]
19.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物持续至少六个月呈现出加波沙朵或其药学上可接受的盐的量的不多于约5%的减少。
[0156]
20.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含至少一种赋形剂。
[0157]
21.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物呈现出的加波沙朵的最大血浆浓度的时间(t
max
)在施用所述组合物之后约1小时或更长时间。
[0158]
22.如项目12所述的方法,其中所述组合物的肠胃外施用提供包括大于约25ng
·
hr/ml的平均auc
0-∞
的加波沙朵的体内血浆谱。
[0159]
23.如项目12所述的方法,其中所述组合物的肠胃外施用提供包括小于约10000ng/ml的平均c
max
的加波沙朵的体内血浆谱。
[0160]
24.如项目12所述的方法,其中所述组合物的肠胃外施用呈现出包括以下的药代动力学谱:t
max
在施用所述肠胃外组合物之后约1分钟至约120分钟;随后是持续约90分钟至约360分钟的持续时间的至少50%c
max
的血浆药物浓度。
[0161]
25.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物被包含在袋、玻璃小瓶、塑料小瓶或瓶中。
[0162]
26.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物是水性的。
[0163]
27.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物是可即用的。
[0164]
28.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物是充分可溶的。
[0165]
29.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含选自由以下组成的组的赋形剂:缓冲剂、增溶剂、张度剂、抗氧化剂、螯合剂、抗微生物剂和防腐剂。
[0166]
30.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含以小于约10%的重量百分比(w/v)存在的赋形剂。
[0167]
31.如项目30所述的方法,其中所述赋形剂以约0.01%至约10%之间的重量百分比(w/v)存在。
[0168]
32.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含的赋形剂以约0.1:1至约0.25:1的赋形剂与加波沙朵或药学上可接受的盐的摩尔比存在。
[0169]
33.如项目29所述的方法,其中所述赋形剂包括稳定量的缓冲剂。
[0170]
34.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物在约4至约8的ph。
[0171]
35.如项目34所述的方法,其中用于肠胃外施用的所述药物组合物在约6至约8的ph。
[0172]
36.如项目26所述的方法,其中用于肠胃外施用的所述药物组合物的ph是从约6.8
至约7.8。
[0173]
37.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物被提供在密封的玻璃容器中。
[0174]
38.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物还包含在约0.01重量百分比和约2.0重量百分比之间的浓度的氯化钠。
[0175]
39.如项目38所述的方法,其中用于肠胃外施用的所述药物组合物包含约0.9重量百分比的浓度的氯化钠。
[0176]
40.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物被配制为选自由20ml、50ml和100ml组成的组的总体积。
[0177]
41.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物被制备为用于皮下、肌内、经皮或静脉内施用。
[0178]
42.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物包含赋形剂,其中所述赋形剂包括稳定量的增溶剂。
[0179]
43.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物在40℃一个月之后未示出可检测到的化学降解。
[0180]
44.如项目12所述的方法,其中用于肠胃外施用的所述药物组合物可以在环境条件下储存,并且持续至少约12周保持澄清和无色。
[0181]
45.如项目1所述的方法,其中所述组合物提供选自由以下组成的组的症状的频率降低:悲伤、嗜睡、情绪抑郁、焦虑感觉、对所有活动或几乎所有活动的兴趣减少、导致体重增加或体重减轻的显著增加或降低的食欲、失眠、易怒、疲劳、无价值的感觉、无助的感觉、无法集中注意力以及反复想到死亡或自杀。
[0182]
46.如项目1所述的方法,其中所述加波沙朵或其药学上可接受的盐每天一次、每天两次、每天三次、或每隔一天被施用。
[0183]
47.如项目1所述的方法,其中所述加波沙朵或其药学上可接受的盐与以下的一种或更多种一起被施用:西酞普兰、艾司西酞普兰、帕罗西汀、氟伏沙明、舍曲林、去甲文拉法辛、度洛西汀、左旋米那普仑、米那普仑、托芬那辛、文拉法辛、维拉佐酮、沃替西汀、依托哌酮、曲唑酮、瑞波西汀、维洛沙嗪、阿米替林、氧阿米替林、氯米帕明、地昔帕明、二苯西平、二甲他林、度硫平、多虑平、丙咪嗪、洛非帕明、美利曲辛、硝沙西平、去甲替林、诺昔替林、哌泊非嗪、普罗替林、曲米帕明、阿莫沙平、马普替林、米安色林、米氮平、司普替林、异卡波肼、苯乙肼、反苯环丙胺、司来吉兰、美曲吲哚、吗氯贝胺、吡吲哚、托洛沙酮、氨磺必利、鲁拉西酮、喹硫平、阿戈美拉汀、二苯美伦、安非他酮、氯胺酮、坦度螺酮和替尼沙秦。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1