用于治疗和/或预防HIV相关疾病的APTC偶联物及其应用的制作方法
用于治疗和/或预防hiv相关疾病的aptc偶联物及其应用
技术领域
1.本发明涉及生物医药领域,更具体地涉及一种用于治疗和/或预防hiv相关疾病的aptc偶联物及其应用。
背景技术:
2.艾滋病,全称是“获得性免疫缺陷综合征”(acquired immunodeficiency syndrome,aids),是由hiv病毒即人类免疫缺陷病毒引起的一种病死率极高的恶性传染病。hiv病毒侵入人体,能破坏人体的免疫系统,令感染者逐渐丧失对各种疾病的抵抗能力,最后导致死亡。目前还没有疫苗可以预防,也没有治愈这种疾病的有效药物或方法。
3.抗hiv抗体是通过生物技术从hiv感染者体内分离的一类抗体。该类抗体可以识别hiv病毒的包膜糖蛋白gp120,可直接中和hiv病毒降低体内hiv病毒水平,同时与gp120的结合能阻止病毒进入细胞,从而减少病毒在体内的复制,该抗体还能够通过激发体内其它免疫组分共同杀伤病毒。
4.在大多数病毒感染的早期过程中,抗病毒免疫通过模式识别受体被诱导,例如toll样受体(tlrs),存在于巨噬细胞和树突状细胞中,介导对外来病原体的识别和反应,刺激tlrs可以触发细胞因子分泌,树突状细胞(dc)成熟和抗原递呈,这样可以增强获得性免疫反应。除了增强抗病毒免疫,几种tlrs的激动剂,如tlr1/2、tlr5、tlr8和tlr9已被证明可以诱导潜伏hiv病毒的表达,通过触发这类先天性免疫受体,有助于暴露潜在已感染的细胞,并激活免疫应答从而杀死被感染细胞。
5.tlr7主要存在于浆细胞淋巴样dc(pdc)和b细胞的胞内体上。受体激动剂已被鉴定并作为疫苗佐剂、抗病毒剂和抗肿瘤疗法进行了研究。在tlr7受体被激活时,pdc分泌大量的i型干扰素(ifns),例如作为干扰素α(ifn-α)和ifn-ω,通过干扰素刺激基因(isg)促进细胞自主抗病毒防御。i型干扰素也可以作为先天性免疫和获得性免疫的桥梁,增强抗体依赖性免疫和刺激更强cd8+t细胞应答。
6.tlr激动剂是免疫检查点阻断疗法的潜在联合对象之一。单克隆抗体在抗病毒治疗中取得了突破性进展。adc药物兼具小分子药物的毒性和单克隆抗体的靶向性,由抗体,连接子和小分子激动剂三部分组成。
7.如果能够研究开发提供一种新型、有效、靶向性更精准、抗病毒活性更好的hiv抗体的adc药物,将有利于hiv的治疗,甚至有望实现功能性治愈。
技术实现要素:
8.本发明的目的在于提供一种用于治疗和/或预防hiv相关疾病的aptc偶联物及其应用,通过将具有中和hiv病毒作用的抗hiv抗体与tlr小分子激动剂偶联,实现在精准靶向抗原的基础上,激发更强的免疫应答,借助患者自身免疫系统杀死病毒和被感染细胞,从而获得更佳的艾滋病治疗效果。
9.本发明的目的在于提供一种用于治疗和/或预防hiv相关疾病的aptc偶联物及其
应用,具体为抗hiv抗体和tlr小分子激动剂联合抗hiv治疗用途以及提供抗hiv抗体和tlr小分子激动剂偶联物。
10.在本发明的第一方面,提供了一种抗体-药物偶联物或其药学上可接受的盐,所述的抗体-药物偶联物结构如式ⅰ所示:
11.ab-(j-u)n(ⅰ)
12.式中,
13.ab为抗hiv抗体;
14.u各自独立地为tlr小分子激动剂;
15.j为化学键或连接子;
16.n为0或正整数;
17.“‑”
为化学键或接头或连接子。
18.在另一优选例中,所述的抗hiv抗体包括单特异性抗体、双特异性抗体、多特异性抗体(如三特异性抗体)。
19.在另一优选例中,所述的抗hiv抗体包括:单克隆抗体、单链抗体(scfv)、纳米抗体。
20.在另一优选例中,所述的抗hiv抗体包括单价、二价或多价抗体。
21.在另一优选例中,所述的抗hiv抗体包括多聚体形式的抗体。
22.在另一优选例中,所述的抗hiv抗体特异性结合hiv。
23.在另一优选例中,所述的抗hiv抗体包括hiv单价抗体、二价抗体和/或多价抗体。
24.在另一优选例中,所述的hiv为人hiv或非人哺乳动物的hiv(如小鼠hiv)。
25.在另一优选例中,所述的抗hiv抗体为人或非人哺乳动物抗体。
26.在另一优选例中,所述非人哺乳动物选自下组:骆驼、羊驼、小鼠、食蟹猴。
27.在另一优选例中,所述的抗hiv抗体为抗hiv抗体或其衍生抗体。
28.在另一优选例中,所述的衍生抗体为针对抗hiv抗体的修饰改造,包括但不限于将抗hiv抗体连接fc片段、人血清白蛋白、聚乙二醇peg、形成二价抗体和/或多价抗体。
29.在另一优选例中,所述的抗体包括人源化抗体、骆驼源抗体、嵌合抗体。
30.在另一优选例中,所述的抗hiv抗体包含如seqidno:1所示的重链和如seqidno:2所示的轻链;或
31.所述的抗hiv抗体包含如seqidno:3所示的重链和如seqidno:2所示的轻链(“分子j”或“抗hiv抗体突变抗体j”);或其突变抗体。
32.在另一优选例中,所述突变抗体为10-1074或vrc01。
33.在另一优选例中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个(如1-3个,较佳地1-2个,更佳地1个)氨基酸并能保留与hiv结合能力的衍生序列。
34.在另一优选例中,所述的衍生序列包含与seqidno:1或seqidno:2具有至少80%、优选地至少90%、更优选地至少95%、甚至更优选地至少99%的序列相似性的氨基酸序列。
35.在另一优选例中,所述tlr小分子激动剂包括但不限于tlr1激动剂、tlr2激动剂、tlr3激动剂、tlr4激动剂、tlr5激动剂、tlr6激动剂、tlr7激动剂、tlr8激动剂和tlr9激动
剂。
36.在另一优选例中,n为所述抗体-药物偶联物中的药物平均偶联数量,较佳地n为1~9,优选为2.5~6.5,更优选为3.5~5.5。
37.在另一优选例中,所述的抗hiv抗体为hiv中和抗体或其衍生抗体。
38.在另一优选例中,所述的tlr小分子激动剂为:t-785:
[0039][0040]
或um01:
[0041][0042]
在另一优选例中,所述tlr小分子激动剂为t-785或um01的衍生化合物,包括但不限于在t-785或um01基础进行的一个或多个基团的替换、修饰或删除。
[0043]
在另一优选例中,所述tlr小分子激动剂为t-785或um01的多价化合物。
[0044]
在另一优选例中,所述tlr小分子激动剂(如t-785或um01)连接于抗hiv抗体的重链恒定区或重链可变结构域的末端氨基或侧链氨基。
[0045]
在另一优选例中,所述tlr小分子激动剂(如t-785或um01)连接于抗hiv抗体的巯基。
[0046]
在另一优选例中,所述的tlr小分子激动剂定点和/或随机地连接于所述的抗hiv抗体(即式i中,所述的u定点和/或随机地连接于j)。
[0047]
在另一优选例中,所述的u定点连接于j。
[0048]
在另一优选例中,所述连接子为mpa-aeea、mpa-aeea-val-cit-pabc或聚乙二醇peg。
[0049]
在另一优选例中,所述连接子为mpa-aeea、mpa-aeea-val-cit-pabc或聚乙二醇peg的衍生化合物,包括但不限于在其各自的基础上进行的一个或多个基团的替换、修饰或删除。
[0050]
在另一优选例中,所述连接子为mpa-aeea或mpa-aeea-val-cit-pabc。
[0051]
在另一优选例中,所述化学键的聚合度为大于等于1的正整数。
[0052]
在本发明的第二方面,提供了一种药物组合物,所述药物组合物包含:
[0053]
(a)如本发明的第一方面所述的抗体-药物偶联物或其药学上可接受的盐;
[0054]
(b)药学上可接受的载体。
[0055]
在另一优选例中,所述的药物组合物还包含:
[0056]
(c)其他生物活性的药物,如治疗和/或预防hiv的药物。
[0057]
在另一优选例中,所述治疗和/或预防hiv的药物选自下组中的任意一种或多种:
[0058]
agenerase、combivir、crixivan、emtriva、epivir、fortovase、hivid、invirase、kaletra、norvir、rescriptor、retrovir、reyataz、sustiva、trizivir、videxec、videx、viracept、viramune、viread、zerit和ziagen。
[0059]
在另一优选例中,所述的药物组合物包括单方药物、复方药物、或协同药物。
[0060]
在另一优选例中,所述的药物组合物的施用方式选自下组:皮下注射、皮内注射、肌肉注射、静脉注射、腹腔注射、微针注射、口服、或口鼻腔喷入和雾化吸入。
[0061]
在另一优选例中,所述药物组合物的施用方式为,将所述药物组合物和免疫细胞(如树突状细胞、自然杀伤细胞、淋巴细胞、单核/巨噬细胞、粒细胞等)共培养后,分离免疫细胞进行体内回输。
[0062]
在另一优选例中,所述药物组合物与用于治疗和/或预防hiv或hiv诱发疾病的一个或多个另外的化合物共同给药。
[0063]
在另一优选例中,所述化合物选自下组:三甲曲沙葡糖醛酸盐(治疗卡氏肺孢子虫肺炎);更昔洛韦(治疗巨细胞病毒性视网膜炎);喷雾型喷他脒(治疗卡氏肺孢子虫肺炎);红细胞生成素(治疗齐多夫定相关性贫血);阿托伐醌(治疗卡氏肺孢子虫肺炎);利福布汀(治疗鸟分枝杆菌);v1stide(治疗复发性巨细胞病毒性视网膜炎);serostim(治疗aids相关的消瘦)、或其组合。
[0064]
在另一优选例中,所述的药物组合物的剂型选自下组:液态、固体、或凝胶态。
[0065]
在另一优选例中,所述的药物组合物用于治疗和/或预防hiv相关疾病。
[0066]
在本发明的第三方面,提供了一种免疫偶联物,所述的免疫偶联物含有:
[0067]
(a)如本发明的第一方面所述的抗体-药物偶联物;和
[0068]
(b)其他偶联部分。
[0069]
在另一优选例中,所述其他的偶联部分选自下组:小分子化合物、peg、荧光素、放射性同位素、造影剂、脂肪酸链、蛋白片段、或其组合。
[0070]
在另一优选例中,所述的组分(a)和(b)可操作性连接。
[0071]
在另一优选例中,所述的偶联部分包括化学标记和生物标记。
[0072]
在另一优选例中,所述化学标记选自同位素、免疫毒素和/或化学药物。
[0073]
在另一优选例中,所述生物标记选自生物素、亲和素或酶标记。
[0074]
在另一优选例中,所述小分子化合物选自治疗hiv的药物或毒素。
[0075]
在另一优选例中,所述的放射性同位素包括:
[0076]
(i)诊断用同位素,所述的诊断用同位素选自下组:tc-99m、ga-68、f-18、i-123、i-125、i-131、in-111、ga-67、cu-64、zr-89、c-11、lu-177、re-188,或其组合;和/或
[0077]
(ii)治疗用同位素,所述的治疗用同位素选自下组:lu-177、y-90、ac-225、as-211、bi-212、bi-213、cs-137、cr-51、co-60、dy-165、er-169、fm-255、au-198、ho-166、i-125、i-131、ir-192、fe-59、pb-212、mo-99、pd-103、p-32、k-42、re-186、re-188、sm-153、ra223、ru-106、na24、sr89、tb-149、th-227、xe-133、yb-169、yb-177,或其组合。
[0078]
在另一优选例中,所述的放射性同位素包括但不限于碘131、铟111和镥177。
[0079]
在另一优选例中,所述的造影剂用于mri或ct。
[0080]
在另一优选例中,所述的蛋白片段包括但不限于抗体fc、生物素、亲和素、hrp、抗体、酶、细胞因子及其他生物活性蛋白或多肽。
[0081]
在另一优选例中,所述偶联部分为可检测标记物。
[0082]
在另一优选例中,所述偶联部分选自下组:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂,或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2等)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))或任何形式的纳米颗粒。
[0083]
在本发明的第四方面,提供了一种制备如本发明的第一方面所述的抗体-药物偶联物的方法,所述方法包括步骤:
[0084]
(1)用抗hiv抗体与还原试剂在缓冲液中反应,得到经还原后的抗hiv抗体;
[0085]
(2)用tlr小分子激动剂与步骤(1)中得到的经还原后的抗hiv抗体在缓冲液与有机溶剂混合液中进行交联(偶联),得到如本发明的第一方面所述的抗体-药物偶联物。
[0086]
在另一优选例中,所述步骤(1)中所述抗体经还原试剂还原,从而使抗体链间二硫键被还原,产生巯基基团。
[0087]
在另一优选例中,所述步骤(1)中还原试剂为三(2-羧乙基)膦盐酸盐(tcep)、beta-巯基乙醇、beta-巯基乙胺盐酸盐、或二硫苏糖醇(dtt)。
[0088]
在本发明的第五方面,提供了一种药盒,所述的药盒包括:
[0089]
(1)第一容器,以及位于所述第一容器内的抗hiv抗体,以及药学上可用的载体;
[0090]
(2)第二容器,以及位于所述第二容器内的tlr激动剂,以及药学上可用的载体;
[0091]
以及(3)任选的使用说明书。
[0092]
在本发明的第六方面,提供了一种治疗hiv的方法,包括:向有需要的受试者施用如本发明的第一方面所述的抗体偶联药物。
[0093]
在本发明的第七方面,提供了上述的抗体-药物偶联物、药物组合物或免疫偶联物制备用于治疗和/或预防hiv相关疾病的药物中的应用。
[0094]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0095]
图1显示了还原后的抗hiv抗体或其突变抗体j(ls突变)与tlra-linker-1/2/3/4的连接示意图。
[0096]
图2显示了样品对hiv-1重组病毒caan5342的抑制活性。
[0097]
图3显示了样品对hiv-1重组病毒caan5342的抑制活性。
[0098]
图4显示了样品对hiv-1重组病毒cne15的抑制活性。
[0099]
图5显示了样品对hiv-1重组病毒cne15的抑制活性。
[0100]
图6显示了0.5μm化合物作用下ifn-γ的释放。
[0101]
图7显示了0.025μm化合物作用下ifn-γ的释放。
[0102]
图8显示了待测物溶剂对hl2/3+pbmc细胞活性的影响。
[0103]
图9显示了化合物对hl2/3+pbmc细胞活性的影响。
具体实施方式
[0104]
发明人通过广泛而深入的研究,首次筛选并鉴定了一种抗hiv抗体,并开发了一种抗hiv抗体和tlra药物偶联物。具体地,本发明的双靶向抗体偶联药物具有优异的抗hiv病毒活性。本发明开发的抗hiv抗体和tlra药物偶联物表现出突出的抗hiv效果和新颖的作用机制,具备临床开发和应用价值。在此基础上完成了本发明。
[0105]
术语
[0106]
本发明的tlr受体及tlr受体激动剂
[0107]
如本文所用,术语“tlr受体”是指toll样受体,是生物体免疫系统中一类重要的固有免疫模式识别受体,可特异性的识别病原微生物进化过程中相对保守的抗原分子(或称为病原相关分子模式),实现病原微生物入侵的有效检测和固有免疫应答诱导。在人体中已发现十种tlr受体,即tlr1-tlr10,其中tlr3、tlr7、tlr8、tlr9定位于细胞的内体、溶酶体膜上,其余定位于细胞质膜上。在本发明实施方式中,优选tlr作为药物分子靶标之一。tlr分子的天然配体为单链线性rna。
[0108]
如本文所用,术语“tlr受体激动剂”、“tlr激动剂”、“tlra(toll-like receptor agonist)”、可互换使用,是指可以特异性结合并激活tlr受体的大分子(蛋白质或核酸)或小分子激动剂,促进tlr受体的下游信号的转导,实现固有免疫细胞的活化。在本发明实施方式中,优选tlr小分子激动剂构建抗体偶联药物。除本发明实施方式中应用的t-785外,可用的tlr激动剂还包括um01等。
[0109]
抗体
[0110]
如本文所用,术语“本发明抗体”、“本发明的靶向hiv的抗体”、“本发明的抗hiv抗体”可互换使用,均指特异性识别和结合于hiv(包括人或鼠hiv)的抗体。特别优选的是重链的氨基酸序列如seq id no:1所示、轻链序列如seq id no:2所示的抗hiv抗体。
[0111]
如本文所用,术语“本发明抗体偶联药物”、“本发明的双靶向抗体偶联药物”、“本发明的抗hiv抗体和tlra药物偶联物”,可互换使用,均指特异性识别和结合于hiv(包括人或鼠hiv)的抗体及其衍生蛋白偶联tlr激动剂形成的新型药物分子。抗体偶联药物中的抗体特别优选的是重链的氨基酸序列如seq id no:1所示、轻链序列如seq id no:2所示的抗hiv抗体。
[0112]
应理解,本发明的抗hiv抗体是采用其他具有类似功能的抗体,比如抗体10-1074,vrc01等(cristina possas,et al.hiv cure:global overview of bnabs'patents and related scientific publications.expert opin ther pat.2018jul;28(7):551-560)。
[0113]
在本发明的另一个优选实施例中,所述抗体是在如seq id no:1所示、轻链序列如seq id no:2所示的抗hiv抗体的基础上突变获得的突变抗体,以下称为“分子j”或“抗hiv抗体突变抗体j”,其重链的氨基酸序列如seq id no:3所示,轻链的氨基酸序列如seq id no:2所示。
[0114]
本发明中的“抗hiv抗体”,是利用一系列生物技术制备而来。具体地,流式细胞术分选患者单个b淋巴细胞获得抗体序列,从单个b淋巴细胞中获得单克隆抗体的mrna,通过pcr技术反转录成cdna,再通过测序技术获得单克隆抗体的重链和轻链的dna序列。通过基
因合成技术合成重、轻链dna,再通过酶切酶连技术将重、轻链dna分别克隆进表达载体中,制备表达质粒。将表达质粒转染进cho稳定细胞系,通过msx加压筛选使重轻链重组进cho细胞基因组,构建稳定表达细胞系。通过细胞传代培养技术构建主细胞库和工作细胞库。先后进行上游、下游工艺开发,优化抗体表达的上游细胞培养条件及下游纯化条件。经过一系列方法验证及微生物验证后进行无菌制剂灌装。
[0115]
如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
[0116]
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
[0117]
如本领域技术人员所知,免疫偶联物及融合表达产物包括:药物、毒素、细胞因子(cytokine)、放射性核素、酶和其他诊断或治疗分子与本发明的抗体或其片段结合而形成的偶联物。
[0118]
如本文所用,术语“抗体偶联药物”与“抗体药物偶联物”可互换使用。如本领域技术人员所知,抗体偶联物是一种特殊的抗体药物偶联药物形式,其是将抗体或者衍生蛋白偶联药物、毒素、细胞因子、放射性核素、酶和其他诊断或治疗分子形成的药物分子形式,可用于抗病毒治疗、肿瘤治疗、药物递送和体内成像等,具有广阔的临床应用价值。
[0119]
如本文所用,术语“重链可变区”与“v
h”可互换使用。
[0120]
如本文所用,术语“可变区”与“互补决定区(complementarity determining region,cdr)”可互换使用。
[0121]
在本发明的一个优选的实施方式中,所述抗体的重链可变区包括三个互补决定区cdr1、cdr2、和cdr3。
[0122]
在本发明的一个优选的实施方式中,所述抗体的重链包括上述重链可变区和重链恒定区。
[0123]
此外,在本发明中,抗体的fc区段可以是野生型或突变型,例如含有ls等突变,从而延长半衰期和/或增加adcc/cdc活性。
[0124]
在本发明中,术语“本发明抗体”、“本发明的抗hiv抗体”、“本发明蛋白”、或“本发明多肽”可互换使用,都指特异性结合hiv的多肽,例如具有重链可变区的蛋白或多肽。它们
可含有或不含起始甲硫氨酸。
[0125]
本发明还提供了具有本发明抗体的其他蛋白质或融合表达产物。具体地,本发明包括具有含可变区的重链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该可变区与本发明抗体的重链可变区相同或至少90%同源性,较佳地至少95%同源性。
[0126]
一般,抗体的抗原结合特性可由位于重链可变区的3个特定区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
[0127]
本发明抗体的重链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的抗体重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。
[0128]
本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
[0129]
如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
[0130]
本发明抗体指具有hiv结合活性的、包括上述cdr区的多肽。该术语还包括具有与本发明抗体相同功能的、包含上述cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。
[0131]
该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。
[0132]
本发明还提供了其他多肽,如包含抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约50个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。
[0133]
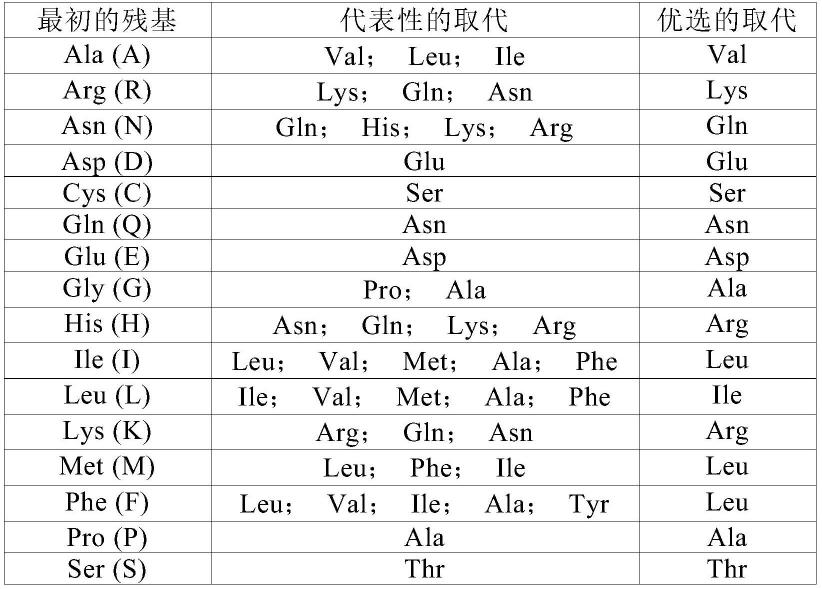
在本发明中,本发明抗体还含有保守性变异体,指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近
的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
[0134]
表a
[0135][0136][0137]
本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。
[0138]
编码本发明的抗体的多核苷酸包括:只编码本发明抗体的编码序列;本发明抗体的编码序列和各种附加编码序列;本发明抗体的编码序列(和任选的附加编码序列)以及非编码序列。
[0139]
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0140]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与成熟多肽有相同的生物学功能和活性。
[0141]
本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工
合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。
[0142]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。
[0143]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0144]
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0145]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293细胞的动物细胞等。
[0146]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。
[0147]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0148]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0149]
本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
[0150]
用于诊断目的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
[0151]
可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素;2.生物毒;3.细胞因子如il-2等;4.金纳米颗粒/纳米棒;5.病毒颗粒;6.脂质体;7.纳米磁粒;8.药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));9.疗剂(例如,顺铂)或任何形式的纳米颗粒等。
[0152]
连接子
[0153]
按照在细胞内药物释放的机制,“连接子”或“抗体药物偶联物的连接子”可被分为
两类:不可断裂连接子和可断裂连接子。
[0154]
对于含有不可断裂连接子的抗体药物偶联物,其药物释放机制为:偶联物与抗原结合并被细胞内吞后,抗体在溶酶体中被酶解,释放出由小分子药物,连接子,和抗体氨基酸残基共同组成的活性分子。由此带来的药物分子结构改变并不减弱其细胞毒性,但由于活性分子是带电荷的(氨基酸残基),从而导致其不能渗入邻近细胞。因此,此类活性药物不能杀死邻近不表达靶向抗原(抗原阴性细胞)的肿瘤细胞(旁观者效应,bystander effect)。
[0155]
可断裂连接子,顾名思义,可以在目标细胞内断裂并释放出活性药物(小分子药物本身)。可断裂连接子可分为两个主要的类别:化学不稳定连接子和酶不稳定连接子。化学不稳定连接子可以由于血浆和细胞质性质的不同而选择性的断裂。这样的性质包括ph值,谷胱甘肽浓度等。对ph值敏感的连接子,通常又称为酸断裂连接子。这样的连接子在血液的中性环境下相对稳定(ph7.3-7.5),但是在弱酸性的内涵体(ph5.0-6.5)和溶酶体(ph4.5-5.0)内将会被水解。第一代的抗体药物偶联物大多应用这类连接子,例如腙,碳酸酯,缩醛,缩酮类。由于酸断裂连接子有限的血浆稳定性,基于此类连接子的抗体药物偶联物通常具有较短的半衰期(2-3天)。这种较短的半衰期在一定程度上限制了ph敏感连接子在新一代抗体药物偶联物中的应用。
[0156]
对于谷胱甘肽敏感的连接子,又称二硫键连接子。药物释放是基于细胞内谷胱甘肽的高浓度(毫摩尔范围)与血液中相对较低的谷胱甘肽浓度(微摩尔范围)差异引起的。对于肿瘤细胞而言尤其如此,其低含氧量导致还原酶的活性增强,因而导致更高的谷胱甘肽浓度。二硫键具有热力学稳定性,因此在血浆中具有较好的稳定性。
[0157]
酶不稳定连接子,如肽连接子,能够更好地控制药物释放。肽连接子能够被溶酶体内蛋白酶,如组织蛋白酶(cathepsin b)或纤溶酶(在一些肿瘤组织中此类酶含量增加),有效地切断。这种肽连接被认为在血浆循环中非常稳定,这是因为细胞外不合宜的ph值及血清蛋白酶抑制剂导致蛋白酶通常不具备活性。鉴于较高的血浆稳定性和良好的细胞内断裂选择性和有效性,酶不稳定连接子被广泛用做抗体药物偶联物的可断裂连接子。典型的酶不稳定连接子包括val-cit(vc),phe-lys等。
[0158]
自释放连接子一般嵌合在可断裂连接子与活性药物之间,或者本身就是可断裂连接子的一部分。自释放连接子的作用机制是:当可断裂连接子在适宜的条件下断裂后,自释放连接子能够自发地进行结构重排,进而释放与之连接的活性药物。常见的自杀式连接子包括对氨基苄醇类(pab)和β-葡萄糖醛酸苷类(β-glucuronide)等。
[0159]
本发明提供了连接子或偶联试剂,包含二芳硫基马来酰亚胺单元和一个偶联基团。二芳硫基马来酰亚胺单元用于交联抗体链间的巯基基团(还原后),而偶联基团用于与小分子药物或药物-连接子单元偶联。由于该二芳硫基马来酰亚胺单元与抗体中的开放半胱氨酸-半胱氨酸二硫键的两个硫原子的二齿结合(bidentate binding),因此这些adc是均质的并比含有单齿接头的adc具有更强的稳定性。因此它们将具有增长的体内半衰期,减少全身性释放的细胞毒素的量,并且比具有单齿接头的adc更加安全的药物性质。
[0160]
在另一个方面,所产生的药物-连接子单元通过该连接子与抗体偶联,生成部分链间交联的偶联物。与传统的抗体药物偶联物相比,应用本发明方法制备的抗体药物偶联物的药物/抗体比值(dar)分布更窄,从而大幅提升了产品均一性及药理学特性均一性。该抗
体药物偶联物可用于靶向输送药物到达目标细胞群体,例如肿瘤细胞。抗体药物偶联物可以特异性的与细胞表面蛋白结合,所产生的结合物随即被细胞内吞。在细胞内,药物以活性药物的方式释放出来产生功效。抗体包括嵌合抗体,人源化抗体,人抗体;可与抗原结合的抗体片段;或者抗体fc融合蛋白;或者蛋白。“药物”是高活性药物(见定义部分),在某种情况下,药物可以是聚乙二醇。
[0161]
抗体-药物偶联物(adc,即aptc偶联物)
[0162]
本发明还提供了基于本发明抗体的抗体-药物偶联物(antibody-drug conjugate,adc)。特别地,本发明的抗体药物偶联物adc,指本发明的第一方面所述的包含抗hiv抗体和tlr小分子激动剂的抗体-药物偶联物(aptc)。
[0163]
如本文所用,“本发明的aptc(antibody peptide tlra conjugate)”、“本发明的aptc偶联物”、“本发明的抗体-tlra多肽偶联物”、“本发明的抗体-药物偶联物”可以互换使用,指本发明所述的抗hiv抗体和tlr小分子激动剂形成的偶联物,tlr小分子激动剂tlr7/8激动剂。
[0164]
典型地,所述抗体偶联药物包括所述抗体、以及效应分子,所述抗体与所述效应分子偶联,并优选为化学偶联。其中,所述效应分子优选为具有治疗活性的药物或具有促进免疫功能的药物。
[0165]
本发明抗体与所述效应分子之间可以是通过偶联剂进行偶联。所述偶联剂的例子可以是非选择性偶联剂、利用羧基的偶联剂、肽链、利用二硫键的偶联剂中的任意一种或几种。所述非选择性偶联剂是指使效应分子和抗体形成共价键连接的化合物,如戊二醛等。所述利用羧基的偶联剂可以是顺乌头酸酐类偶联剂(如顺乌头酸酐)、酰基腙类偶联剂(偶联位点为酰基腙)中的任意一种或几种。
[0166]
抗体上某些残基(如cys或lys等)用于与多种功能基团相连,其中包括成像试剂(例如发色基团和荧光基团),诊断试剂(例如mri对比剂和放射性同位素),稳定剂(例如乙二醇聚合物)和治疗剂。抗体可以被偶联到功能剂以形成抗体-功能剂的偶联物。功能剂(例如药物,检测试剂,稳定剂)被偶联(共价连接)至抗体上。功能剂可以直接地、或者是通过接头间接地连接于抗体。
[0167]
抗体可以偶联药物从而形成抗体药物偶联物(adcs)。典型地,adc包含位于药物和抗体之间的接头。接头可以是可降解的或者是不可降解的接头。可降解的接头典型地在细胞内环境下容易降解,例如在目标位点处接头发生降解,从而使药物从抗体上释放出来。合适的可降解的接头包括,例如酶降解的接头,其中包括可以被细胞内蛋白酶(例如溶酶体蛋白酶或者内体蛋白酶)降解的含有肽基的接头,或者糖接头例如,可以被葡糖苷酸酶降解的含葡糖苷酸的接头。肽基接头可以包括,例如二肽,例如缬氨酸-瓜氨酸,苯丙氨酸-赖氨酸或者缬氨酸-丙氨酸。其它合适的可降解的接头包括,例如,ph敏感接头(例如ph小于5.5时水解的接头,例如腙接头)和在还原条件下会降解的接头(例如二硫键接头)。不可降解的接头典型地在抗体被蛋白酶水解的条件下释放药物。
[0168]
连接到抗体之前,接头具有能够和某些氨基酸残基反应的活性反应基团,连接通过活性反应基团实现。巯基特异性的活性反应基团是优选的,并包括:例如马来酰亚胺类化合物,卤代酰胺(例如碘、溴或氯代的);卤代酯(例如碘、溴或氯代的);卤代甲基酮(例如碘、溴或氯代),苄基卤代物(例如碘、溴或氯代的);乙烯基砜,吡啶基二硫化物;汞衍生物例如
3,6-二-(汞甲基)二氧六环,而对离子是醋酸根、氯离子或者硝酸根;和聚亚甲基二甲基硫醚硫代磺酸盐。接头可以包括,例如,通过硫代丁二酰亚胺连接到抗体上的马来酰亚胺。
[0169]
应理解,药物通常可以是任何细胞毒性,抑制细胞生长或者免疫抑制的药物。在本发明中,药物为激活或促进免疫反应的药物,例如激活固有免疫反应从而辅助适应性免疫的激活。在具体的实施方式中,药物为tlr受体激动剂。
[0170]
在实施方式中,接头连接抗体和药物,而药物具有可以和接头成键的功能性基团。例如,药物可以具有可以和连接物成键的氨基,羧基,巯基,羟基,或者酮基。在药物直接连接到接头的情况下,药物在连接到抗体之前,具有反应的活性基团。
[0171]
有用的药物类别包括,例如,tlr1激动剂、tlr2激动剂、tlr3激动剂、tlr4激动剂、tlr5激动剂、tlr6激动剂、tlr7激动剂、tlr8激动剂和tlr9激动剂,例如t-785、或um01等。在本发明中,药物-接头可以用于在一个简单步骤中形成adc。在其它实施方式中,双功能连接物化合物可以用于在两步或多步方法中形成adc。例如,半胱氨酸残基在第一步骤中与接头的反应活性部分反应,并且在随后的步骤中,接头上的功能性基团与药物反应,从而形成adc。
[0172]
通常,选择接头上功能性基团,以利于特异性地与药物部分上的合适的反应活性基团进行反应。作为非限制性的例子,基于叠氮化合物的部分可以用于特异性地与药物部分上的反应性炔基基团反应。药物通过叠氮和炔基之间的1,3-偶极环加成,从而共价结合于接头。其它的有用的功能性基团包括,例如酮类和醛类(适合与酰肼类和烷氧基胺反应),膦(适合与叠氮反应);异氰酸酯和异硫氰酸酯(适合与胺类和醇类反应);和活化的酯类,例如n-羟基琥珀酰亚胺酯(适合与胺类和醇类反应)。这些和其它的连接策略,例如在《生物偶联技术》,第二版(elsevier)中所描述的,是本领域技术人员所熟知的。本领域技术人员能够理解,对于药物部分和接头的选择性反应,当选择了一个互补对的反应活性功能基团时,该互补对的每一个成员既可以用于接头,也可以用于药物。
[0173]
本发明还提供了制备adc的方法,可进一步地包括:将抗体与药物-接头化合物,在足以形成抗体偶联物(adc)的条件下进行结合。
[0174]
在某些实施方式中,本发明方法包括:在足以形成抗体-接头偶联物的条件下,将抗体与双功能接头化合物进行结合。在这些实施方式中,本发明方法还进一步地包括:在足以将药物部分通过接头共价连接到抗体的条件下,将抗体接头偶联物与药物部分进行结合。
[0175]
在一些实施方式中,抗体药物偶联物adc如下分子式所示:
[0176]
ab-(j-u)n(ⅰ)
[0177]
式中,
[0178]
ab为抗hiv抗体;
[0179]
u各自独立地为tlr小分子激动剂;
[0180]
j为化学键或连接子;
[0181]
n为0或正整数;
[0182]
“‑”
为化学键或接头或连接子。
[0183]
在本发明中,一种优选的抗hiv抗体为包含如seq id no:1所示的重链和如seq id no:2所示的轻链的抗hiv抗体;
[0184]
或抗hiv抗体为包含如seq id no:3所示的重链和如seq id no:2所示的轻链的抗hiv抗体。
[0185]
应用
[0186]
本发明提供了本发明抗体药物偶联物的用途,例如用于制备诊断制剂、或制备用于预防和/或治疗hiv相关疾病的药物。
[0187]
本发明的抗体药物偶联物还可与其他治疗剂一起使用。其他治疗剂可以是一个或多个抗病毒hiv治疗药物,包括但不限于,agenerase(amprenavir;glaxosmithkline);combivir(拉米夫定,齐多夫定;glaxosmithkline);crixivan(indinavir,idv,mk-639;merck);emtriva(ftc,emtricitabine;gilead sciences);epivir(拉米夫定,3tc;glaxosmithkline);fortovase(沙奎那韦;hoffmann-la roche);hivid(扎西他滨,ddc,双脱氧胞苷;hoffmann-laroche);invirase(沙奎那韦甲磺酸,sqv;hoffmann-la roche);kaletra(lopinavir,ritonavir;abbott laboratories);norvir(ritonavir,abt-538;abbott laboratories);rescriptor(delaviridine,dlv;pfizer);retrovir(齐多夫定,azt,叠氮胸苷,zdv;glaxosmithkline);reyataz(atazanavir sulfate;bristolmyers-squibb);sustiva(efavirenz;bristol myers-squibb);trizivir(abacavir,齐多夫定,拉米夫定;glaxosmithkline);videxec(肠衣去羟肌苷;bristol myers-squibb);videx(去羟肌苷,ddl,双脱氧肌苷;bristol myers-squibb);viracept(nelfinavir mesylate,nfv;agouron pharmaceuticals);viramune(奈韦拉平,bi-rg-587;boehringer ingelheim);viread(tenofovir disoproxil fumarate;gilead);zerit(stavudine,d4t;bristol myers-squibb);ziagen(abacavir;glaxosmithkline)。
[0188]
本发明另外的实施方案中,本发明的抗体药物偶联物与用于治疗hiv或hiv诱发疾病的一个或多个另外的化合物共同给药。这些可与本发明的药物组合物共同给药的其它药物包括,但不限于,三甲曲沙葡糖醛酸盐(治疗卡氏肺孢子虫肺炎);更昔洛韦(治疗巨细胞病毒性视网膜炎);喷雾型喷他脒(治疗卡氏肺孢子虫肺炎);红细胞生成素(治疗齐多夫定相关性贫血);阿托伐醌(治疗卡氏肺孢子虫肺炎);利福布汀(治疗鸟分枝杆菌);v1stide(治疗复发性巨细胞病毒性视网膜炎);和serostim(治疗aids相关的消瘦)。在本发明另外的实施方案中,本发明的药物组合物可以与其他hiv治疗药物共同给药,以防止hiv(包括hiv-1,hiv-2及其所有其它血清型)或siv病毒颗粒在患者体内复制。
[0189]
药物组合物
[0190]
本发明还提供了一种组合物。优选地,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体或赋形剂,以及任选的其他生物活性物质。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):腹膜内、静脉内、或局部给药。
[0191]
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡
萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约10微克/千克体重-约50毫克/千克体重。本发明的药物组合物还可以包含其他生物活性的药物,如治疗hiv的药物。所述治疗hiv的药物可以是一个或多个抗病毒hiv治疗药物。本发明的药物组合物还可以与用于治疗hiv或hiv诱发疾病的一个或多个另外的化合物共同施用于有需要的受试者。
[0192]
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约10毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0193]
抗体-药物偶联物的制备方法
[0194]
抗体药物偶联物制备路线如下:抗体链间二硫键被还原,产生2n个(如4个)巯基基团。本发明的取代马来酰亚胺类连接子-药物缀合物与还原后的抗体巯基交联,生成相应的抗体药物偶联物。
[0195]
本发明的主要优点包括:
[0196]
(a)本发明首次提供了抗hiv抗体和tlr激动剂的联合治疗方案,表现出了显著的体内抗hiv活性,表明抗hiv抗体疗法和tlr免疫激动剂具有联合合理性,可协同抗hiv;
[0197]
(b)并且通过实验表明,本发明的aptc偶联物具有靶向hiv而增强免疫细胞对抗感染因子ifn-γ的分泌作用,有助于艾滋病的功能性治愈。
[0198]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0199]
试剂和材料
[0200]
1.抗体
[0201]
抗hiv抗体的重链hc和lc的序列分别为seq id no:1和2所示的抗hiv抗体,其为两条重链和两条轻链构成的二聚体。
[0202]
抗hiv抗体的重链hc
[0203]
qvqllqsgaavtkpgasvrvsceasgynirdyfihwwrqapgqglqwvgwinpktgqpnnprqfqgrvsltrhaswdfdtfsfymdlkalrsddtavyfcarqrsdywdfdvwgsgtqvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:1)
[0204]
抗hiv抗体的轻链lc
[0205]
diqmtqspsslsasvgdtvtitcqangylnwyqqrrgkapklliydgsklergvpsrfsgrrwgqeynltinnlqpediatyfcqvyefvvpgtrldlkrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:2)
[0206]
抗hiv抗体突变抗体j(ls突变):具有如下所示的抗体重链和轻链:
[0207]
分子j的重链,其相对于抗hiv抗体1的重链(seq id no.1)具有两个氨基酸的突变:m434l和n440s:
[0208]
qvqllqsgaavtkpgasvrvsceasgynirdyfihwwrqapgqglqwvgwinpktgqpnnprqfqgrvsltrhaswdfdtfsfymdlkalrsddtavyfcarqrsdywdfdvwgsgtqvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvlhealhshytqkslslspgk(seq id no:3)
[0209]
分子j的轻链与上述抗hiv抗体的轻链相同:
[0210]
diqmtqspsslsasvgdtvtitcqangylnwyqqrrgkapklliydgsklergvpsrfsgrrwgqeynltinnlqpediatyfcqvyefvvpgtrldlkrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:2)
[0211]
2.tlr激动剂以及连接子
[0212]
2种tlra(toll-like receptor agonist)分别为t-785和um01:
[0213]
t-785
[0214][0215]
um01
[0216][0217]
2种linker的结构如下:
[0218]
mpa-aeea
[0219]
mpa-aeea-val-cit-pabc
[0220]
2种tlra和2种linker构成以下4种结构:
[0221]
tlra-linker-1mpa-aeea-t-785(tlra-linker-1)
[0222]
[0223]
tlra-linker-2mpa-aeea-um01(tlra-linker-2)
[0224][0225]
tlra-linker-3mpa-aeea-val-cit-pabc-t-785(tlra-linker-3)
[0226][0227]
tlra-linker-4mpa-aeea-val-cit-pabc-um01(tlra-linker-4)
[0228][0229]
实施例1抗hiv抗体-tlr小分子激动剂偶联物的制备
[0230]
1.tlra-linker化合物合成
[0231]
1.1tlra-linker-1、2合成
[0232]
采用ctc树脂进行mpa-aeea-ctc resin合成,合成完成后进行裂解得到二肽mpa-aeea,二肽分别与1-(4-氨基丁基)-2-丁基-1h-咪唑并[4,5-c]喹啉-4-胺、1-(4-氨基甲基苄基)-2-丁基-1h-咪唑并[4,5-c]喹啉-4-胺进行酰胺缩合得到tlra-linker-1、2,详细方案如下。
[0233][0234]
1.2 tlra-linker-3、4合成
[0235]
采用ctc树脂先合成fmoc-aeea-val-cit-ctc resin,然后裂解得到三肽,再依次与对氨基苄醇、二(4-硝基苯基)碳酸酯、mpa反应得到linker,再分别与1-(4-氨基丁基)-2-丁基-1h-咪唑并[4,5-c]喹啉-4-胺和1-(4-氨基甲基苄基)-2-丁基-1h-咪唑并[4,5-c]喹啉-4-胺反应得到tlra-linker-3、4,详细方案如下:
[0236]
[0237]
[0238][0239]
2.tlra-linker与抗体偶联
[0240]
2.1抗hiv抗体二硫键还原
[0241]
缀合缓冲液:20mm pb ph=7.4
[0242]
将抗hiv抗体用缀合缓冲液配制成4mg/ml,配制两份,分别加入1:1和1:2.5摩尔当量比的还原剂tcep,混匀,37℃反应1h。
[0243]
2.2aptc偶联物缀合反应:用20%acn将tlra-linker1-tlra-linker4分别配制成5mm tlra-linker的溶液;分别向不同还原反应体系中加入10倍摩尔当量比的tlra-linker1,tlra-linker2、tlra-linker3、tlra-linker4,混匀,室温反应30min后,离心取上清,超滤管超滤离心三次,取样进行hic检测。
[0244]
3.aptc分子设计:
[0245]
抗hiv抗体或其突变抗体j(ls突变)还原后,抗体分子中的巯基分别与tlra-linker-1/2/3/4(表1)分子中的马来酰亚胺(mpa)基团间形成硫醚键,形成aptc偶联物,分别命名为aptc1、aptc2、aptc3、aptc4或aptc1-j、aptc2-j、aptc3-j、aptc4-j。
[0246]
表1.tlra-linker的种类名称、组成及结构式
[0247][0248]
备注:
[0249]
1.tlra,toll-like receptor agonist,包括t-785、um01。
[0250]
2.mpa,马来酰亚胺,分子式为c4h3no2。
[0251]
实施例2aptc偶联物的活性测试
[0252]
基于hiv-1基因组骨架质粒psg3δenv和包膜蛋白(env)表达质粒共转染所制备的hiv重组病毒可以单次感染靶细胞,被广泛用于抗病毒药物、中和抗体和疫苗的筛选和评价,尤其是作为评价hiv中和抗体、膜融合抑制剂等病毒进入抑制剂的标准方法。本实验采用含有荧光素酶报告基因的tzm-bl(由美国国立卫生研究院艾滋病试剂项目提供(目录号8129))作为靶细胞。并采用2种hiv-1重组病毒,包括1个b亚型(caan5342(p11038))、1个b/c亚型(cne15)进行实验。
[0253]
各亚型hiv-1重组病毒的制备及基于单次感染的抗病毒试验按本实验室常规方法进行。抗病毒试验步骤简介如下:将药物在96孔细胞培养板进行3倍倍比稀释,50μl/孔,设置3个复孔和9个梯度;将50μl体积的重组病毒(100tcid
50
)加入培养孔中,于37℃放置60min;然后每孔加入100μl体积的1
×
104tzm-bl细胞。加入终浓度为15μg/ml的deae-dextran后,于37℃、5%co2细胞培养箱中孵育48h左右。小心弃掉培养液后,每孔用30μl细胞裂解液于室温裂解细胞15min,之后加入100μl/孔luciferaese assay试剂,充分混匀后取100μl转移到96孔白板中。使用化学发光检测仪测定rlu,利用graphpad prism software软件采用非线性回归分析中s形剂量反应公式计算药物的ic
50
、ic
90
值及药物抑制曲线。抗病毒试验重复三次,汇总其重复结果,ic50如表2-1、2-2所示,ic90如表3-1、3-2所示:三次结果汇总如表5、9所示,三次实验汇总曲线如图2-5所示。
[0254]
表2-1.样品对hiv-1重组病毒的抑制活性ic
50
(3次试验结果汇总)
[0255][0256]
表2-2.样品对hiv-1重组病毒的抑制活性ic
50
(3次试验结果汇总)
[0257][0258][0259]
表3-1.样品对hiv-1重组病毒的抑制活性ic
90
(3次试验结果汇总)
[0260][0261]
表3-2.样品对hiv-1重组病毒的抑制活性ic
90
(3次试验结果汇总)
[0262][0263][0264]
实验结论:aptc偶联物的体外抗hiv病毒活性与抗hiv抗体较为接近。aptc-j的体外抗hiv病毒活性略优于抗hiv抗体。
[0265]
实施例3 aptc偶联物体外免疫激活的细胞因子释放实验
[0266]
利用cytometricbead array(cba)试剂盒,检测待测物诱发的细胞因子释放情况。cba检测是微量样本多指标流式蛋白定量技术。具有样本用量少,灵敏度高、重复性好、准确度高等优点;另一重要优势在于,可同时对单个样品进行多参数检测。如,对单个细胞培养液样品可同时检测多种可溶性细胞因子、炎症因子等的浓度。
[0267]
细胞因子释放检测实验:将待检测化合物与hl2/3细胞(购自nih,产品目录号为:
1294)孵育1小时,再与pbmc(购自上海赛笠生物科技有限公司,货号为xfb-hp050a)共孵育29小时,检测细胞因子释放情况。toll样受体7或8激动剂能激活tlr7或8(toll-like receptor 7/8),引起相应的pbmc细胞产生并分泌ifn-γ,通过hl2/3细胞和pbmc细胞能够检测aptc偶联物体外免疫激活的细胞因子释放情况。待测化合物为aptc2,其余为对照组。
[0268]
其中上述各对照组的具体设置情况如下:
[0269]
培养基(medium)+hl2/3+pbmc对照组
[0270]
待测物溶剂(vehicle)+hl2/3+pbmc对照组um01+pbmc对照组,用以确定pbmc对tlr激动剂是否具有应答能力。
[0271]
tlra2+pbmc对照组,用以确定linker是否本身增强um01基团对pbmc对ifn-γ的分泌能力。
[0272]
抗hiv抗体+hl2/3+pbmc对照组,用以分析缀合物通过其抗hiv抗体组件结合hl2/3而被内吞入pbmc后,hl2/3中的hiv蛋白成分被提呈后是否可增强对pbmc的免疫激活作用。
[0273]
3.1实验步骤:
[0274]
1.药物配制:将所有待测化合物分别配制到所需浓度。
[0275]
2.制备细胞悬液:消化后,将hl2/3细胞悬液浓度调整到2e6个/ml。
[0276]
3.hl2/3细胞与化合物预孵育:medium及vehicle或各不同浓度的化合物分别加入到96孔板中,总体积为50μl;在相应孔中加入50μl的medium或hl2/3细胞,孵育1小时。各孔中化合物终浓度为本实验设置的工作浓度。
[0277]
4.制备pbmc细胞悬液:pbmc细胞悬液浓度为3e6个/ml。
[0278]
5.与pbmc共孵育:上述步骤“3”孵育1小时结束后,每孔中均加入100μl的pbmc细胞悬液,共孵育29小时。
[0279]
6.样品收集:收集各孔中液体,离心,取上清,cba法检测培养液中细胞因子浓度,以分析细胞因子释放情况。
[0280]
7.细胞活性检测:采用ctg法检测各孔中的贴壁细胞数(即活细胞数),以分析各化合物对细胞活性的影响。
[0281]
3.2实验结果:
[0282]
3.2.1 ifn-γ的释放情况:
[0283]
结果如图6、7所示。图6显示了0.5μm化合物作用下ifn-γ的释放。图7显示了0.025μm化合物作用下ifn-γ的释放。
[0284]
结果表明:
[0285]
1)2种浓度的tlra2直接处理pbmc对于ifn-γ无诱导活性,um01直接处理pbmc对ifn-γ有较低的诱导活性。
[0286]
2)hl2/3+pbmc条件下,2种浓度的aptc2对ifn-γ均有不同程度上调,两种浓度下的抗hiv抗体对ifn-γ无诱导活性。
[0287]
3.2.2 ifn-γ释放的原始数据:
[0288]
表4.化合物作用下ifn-γ的释放浓度
[0289][0290]
3.2.3细胞毒性情况:
[0291]
图8显示了待测物溶剂对hl2/3+pbmc的细胞活性的影响,图9显示了化合物对hl2/3+pbmc的细胞活性的影响。
[0292]
结果表明:
[0293]
1)当用0.025、0.5μm的化合物处理hl2/3+pbmc时,2种浓度的化合物中所含的溶剂本身对细胞的活性略有影响,但影响不明显;
[0294]
2)用0.025、0.5μm的化合物来处理hl2/3+pbmc细胞时,与溶剂对照组相比,抗hiv抗体不影响细胞活性;尽管apct2使细胞活性略有降低,但影响不大。
[0295]
3.3实验分析:
[0296]
ifn-γ(interferon-gamma)是细胞介导免疫的关键性调节因子,在机体对抗感染中发挥重要作用。巨噬细胞、活化的cd8t细胞、nk细胞以及cd4 th1细胞均可分泌大量ifn-γ。研究表明,ifn-γ可增强抗病毒作用。
[0297]
aptc2是由抗hiv抗体抗体与tlr7/8激动剂um01通过连接子mpa-aeea缀合而形成的抗体偶联物,即抗hiv抗体-tlra2偶联物。
[0298]
数据显示,aptc2的2种组分抗hiv抗体、tlra2,单独与hl2/3、pbmc细胞共孵育时,在0.025μm、0.5μm浓度下均不能促进ifn-γ的释放;但是,抗hiv抗体与tlra2缀合物aptc2在hl2/3存在情况下,0.025μm的aptc2对pbmc即表现出明显的促ifn-γ释放效应,这种促进效果在0.5μm浓度下更为强烈。实验结果提示,aptc2具有靶向hiv而增强免疫细胞对抗感染因子ifn-γ的分泌作用。
[0299]
3.4实验结论:
[0300]
aptc2是一种新的靶向hiv的抗体的aptc偶联物,其增强免疫细胞分泌ifn-γ的效果优于抗hiv抗体、tlra2单独与hl2/3、pbmc细胞共孵育时的效果,具有协同效应,能够有效靶向hiv而增强免疫细胞对抗感染因子ifn-γ的分泌作用。
[0301]
此外,还对aptc2-j进行了上述体外免疫激活的细胞因子释放实验,其效果与aptc2相似,具体结果未显示。
[0302]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1