一种靶向蛋白酶体治疗乳腺癌的药物应用
1.本发明涉及生物医药和分子生物学技术领域,具体涉及一种靶向蛋白酶体治疗乳腺癌的药物应用。
背景技术:
2.据2020年全球癌症统计数据显示女性乳腺癌新发病例数高达226万例,力压肺癌,成为全球第一大癌,同时也是女性癌症相关死亡的主要原因。在乳腺癌分子分型中,三阴性乳腺癌(tnbc,er-/pr-/her2-)约占所有乳腺癌的15-20%,具有侵袭性强、复发转移风险高、对可用疗法的反应持续时间短以及总生存率低等特征。同时tnbc缺乏公认有效的治疗靶点,难以从传统靶向治疗中获益,是目前预后最差的乳腺癌亚型,也是乳腺癌临床治疗中最棘手的难题之一。
3.目前,传统化疗、放疗以及手术切除是三阴性乳腺癌的标准治疗手段。虽然一些早期患者受益于这些常规的治疗,但其总体临床预后仍然很差。全身性的细胞毒性化疗最初抑制了肿瘤体积,但大多数患者仍会复发、转移并最终死于这种疾病。基于铂类药物的新辅助化疗将tnbc患者的病理完全缓解率提高了10-15%,但却伴随着较高的血液学毒性和治疗中断率。因此,迫切的需要为tnbc患者开发更有效的治疗方案。
4.近年来,对于tnbc新治疗靶点的筛选以及开发有效的联合治疗方案依然是乳腺癌领域的研究热点。mapk通路作为人类癌症中最常见的信号通路之一,其异常激活会直接导致癌细胞增殖失控,进而促进肿瘤发生。在未经治疗的tnbc中,编码mapk通路成分的基因改变虽然不像其他类型的癌症那样频繁,但其上游表皮生长因子受体(egfr)约在89%基底样tnbc中的表达可导致mapk信号通路的激活。同时,mapk信号通路的异常激活也被证明与tnbc的不良预后高度相关,如促进化疗耐药性、免疫逃避,降低总生存期和提高复发风险等。因此,靶向mapk信号通路治疗tnbc是有前景的策略之一。
5.在这个线性激酶信号级联中,针对mek1/2的小分子药物是众多科学家和制药公司研究和开发的热点。目前,已有四种靶向mek1/2的小分子抑制剂(曲美替尼(trametinib)、司美替尼(selumetinib)、考比替尼(cobimetinib)和比美替尼(binimetinib))被美国食品和药物管理局(fda)批准用于治疗转移性黑色素瘤,其抗肿瘤疗效同时也在结直肠癌、非小细胞肺癌和甲状腺癌等癌症中被进一步证实。然而,多项临床试验结果显示,这些mek抑制剂无论是单药还是与化疗联合治疗tnbc均显示出微弱的抗肿瘤效果。因此,寻找mek抑制剂的协同治疗新靶点和开发有效的联合治疗方案对改善tnbc患者的长期疗效是非常迫切的。
技术实现要素:
6.本发明针对mek抑制剂单药治疗tnbc患者疗效不佳的问题提供一种靶向蛋白酶体治疗乳腺癌的药物应用。
7.本发明通过研究发现,在tnbc细胞中,psmg2可作为mek抑制剂协同治疗的靶点。psmg2沉默通过抑制蛋白酶体增强tnbc细胞对mek抑制剂的敏感性,靶向蛋白酶体联合mek
抑制剂能在体内外协同抑制tnbc细胞增殖,基于上述研究成果,从而完成本发明。
8.本发明采用的技术方案是:
9.一种靶向蛋白酶体治疗乳腺癌的药物应用,药物包括靶向蛋白酶体和mek抑制剂,靶向蛋白酶体也称为抑制蛋白酶体。
10.进一步的,所述靶向蛋白酶体为抑制蛋白酶体组装伴侣2(proteasome assembly chaperone2,psmg2)靶点或蛋白酶体抑制剂。
11.进一步的,所述靶向蛋白酶体的蛋白酶体抑制剂为mg132、硼替佐米(bortezomib)、卡非佐米(carfilzomib)、伊沙佐米(ixazomib)中的一种。
12.进一步的,所述mek抑制剂为司美替尼(azd6244)、曲美替尼(trametinib)、比美替尼(binimetinib)、考比替尼(cobimetinib)中的一种。
13.进一步的,所述乳腺癌肿瘤为三阴性乳腺癌肿瘤。
14.进一步的,所述药物时包括靶向蛋白酶体、mek抑制剂及药物上可接受的辅料。
15.本发明的有益效果是:
16.本发明提供一种靶向蛋白酶体治疗乳腺癌的药物应用,将靶向蛋白酶体用于制备治疗乳腺癌药物,属于生物医药和分子生物学技术领域。靶向蛋白酶体为蛋白酶体组装伴侣2(psmg2)沉默或蛋白酶体抑制剂;psmg2作为mek抑制剂的协同治疗靶点,其沉默联合mek抑制剂能够抑制tnbc细胞的增殖;蛋白酶体抑制剂联合mek抑制剂能够在体内外协同抑制tnbc细胞增殖,且其体内肿瘤抑制率能够达到66.25%,抗肿瘤疗效显著优于任一单药组,为tnbc的临床治疗提供了新的协同治疗靶点以及联合治疗方案。
附图说明
17.图1为本发明实施例中tnbc细胞对azd6244的响应效果图。a图为bt549,mb468,mb231细胞对azd6244的短期响应效果图,b图为bt549,mb468,mb231细胞对azd6244的长期响应效果图,c图为azd6244对mapk通路的抑制效果图。
18.图2抑制psmg2联合mek抑制剂azd6244同时抑制bt549和mb468细胞增殖的效果图。
19.图3为本发明实施例中抑制psmg2与蛋白酶体抑制剂mg132抑制蛋白酶体,促进泛素化蛋白积累的效果图,a为bt549细胞结果,b为mb468细胞结果。
20.图4为本发明实施例中蛋白酶体抑制剂联合mek抑制剂同时抑制tnbc细胞增殖的效果图。a图为蛋白酶体抑制剂mg132联合mek抑制剂azd6244同时抑制四株tnbc细胞增殖的效果图。b图为蛋白酶体抑制剂mg132联合mek抑制剂azd6244同时抑制两株mek抑制剂敏感的tnbc细胞增殖的效果图。c图为蛋白酶体抑制剂bortezomib联合mek抑制剂trametinib同时抑制bt549和mb468细胞增殖的效果图。
21.图5为本实施例中蛋白酶体抑制剂mg132联合不同浓度mek抑制剂抑制tnbc细胞的增殖,a为bt549细胞结果,b为mb468细胞结果。
22.图6为本发明实施例中蛋白酶体抑制剂mg132联合不同浓度mek抑制剂抑制tnbc细胞增殖的协同效应统计图。
23.图7为本发明实施例中以cppt为对照,过表达psmg2部分缓解azd6244+mg132对细胞的生长抑制作用效果图,a为bt549细胞结果,b为mb468细胞结果。
24.图8为本发明实施例中蛋白酶体抑制剂协同mek抑制剂抑制小鼠tnbc细胞4t1的增
azd6244。结合图1a结果表明,mb231细胞无论是短期或长期内均对1μmazd6244敏感,因此mb231细胞不能作为筛选mek抑制剂协同治疗靶点的模型细胞系。mb468短期内对1μm azd6244无明显的反应,但其长期内对1μm azd6244有轻微的响应,约5%细胞增殖被抑制,因此mb468细胞可作为后续验证的模型细胞系。而bt549细胞则可在短期和长期内耐受1μm azd6244,因此bt549细胞可作为筛选mek抑制剂协同治疗靶点的模型细胞系。
37.最后,通过western blot检测不同浓度azd6244对mapk通路的抑制效果以确定mek抑制剂的药物筛选浓度。
38.分别使用不同浓度azd6244(0、0.1、1、2、3、4、5μm)处理bt549和mb468细胞,2h后western blot(蛋白质印迹)检测mapk信号级联中相关激酶的磷酸化变化。结果如图1c所示,在bt549和mb468细胞中,mapk信号级联中的关键激酶磷酸化erk(p-erk)均随着azd6244的加入而减少,且在azd6244浓度低至1μm时,p-erk被下调至极低水平,这一结果表明在两株tnbc细胞中,mapk信号级联能够被1μm azd6244有效且充分的阻断,因此1μm azd6244可作为后续药物筛选浓度。
39.实施例2
40.本实施例中,利用crispr/cas9技术在mek抑制剂抗性的bt549细胞中进行全基因组范围内筛选mek抑制剂的协同治疗靶点psmg2,即抑制psmg2联合mek抑制剂能够抑制tnbc细胞的增殖。
41.利用慢病毒系统对cas9和sgrna文库质粒进行包装,得到cas9和sgrna文库的慢病毒颗粒。使用cas9慢病毒颗粒感染bt549细胞,经过5μg/ml blasticidin处理7天后,得到稳定表达cas9蛋白的bt549细胞,即bt549-cas9细胞。随后,将bt549-cas9细胞扩增培养至指定数目,并以低至0.3的病毒感染复数(moi=0.3)对其进行sgrna文库的慢病毒感染,以此确保每个bt549-cas9细胞有且仅感染一个sgrna,即每个细胞仅敲除一个基因。同时使用0.5μg/ml puromycin对感染后的细胞进行筛选,以去除没有被sgrna成功感染的细胞。随后,将经过puromycin筛选后存活的细胞扩大培养后均分为三组,一组直接收集细胞并标记为dmso-day0,另外两组分别用dmso和1μm azd6244处理7天,并标记为dmso-day7和azd-day7。通过dna提取、sgrna扩增以及高通量测序等一系列操作,最终获得dmso-day0、dmso-day7、azd-day7三个测序数据集。理论上,在gecko敲除模型中,驱动mek抑制剂耐药的基因被sgrna靶向敲除后,会使细胞对mek抑制剂重新敏感,导致细胞在药物筛选过程中被抑制。因此,本研究主要关注在mek抑制剂处理组中下调的基因。借助生物信息学分析比较dmso-day7和azd-day7的sgrna数据,筛选出在azd6244药物处理组中下调的1649个基因;接着通过与bt549细胞系的转录组数据(geo数据库中gse112365数据集)进行比对,筛选出在模型细胞中高效表达的684个基因;然后结合tnbc患者临床样本的群体转录组数据(ncbi网站中的prjna553096数据集和tcga数据库中的tnbc数据集)以及单细胞转录组数据(geo数据库中gse11838和gse75688数据集)分析,筛选出在肿瘤组织(或细胞)中反复上调的57个基因;最后通过比较dmso-day0和dmso-day7的sgrna数据,剔除5个管家基因,最终得到52个可能作为mek抑制剂治疗靶点的候选基因。
42.随后,根据基因的差异显著性(p)以及差异倍数(log2(fold chang))挑选在52个候选基因中排名靠前的5个基因进行后续验证,依次为c1orf131、polr3k、psmg2、pkmyt1、snrnp25。针对每个基因,我们均设计shrna进行功能缺失,并通过长期的克隆形成实验中评
估这些基因单独沉默或其沉默联合mek抑制剂对两株tnbc细胞增殖的影响。首先使用shrna在bt549和mb468细胞中沉默相应的基因后,每隔一天分别使用0μm或1μmazd6244处理对照组(plko.1)和功能缺失组(shrna)的细胞。
43.结果如图2结果显示,单独沉默c1orf131和pkmyt1均会抑制bt549和mb468细胞的增殖,且其抑制效果根据细胞的不同而有所差异,表明这些基因可能间接参与细胞生长、凋亡、分化等一系列生理活动,并且在不同细胞中,这些基因间接调控的生理活动的所占比重不同。然而,polr3k和snrnp25无论是单独沉默或其沉默联合1μm azd6244对bt549和mb468细胞的增殖均无明显影响。因此,可以直接排除上述4个候选基因作为mek抑制剂协同治疗靶点。psmg2单独沉默导致bt549细胞增殖受到一定程度的抑制,其原因可能是psmg2作为蛋白酶体伴侣蛋白2可促进20s蛋白酶体组装,并在维持细胞内蛋白稳态中起着重要作用,因此沉默psmg2可能会引起细胞内蛋白降解的紊乱,而bt549细胞对细胞内蛋白稳态较为敏感,导致细胞增殖被影响。同时,psmg2单独沉默对mb468细胞的增殖无明显影响。然而,psmg2沉默联合1μm azd6244能够同时抑制两株tnbc细胞的增殖,表明psmg2可能是mek抑制剂的协同治疗靶点。
44.实施例3
45.本实施例中,抑制psmg2可促进泛素化蛋白积累。
46.分别利用shrna和蛋白酶体抑制剂mg132处理两株tnbc细胞,然后通过western blot检测细胞中的整体泛素化蛋白水平的变化。
47.如图3结果显示,使用shrna抑制psmg2促进了bt549和mb468细胞中的整体泛素化水平的积累。mg132是一种蛋白酶体抑制剂,在泛素-蛋白酶体系统中,mg132通过抑制蛋白酶体,进而导致泛素化蛋白在蛋白酶体中的降解被抑制而积累。使用mg132处理两株tnbc细胞24h后,通过western blot检测细胞中的整体泛素化蛋白水平的变化。结果显示,mg132药物处理组中的整体泛素化水平显著增加,这与psmg2抑制的结果一致,表明抑制psmg2可能会抑制蛋白酶体,促进泛素化蛋白积累。
48.实施例4
49.本实施例中,蛋白酶体抑制剂联合mek抑制剂能够抑制tnbc细胞的增殖。
50.通过体外克隆实验检测mek抑制剂azd6244,蛋白酶体抑制剂mg132及其组合对tnbc细胞增殖的影响,结果如图4所示,其中图a为对四株tnbc细胞增殖的影响,b为对其余两株mek抑制剂敏感的tnbc细胞增殖的影响。图中
“‑”
表示不含该抑制剂,“+”表示含该抑制剂。
51.图4a可以看出,分别使用1μm azd6244、0.4μm mg132及其组合按两天一次的频率处理四株tnbc细胞,10-14天后,使用0.5%的结晶紫进行染色。结果显示单独使用1μmazd6244对tnbc细胞的增殖均无明显的影响;单独使用0.4μm mg132能部分抑制tnbc细胞的增殖;1μm azd6244与0.4μm mg132联合使用能够有效的抑制四株tnbc细胞的增殖,且抑制效果显著优于任一单药组,表明mg132联合azd6244能够显著抑制tnbc细胞的增殖。
52.图4b可以看出,分别使用0.05μm azd6244、0.2μm mg132及其组合按两天一次的频率处理四株tnbc细胞,10-14天后,使用0.5%的结晶紫进行染色。结果显示单独使用0.05μmazd6244能部分抑制azd6244敏感的tnbc细胞的增殖;单独使用0.2μm mg132同样能部分抑制其增殖;但0.05μm azd6244与0.2μm mg132联合使用能够有效的抑制两株azd6244敏感
tnbc细胞的增殖,且抑制效果显著优于任一单药组,表明mg132联合azd6244能够显著抑制mek抑制剂敏感tnbc细胞的增殖。
53.进一步通过体外克隆实验检测使用fda批准的mek抑制剂trametinib,蛋白酶体抑制剂bortezomib及其组合对tnbc细胞增殖的影响。按两天一次的频率分别使用20mm trametinib、2nm bortezomib及其组合按两天一次的频率处理两株tnbc细胞,10-14天后,使用0.5%的结晶紫进行染色,图中
“‑”
表示不含该抑制剂,“+”表示含该抑制剂。
54.图4c可以看出,与azd6244联合mg132的结果一致,20mm trametinib与2nm bortezomib联合使用能够有效的抑制bt549和mb468细胞的增殖,且抑制效果显著优于任一单药组,表明trametinib联合bortezomib能够显著抑制tnbc细胞的增殖,即mek抑制剂联合蛋白酶体抑制剂能够抑制tnbc细胞的增殖。
55.实施例5
56.本实施例中,蛋白酶体抑制剂与mek抑制剂的协同抑制效应。
57.为了进一步评估蛋白酶体抑制剂与mek抑制对细胞的协同抑制效应,分别用不同浓度的azd6244、0.4μm mg132及其组合处理两株tnbc细胞,结果如图5a和图5b所示。
58.从图5a和图5b中可以看出,0.5μm、1μm、3μm azd6244单药能够部分抑制tnbc细胞增殖,抑制效果呈azd6244的剂量依赖性;0.4μm mg132同样能部分抑制tnbc细胞的增殖;0.5μm、1μm、3μm azd6244分别联合0.4μm mg132均能抑制两株tnbc细胞的增殖,呈azd6244的剂量依赖性,且抑制效果显著优于任一单药组,表明mg132联合mek抑制剂可以抑制tnbc细胞的增殖,不同剂量的药物浓度其抑制效果不同。
59.采用calcusyn v2.0软件中的chou和taladay方法计算的上述不同浓度的azd6244与mg132组合(图5a和图5b)的相对协同作用,以评估tnbc细胞中mg132与mek抑制剂的协同效应,结果如表1所示。
60.从表中可以看出,在bt549细胞中,0.5μm、1μm、3μm azd6244与0.4μm mg132的联合指数(ci)分别为0.011,0.007,0.005,均小于0.1,表明0.5μm、1μm、3μm azd6244分别联合0.4μm mg132对bt549细胞的增殖具有极强的协同抑制效应;针对mb468细胞,0.5μm azd6244、1μm azd6244与0.4μm mg132的ci值分别为0.113,0.137,均位于0.1-0.3区间,表明0.5μm、1μm azd6244分别联合0.4μm mg132对mb468细胞的增殖具有强协同抑制效应;3μm azd6244与0.4μm mg132的ci值为0.323,位于0.3-0.7区间,表明3μmazd6244联合0.4μm mg132对mb468细胞的增殖具有协同抑制效应。这些结果表明,在一定的药物浓度范围内,mg132能够协同mek抑制剂显著抑制tnbc细胞的增殖。
61.表1.mg132与mek抑制剂在tnbc细胞中的抑制效应(fa)和联合指数(ci)的完整值
[0062][0063]
注释:ci《0.1,非常强的协同效应;0.1《ci《0.3,强协同效应;0.3《ci《0.7,协同效应;0.7《ci《0.85,适度的协同效应;0.85《ci《0.90,轻微的协同效应;0.90《ci《1.10,叠加效应;ci》1,拮抗效应。
[0064]
根据表1中的ci值以log
10
(ci)进行表示,采用graphpad进行作图,结果如图6所示。
[0065]
实施例6
[0066]
本实施例中,过表达psmg2能够缓解蛋白酶体抑制剂与mek抑制剂的协同抑制作用。
[0067]
采用克隆实验检测psmg2外源表达的tnbc细胞对azd6244、mg132及其组合的响应情况,如图7所示。图中
“‑”
表示不含该抑制剂,“+”表示含该抑制剂。
[0068]
分别按两天一次的频率用1μm azd6244和0.4μm mg132对cppt和外源表达psmg2的bt549或mb468细胞进行单独或联合处理10-14天,然后用0.5%的结晶紫对其进行染色。结果显示单药azd6244对cppt组和psmg2组的细胞增殖无明显影响。单药mg132能够部分抑制细胞的增殖,但对cppt组的抑制作用强于psmg2组,表明外源表达psmg2能够缓解mg132对细胞的抑制作用。azd6244联合mg132对cppt组和psmg2表达的细胞增殖的抑制效果优于任一单药,这与之前的结果一致,并且该组合对cppt组细胞的抑制作用显著强于psmg2组。这些结果表明外源表达psmg2能够部分缓解azd6244与mg132对tnbc细胞的协同抑制作用。
[0069]
实施例7
[0070]
本实施例中,蛋白酶体抑制剂与mek抑制剂协同抑制小鼠tnbc细胞系4t1的增殖。
[0071]
分别用不同浓度的azd6244、0.6μm mg132及其组合按两天一次的频率处理4t1细胞,10-14天后,用0.5%的结晶紫染色,结果如图8所示。
[0072]
结果显示,0.5μm、1μm、3μm azd6244单药不影响4t1细胞的增殖;0.6μm mg132能部分抑制4t1细胞的增殖,0.5μm、1μm、3μm azd6244分别与0.6μm mg132组合都能抑制4t1细胞的增殖,呈azd6244的剂量依赖性,且抑制效果显著优于任一单药组,表明mg132联合mek抑制剂可以抑制小鼠4t1细胞的增殖,不同剂量的药物浓度其抑制效果不同。
[0073]
用calcusyn v2.0软件中的chou和taladay方法计算的上述不同浓度的azd6244与mg132组合(图7)的相对协同作用,以评估tnbc细胞中mg132与mek抑制剂的协同效应,结果如表2所示。
[0074]
表2.mg132与mek抑制剂在4t1细胞中的抑制效应(fa)和联合指数(ci)的完整值
[0075][0076]
注释:ci《0.1,非常强的协同效应;0.1《ci《0.3,强协同效应;0.3《ci《0.7,协同效应;0.7《ci《0.85,适度的协同效应;0.85《ci《0.90,轻微的协同效应;0.90《ci《1.10,叠加效应;ci》1,拮抗效应。
[0077]
从表2可以看出,在4t1细胞中,0.5μm与0.6μm mg132的ci值为0.333,位于0.3-0.7区间,表明0.5μm azd6244与0.6μm mg132对4t1细胞的抑制具有协同效应;1μm与0.6μm mg132的ci值为0.108,位于0.1-0.3区间,表明1μm azd6244与0.6μm mg132对4t1细胞的抑制具有强协同效应;3μm与0.6μm mg132的ci值为0.034,小于0.1,表明1μmazd6244与0.6μm mg132对4t1细胞的抑制具有非常强的协同效应,表明mg132与azd6244同样能够协同抑制4t1细胞的增殖。
[0078]
根据表2中的ci值以log
10
(ci)进行表示,采用graphpad进行作图,如图9所示。
[0079]
实施例8
[0080]
本实施例中,蛋白酶体抑制剂与mek抑制剂协同抑制tnbc肿瘤的生长。
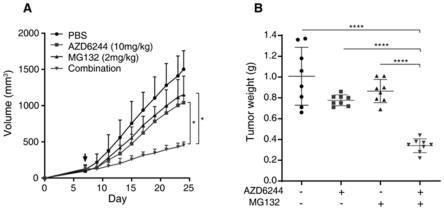
[0081]
为了进一步研究蛋白酶体抑制剂与mek抑制剂的体内抗肿瘤效果,通过使用tnbc小鼠模型中评估mg132,azd6244及其组合对肿瘤生长的影响。首先,将小鼠tnbc 4t1细胞接种于balb/c小鼠后背皮下,待肿瘤生长至约100mm3时(第7天,图10a黑色箭头),将小鼠随机成4组,并通过腹腔注射,按两天一次的给药时间分别给予pbs、10mg/kg azd6244、2mg/kg mg132、10mg/kg azd6244+2mg/kg mg132治疗,结果如图9所示。在治疗过程中,每两天记录一次肿瘤体积,并绘制肿瘤生长曲线(图10a)。治疗结束后(第24天),测量并记录肿瘤的体积,随后处死小鼠并解剖、分离肿瘤组织,对其进行称重,绘制瘤重曲线(图10b)。肿瘤抑制率如表3所示。
[0082]
从表3中可以看出无论是azd6244或mg132单药治疗组均显示出轻微的抗肿瘤疗效((mek抑制剂单药组的抑制率:22.95%;蛋白酶体抑制剂mg132单药组的抑制率:14.14%),而azd6244+mg132联合治疗组的抗肿瘤疗效显著优于任一单药组(抑制率约66.25%),表明mek抑制剂联合蛋白酶体抑制剂能够在体内抑制tnbc肿瘤的生长。
[0083]
表3.mg132与azd6244的体内抗肿瘤疗效
[0084][0085]
根据表3中的抑制率采用graphpad进行作图,如图11所示。
[0086]
本发明中靶向蛋白酶体为抑制蛋白酶体组装伴侣2(psmg2)靶点和蛋白酶体抑制剂;psmg2作为mek抑制剂的协同治疗靶点,其沉默联合mek抑制剂能够抑制tnbc细胞的增殖;蛋白酶体抑制剂联合mek抑制剂能够在体内外协同抑制tnbc细胞增殖,且其体内肿瘤抑制率能够达到66.25%,抗肿瘤疗效显著优于任一单药组(mek抑制剂azd6244单药组的抑制
率:22.95%;蛋白酶体抑制剂mg132单药组的抑制率:14.14%),为tnbc的临床治疗提供了新的协同治疗靶点以及联合治疗方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1