香连丸在制备用于免疫治疗泛癌患者减毒增效的药物中的应用的制作方法
1.本发明属于中医药技术领域,涉及香连丸在制备用于免疫治疗泛癌患者减毒增效的药物中的应用。
背景技术:
2.免疫检查点抑制剂(icpis)开启了肿瘤免疫治疗的新时代,这显著提高晚期恶性肿瘤临床疗效,但其逐渐出现的毒副反应需引起足够重视,接受免疫治疗的90%患者会出现不同程度的免疫相关不良事件(iraes)。
3.现代研究认为肠道菌群多样性的改变能够提高免疫治疗疗效,肠道菌群和炎症细胞因子的影响与iraes也密切相关,导致了治疗的延后或者停止,影响治疗效果,严重者甚至影响生命。
4.中重度iraes需暂停免疫检查点抑制剂的治疗,并使用类固醇激素治疗irae,这不仅会抑制机体免疫,也会降低免疫治疗效果;此外,应用激素会增高机会性感染、睡眠障碍、胃炎、高血压、糖尿病和骨质疏松的风险。
技术实现要素:
5.基于现有技术存在的缺陷,本发明采用古方新用,探索中药香连丸在晚期肿瘤免疫治疗方法的临床价值,扩宽经方香连丸的药物应用范围,具体地,本发明的第一目的在于提供香连丸在制备用于免疫治疗泛癌患者减毒增效的药物中的应用;本发明的第二目的在于提供包含香连丸的药物组合物;本发明的第三目的在于提供一种在受试者中预防或治疗晚期恶性肿瘤的方法;本发明的第四目的在于提供一种在免疫治疗的泛癌患者中提高患者生存期和/或生存质量的方法;本发明的第五目的在于提供一种在免疫治疗的泛癌患者中改善患者肠道微生物、增加b淋巴细胞和降低il-2的方法。
6.本发明的目的通过以下技术方案得以实现:
7.一方面,本发明提供香连丸在制备用于免疫治疗泛癌患者减毒增效的药物中的应用。
8.香连丸又称大香连丸,出自《太平惠民和剂局方》,为治疗湿热型腹泻专方,临床多用于湿热型胃肠疾病,多有成效。全方由木香、黄连组成,黄连功善清热燥湿、泻火解毒,木香能行气止痛、健脾消胃。古代经典文献中多有阐述,说明香连丸在脾胃系疾病中的重要作用。
9.香连丸的临床应用经久不衰,其具有抗胃溃疡、抗腹泻、抗溃疡性结肠炎及抗菌等多种药理活性,临床主要用于痢疾、泄泻、肠炎与胃炎等疾病。研究显示,香连丸能够保护家兔和小鼠肠道屏障损伤,下调小鼠回肠中促炎因子tnf-α、ifn-γ,减轻小鼠化疗相关性腹泻,防治放射性直肠炎,联合美沙拉嗪治疗溃疡性结肠炎等作用。也有网络药理学研究提及,香连丸作用靶点可富集到结直肠癌、非小细胞肺癌、胰腺癌、前列腺癌等多条癌症信号
通路,具有潜在的抗癌价值。本课题组研究发现,香连丸能增加化疗小鼠akk菌的丰度。
10.上述的应用中,优选地,所述泛癌患者为晚期恶性肿瘤患者。
11.另一方面,本发明还提供一种药物组合物,所述药物组合物包括香连丸或香连片,以及任选地药用辅料。
12.上述的药物组合物中,优选地,所述药物组合物还包括第二治疗剂。
13.上述的药物组合物中,优选地,所述第二治疗剂选自抗pd-1抗体、抗pd-l1抗体和抗ctla-4抗体中的一种或多种的组合。
14.再一方面,本发明还提供一种在受试者中预防或治疗晚期恶性肿瘤的方法,所述方法包括向所述受试者施用有效量的香连丸或上述的药物组合物。
15.再一方面,本发明还提供一种在免疫治疗的泛癌患者中提高患者生存期和/或生存质量的方法,所述方法包括向所述受试者施用有效量的香连丸或上述的药物组合物。
16.再一方面,本发明还提供一种在免疫治疗的泛癌患者中改善患者肠道微生物、增加b淋巴细胞和降低il-2的方法,所述方法包括向所述受试者施用有效量的香连丸或上述的药物组合物。
17.本发明的有益效果:
18.本发明的香连丸对经免疫治疗的泛癌患者具有增效减毒方面的临床价值,在改善预后、有效提高患者一年总生存率的同时,减轻免疫治疗相关性不良反应的发生,同时对机体有良好的安全性,相关机制可能与肠道微生物的参与、b淋巴细胞的增加和il-2的降低有关,通过探索香连丸在晚期肿瘤免疫治疗方面的临床价值,拓宽经方香连丸的适用范围。
附图说明:
19.为了更清楚的说明本发明实施例或现有的技术中的技术方案,下面将对实施例或者现有技术描述中有关于本发明需要图作简单地介绍,显而易见地,下面描述中的有关本发明的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
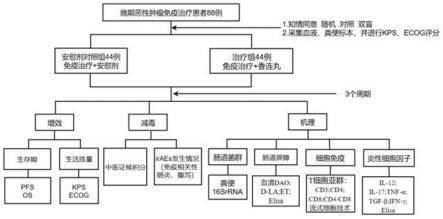
20.图1为本发明香连丸对经免疫治疗的泛癌患者具有增效减毒方面的临床实验流程图。
21.图2为免疫治疗两组患者性别分布。
22.图3为免疫治疗两组患者年龄分布。
23.图4为免疫治疗两组患者肿瘤转移情况分布。
24.图5为免疫治疗两组患者血常规情况治疗前后比较。
25.图6免疫治疗两组患者肝肾功能情况治疗前后比较。
26.图7为免疫治疗两组患者1年生存情况。
27.图8为免疫治疗两组患者os情况。
28.图9为免疫治疗两组患者pfs情况。
29.图10为免疫治疗两组患者iraes发生情况。
30.图11为免疫治疗两组治疗前后患者kps评分情况。
31.图12为免疫治疗两组治疗前后患者ecog评分情况。
32.图13为免疫治疗两组患者疗效预测指标治疗前后比较。
33.图14为免疫治疗两组患者淋巴细胞亚群百分比治疗前后比较。
34.图15为免疫治疗两组患者淋巴细胞亚群计数治疗前后比较。
35.图16为免疫治疗两组患者炎症因子水平治疗前后比较(1)。
36.图17为免疫治疗两组患者炎症因子水平治疗前后比较(2)。
37.图18为免疫治疗两组患者肠道屏障水平治疗前后比较。
具体实施方式
38.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的各实施方式进行详细的阐述。然而,本领域的普通技术人员可以理解,在本发明各实施方式中,为了使读者更好地理解本发明而提出了许多技术细节。但是,即使没有这些技术细节和基于以下各实施方式的种种变化和修改,也可以实现本发明各权利要求所要求保护的技术方案。本发明下述实施例中所采用的原料若无特殊说明,均为常规市售获得,所采用的实验操作若无特殊说明,均为本领域常规操作。
39.实施例:
40.本实施例针对91例来自于上海中医药大学附属上海市中西医结合医院接受免疫治疗的晚期肿瘤患者病例,在接受了免疫治疗剂pd-1、pd-l1、ctla-4等抗体治疗后,进一步加入香连丸进行治疗。
41.1、标准:
42.1.1、诊断标准:
43.临床诊断参照2018年中国临床肿瘤学会(csco)制定的常见恶性肿瘤诊疗指南;免疫相关性肠炎诊断标准2018年美国临床肿瘤学会(asco)联合美国国家综合癌症网络(nccn)制定的《免疫检查点抑制剂治疗相关毒性的管理指南》。中医辨证标准参照《中医病证诊断疗效标准》、《中药新药临床研究指导原则》大肠湿热证标准。
44.1.2、纳入标准:
45.①
符合恶性肿瘤诊断标准,病理学检查明确诊断,tnm分期iv期;
46.②
接受pd-1/l1单抗、ctla-4抗体,或免疫联合治疗;
47.③
入组前1月内未使用抗生素、全身性皮质类固醇(或小于10mg/天强的松剂量)及其他免疫抑制剂;
48.④
无炎症性肠病、放射性肠炎、风湿免疫等疾病;
49.⑤
无其他严重合并症;
50.⑥
年龄18-80岁,男女不限;
51.⑦
kps评分≥60分,预计生存期≥3个月;
52.1.3、排除标准:
①
合并有严重的心脑血管等严重原发疾病,以及精神疾病者;
53.②
临床研究过程中依从性差,资料不全者;
54.③
诊断不明确者;
55.④
未执行本实验方案规定的受试者;
56.⑤
观察项目不完全且不能评价试验效果及副反应的受试者;
57.⑥
近3个月内参加过其他临床试验者;
58.⑦
已接受其他免疫相关治疗或可能影响免疫功能的中药治疗者;
59.⑧
用药过程中,因非药物因素而患其他疾病不能继续完成免疫治疗者。
60.2、实验设计:
61.这是一项针对接受免疫治疗的泛癌患者的随机、双盲、安慰剂对照得临床研究,在上海市中西医结合医院肿瘤科进行。
62.随机方法:采取完全随机法。第三方专家运用spss24.0统计软件程序生成随机序列,91个随机号被等分为2组,随机数字表交由主要研究单位科研中心密封保存。
63.盲法:由第三方专家使用spss24.0统计软件产生随机用药编号,产生随机号的同时产生一级、二级盲底,编码形成后采用文件形式予以确定,确保受试者及研究者双盲要求,医院药物临床研究办公室人员保存应急信封以备紧急揭盲处理。
64.安慰剂对照组在免疫治疗基础上给予安慰剂治疗,治疗组在免疫治疗基础给予香连丸(每日三次,每次3克)口服治疗。3周为1个周期,治疗3个周期,在入组前及疗程结束后进行标本采集和临床症状等的记录和观察。
65.主要终点:该研究的主要目的是观察香连颗粒对经免疫治疗的泛癌患者的疗效,主要终点是1年生存率、总生存期(os)。
66.次要终点:次要终点是疗效和安全性,包括无进展生存期(pfs)、疗效相关预测因子、免疫不良反应发生率、以及相关生物学指标的表达。
67.统计学方法:用spss 24.0统计软件进行数据处理。计量资料以均数
±
标准差表示,符合正态分布数据组间比较采用t检验;非正态分布计量资料采用秩和检验,计数资料与相关性采用卡方检验,对治疗后生存时间、生存率采用log-rank检验,生存分析采用kaplan-meier法进行分析。以α=0.05为检验标准,p<0.05为差异有统计学意义。
68.3、实验过程及结果:
69.(一)一般资料
70.治疗组和对照组的免疫治疗患者数据经统计学检测,两组患者的性别(见表1、图2)、年龄(见表2、图3)、肿瘤转移情况(见表3、图4)各方面对比无差别(p>0.05)。
71.表1免疫治疗两组患者性别情况(单位:例)
[0072][0073]
注:经pearson卡方试验,p》0.05,两组资料比较无统计学差异
[0074]
表2免疫治疗两组患者年龄情况(单位:岁)
[0075][0076]
注:经独立样本t检验,两组年龄比较p》0.05,无统计学差异
[0077]
表3免疫治疗两组患者肿瘤转移情况(单位:例)
[0078][0079]
注:经pearson卡方试验,p》0.05,两组资料比较无统计学差异
[0080]
(二)安全性资料
[0081]
对治疗前后两组血常规结果进行研究发现,治疗前治疗组和对照组的血红蛋白(115.38
±
28.41,120.92
±
28.04,p=0.38)、红细胞(4.06
±
1.31,4.31
±
1.00,t=-1.47,p=0.20)、白细胞(5.74
±
2.21,6.18
±
3.30,t=-0.72,p=0.48)、血小板(203.82
±
97.19,210.61
±
95.48,p=0.75)水平均无统计学差异;治疗后治疗组和对照组的血红蛋白(119.79
±
21.75,120.66
±
19.86,p=0.85)、红细胞(3.90
±
0.87,4.07
±
0.92,t=-0.58,p=0.43)、白细胞(5.77
±
3.02,5.43
±
2.43,t=0.62,p=0.58)、血小板(181.97
±
82.45,203.41
±
109.97,p=0.30)水平也均无统计学差异(见表4、图5)。
[0082]
表4免疫治疗两组患者血常规情况
[0083]
[0084][0085]
注:经配对t试验,p》0.05,两组资料比较无统计学差异
[0086]
对治疗前后两组肝肾常规结果进行研究发现,治疗前治疗组和对照组的谷丙转氨酶(23.88
±
14.55,28.23
±
27.87,t=-0.89,p=0.38)、谷草转氨酶(25.10
±
12.91,30.70
±
18.34,p=0.13)、肌酐(67.17
±
34.61,61.32
±
25.19,t=0.35,p=0.68)、尿素氮(7.18
±
6.17,7.24
±
9.30,t=-0.089,p=0.98)、总胆红素(13.85
±
8.54,14.21
±
7.82,t=-0.13,p=0.84)水平均无统计学差异;治疗后治疗组和对照组的谷丙转氨酶(32.18
±
30.32,28.88
±
32.62,t=0.42,p=0.64)、谷草转氨酶(34.04
±
29.33,50.11
±
104.94,p=0.37)、肌酐(67.15
±
23.88,62.09
±
20.66,t=1.28,p=0.32)、尿素氮(7.48
±
5.70,6.81
±
5.27,t=0.55,p=0.59)、总胆红素(16.15
±
10.48,13.65
±
9.26,t=1.09,p=0.27)水平也均无统计学差异(见表5、图6)。
[0087]
表5免疫治疗两组患者肝肾功能情况
[0088]
[0089][0090]
注:经配对t试验,p》0.05,两组资料比较无统计学差异。
[0091]
(三)1年生存率、os、pfs情况
[0092]
研究结果发现,对照组的肿瘤免疫治疗患者1年os率为26.3%,而经过香连丸联合肿瘤免疫治疗的治疗组的1年os率提高为55%,两者比较具有统计学差异(χ2=78,df=3,p《0.01)(见表6、图7)。
[0093]
表6免疫治疗两组患者1年生存情况
[0094][0095]
注:经pearson卡方试验,**p<0.01,两组资料比较有统计学差异
[0096]
研究结果发现,对照组的肿瘤免疫治疗患者平均os为8.58
±
1.13个月、中位os为7个月,而经过香连丸联合肿瘤免疫治疗的治疗组的平均os提高为16.87
±
2.02个月、中位os为13个月,两者比较具有统计学差异(χ2=9.52,df=1,p《0.01)(见表7、图8)。
[0097]
表7免疫治疗两组患者os情况
[0098][0099]
注:经kaplan-meier法进行分析,p》0.05,两组资料比较无统计学差异;**p《0.01,两组资料比较有统计学差异。
[0100]
研究结果发现,对照组的肿瘤免疫治疗患者平均pfs为6.31
±
0.82个月、中位pfs为4个月,而经过香连丸联合肿瘤免疫治疗的治疗组的平均pfs提高为11.00
±
1.22个月、中位pfs为10个月,两者比较具有统计学差异(χ2=11.17,df=1,p《0.01)(见表8、图9)。
[0101]
表8免疫治疗两组患者pfs情况
[0102][0103]
注:经kaplan-meier法进行分析,p》0.05,两组资料比较无统计学差异;**p《0.01,两组资料比较有统计学差异。
[0104]
(四)不良反应发生情况
[0105]
根据《免疫检查点抑制剂治疗相关毒性的管理指南》,研究结果发现,对照组的肿瘤免疫治疗患者iraes发生比例为32.6%,而经过香连丸联合肿瘤免疫治疗的治疗组的iraes发生比例减少为22.2%,但两者比较不具有统计学差异(χ2=1.23,df=1,p》0.05)(见表9、图10)。
[0106]
表9免疫治疗两组患者iraes发生情况
[0107][0108]
注:经pearson卡方试验,p>0.05,两组资料比较无统计学差异
[0109]
(五)活质量评分
[0110]
对两组的kps评分进行分析,发现治疗组和对照组治疗前的kps评分(68.89
±
7.75,66.96
±
8.40,t=1.14,p=0.26)均无统计学差异。而联合香连丸治疗后,而治疗组的kps评分(77.33
±
10.09,72.17
±
9.64,t=2.49,p=0.01)高于对照组,两者具有统计学差异(见表10、图11)。
[0111]
表10免疫治疗两组治疗前后患者kps评分情况
[0112][0113]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异。
[0114]
对两组的ecog评分进行分析,发现治疗组和对照组治疗前的ecog评分(2.20
±
0.82,2.13
±
0.81,t=0.41,p=0.68)均无统计学差异。而联合香连丸治疗后,而治疗组的ecog评分(1.49
±
1.10,1.83
±
0.85,t=-1.63,p=0.11)低于对照组,两者具有统计学差异(见表11、图12)。
[0115]
表11免疫治疗两组治疗前后患者ecog评分情况
[0116][0117]
注:经配对t试验,p》0.05,两组资料比较无统计学差异。
[0118]
(六)肿瘤免疫治疗相关的疗效预测指标
[0119]
对两组的肿瘤免疫治疗相关的疗效预测指标进行分析,发现治疗组和对照组治疗前的nlr(5.26
±
3.07,5.80
±
5.46,t=-0.53,p=0.60)、ldh(307.86
±
249.48,312.35
±
169.55,t=-0.10,p=0.92)、dnlr(2.97
±
1.88,3.23
±
1.98,t=-0.59,p=0.56)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,nlr(4.52
±
3.98,4.75
±
4.02,t=0.81,p=0.81)、dnlr(2.56
±
1.99,2.96
±
2.33,t=0.66,p=0.41)仍无统计学差异;而治疗组的ldh低于对照组(244.21
±
125.70,364.29
±
247.37,t=2.56,p=0.02),两者具有统计学差异(见表12、图13)。
[0120]
表12免疫治疗两组患者疗效预测指标情况
[0121][0122]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异;
[0123]
(七)淋巴细胞亚群
[0124]
对两组的淋巴细胞亚群百分比进行分析,发现治疗组和对照组治疗前的总t淋巴细胞百分比(69.14
±
11.07,69.93
±
13.20,t=-0.40,p=0.79)、cd4+t%(39.10
±
11.26,39.08
±
11.58,t=-0.03,p=0.99)、cd8+t%(28.21
±
10.33,28.31
±
11.69,t=-0.12,p=0.97)、b细胞%(10.60
±
7.42,9.13
±
6.06,t=1.04,p=0.38)、nk细胞%(17.76
±
10.12,20.10
±
11.60,t=-0.82,p=0.38)、cd4+/cd8+t(1.67
±
0.97,1.74
±
1.07,t=-0.27,p=0.47)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,总t%(69.34
±
12.06,67.99
±
12.48,t=0.36,p=0.65)、cd4+t%(38.11
±
10.44,38.42
±
11.43,t=-0.09,p=0.91)、cd8+t%(29.80
±
12.40,28.94
±
11.85,t=-0.38,p=0.78)、nk细胞%(17.55
±
10.32,21.90
±
12.54,t=-1.5,p=0.13)、cd4+/cd8+t(1.59
±
0.97,1.59
±
1.04,t=-0.44,p=0.98)仍无统计学差异;而治疗组的b细胞%(11.31
±
8.21,7.73
±
4.82,t=2.36,p=0.035)高于对照组,两者具有统计学差异(见表13、图14)。
[0125]
表13免疫治疗两组患者淋巴细胞亚群百分比情况
[0126][0127][0128]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异。
[0129]
对两组的淋巴细胞亚群计数进行分析,发现治疗组和对照组治疗前的诱导t淋巴细胞计数(518.81
±
271.27,471.61
±
224.46,t=0.62,p=0.47)、b淋巴细胞计数(146.31
±
121.34,111.81
±
86.27,t=1.4,p=0.18)、nk细胞计数(912.41
±
440.17,829.80
±
324.17,t=-0.56,p=0.63)、总t淋巴细胞计数(912.41
±
440.17,829.80
±
324.17,t=0.73,p=0.39)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,诱导t淋巴细胞计数(464.71
±
244.39,447.01
±
250.21,t=0.26,p=0.77)、nk细胞计数(230.42
±
197.19,258.28
±
208.80,t=-1.11,p=0.58)、总t淋巴细胞计数(847.95
±
373.54,803.50
±
420.03,t=0.36,p=0.65)仍无统计学差异;而治疗组的b淋巴细胞计数(140.82
±
114.24,90.37
±
71.95,t=2.27,p=0.04)高于对照组,两者具有统计学差异(见表14、图15)。
[0130]
表14免疫治疗两组患者淋巴细胞亚群计数情况
[0131][0132]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异;
[0133]
(八)炎症因子
[0134]
对两组的炎症因子水平进行分析,发现治疗组和对照组治疗前的白细胞介素1(62.75
±
93.29,46.90
±
39.75,t=0.96,p=0.40)、白细胞介素2(258.58
±
156.61,324.34
±
303.42,t=0.47,p=0.30)、白细胞介素4(123.02
±
168.12,108.60
±
87.83,t=0.40,p=0.68)、白细胞介素8(36.03
±
43.02,55.07
±
60.17,t=-0.89,p=0.18)、白细胞介素10(5.02
±
0.07,5.39
±
1.72,t=-1.20,p=0.25),c反应蛋白(17.27
±
26.45,16.23
±
29.14,p=0.87)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,白细胞介素1(61.56
±
105.39,80.68
±
122.53,t=-1.11,p=0.52)、白细胞介素4(105.06
±
85.08,137.36
±
193.95,t=-0.32,p=0.41)、白细胞介素8(54.03
±
107.36,103.00
±
245.39,t=0.33,p=0.33)、白细胞介素10(7.05
±
5.27,5.88
±
3.66,t=0.54,p=0.32)、c反应蛋白(16.75
±
25.85,17.21
±
26.86,p=0.94)仍无统计学差异;而治疗组的白细胞介素2(244.88
±
139.88,398.81
±
379.28,t=-0.93,p=0.045)低于对照组,两者具有统计学差异(见表15、图16)。
[0135]
表15免疫治疗两组患者炎症因子水平情况(1)
[0136][0137]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异;
[0138]
对两组的炎症因子水平进行分析,发现治疗组和对照组治疗前的白细胞介素-12(44.61
±
5.39,47.59
±
6.03,t=-1.37,p=0.18)、白细胞介素-15(44.12
±
5.30,46.18
±
3.55,t=-1.21,p=0.24)、白细胞介素-17(47.33
±
6.48,49.48
±
3.64,t=-1.07,p=0.29)、转化生长因子-β(3174.19
±
374.53,3255.52
±
358.24,t=-0.62,p=0.54)、肿瘤坏死因子-α(74.33
±
8.46,79.25
±
10.70,t=-1.41,p=0.17)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,白细胞介素-12(46.56
±
5.39,44.66
±
5.15,t=0.96,p=0.35)、白细胞介素-15(45.92
±
5.46,43.74
±
3.61,t=1.24,p=0.23)、白细胞介素-17(49.42
±
5.04,48.00
±
3.78,t=0.84,p=0.41)、转化生长因子-β(3261.34
±
454.14,
3078.33
±
264.90,t=1.29,p=0.21)、肿瘤坏死因子-α(76.42
±
8.59,74.09
±
8.24,t=0.75,p=0.46)仍均无统计学差异(见表16、图17)。
[0139]
表16免疫治疗两组患者炎症因子水平情况(2)
[0140][0141]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异;
[0142]
(九)肠道屏障
[0143]
对两组的肠道屏障进行分析,发现治疗组和对照组治疗前的二胺氧化酶(16.16
±
30.67,9.99
±
7.10,t=0.83,p=0.37)、d乳酸(5.50
±
6.68,7.51
±
8.23,t=-0.98,p=0.39)、细菌内毒素(10.95
±
7.38,15.28
±
9.77,t=-1.02,p=0.14)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,二胺氧化酶(11.22
±
6.38,14.13
±
8.31,t=-1.47,p=0.21)、细菌内毒素(12.56
±
12.38,19.62
±
14.34,t=-1.96,p=0.10)仍无统计学差异;而治疗组的d乳酸(5.96
±
7.49,14.15
±
11.87,t=-3.39,p=0.013)低于对照组,两者具有统计学差异(见表17、图18)。
[0144]
表17免疫治疗两组患者肠道屏障水平情况
[0145][0146]
注:经配对t试验,p》0.05,两组资料比较无统计学差异;*p《0.05,两组资料比较有统计学差异;
[0147]
(十)其他指标
[0148]
对两组的肿瘤免疫治疗相关的疗效预测指标进行分析,发现治疗组和对照组治疗前的5-羟色胺(323.47
±
51.03,318.93
±
22.46,t=0.30,p=0.77)、p物质(105.06
±
16.77,105.05
±
11.42,t=0.02,p=0.99)、胃动素(605.66
±
73.19,610.56
±
52.77,t=-0.20,p=0.84)、神经细胞生长因子(361.58
±
127.48,430.77
±
71.94,t=-1.83,p=0.08)、白血病抑制因子(2185.69
±
255.10,2211.80
±
171.28,t=-0.32,p=0.75)、血管内皮细胞生长因子(252.67
±
44.77,305.33
±
135.49,t=-1.51,p=0.14)、基质金属蛋白酶9(476.80
±
51.70,498.52
±
41.00,t=-1.24,p=0.22)均无统计学差异。而联合香连丸治疗后,治疗组和对照组比较,5-羟色胺(341.85
±
57.18,311.14
±
43.72,t=1.61,p=0.12)、p物质(111.12
±
17.89,99.66
±
12.76,t=1.96,p=0.06)、神经细胞生长因子(387.50
±
140.98,471.46
±
127.95,t=-1.68,p=0.10)、白血病抑制因子(2318.62
±
276.37,2165.09
±
228.59,t=1.62,p=0.12)、血管内皮细胞生长因子(262.09
±
34.26,280.43
±
48.68,t=-1.21,p=0.24)、基质金属蛋白酶9(516.58
±
63.88,511.88
±
106.48,t=0.15,p=0.04)仍无统计学差异;而治疗组的胃动素高于对照组(647.10
±
92.83,583.11
±
62.92,t=2.14,p=0.04),两者具有统计学差异(见表18)。
[0149]
表18免疫治疗两组患者其他指标情况
[0150][0151]
最后,需要说明的是,本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1