用于治疗骨髓增生性病症的方法与流程
背景技术:
1、骨髓增生性病症(mpd)或肿瘤(mpn)是一组通常以一些或全部血细胞(血小板、白细胞和红细胞)长期增加为特征的病况[talarico等. (1998) patient care 30:37–57;yavorkovsky等. (2001) j clin oncol 19:3790–3792和campbell等(2006) n engl j med 355:2452–2-466]。该组血液病症包括真性红细胞增多症(pv)、原发性血小板增多症(et)、骨髓纤维化症(例如原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症和原发性血小板增多症后的骨髓纤维化症)以及慢性髓细胞样白血病(cml)。pv的特征在于所有3种类型血细胞的生产增加,而et表现为血小板升高。骨髓纤维化症(mf)是由于红细胞、白细胞和/或血小板的异常生成而在骨髓中形成纤维(瘢痕样)组织的疾病。cml的特征在于骨髓中主要是髓样细胞的增加和不受调节的生长以及这些细胞在外周血中的积聚。
2、通常认为mpd是由造血干细胞的转化引起的。事实上,cml现在由其致病分子病变 bcr-abl融合基因定义,其最常见由费城染色体易位(ph)导致。因此,cml被表征为 bcr-abl阳性(+)骨髓增生性病症。这种确定的分子缺陷的发现导致治疗cml的药物伊马替尼甲磺酸盐(gleevec; novartis, basel, switzerland)的开发[druker等 . (2001) n engl j med344:1031–1037]。
3、其它三种骨髓增生性肿瘤(pv、et和mf)表征为 bcr-abl阴性骨髓增生性病症。最近,有几个研究小组将酪氨酸激酶 jak2的功能获得性突变 (jak2v617f)鉴定为约90%pv患者、约50%et患者和约50-60%mf患者的主要分子缺陷[baxter等. (2005) lancet 365:1054-1061; james等 (2005) nature 434:1144-1148; kralovics (2005) n. engl. j. med. 352:1770-1790]。有趣的是,最近的研究已经证明,从医院患者收集的血样中有近1%测试为 jak2v617f突变阳性[xu等 . (2007) blood 109:339–342]。这些 jakv617f阳性患者大多数不符合诊断mpd的标准,但以高于 jakv617f阴性患者的比率发展血管疾病,包括血栓形成、冠心病、动脉硬化、脑缺血和脑梗塞。这些数据表明mpd和前mpd病况可能代表比最初预期更深刻的公共健康问题,并进一步强调了 jak2v617f以及其它janus激酶突变的病理重要性。
4、同种异体造血干细胞移植是 bcr-abl阴性mpd的唯一已知疗法[gupta等. (2012) blood 120:1367-1379]。然而,干细胞治疗相关的死亡率很高,只有少数患者有资格接受移植。尽管jak抑制剂的开发和使用代表了显著的治疗进展,但是它们在治疗 bcr-abl阴性mpd中的应用存在明显的限制。特别是,jak抑制剂似乎可用于减少骨髓纤维化症患者中的脾肿大;然而,它们对疾病的影响在很大程度上却是姑息性的[gupta等 . (2012) blood 120:1367-1379]。特别地,jak抑制剂对疾病的许多表现(并发症)有很少至没有影响,所述表现包括例如血细胞减少症、输血依赖性、加速或急变期(blast phase)疾病和纤维化。此外,jak抑制剂已显示在一些患者中促进或恶化血小板减少症、贫血症和嗜中性白细胞减少症。
5、因此,对于治疗mpd和janus激酶相关病症的有效疗法存在高度未满足的需求。因此,本公开内容的目的是提供治疗、预防mpd或janus激酶相关病症或mpd或janus激酶相关病症的一种或多种并发症,或降低其进展速率和/或严重性的方法。
技术实现思路
1、部分地,本公开内容涉及以下发现:tgfβ ii型受体(tβrii)拮抗剂(抑制剂)可用于治疗骨髓纤维化症,特别是改善疾病的各种并发症,所述并发症包括例如纤维化、脾肿大和炎性并发症。具体而言,本文提供的数据显示tβrii多肽减少骨髓纤维化症的jak2v617f模型中的纤维化、脾肿大和炎症。这些数据表明tβrii拮抗剂可用于治疗骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症、以及原发性血小板减少症后的骨髓纤维化症)以及其它骨髓增生性病症,包括例如真性红细胞增多症和原发性血小板减少症。此外,来自jak2v617f模型的数据表明可以使用tβrii拮抗剂治疗janus激酶相关病症,特别是与升高的或组成型janus激酶活性(例如升高的或组成型jak2活性)相关的病症。因此,在某些方面,本公开涉及通过向有需要的患者施用有效量的一种或多种tβrii拮抗剂,任选地与用于治疗骨髓增生性病症或janus激酶相关病症的一种或多种其它支持疗法或活性剂组合,用于治疗、预防骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)或janus激酶相关病症或骨髓增生性病症的一种或多种并发症(例如纤维化、脾肿大和炎症)或janus激酶相关病症的一种或多种并发症,或降低其进展速率和/或严重性的组合物和方法。尽管tβrii多肽可以通过除tβrii拮抗作用以外的机制影响骨髓增生性病症和janus激酶相关病症[例如,tgfβ1、tgfβ2和tgfβ3中的一种或多种的抑制可能是药剂抑制一系列其它试剂,包括可能tgf-β超家族的其它成员的活性的趋势的指示剂,以及这种集体抑制可能导致对例如骨髓增生性病症和janus激酶相关病症的所需效应],但本公开内容仍然证明可以基于tβrii拮抗作用选择所需治疗剂。因此,虽然不希望受限于特定的作用机制,但预计其它tβrii拮抗剂[例如tβrii受体的拮抗剂,一种或多种tβrii-结合配体(例如tgfβ1、tgfβ2和tgfβ3)的拮抗剂,一种或多种tβrii相关i型受体(例如alk5)的拮抗剂,一种或多种tβrii相关共同受体(β聚糖)的拮抗剂,一种或多种tβrii下游信号传导组分(例如smads)的拮抗剂或这些拮抗剂组合]可用于治疗骨髓增生性病症或janus激酶相关病症,特别是用于治疗、预防一种或多种骨髓增生性病症或janus激酶相关病症并发症或降低其进展速率和/或严重性。这些药剂在本文中统称为“tβrii拮抗剂”或“tβrii抑制剂”。
2、因此,在某些方面,本公开内容涉及用于治疗janus激酶相关病症的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防janus激酶相关病症的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低janus激酶相关病症的进展速率的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低janus激酶相关病症的严重性的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗janus激酶相关病症的一种或多种并发症的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防janus激酶相关病症的一种或多种并发症的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低janus激酶相关病症的一种或多种并发症的进展速率的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低janus激酶相关病症的一种或多种并发症的严重性的方法,其包括向有需要的患者施用有效量的tβrii拮抗剂。在一些实施方案中,本公开内容涉及用于治疗、预防以下的janus激酶相关性病症的一种或多种并发症或降低其进展速率和/或严重性的方法:无效造血、髓外造血(例如脾髓外造血、肝髓外造血、肺髓外造血和淋巴髓外造血)、炎性并发症、全血细胞减少症、纤维化(例如骨髓纤维化、脾纤维化和肝纤维化)、脾肿大、肝肿大、血小板减少症、贫血症、异型红细胞症、进行性肝脾肿大、疲劳、体重减轻、盗汗、发热、瘙痒症、骨痛、早饱、腹痛或不适、关节痛、肌痛、感觉异常、恶病质、脾梗塞、出血、炎症、嗜中性白细胞减少症、细胞因子水平升高、凝血障碍、il-6介导的炎症或炎性并发症、骨硬化症和骨髓纤维化症。在一些实施方案中,janus激酶相关病症与一种或多种功能获得性janus激酶突变相关。在一些实施方案中,janus激酶相关病症与选自jak1、jak2和jak3的一种或多种janus激酶中的一种或多种功能获得性janus激酶突变相关。在一些实施方案中,janus激酶相关病症与jak2中的一种或多种功能获得性janus激酶突变相关。在一些实施方案中,janus激酶相关病症与一种或多种janus激酶的升高的激酶活性(例如与例如相同年龄和性别的健康受试者相比升高的激酶活性)相关。在一些实施方案中,janus激酶相关病症与一种或多种janus激酶的组成型激酶活性相关。在一些实施方案中,janus激酶相关病症与选自jak1、jak2或jak3的一种或多种janus激酶的升高的或组成型激酶活性相关。在一些实施方案中,janus激酶相关病症与jak2的升高的或组成型激酶活性相关。在一些实施方案中,janus激酶相关病症是jak2相关病症。在一些实施方案中,janus激酶相关病症是jak2v617f相关病症。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有骨髓纤维化症。在一些实施方案中,具有janus激酶相关病症的患者具有原发性骨髓纤维化症。在一些实施方案中,具有janus激酶相关病症的患者具有真性红细胞增多症后的骨髓纤维化症。在一些实施方案中,具有janus激酶相关病症的患者具有原发性血小板增多症后的骨髓纤维化症。在一些实施方案中,本公开内容涉及用于在具有骨髓纤维化症的患者中治疗、预防janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,所述并发症选自:无效造血、髓外造血(例如脾髓外造血、肝髓外造血、肺髓外造血和淋巴髓外造血)、炎性并发症、全血细胞减少症、纤维化(例如骨髓纤维化、脾纤维化和肝纤维化)、脾肿大、肝肿大、血小板减少症、贫血症、异型红细胞症、进行性肝脾肿大、疲劳、体重减轻、盗汗、发热、瘙痒症、骨痛、早饱、腹痛或不适、关节痛、肌痛、感觉异常、恶病质、脾梗塞、出血、炎症、嗜中性白细胞减少症、细胞因子水平升高、凝血障碍、il-6介导的炎症或炎性并发症、骨硬化症、骨髓纤维化症和出血。在一些实施方案中,根据国际预后评分系统(ipss),具有janus激酶相关病症的患者具有低风险的骨髓纤维化症。在一些实施方案中,根据ipss,具有janus激酶相关病症的患者具有中等-1风险的骨髓纤维化症。在一些实施方案中,根据ipss,具有janus激酶相关病症的患者具有中等-2风险的骨髓纤维化症。在一些实施方案中,根据ipss,具有janus激酶相关病症的患者具有高风险的骨髓纤维化症。在一些实施方案中,根据动态ipss(dipss),具有janus激酶相关病症的患者具有低风险的骨髓纤维化症。在一些实施方案中,根据dipss,具有janus激酶相关病症的患者具有中等-1风险的骨髓纤维化症。在一些实施方案中,根据dipss,具有janus激酶相关病症的患者具有中等-2风险的骨髓纤维化症。在一些实施方案中,根据dipss,具有janus激酶相关病症的患者具有高风险的骨髓纤维化症。在一些实施方案中,根据dipss-plus,具有janus激酶相关病症的患者具有低风险的骨髓纤维化症。在一些实施方案中,根据dipss-plus,具有janus激酶相关病症的患者具有中等-1风险的骨髓纤维化症。在一些实施方案中,根据dipss-plus,具有janus激酶相关病症的患者具有中等-2风险的骨髓纤维化症。在一些实施方案中,根据dipss-plus,具有janus激酶相关病症的患者具有高风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中所述患者具有真性红细胞增多症。在一些实施方案中,本公开内容涉及用于在具有真性红细胞增多症的患者中治疗、预防janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,所述并发症选自:疲劳、瘙痒症、盗汗、骨痛、发热、和体重减轻、脾肿大、肝肿大、腹痛、早饱、恶心、腹部器官受压、门静脉高血压、血管事件、血栓栓塞事件、大出血、血栓形成、大血管并发症、头痛、头晕、视力障碍、远端感觉异常、手足发绀、红斑性肢痛、类红细胞过度增殖、髓样细胞过度增殖、巨核细胞过度增殖、高红细胞水平、高白细胞水平、高血小板水平、炎性细胞因子升高、炎性并发症和il-6介导的炎性并发症。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的真性红细胞增多症。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的真性红细胞增多症并且没有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的真性红细胞增多症并且具有或先前具有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的真性红细胞增多症。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的真性红细胞增多症并且没有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的真性红细胞增多症并且具有或先前具有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的真性红细胞增多症并且对羟基脲治疗难治。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的真性红细胞增多症并且不耐受用羟基脲治疗。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有原发性血小板增多症。在一些实施方案中,本公开内容涉及用于在具有原发性血小板增多症的患者中治疗、预防janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,所述并发症选自:血小板增多症、低白细胞计数、低血红蛋白水平、低乳酸脱氢酶(ldh)水平、疲劳、盗汗、恶心、麻木、视力障碍、体重减轻、微血管并发症、头痛、胸痛、头晕、红斑性肢痛、脾肿大、肝肿大、炎性并发症、il-6炎性并发症、炎性细胞因子水平升高、il-6水平升高和大出血。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的原发性血小板增多症。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的原发性血小板增多症并且没有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有低风险的原发性血小板增多症并且具有或先前具有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的原发性血小板增多症。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的原发性血小板增多症并且没有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的原发性血小板增多症并且具有或先前具有血栓形成史。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的原发性血小板增多症并且对羟基脲治疗难治。在一些实施方案中,具有janus激酶相关病症的患者具有高风险的原发性血小板增多症并且不耐受用羟基脲治疗。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有纤维化。在一些实施方案中,本公开内容涉及用于在janus激酶相关病症患者中治疗、预防纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于在janus激酶相关病症患者中治疗、预防纤维化或降低其进展速率和/或严重性的方法,其中所述纤维化在选自以下的一种或多种器官/组织中:脾、肝、肺、淋巴结和骨髓。在一些实施方案中,本公开内容涉及用于在janus激酶相关病症患者中治疗、预防脾纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于在janus激酶相关病症患者中治疗、预防骨髓纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,具有janus激酶相关病症的患者根据bauermeister评分系统具有等级0骨髓纤维化。在一些实施方案中,具有janus激酶相关病症的患者根据bauermeister评分系统具有等级1骨髓纤维化。在一些实施方案中,具有janus激酶相关病症的患者根据bauermeister评分系统具有等级2骨髓纤维化。在一些实施方案中,具有janus激酶相关病症的患者根据bauermeister评分系统具有等级3骨髓纤维化。在一些实施方案中,具有janus激酶相关病症的患者根据bauermeister评分系统具有等级4骨髓纤维化。在一些实施方案中,本公开内容的方法涉及在具有janus激酶相关病症的患者中将骨髓纤维化减少根据bauermeister评分系统的至少1个等级(例如从4至3、4至2、4至1、4至0、3至2、3至1、3至0、2至1、2至0或1至0骨髓纤维化的等级降低)。在一些实施方案中,本公开内容的方法涉及在具有janus激酶相关病症的患者中预防或延缓根据bauermeister评分系统的骨髓纤维化等级进展(例如,预防或延缓骨髓纤维化从0至1、0至2、0至3、0至4、1至2、1至3、1至4、2至3、2至4或3至4的等级进展)。在一些实施方案中,根据欧洲共识评分系统,具有janus激酶相关病症的患者具有等级1骨髓纤维化。在一些实施方案中,根据欧洲共识评分系统,具有janus激酶相关病症的患者具有等级2骨髓纤维化。在一些实施方案中,根据欧洲共识评分系统,具有janus激酶相关病症的患者具有等级3骨髓纤维化。在一些实施方案中,本公开内容的方法涉及在具有janus激酶相关病症的患者中将骨髓纤维化减少根据欧洲共识评分系统的至少1个等级(例如从3至2、3至1、3至0、2至1、2至0或1至0骨髓纤维化的等级降低)。在一些实施方案中,本公开内容的方法涉及在具有janus激酶相关病症的患者中预防或延缓根据欧洲共识评分系统的骨髓纤维化等级进展(例如,预防或延迟骨髓纤维化从0至1、0至2、0至3、1至2、1至3、2至3的等级进展)。在一些实施方案中,本公开内容涉及在janus激酶相关病症患者中预防纤维化或降低其进展速率和/或严重性的方法,其中tβrii拮抗剂在纤维化发作前施用。在一些实施方案中,本公开内容涉及在janus激酶相关病症患者中治疗纤维化或降低其进展速率和/或严重性的方法,其中tβrii拮抗剂在纤维化发作后施用。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有器官/组织增大(例如,与例如相同年龄和性别的健康受试者相比,增加的器官/组织尺寸和/或重量)。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者中器官/组织增大或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的器官/组织增大或降低其进展速率和/或严重性的方法,其中一种或多种器官/组织选自脾、肝、肺和淋巴结。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的脾增大或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的肝增大或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有器官/组织炎症(例如,与例如相同年龄和性别的健康受试者相比,器官/组织炎症增加)。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的器官/组织炎症或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症患者的器官/组织炎症或降低其进展速率和/或严重性的方法,其中一种或多种器官/组织选自:脾、肝、肺和淋巴结。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的脾炎症或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的肝炎症或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有脾肿大。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的脾肿大或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有肝肿大。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的肝肿大或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有髓外造血。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的髓外造血或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于在janus激酶相关病症患者中治疗、预防髓外造血或降低其进展速率和/或严重性的方法,其中一种或多种器官/组织选自:脾、肝、淋巴结和肺。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有升高的炎性细胞因子水平(例如与例如相同年龄和性别的健康受试者相比升高的炎性细胞因子水平)。在一些实施方案中,本公开内容涉及用于降低janus激酶相关病症患者的一种或多种器官/组织中的炎性细胞因子水平(例如,血清细胞因子水平)的方法。在一些实施方案中,本公开内容涉及降低janus激酶相关病症患者的一种或多种器官/组织中il-6水平的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中所述患者具有低红细胞水平(例如,与例如相同年龄和性别的健康受试者相比,低红细胞水平)。在一些实施方案中,本公开内容涉及用于增加janus激酶相关病症患者的红细胞水平的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者的血红蛋白水平低(例如,与例如相同年龄和性别的健康受试者相比,血红蛋白水平低)。在一些实施方案中,本公开内容涉及用于增加janus激酶相关病症患者中的血红蛋白水平的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有贫血症。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症患者的贫血症或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中在tβrii拮抗剂治疗开始之前已经给患者施用一次或多次血细胞输血。在一些实施方案中,具有janus激酶相关病症的患者是血细胞输血依赖性的。在一些实施方案中,本公开内容涉及用于降低具有janus激酶相关病症的患者的血细胞输血负荷的方法。在一些实施方案中,本公开内容涉及用于降低具有janus激酶相关病症的患者的血细胞输血负荷的方法,其中相对于tβrii拮抗剂治疗开始之前的相等时间,所述方法使血细胞输血减少大于约30%、40%、50%、60%、70%、80%、90%或100%,持续4至8周。在一些实施方案中,本公开内容涉及用于降低具有janus激酶相关病症的患者的血细胞输血负荷的方法,其中相对于tβrii拮抗剂治疗开始之前的相等时间,所述方法使血细胞输血减少大于约50%,持续4至8周。在某些方面,具有janus激酶相关病症的患者具有铁过载。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症患者的铁过载或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症患者的脾(脾的)铁过载或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防janus激酶相关病症中的肝(肝的)铁过载或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症中的心脏(心脏的)铁过载或降低其进展速率和/或严重性的方法。在某些方面,本公开内容涉及减少janus激酶相关病症患者的等位基因负荷的方法。在一些实施方案中,本公开内容涉及减少janus激酶相关病症患者中一种或多种janus激酶等位基因的等位基因负荷的方法。在一些实施方案中,本公开内容涉及用于减少janus激酶相关病症患者中选自jak1、jak2和jak3的一种或多种janus激酶等位基因的等位基因负荷的方法。在一些实施方案中,本公开内容涉及用于减少janus激酶相关病症患者中一个或多个jak2等位基因的等位基因负荷的方法。在一些实施方案中,本公开内容涉及用于减少janus激酶相关病症患者中与一个或多个突变相关的一种或多种janus激酶等位基因的等位基因负荷的方法,所述一个或多个突变导致一种或多种janus激酶的升高的(例如,与例如相同年龄和性别的健康受试者相比升高的janus激酶活性)或组成型激活。在一些实施方案中,本公开内容涉及用于减少janus激酶相关病症患者中jak2v617f的等位基因负荷的方法。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用janus激酶抑制剂治疗。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者不耐受用janus激酶抑制剂(例如鲁索替尼)治疗。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者对janus激酶抑制剂(例如鲁索替尼)治疗难治。在一些实施方案中,具有janus激酶相关病症的患者已经用抑制至少jak2的janus激酶抑制剂治疗。在一些实施方案中,具有janus激酶相关病症的患者已经用janus激酶抑制剂治疗,所述janus激酶抑制剂选自:鲁索替尼、fedratinib (sar302503)、monoelotinib (cyt387)、pacritinib、来他替尼、azd-1480、bms-911543、ns-018、ly2784544、sep-701、xl019和at-9283。在一些实施方案中,具有janus激酶相关病症的患者已经用鲁索替尼治疗。在某些方面,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用羟基脲治疗。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中所述患者不耐受用羟基脲治疗。在一些实施方案中,本公开内容涉及治疗、预防janus激酶相关病症或janus激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中所述患者对用羟基脲治疗难治。
3、因此,在某些方面,本公开内容涉及用于治疗骨髓增生性病症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防骨髓增生性病症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓增生性病症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓增生性病症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗骨髓增生性病症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防骨髓增生性病症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓增生性病症的一种或多种并发症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓增生性病症的一种或多种并发症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的一种或多种并发症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低骨髓纤维化症(例如,原发性骨髓纤维化症、真性红细胞增多症后的骨髓纤维化症或原发性血小板减少症后的骨髓纤维化症)的一种或多种并发症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗真性红细胞增多症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防真性红细胞增多症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低真性红细胞增多症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低真性红细胞增多症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗真性红细胞增多症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防真性红细胞增多症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低真性红细胞增多症的一种或多种并发症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低真性红细胞增多症的一种或多种并发症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗原发性血小板增多症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及预防原发性血小板增多症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低原发性血小板增多症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低原发性血小板增多症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于治疗原发性血小板增多症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于预防原发性血小板增多症的一种或多种并发症的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低原发性血小板增多症的一种或多种并发症的进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及用于降低原发性血小板增多症的一种或多种并发症的严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据国际预后评分系统(ipss)患者具有低风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法骨髓纤维化症的并发症,其中根据ipss患者具有中等-1风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据ipss患者具有中等-2风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据ipss患者具有高风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据动态ipss(dipss)患者具有低风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss所述患者具有中等-1风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss患者具有中等-2风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss患者具有高风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss-plus患者具有低风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss-plus患者具有中等-1风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss-plus患者具有中等-2风险的骨髓纤维化症。在某些方面,本公开内容涉及治疗、预防骨髓纤维化症或骨髓纤维化症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中根据dipss-plus患者具有高风险的骨髓纤维化症。在某些方面,根据用于骨髓纤维化症(例如,ipss、dipps和dipss-plus)的任何公认的风险分层模型,tβrii拮抗剂可用于预防或延缓骨髓纤维化症的风险进展。例如,在一些实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可用于预防或延缓骨髓纤维化症从低风险至中等-1风险的风险进展。在其它实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可用于预防或延缓骨髓纤维化症从中级-1风险进展至中级-2风险的风险进展。在其它实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可以用于预防或延缓骨髓纤维化症从中级-2风险至高风险的风险进展。在某些方面,根据用于骨髓纤维化症(例如,ipss、dipps和dipss-plus)的任何公认的风险分层模型,tβrii拮抗剂可用于促进或增加骨髓纤维化症风险消退。例如,在一些实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可用于促进或增加骨髓纤维化症从高风险至中等-2风险的风险消退。在其它实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可用于促进或增加骨髓纤维化症从中等-2风险至中等-1风险的风险消退。在其它实施方案中,根据ipss、dipps或dipss-plus,tβrii拮抗剂可用于促进或增加骨髓纤维化症从中等-1风险至低风险的风险消退。在某些方面,本公开内容涉及治疗、预防真性红细胞增多症或真性红细胞增多症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有低风险的真性红细胞增多症。在一些实施方案中,患者具有低风险的真性红细胞增多症并且没有血栓形成史。在一些实施方案中,患者具有低风险的真性红细胞增多症并且具有或先前具有血栓形成。在某些方面,本公开内容涉及治疗、预防真性红细胞增多症或真性红细胞增多症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有高风险的真性红细胞增多症。在一些实施方案中,患者具有高风险的真性红细胞增多症并且没有血栓形成史。在一些实施方案中,患者具有高风险的真性红细胞增多症并且具有或先前具有血栓形成。在一些实施方案中,患者具有高风险的真性红细胞增多症并且对用羟基脲治疗难治或不耐受。在某些方面,本公开内容涉及治疗、预防原发性血小板减少症或原发性血小板减少症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有低风险的原发性血小板减少症。在一些实施方案中,患者具有低风险的原发性血小板减少症并且没有血栓形成史。在一些实施方案中,患者具有低风险的原发性血小板减少症并且具有或先前具有血栓形成。在某些方面,本公开内容涉及治疗、预防原发性血小板减少症或原发性血小板减少症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有高风险的原发性血小板减少症。在一些实施方案中,患者具有高风险的原发性血小板减少症并且没有血栓形成史。在一些实施方案中,患者具有高风险的原发性血小板减少症并且具有或先前具有血栓形成。在一些实施方案中,患者具有高风险的原发性血小板减少症并且对用羟基脲治疗难治或不耐受。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板增多症)或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者包含一个或多个基因突变或与骨髓增生性病症相关的其它分子标志物。例如,在一些实施方案中,tβrii拮抗剂可用于治疗、预防骨髓增生性病症或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性,其中所述骨髓增生性病症与选自idh1、idh2、ezh2、srsf2、asxl1、jak1、jak2、jak3、tyk2、mpl、calr、tet2、thpo和lnk的一个或多个基因中的一个或多个突变相关。在一些实施方案中,骨髓增生性病症与janus激酶(jak)(例如jak1、jak2和/或jak3)中的一个或多个基因突变相关。在一些实施方案中,骨髓增生性病症与一个或多个jak2突变相关。在一些实施方案中,骨髓增生性病症与一个或多个功能获得性janus激酶突变相关。在一些实施方案中,骨髓增生性病症与一种或多种选自jak1、jak2和jak3的janus激酶中的一个或多个功能获得性janus激酶突变相关。在一些实施方案中,骨髓增生性病症与jak2中的一个或多个功能获得性janus激酶突变相关。在一些实施方案中,骨髓增生性病症与一种或多种janus激酶的升高的激酶活性(例如,与例如相同年龄和性别的健康受试者相比升高的激酶活性)相关。在一些实施方案中,骨髓增生性病症与一种或多种janus激酶的组成型激酶活性相关。在一些实施方案中,骨髓增生性病症与选自jak1、jak2或jak3的一种或多种janus激酶的升高的或组成型激酶活性相关。在一些实施方案中,骨髓增生性病症与jak2的升高的或组成型激酶活性相关。在一些实施方案中,骨髓增生性病症是jak2相关病症。在一些实施方案中,骨髓增生性病症与选自以下的一种或多种遗传标志物有关:对于jak2 46/1单倍型的缺合子性、jak2v617f、calr+asxl1-、calr-askl1+、calr+askl1+和calr-askl1-。在一些实施方案中,骨髓增生性病症与jak2v617f突变相关。在一些实施方案中,所述方法降低患者中骨髓增生性病症相关等位基因负荷。在一些实施方案中,所述方法降低一个或多个jak2突变的等位基因负荷。在一些实施方案中,该方法降低jak2v617f的等位基因负荷。在一些实施方案中,所述方法降低选自idh1、idh2、ezh2、srsf2、asxl1、jak1、jak3、tyk2、mpl、calr、tet2、thpo和lnk的一个或多个基因中的一个或多个突变的等位基因负荷。在一些实施方案中,所述方法降低选自选自以下的一种或多种遗传标志物的等位基因负荷:对于jak2 46/1单倍型的缺合子性、calr+asxl1-、calr-askl1+、calr+askl1+和calr-askl1-。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板增多症)或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中骨髓纤维化症与一种或多种升高的血清标志物相关,所述升高的血清标志物选自:升高的血清il-8水平,升高的血清il-2r水平和升高的无血清轻链水平。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板增多症)或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用janus激酶抑制剂治疗。在一些实施方案中,患者已经用jak2抑制剂治疗。在一些实施方案中,患者已经用选自以下的janus激酶抑制剂治疗:鲁鲁索替尼、fedratinib (sar302503)、monoelotinib (cyt387)、pacritinib、来他替尼、azd-1480、bms-911543、ns-018、ly2784544、sep-701、xl019和at-9283。在一些实施方案中,患者已经用鲁索替尼治疗。在一些实施方案中,tβrii拮抗剂可用于治疗、预防骨髓增生性病症或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者不耐受janus激酶抑制剂。在一些实施方案中,tβrii拮抗剂可用于治疗、预防骨髓增生性病症或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者对janus激酶抑制剂的反应不足。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板增多症)或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用羟基脲治疗。在一些实施方案中,tβrii拮抗剂可用于治疗、预防骨髓增生性病症或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者不耐受羟基脲。在一些实施方案中,tβrii拮抗剂可用于治疗、预防骨髓增生性病症或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者对羟基脲的反应不足。
4、如本文所述的骨髓增生性病症是造血系统的克隆性肿瘤疾病,其与在患者疾病进展过程中可能出现的各种临床并发症有关。本公开内容的实施例证明可以使用tβrii拮抗剂来减轻众多的这些临床并发症,表明相对于许多目前的骨髓增生性病症疗法(其仅治疗一种或有限数量的疾病并发症),tβrii拮抗剂可以用于更广泛地治疗骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的各种并发症。因此,在某些方面,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防一种或多种体质症状(例如,疲劳、体重减轻、盗汗、发热、瘙痒症、早饱、腹痛或不适、关节痛、肌痛、感觉异常、恶心、腹部器官受压、头痛和恶病质),或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防骨痛或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者的视力障碍或降低其进展速率和/或严重性。在某些方面,本公开内容涉及治疗、预防骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症))或骨髓增生性病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者具有纤维化。在一些实施方案中,本公开内容涉及用于治疗、预防骨髓增生性病症患者的纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防骨髓增生性病症患者的纤维化或降低其进展速率和/或严重性的方法,其中纤维化在选自以下的一种或多种器官/组织中:脾、肝、肺、淋巴结和骨髓。在一些实施方案中,本公开内容涉及治疗、预防骨髓增生性病症患者的脾纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及用于治疗、预防骨髓增生性病症患者的骨髓纤维化或降低其进展速率和/或严重性的方法。在一些实施方案中,根据bauermeister评分系统,具有骨髓增生性病症的患者具有等级0骨髓纤维化。在一些实施方案中,根据bauermeister评分系统,具有骨髓增生性病症的患者具有等级1骨髓纤维化。在一些实施方案中,根据bauermeister评分系统,具有骨髓增生性病症的患者具有等级2骨髓纤维化。在一些实施方案中,根据bauermeister评分系统,具有骨髓增生性病症的患者具有等级3骨髓纤维化。在一些实施方案中,根据bauermeister评分系统,具有骨髓增生性病症的患者具有等级4骨髓纤维化。在一些实施方案中,本公开内容的方法涉及在具有骨髓增生性病症的患者中将骨髓纤维化减少根据bauermeister评分系统的至少1个等级(例如从4至3、4至2、4至1、4至0、3至2、3至1、3至0、2至1、2至0或1至0骨髓纤维化的等级降低)。在一些实施方案中,本公开内容的方法涉及在具有骨髓增生性病症的患者中预防或延缓根据bauermeister评分系统的骨髓纤维化等级进展(例如,预防或延缓骨髓纤维化从0至1、0至2、0至3、0至4、1至2、1至3、1至4、2至3、2至4或3至4的等级进展)。在一些实施方案中,根据欧洲共识评分系统,具有骨髓增生性病症的患者具有等级1骨髓纤维化。在一些实施方案中,根据欧洲共识评分系统,具有骨髓增生性病症的患者具有等级2骨髓纤维化。在一些实施方案中,根据欧洲共识评分系统,具有骨髓增生性病症的患者具有等级3骨髓纤维化。在一些实施方案中,本公开内容的方法涉及在具有骨髓增生性病症的患者中将骨髓纤维化减少根据欧洲共识评分系统的至少1个等级(例如从3至2、3至1、3至0、2至1、2至0或1至0骨髓纤维化的等级降低)。在一些实施方案中,本公开内容的方法涉及在具有骨髓增生性病症的患者中预防或延缓根据欧洲共识评分系统的骨髓纤维化等级进展(例如,预防或延迟骨髓纤维化从0至1、0至2、0至3、1至2、1至3、2至3的等级进展)。在一些实施方案中,本公开内容涉及预防骨髓增生性病症中的纤维化或降低其进展速率和/或严重性的方法,其中tβrii拮抗剂在纤维化发作前施用。在一些实施方案中,本公开内容涉及治疗骨髓增生性病症患者中的纤维化或降低其进展速率和/或严重性的方法,其中tβrii拮抗剂在纤维化发作后施用。在某些方面,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防器官/组织(例如脾、肝、淋巴结和肺)炎症(例如,与例如相同年龄和性别的健康受试者相比增加的器官/组织尺寸)和/或增大(例如,与例如相同年龄和性别的健康受试者相比增加的器官/组织大小和/或重量)或降低其进展速率和/或严重性。在一些实施方案中,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防脾肿大或降低其进展速率和/或严重性。在一些实施方案中,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防肝肿大或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于在具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防脾梗塞或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于在具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中治疗、预防一种或多种炎性并发症或降低其进展速率和/或严重性。在一些实施方案中,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中的炎性细胞因子水平。在一些实施方案中,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者的il6水平。在一些实施方案中,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中一种或多种il6相关并发症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者的髓外造血(例如,脾髓外造血、肝外髓血造血、肺外髓造血和淋巴髓外造血)或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者的血管并发症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者中的血栓形成或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者的大出血或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的无效红细胞生成或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的无效红细胞生成或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的全血细胞减少症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的全血细胞减少症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的血小板减少症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的贫血症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者中的异型红细胞症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的嗜中性白细胞减少症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的骨硬化症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者中骨髓纤维化症或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如真性红细胞增多症)的患者的一种或多种血细胞(例如,类红细胞、髓样细胞和巨核细胞)的过度增殖或降低其进展速率和/或严重性。在某些方面,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如真性红细胞增多症)的患者中的红细胞水平。在某些方面,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如真性红细胞增多症)的患者中的白细胞水平。在某些方面,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如真性红细胞增多症和原发性血小板增多症)的患者的血小板水平。在某些方面,本公开内容涉及通过施用有效量的tβrii拮抗剂来增加具有骨髓增生性病症(例如骨髓纤维化症)的患者的红细胞水平。在某些方面,公开内容涉及通过施用有效量的tβrii拮抗剂来增加具有骨髓增生性病症(例如骨髓纤维化症)的患者的血红蛋白水平。在某些方面,根据本文所述方法治疗的具有骨髓增生性病症(例如骨髓纤维化症)的患者具有贫血症。在一些实施方案中,tβrii拮抗剂可用于治疗、预防具有骨髓增生性病症(例如骨髓纤维化症)的患者的贫血症或降低其进展速率和/或严重性。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防已经施用一次或多次血细胞输血(全血或红细胞输血)的患者中的骨髓增生性病症(例如骨髓纤维化症)或骨髓增生性病症并发症或降低其进展速率和/或严重性的方法。在一些实施方案中,本公开内容涉及使用tβrii拮抗剂治疗、预防血细胞输血依赖性患者中骨髓增生性病症(例如骨髓纤维化症)或骨髓增生性病症并发症或降低其进展速率和/或严重性的方法。在某些方面,tβrii拮抗剂可用于降低(减少)具有骨髓增生性病症(例如骨髓纤维化症)的患者的血细胞输血负荷。例如,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症)的患者中相对于tβrii拮抗剂治疗开始之前的相等时间,使血细胞输血减少大于约30%、40%、50%、60%、70%、80%、90%或100%,持续4至8周。在一些实施方案中,tβrii拮抗剂可用于在具有骨髓增生性病症(例如骨髓纤维化症)的患者中相对于tβrii拮抗剂治疗开始之前的相等时间,使血细胞输血减少大于约50%,持续4至8周。在某些方面,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症)的患者的铁过载。例如,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症)的患者的器官和/或组织中的铁过载。在一些实施方案中,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症)的患者脾中的铁过载。在一些实施方案中,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症)的患者肝中的铁过载。在一些实施方案中,tβrii拮抗剂可用于降低具有骨髓增生性病症(例如骨髓纤维化症)的患者心脏中的铁过载。
5、部分地,本公开内容涉及治疗、预防jak2激酶相关病症或降低其严重性或进展速率的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。在一些实施方案中,患者具有jak2v617f突变相关病症。在某些方面,本公开内容涉及用于治疗、预防jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,所述方法包括向有需要的患者施用有效量的tβrii拮抗剂。例如,在一些实施方案中,jak2激酶相关病症的一种或多种并发症选自:无效造血、髓外造血(例如脾髓外造血、肝髓外造血、肺髓外造血和淋巴髓外造血)、炎性并发症、全血细胞减少症、纤维化(例如骨髓纤维化、脾纤维化和肝纤维化)、脾肿大、肝肿大、血小板减少症、贫血症、异型红细胞症、进行性肝脾肿大、疲劳、体重减轻、盗汗、发热、瘙痒症、骨痛、早饱、腹痛或不适、关节痛、肌痛、感觉异常、恶病质、脾梗塞、出血、炎症、中性白细胞减少症、细胞因子水平升高、凝血障碍、il-6介导的炎症或炎性并发症、骨硬化症和骨髓纤维化症。在某些方面,本公开内容涉及使用tβrii拮抗剂来治疗、预防jak2激酶相关病症或jak2激酶相关病症(例如,jak2功能获得性相关病症)的一种或多种并发症或降低其进展速率和/或严重性,其中患者进一步包含一个或多个额外的基因突变或与骨髓增生性病症相关的其它分子标志物。例如,在一些实施方案中,tβrii拮抗剂可用于治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性,其中骨髓增生性病症疾病进一步与选自idh1、idh2、ezh2、srsf2、asxl1、tyk2、mpl、calr、tet2、thpo和lnk的一个或多个基因中的一个或多个突变相关。在一些实施方案中,jak2激酶相关病症进一步与选自以下的一种或多种遗传标志物相关:对于jak246/1单倍型的缺合子性、jak2v617f、calr+asxl1-、calr-askl1+、calr+askl1+和calr-askl1-。在一些实施方案中,所述方法降低患者中jak2相关病症等位基因负荷。在一些实施方案中,所述方法降低一个或多个jak2突变的等位基因负荷。在一些实施方案中,所述方法降低jak2v617f的等位基因负荷。在一些实施方案中,所述方法降低选自idh1、idh2、ezh2、srsf2、asxl1、jak1、jak3、tyk2、mpl、calr、tet2、thpo和lnk的一个或多个基因中的一个或多个突变的等位基因负荷。在一些实施方案中,所述方法降低选自以下的一种或多种遗传标志物的等位基因负荷:对于jak2 46/1单倍型的缺合子性、calr+asxl1-、calr-askl1+、calr+askl1+和calr-askl1-。在某些方面,本公开内容涉及使用tβrii拮抗剂治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中jak2激酶相关病症进一步与一种或多种升高的血清标志物相关,所述升高的血清标志物选自:升高的血清il-8水平、升高的血清il-2r水平和升高的无血清轻链水平。在某些方面,本公开内容涉及使用tβrii拮抗剂来治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用janus激酶抑制剂治疗。在一些实施方案中,患者已经用jak2抑制剂治疗。在一些实施方案中,患者已经用选自以下的janus激酶抑制剂治疗:鲁索替尼、fedratinib (sar302503)、monoelotinib (cyt387)、pacritinib、来他替尼、azd-1480、bms-911543、ns-018、ly2784544、sep-701、xl019和at-9283。在一些实施方案中,患者已经用鲁索替尼治疗。在一些实施方案中,tβrii拮抗剂可用于治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者不耐受janus激酶抑制剂。在一些实施方案中,tβrii拮抗剂可用于治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者对janus激酶抑制剂的反应不足。在某些方面,本公开内容涉及使用jak2激酶相关病症治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性的方法,其中患者已经用羟基脲治疗。在一些实施方案中,tβrii拮抗剂可用于治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者不耐受羟基脲。在一些实施方案中,tβrii拮抗剂可用于治疗、预防jak2激酶相关病症或jak2激酶相关病症的一种或多种并发症或降低其进展速率和/或严重性,其中患者对羟基脲的反应不足
6、在本文描述的任何方法和用途中,除了施用一种或多种tβrii拮抗剂外,还可以向具有骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)的患者和/或具有janus激酶相关病症(例如,jak2激酶相关病症)的患者施用一种或多种另外的活性剂和/或支持疗法来治疗、预防骨髓增生性病症和/或janus激酶相关病症或骨髓增生性病症和/或janus激酶相关病症的一种或多种并发症,或降低其进展速率和/或严重性。例如,在一些实施方案中,可以向患者进一步施用一种或多种支持疗法或活性剂,所述支持疗法或活性剂选自:输血(全血或红细胞输血)、红细胞生成刺激剂[例如esa如促红细胞生成素(epo)及其衍生物]、雄激素(例如庚酸睾酮和氟甲睾酮)、泼尼松、达那唑、沙利度胺、泼尼松、来那度胺、铁螯合剂、去铁胺、去铁酮、地拉罗司、羟基脲、克拉屈滨、鲁索替尼、sar302503、cyt387、pacritinib、azd-1480、bms-911543、ns-018、ly2784544、来他替尼、sep-701、at-9283、janus激酶抑制剂(例如jak1、jak2和jak3的一种或多种的抑制剂)、脾切除术、放射疗法、阿司匹林、免疫调节药物、pi3k/mtor抑制剂、表观遗传因子调节剂、pomalidonmide、雷帕霉素、西罗莫司、deforolimus、依维莫司、temsirolimus、nvp-bez235、bgt226、sf1126、pk1-587、ink128、azd8055、azd2014、组蛋白脱乙酰酶抑制剂、givinostat、panobinostat、pracinostat、皮质类固醇,γ-干扰素、环磷酰胺、硫唑嘌呤、甲氨蝶呤、青霉胺、环孢菌素、秋水仙碱、抗胸腺细胞球蛋白、霉酚酸酯、羟基氯喹、钙通道阻断剂、硝苯地平、血管紧张素转化酶抑制剂、对氨基苯甲酸、二甲亚砜、白细胞介素-5(il-5)抑制剂、泛胱天蛋白酶抑制剂、凝集素、秋水仙碱、硫唑嘌呤、环磷酰胺、泼尼松、沙利度胺、己酮可可碱和茶碱。
7、在某些方面,本公开内容涉及用于治疗、预防骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)和/或janus激酶相关病症(例如jak2激酶相关病症)或骨髓增生性病症和/或janus激酶相关病症的一种或多种并发症的患者,或降低其进展速率和/或严重性的方法,所述方法包括向有需要的患者施用:a)janus激酶抑制剂;和b)tβrii拮抗剂,其中janus激酶抑制剂和tβrii拮抗剂以有效量施用。在一些实施方案中,在用janus激酶抑制剂治疗之前施用tβrii拮抗剂。在其它实施方案中,在用janus激酶抑制剂治疗后施用tβrii拮抗剂。在其它实施方案中,tβrii拮抗剂与janus激酶抑制剂同时施用。根据本文所述的方法使用的janus激酶抑制剂可以是抑制选自jak1、jak2和jak3的一种或多种janus激酶的药剂。例如,janus激酶抑制剂可以是在基于细胞的测定中抑制jak1、jak2和jak3中的一种或多种的信号传导的药剂。在一些实施方案中,根据本文所述方法使用的janus激酶抑制剂选自鲁索替尼、fedratinib (sar302503)、monoelotinib (cyt387)、pacritinib、来他替尼、azd-1480、bms-911543、ns-018、ly2784544、sep-701、xl019和at-9283。在一些优选的实施方案中,根据本文所述方法使用的janus激酶抑制剂是鲁索替尼。
8、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制tgfβ1的药剂(例如tgfβ1拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对tgfβ1抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少与tgfβ1结合。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合至少与tgfβ1以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制tgfβ1的各种tβrii拮抗剂,包括例如配体诱捕物(ligandtrap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制tgfβ1的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ2、tgfβ3、tβrii、alk5和β聚糖中的一种或多种。在一些实施方案中,抑制tgfβ1的tβrii拮抗剂或拮抗剂的组合进一步抑制tgfβ3。在一些实施方案中,抑制tgfβ1的tβrii拮抗剂或拮抗剂的组合不抑制或基本上不抑制tgfβ2。在一些实施方案中,抑制tgfβ1的tβrii拮抗剂或拮抗剂的组合进一步抑制tgfβ3,但不抑制或基本上不抑制tgfβ2。
9、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制tgfβ2的药剂(例如tgfβ2拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对tgfβ2抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少与tgfβ2结合。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合至少与tgfβ2以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制tgfβ2的各种tβrii拮抗剂,包括例如配体诱捕物(ligandtrap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制tgfβ2的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ1、tgfβ3、tβrii、alk5和β聚糖中的一种或多种。
10、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制tgfβ3的药剂(例如tgfβ3拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对tgfβ3抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少与tgfβ3结合。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合至少与tgfβ3以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制tgfβ3的各种tβrii拮抗剂,包括例如配体诱捕物(ligandtrap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制tgfβ3的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ1、tgfβ2、tβrii、alk5和β聚糖中的一种或多种。在一些实施方案中,抑制tgfβ3的tβrii拮抗剂或拮抗剂的组合进一步抑制tgfβ1。在一些实施方案中,抑制tgfβ3的tβrii拮抗剂或拮抗剂的组合不抑制或基本上不抑制tgfβ2。在一些实施方案中,抑制tgfβ3的tβrii拮抗剂或拮抗剂的组合进一步抑制tgfβ1,但不抑制或基本上不抑制tgfβ2。
11、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制tβrii的药剂(例如tβrii受体拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对tβrii抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少结合tβrii。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合至少与tβrii以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9 m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制tβrii的各种tβrii拮抗剂,包括例如配体诱捕物(ligandtrap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制tβrii的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ1、tgfβ2、tgfβ3、alk5和β聚糖中的一种或多种。在一些实施方案中,抑制tβrii的tβrii拮抗剂或拮抗剂的组合不抑制或基本上不抑制tgfβ2。
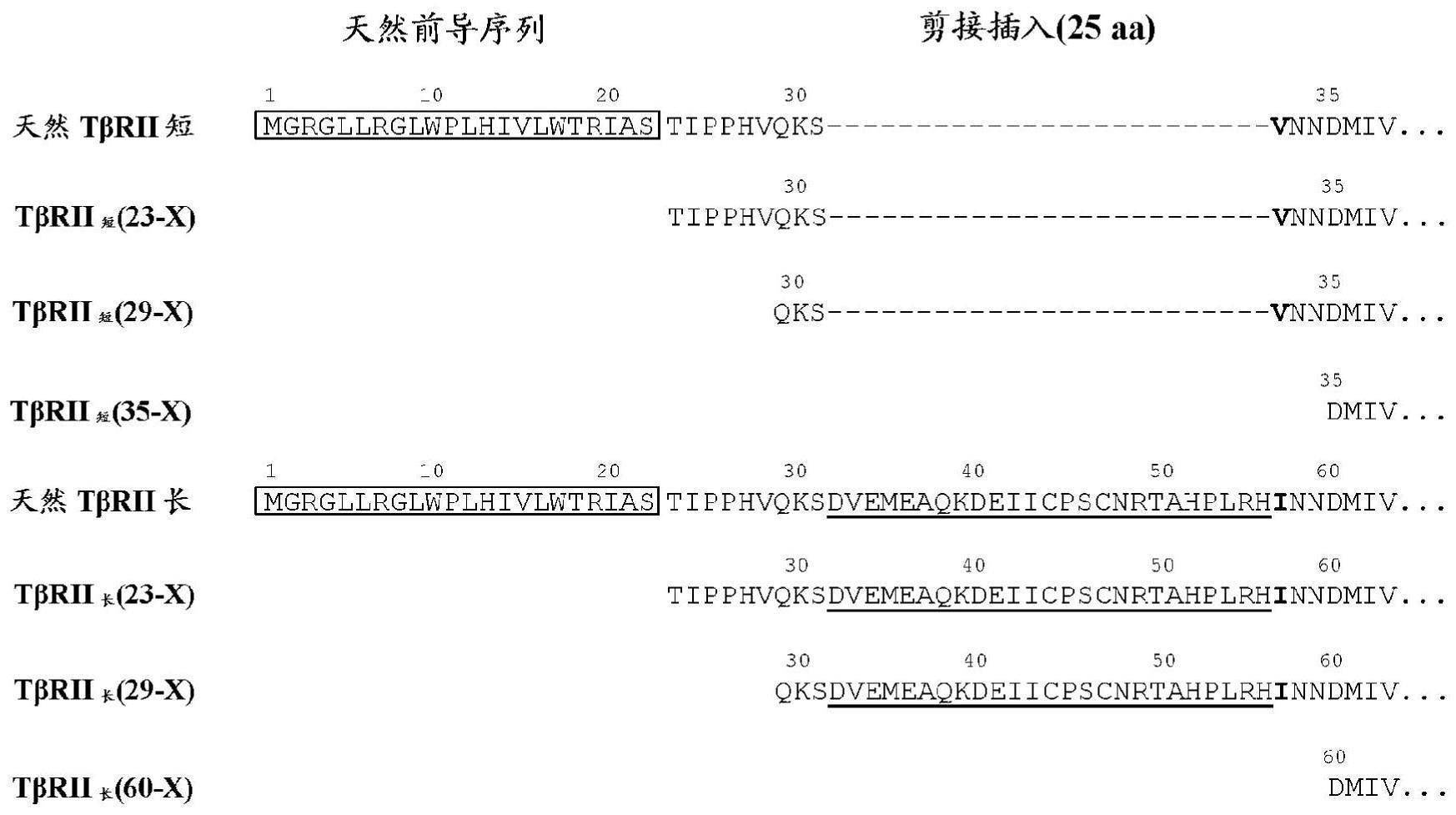
12、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制alk5的药剂(例如alk5拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对alk5抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少与alk5结合。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的alk5拮抗剂或拮抗剂的组合至少与alk5以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9 m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制alk5的各种tβrii拮抗剂,包括例如配体诱捕物(ligand trap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制alk5的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ1、tgfβ2、tgfβ3、tβrii和β聚糖中的一种或多种。在一些实施方案中,抑制alk5的tβrii拮抗剂或拮抗剂的组合不抑制或基本上不抑制tgfβ2。
13、在某些方面,根据本文所述的方法和用途使用的tβrii拮抗剂或拮抗剂的组合是至少抑制β聚糖的药剂(例如β聚糖拮抗剂)。例如,可以使用包括本文所述的基于细胞的测定(例如,smad信号传导测定)来测定对β聚糖抑制的作用。因此,在一些实施方案中,本公开内容的tβrii拮抗剂或拮抗剂的组合可以至少与β聚糖结合。例如,可以使用包括本文所述的那些的结合亲和力测定来测定配体结合活性。在一些实施方案中,本公开内容的β聚糖拮抗剂或拮抗剂的组合至少与β聚糖以至少1 x 10-7 m (例如至少1 x 10-8 m、至少1 x 10-9 m、至少1 x 10-10 m、至少1 x 10-11 m或至少1 x 10-12 m)的kd结合。如本文所述,可根据本文所述的方法和用途使用抑制β聚糖的各种tβrii拮抗剂,包括例如配体诱捕物(ligandtrap)(例如tβrii多肽及其变体)、抗体、小分子、核苷酸序列及其组合。在某些实施方案中,抑制β聚糖的tβrii拮抗剂或拮抗剂的组合可进一步抑制tgfβ1、tgfβ2、tgfβ3、tβrii和alk5中的一种或多种。在一些实施方案中,抑制β聚糖的tβrii拮抗剂或拮抗剂的组合不抑制或基本上不抑制tgfβ2。
14、在某些方面,本公开内容提供了tβrii多肽以及此类tβrii多肽作为tgfβ1和/或tgf-β3的选择性拮抗剂的用途。如本文所述,包含部分或全部tβrii胞外结构域(ecd)(具有或不具有其它突变)的多肽以不同亲和力结合和/或抑制tgfβ1和/或tgfβ3。因此,在某些方面,本公开内容提供了用于选择性抑制tgfβ超家族相关病症的tβrii多肽。
15、在某些方面,本公开内容提供了在tβrii的胞外结构域中包含突变和/或截短的多肽。在某些方面,本公开内容提供了tβrii融合多肽,其包含来自tβrii的胞外结构域的第一氨基酸序列和异源氨基酸序列,其中第一氨基酸序列包含以下氨基酸序列或由以下氨基酸序列组成:其与a) 起始于seq id no: 5的23至35的任一位置和终止于seq id no: 5的153至159的任一位置的序列或b) 起始于seq id no: 6的23至60的任一位置和终止于seq idno: 6的178至184的任一位置的序列具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性。
16、在某些方面,本公开内容提供了包含融合至人igg2的fc结构域的至少一部分的tβrii的野生型或改变和/或截短的胞外结构域的多肽。因此,在某些方面,本公开内容提供了包含来自tβrii胞外结构域的第一氨基酸序列和异源氨基酸序列的tβrii融合多肽,其中第一氨基酸序列包含以下氨基酸序列或由以下氨基酸序列组成:其与a) 起始于seq id no:5的23至35的任一位置和终止于seq id no: 5的153至159的任一位置的序列或b) 起始于seq id no: 6的23至60的任一位置和终止于seq id no: 6的178至184的任一位置的序列具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性,并且其中所述多肽包含第二多肽序列,所述第二多肽序列包含人igg2的至少一个恒定结构域并且可以任选地包含与seq id no: 19具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的氨基酸序列或由其组成,并且其中接头任选位于第一多肽和第二多肽之间。其实例作为seq id no: 50提供,并且由seq id no: 51的核酸序列编码。在某些实施方案中,本公开内容提供了多肽,其氨基酸序列包含与seq idno: 50的氨基酸序列具有至少80%、85%、90%、95%、96%、97%. 98%、99%或100%同一性的氨基酸序列或由其组成。在某些实施方案中,本公开内容提供了由核酸序列编码的多肽,所述核酸序列包含与seq id no: 51的核酸序列具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的核酸序列或由其组成。
17、在某些方面,本公开内容提供了包含融合至人igg1、igg3或igg4的fc结构域的至少一部分的tβrii的野生型或改变和/或截短的胞外结构域的多肽。
18、在某些方面,本公开内容提供了包含融合至人igg1的fc结构域的至少一部分的tβrii的野生型或改变和/或截短的胞外结构域的多肽。因此,在某些方面,本公开内容提供了包含来自tβrii胞外结构域的第一氨基酸序列和异源氨基酸序列的tβrii融合多肽,其中第一氨基酸序列包含与seq id no: 13的氨基酸序列具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的氨基酸序列,基本上由其组成或由其组成和其中接头任选位于第一多肽和第二多肽之间。另一tβrii融合多肽的实例作为seq idno: 101提供和由seq id no: 102的核酸序列编码。在某些实施方案中,本公开内容提供多肽,其氨基酸序列包含与seq id no: 101的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列,基本上由其组成或由其组成。在某些实施方案中,本公开内容提供多肽,其氨基酸序列包含与seq id no: 103的氨基酸序列具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列,基本上由其组成或由其组成。在某些实施方案中,本公开内容提供氨基酸序列,其与起始于seq id no: 101的氨基酸25-46的任一个(例如25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45或46)和终止于seq id no: 101的氨基酸170-186的任一个(例如170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185或186)的氨基酸序列具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性。在某些实施方案中,本公开内容提供由核酸序列编码的多肽,所述核酸序列包含与seq id no: 102的核酸序列具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的核酸序列或由其组成。在某些实施方案中,本公开内容提供核酸序列,其包含与seq id no: 102的核酸序列具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的核酸序列或由其组成。
19、在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置23和终止于seq id no: 5的位置159的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置29和终止于seq id no: 5的位置159的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置35和终止于seq id no: 5的位置159的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置23和终止于seq id no: 5的位置153的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置29和终止于seq id no: 5的位置153的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 5的位置35和终止于seqid no: 5的位置153的序列或由其组成。
20、在一些实施方案中,第一氨基酸序列包含起始于seq id no: 6的位置23和终止于seq id no: 6的位置184的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 6的位置29和终止于seq id no: 6的位置184的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 6的位置23和终止于seq id no: 6的位置178的序列或由其组成。在一些实施方案中,第一氨基酸序列包含起始于seq id no: 6的位置29和终止于seq id no: 6的位置178的序列或由其组成。
21、在一些实施方案中,第一氨基酸序列包含在对应于seq id no: 47的位置36的位置具有d和/或在对应于seq id no: 47的位置76的位置具有k的序列或由其组成。
22、在某些方面,本公开内容提供包含第一氨基酸序列或其活性片段和第二异源部分的tβrii融合多肽,所述第一氨基酸序列与seq id no: 7或seq id no: 13的序列具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性,其中第一氨基酸序列在对应于seq id no: 47的位置36的位置具有d和/或在对应于seq id no: 47的位置76的位置具有k。
23、在一些实施方案中,第一氨基酸序列包含对应于seq id no: 7的氨基酸1-12的1-12个氨基酸,或对应于seq id no: 13的氨基酸1-37的1-37个氨基酸的n-末端截短。在一些实施方案中,第一氨基酸序列包含对应于seq id no: 7或seq id no: 13的氨基酸1-6的6个氨基酸的n-末端截短。在一些实施方案中,第一氨基酸序列包含对应于seq id no: 7的氨基酸1-12的12个氨基酸或对应于seq id no: 13的氨基酸1-37的37个氨基酸的n-末端截短。在一些实施方案中,第一氨基酸序列包含对应于 seq id no: 7的氨基酸137-132或seqid no: 13的氨基酸162-157的1-6个氨基酸的c-末端截短。在一些实施方案中,第一氨基酸序列包含对应于seq id no: 7的氨基酸132-137或seq id no: 13的氨基酸157-162的6个氨基酸的c-末端截短。在一些实施方案中,第一氨基酸序列包含在对应于seq id no: 47的位置117和118残基之间对应于seq id no: 18的插入。
24、在一些实施方案中,异源部分包含一个或多个增强以下一种或多种的多肽部分:体内稳定性、体内半衰期、摄取/给药,组织定位或分布,蛋白质复合物的形成和/或纯化。在一些实施方案中,异源部分包含选自以下的多肽部分:免疫球蛋白fc结构域和血清白蛋白。在进一步的实施方案中,免疫球蛋白fc结构域通过接头连接至tβrii多肽。
25、在一些实施方案中,多肽包括选自以下的一个或多个修饰的氨基酸残基:糖基化氨基酸、peg化氨基酸、法尼基化氨基酸、乙酰化氨基酸、生物素化氨基酸、缀合至脂质部分的氨基酸和与有机衍生剂缀合的氨基酸。在一些实施方案中,多肽是糖基化的。
26、在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含与选自seq id nos:7-17和47-49的氨基酸序列具有至少80%、至少85%、至少90%或至少95%同一性的氨基酸序列。在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含与选自seq id nos: 7-17和47-49的氨基酸序列具有至少96%同一性的氨基酸序列。在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含与选自seq id nos: 7-17和47-49的氨基酸序列具有至少97%同一性的氨基酸序列。在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含与选自seqid nos: 7-17和47-49的氨基酸序列具有至少98%同一性的氨基酸序列。在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含与选自seq id nos: 7-17和47-49的氨基酸序列具有至少99%同一性的氨基酸序列。在某些方面,本公开内容提供包含第一氨基酸序列和第二异源部分的tβrii融合多肽,所述第一氨基酸序列由tβrii胞外结构域的一部分组成,其包含为选自seq id nos: 7-17和47-49的氨基酸序列的氨基酸序列。
27、在某些方面,本公开内容提供多肽,其包含与选自seq id nos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列具有至少80%、至少85%、至少90%或至少95%同一性的氨基酸序列或由其组成,例如包含与选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列具有至少80%、至少85%、至少90%或至少95%同一性的氨基酸序列或由其组成的多肽。在某些方面,本公开内容提供多肽,其包含与选自seq idnos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列具有至少96%同一性的氨基酸序列或由其组成,例如包含与选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列具有至少96%同一性的氨基酸序列或由其组成的多肽。在某些方面,本公开内容提供多肽,其包含与选自seq id nos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列具有至少97%同一性的氨基酸序列或由其组成,例如包含与选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列具有至少97%同一性的氨基酸序列或由其组成的多肽。在某些方面,本公开内容提供多肽,其包含与选自seq id nos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列具有至少98%同一性的氨基酸序列或由其组成,例如包含与选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列具有至少98%同一性的氨基酸序列或由其组成的多肽。在某些方面,本公开内容提供多肽,其包含与选自seq id nos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列具有至少99%同一性的氨基酸序列或由其组成,例如包含与选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列具有至少99%同一性的氨基酸序列或由其组成的多肽。在某些方面,本公开内容提供多肽,其包含选自seq id nos: 25、27、29、31、33、35、37、39、41和43或其部分(前导序列去除)的氨基酸序列或由其组成,例如包含选自seq id nos: 53、54、55、56、57、58、59、60、61和62的氨基酸序列或由其组成的多肽。
28、在某些方面,本公开内容提供tβrii多肽,其包含由在严格条件下与选自seq idnos: 26, 28, 30, 32, 34, 36, 38, 40, 42和44的核苷酸序列的互补序列杂交的核酸序列编码的氨基酸序列。
29、在前述的每一种中,可以选择tβrii多肽,使其不包含全长tβrii ecd。tβrii多肽可以作为单体蛋白质或以二聚化形式使用。tβrii多肽也可以与第二多肽部分融合以提供改善的性质,例如增加的半衰期或更容易的生产或纯化。融合可以是直接的,或者可以在tβrii多肽和任何其它部分之间插入接头。接头可以是结构化的或非结构化的,并且可以由1,2, 3, 4, 5, 10, 15, 20, 30, 50个或更多个氨基酸组成,任选地相对不含二级结构。
30、在一些实施方案中,本公开内容的tβrii多肽具有cho细胞中多肽表达特征性的糖基化模式。
31、在一些实施方案中,本公开内容提供了包含两个本公开内容的tβrii多肽的同二聚体。
32、在一些实施方案中,本公开内容提供了包含本公开内容的tβrii多肽的编码序列的分离的多核苷酸。在一些实施方案中,本公开内容提供了包含与分离的多核苷酸可操作连接的启动子序列的重组多核苷酸。在一些实施例中,本公开内容提供用本发明的分离的多核苷酸或重组多核苷酸转化的细胞。在一些实施方案中,细胞是哺乳动物细胞。在一些实施方案中,细胞是cho细胞或人类细胞。在一些实施方案中,细胞是hek-293细胞。
33、在某些方面,本公开内容提供了包含本公开内容的tβrii多肽或同二聚体和药学上可接受的赋形剂的药物制剂。
34、在某些方面,tβrii拮抗剂是抗体或抗体组合。在某些方面,抗体至少结合tβrii。在一些实施方案中,结合tβrii的tβrii拮抗剂抗体抑制tβrii信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合tβrii的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体、tgfβ超家族i型受体或tgfβ超家族共同受体结合tβrii。在一些实施方案中,结合tβrii的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体与选自tgfβ1、tgfβ2和tgfβ3的tβrii结合。在某些方面,抗体至少结合alk5。在一些实施方案中,结合alk5的tβrii拮抗剂抗体抑制alk5信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合alk5的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体、tgfβ超家族ii型受体或tgfβ超家族共同受体与alk5的结合。在一些实施方案中,结合alk5的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体结合选自tgfβ1、tgfβ2和tgfβ3的alk5。在某些方面,抗体至少结合β聚糖。在一些实施方案中,结合β聚糖的tβrii拮抗剂抗体抑制β聚糖信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合β聚糖的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体、tgfβ超家族i型受体或tgfβ超家族ii型受体结合β聚糖。在一些实施方案中,结合β聚糖的tβrii拮抗剂抗体抑制一种或多种tgf-β超家族配体结合选自tgfβ1、tgfβ2和tgfβ3的β聚糖。在某些方面,tβrii拮抗剂抗体至少结合tgfβ1。在一些实施方案中,结合tgfβ1的tβrii拮抗剂抗体抑制tβrii信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合tgfβ1的tβrii拮抗剂抗体抑制tgfβ1-tβrii、tgfβ1-alk5和/或tgfβ1-β聚糖结合。在某些方面,tβrii拮抗剂抗体至少结合tgfβ2。在一些实施方案中,结合tgfβ2的tβrii拮抗剂抗体抑制tβrii信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合tgfβ2的tβrii拮抗剂抗体抑制tgfβ2-tβrii、tgfβ1-alk5和/或tgfβ1-β聚糖结合。在某些实施方案中,tβrii拮抗剂抗体至少结合tgfβ3。在一些实施方案中,结合tgfβ3的tβrii拮抗剂抗体抑制tβrii信号传导,任选地如在基于细胞的测定例如本文所述的测定中测量的。在一些实施方案中,结合tgfβ3的tβrii拮抗剂抗体抑制tgfβ3-tβrii、tgfβ1-alk5和/或tgfβ1-β聚糖结合。在一些实施方案中,tβrii拮抗剂抗体是多特异性抗体或多特异性抗体的组合,在基于细胞的测定中抑制tgfβ1、tgfβ2、tgfβ3、tβrii、alk5和β聚糖中的一种或多种的信号传导。在一些实施方案中,抗体是嵌合抗体、人源化抗体或人抗体。在一些实施方案中,抗体是单链抗体、f(ab')2片段、单链双抗体、串联单链fv片段、串联单链双抗体或融合蛋白,其包含单链双链体和至少一部分免疫球蛋白重链恒定区。
35、在某些方面,tβrii拮抗剂是小分子抑制剂或小分子抑制剂的组合。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少tβrii的抑制剂。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少alk5的抑制剂。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少β聚糖的抑制剂。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少tgfβ1的抑制剂。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少tgfβ2的抑制剂。在一些实施方案中,tβrii拮抗剂小分子抑制剂是至少tgfβ3的抑制剂。
36、在某些方面,tβrii拮抗剂是核酸抑制剂或核酸抑制剂的组合。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少tβrii的抑制剂。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少alk5的抑制剂。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少β聚糖的抑制剂。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少tgfβ1的抑制剂。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少tgfβ2的抑制剂。在一些实施方案中,tβrii拮抗剂核酸抑制剂是至少tgfβ3的抑制剂。
37、在某些方面,本公开内容提供了调节细胞对tgfβ超家族成员的反应的方法,所述方法包括使细胞暴露于本公开内容的tβrii多肽或同二聚体。
38、在某些方面,本公开内容提供了调节细胞对tgfβ超家族成员的反应的方法,所述方法包括使细胞暴露于本公开内容的tβrii多肽或同二聚体。
39、在某些方面,本公开内容涉及一种或多种tβrii拮抗剂,任选地与一种或多种用于治疗骨髓增生性病症的其它支持疗法或活性剂组合,在制备药物中的用途,所述药物用于治疗、预防本文所述的骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)、骨髓增生性病症的一种或多种并发症(例如纤维化、脾肿大和炎症)或降低其进展速率和/或严重性。在某些方面,本公开内容涉及一种或多种tβrii拮抗剂,任选地与一种或多种用于治疗janus激酶相关病症(例如,jak2激酶相关病症)的其它支持疗法或活性剂组合,在制备药物中的用途,所述药物用于治疗、预防本文所述的janus激酶相关病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)、janus激酶相关病症的一种或多种并发症(例如,纤维化、脾肿大和炎症)或降低其进展速率和/或严重性。在某些方面,本公开内容涉及一种或多种tβrii拮抗剂,任选地与一种或多种用于治疗骨髓增生性病症的其它支持疗法或活性剂组合,用于治疗、预防本文所述的骨髓增生性病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)、骨髓增生性病症的一种或多种并发症(例如纤维化、脾肿大和炎症)或降低其进展速率和/或严重性。在某些方面,本公开内容涉及一种或多种tβrii拮抗剂,任选地与一种或多种用于治疗janus激酶相关病症的其它支持疗法或活性剂组合,用于治疗、预防本文所述的janus激酶相关病症(例如,骨髓纤维化症、真性红细胞增多症和原发性血小板减少症)、janus激酶相关病症的一种或多种并发症(例如,纤维化、脾肿大和炎症)或降低其进展速率和/或严重性。
- 还没有人留言评论。精彩留言会获得点赞!