一种瑞格列奈片及其制备方法与流程
1.本发明涉及药物制剂技术领域,尤其涉及一种瑞格列奈片及其制备方法。
背景技术:
2.胰岛素分泌缺陷对于ii型糖尿病的发生发展起着关键作用。循证医学也已证明,以促泌剂为基础的长期强化降糖治疗可以减少大血管和微血管并发症。促泌剂主要通过关闭胰岛β细胞膜上atp依赖性钾离子通道而促进胰岛素分泌,主要包括传统的磺脲类和新型的非磺脲类促泌剂。非磺脲类促泌剂瑞格列奈对胰岛β细胞上的钾离子通道选择性更强,因而,其特异性更高。
3.瑞格列奈片(商品名:诺和龙)是由丹麦诺和诺德公司成功研制的一种治疗ii型糖尿病的药物,于1997年12月获美国fda批准,1998年先后在美国和欧洲各国上市。临床上,瑞格列奈片主要用于治疗饮食控制、降低体重及运动锻炼不能有效控制高血糖的ii型糖尿病(非胰岛素依赖型)患者。瑞格列奈与胰岛β细胞膜上的特异性受体结合,促进与受体偶联的atp敏感性钾通道关闭,抑制钾离子从β细胞外流,细胞膜去极化,钙通道开放,钙离子内流,促进胰岛素分泌。其作用快于磺酰脲类,故餐后降血糖作用较快;为第一个进餐时服用的葡萄糖调节药;最大的优点是可以模仿胰岛素的生理性分泌,由此有效的控制餐后高血糖。
4.瑞格列奈为白色或类白色结晶性粉末,无臭,在氯仿中易溶,在乙醇或丙酮中略溶,在水中几乎不溶,在0.1mol/l盐酸溶液中微溶;其较差的溶解性是影响临床疗效差异的关键因素。瑞格列奈片中活性物质含量不大于2%,依据中国药典2010版附录xe规定,其含量均匀度应小于15.0;美国药典35版(usp35)中瑞格列奈片的溶出介质ph值为5.0。但瑞格列奈在ph5.0介质中溶解度小(0.012mg/ml)、溶出速度慢,在30min内瑞格列奈的溶出很难达到标示量的70%(q);此外,usp35版对于产品的稳定性限度要求很高,单个杂质含量不超过0.2%,总杂质不超过0.5%。
5.目前市售产品一般采用湿法制粒;cn201210369291.2公开了瑞格列奈片(缓释效果)的组成及制备方法;瑞格列奈片原研处方和制备工艺专利cn200780036006.2公开了一种瑞格列奈片的制备方法,该制备工艺采用喷雾干燥器进行喷雾干燥制粒:将瑞格列奈、葡甲胺、泊洛沙姆、聚维酮制备喷雾干燥颗粒预制剂,改善其溶解度。cn201310565684.5公开了一种瑞格列奈片制备方法,但其溶出曲线未做到与原研制剂一致。
6.因此,提供一种溶出曲线与原研制剂一致,且成本较低,适宜工业化生产的瑞格列奈片是研究热点之一。
技术实现要素:
7.为了解决上述技术问题,本发明提供了一种瑞格列奈片及其制备方法。
8.研究发现,调整产品中聚克立林钾的添加量,能够影响产品溶出,但实验发现,如5%聚克利林钾虽然能够满足片剂在ph值为5时的溶出要求,但完全无法满足ph6.8时的溶出要求。虽然有研究显示,瑞格列奈与葡甲胺的比例能够改善药物在不同ph值下的溶出。但
葡甲胺同样是一种药用成分,其能够增加心肌的收缩力,具有强心的作用,还有扩张外周血管、减轻心脏负荷的作用。因此,其含量在瑞格列奈制剂中影响较大;考虑到药物效果影响和国家对药物一致性评价的要求,调整两种最主要成分比例,难以满足国家审批要求。为解决这一技术问题,发明人经过深入研究,最终发现通过对辅料的具体设计可以满足溶出要求。具体为确定聚克利林钾的含量为5%,并选择乳糖作为填充剂之一,同时平衡乳糖和无水磷酸氢钙的含量(无水磷酸氢钙占片剂总重量10%,而乳糖含量为25-35%,优选为27-32%时),可以解决该问题。
9.第一方面,本发明提供了一种瑞格列奈片,所述瑞格列奈片的组成成分包括:瑞格列奈预制剂、无水磷酸氢钙、乳糖、微晶纤维素、玉米淀粉、聚克立林钾、硬脂酸镁和氧化铁,所述瑞格列奈预制剂由瑞格列奈、葡甲胺、泊洛沙姆和聚维酮组成;
10.其中,以所述瑞格列奈片的总质量为100%计,所述聚克立林钾的含量为5%,无水磷酸氢钙的含量为10%,乳糖的含量为27-32%,微晶纤维素含量为31.91%,玉米淀粉含量为20%,硬脂酸镁含量为0.5%,氧化铁含量为0-0.2%,例如0.05%、0.1%、0.15%等,其余为瑞格列奈预制剂。
11.以所述瑞格列奈预制剂的总质量为100%计,所述瑞格列奈预制剂由44%的瑞格列奈、22%的葡甲胺、21%泊洛沙姆和13%的聚维酮组成。
12.通常,对于片剂而言,崩解剂(如聚克立林钾)含量越高,片剂的崩解速度会更快,但本发明出人意料的发现,当聚克立林钾的添加量为5%时,制备得到的瑞格列奈片在ph=5.0的磷酸盐缓冲液中的体外溶出行为与原研一致,但随着聚克立林钾的添加量升高却会导致崩解速度显著降低,进而导致瑞格列奈片的溶出速率减慢。
13.作为本发明的一种优选技术方案,所述氧化铁为红氧化铁或黄氧化铁。
14.作为本发明的一种优选技术方案,所述泊洛沙姆为泊洛沙姆188;所述聚维酮为聚维酮k30;所述微晶纤维素为微晶纤维素sh-112。
15.第二方面,本发明公开了第一方面所述的瑞格列奈片的制备方法,所述制备方法包括:
16.(1)预制剂制备:按处方量称取预制剂所需原辅料,纯化水加热后,依次加入称取的原辅料搅拌溶解;喷雾干燥和加热干燥后备用;
17.(2)预处理:干燥后预制剂过筛;氧化铁(红氧化铁或黄氧化铁)经机械粉碎后过筛;微晶纤维素、玉米淀粉、乳糖过筛;
18.(3)混合压片:将玉米淀粉、预制剂、聚克立林钾、乳糖、氧化铁和无水磷酸氢钙混合均匀,再先后与微晶纤维素、硬脂酸镁混合,混合均匀后压片。
19.作为本发明的一种具体实施方式,所述步骤(2)为:干燥后预制剂过80目筛;氧化铁(红氧化铁或黄氧化铁)经机械粉碎后过120目筛;微晶纤维素、玉米淀粉、乳糖过60目筛。
20.作为本发明的一种具体实施方式,所述步骤(3)为:将玉米淀粉、预制剂、聚克立林钾、乳糖、氧化铁和无水磷酸氢钙混合均匀,过60目筛;过筛后物料与微晶纤维素混合,混合均匀后,加入硬脂酸镁,混合均匀后压片。
21.本发明实施例提供的技术方案与现有技术相比具有如下优点:
22.(1)本发明通过选用5%的聚克立林钾作为崩解剂,使得到的瑞格列奈片在ph5.0的体外环境中的溶出行为与原研一致;
23.(2)本发明发现,在稀释剂中引入乳糖,同时控制乳糖和无水磷酸氢钙的比例,能够保证聚克立林钾的添加量为5%的情况下,得到的瑞格列奈片在ph6.8的体外环境中的溶出行为与原研一致;
24.(3)本发明提供的瑞格列奈片稳定性好,且溶出曲线与原研制剂一致,同时工艺要求低,适宜工业化生产。
具体实施方式
25.为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
26.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
27.实施例1
28.本实施例提供了一种瑞格列奈片,其组成成分由瑞格列奈预制剂、无水磷酸氢钙、乳糖、微晶纤维素sh-112、玉米淀粉sh-h、聚克立林钾、硬脂酸镁和氧化铁组成,所述瑞格列奈预制剂由瑞格列奈、葡甲胺、泊洛沙姆188和聚维酮k30组成。
29.制备方法为:
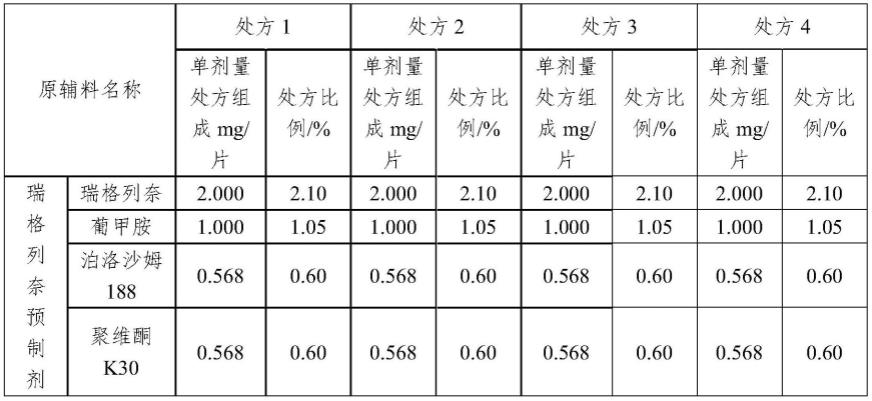
30.(1)预制剂制备:按处方量称取预制剂所需原辅料,纯化水加热至60℃,依次加入上述原料药和原辅料搅拌溶解;使用喷雾干燥机将上述溶液进行喷雾干燥;然后使用热风循环烘箱50℃进行干燥。
31.(2)原辅料预处理:干燥后预制剂过80目筛;氧化铁(红氧化铁或黄氧化铁)经机械粉碎后过120目筛;微晶纤维素、玉米淀粉、乳糖过60目筛;
32.(3)将玉米淀粉、预制剂、聚克立林钾、乳糖、氧化铁和无水磷酸氢钙混合均匀,过60目筛;过筛后物料与微晶纤维素混合,混合均匀后,加入硬脂酸镁,混合均匀后压片。
33.实施例2
34.本实施例考察了聚克立林钾对崩解的影响。
35.(1)参照实施例提供的制备方法,按照表1提供的配方制备瑞格列奈片:
36.表1
[0037][0038][0039]
以ph5.0的磷酸盐缓冲液为溶出介质,转速为50rpm,参照2015版中国药典0931溶出度与释放度测定法,经5、10、15、30、45、60、90、120min时,取样检测并计算每片的溶出量,结果见表2;
[0040]
表2
[0041]
[0042]
由表2可知,在ph5.0的溶出介质下,本发明提供的瑞格列奈片并没有表现出随着崩解剂用量的增加溶出行为一直加快的现象,而在崩解剂的用量高于5%后,崩解速率反而出现降低,与参比制剂出现明显差异,且含量越高,差异越大;因此,本发明特异性的选择崩解剂聚克立林钾的添加量为5%,能够使得到的瑞格列奈片的体外溶出行为与原研一致。
[0043]
(2)参照(1)提供的方法,改变溶出介质为ph6.8的磷酸盐缓冲液,探究瑞格列奈片的溶出行为,结果见表3:
[0044]
表3
[0045][0046]
由表3可知,当本发明选择5%的聚克立林钾作为崩解剂时,其相比参比制剂出现显著的差异,无法达到药品审批要求。
[0047]
实施例3
[0048]
本实施例考察了乳糖和无水磷酸氢钙对溶出试验的影响。
[0049]
(1)体外溶出试验
[0050]
参照实施例1提供的制备方法,按照表4提供的配方制备瑞格列奈片:
[0051]
表4
[0052]
[0053][0054]
以ph6.8的磷酸盐缓冲液为溶出介质,转速为50rpm,参照2015版中国药典0931溶出度与释放度测定法,经5、10、15、30、45、60、90、120min时,取样检测并计算每片的溶出量,结果见表5;
[0055]
表5
[0056][0057]
由表4和表5可知,在瑞格列奈片中添加乳糖能够增加瑞格列奈的溶出,当乳糖的添加量在27.61%时,本发明提供的瑞格列奈片的溶出终点与参比制剂溶出终点相当。
[0058]
验证处方3提供的瑞格列奈片在ph5.0的磷酸盐缓冲液中的溶出情况,结果见表6:
[0059]
表6
[0060]
[0061][0062]
由表6可知,本发明提供的瑞格列奈片在ph5.0的溶出介质中具有与参比制剂相似甚至优于参比制剂的溶出速率。
[0063]
另外,考察1mg/片和0.5mg/片规格,1mg/片和0.5mg/片规格组成见表7:
[0064]
表7
[0065][0066]
结果显示,其在ph5.0与ph6.8情况下溶出均与2mg/片规格相似,均符合要求。
[0067]
需要说明的是,在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些
要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0068]
以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1